文献解读|Nat Commun(16.6):人类和小鼠中性粒细胞在稳态和炎症环境中共有的核心转录程序
✦ +
+
论文ID
原名:Human and mouse neutrophils share core transcriptional programs in both homeostatic and inflamed contexts
译名:人类和小鼠中性粒细胞在稳态和炎症环境中共有的核心转录程序
期刊:Nature Communications
影响因子:16.6
发表时间:2023.12.08
DOI号:10.1038/s41467-023-43573-9
背 景
中性粒细胞介导稳态和炎症过程,并表现出显著的表型和功能异质性。虽然动物模型推动了免疫学的基本发现,但人类和小鼠之间的差异可能会损害研究结果的转化。由于基因组的结构和功能差异,通常不清楚哪些方面反映了保守的生物学。因此,跨物种细胞系统的综合分析对于转化研究的成功非常重要。
实验设计
结 果
01
跨物种白细胞基因表达的综合分析
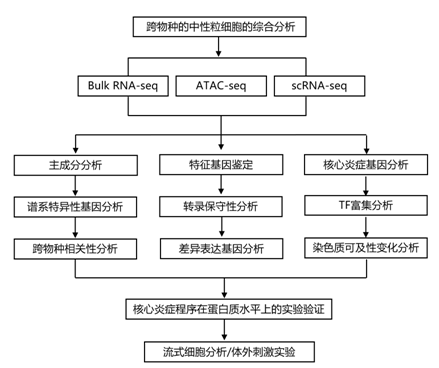
为了评估人类和小鼠免疫细胞之间基因表达的相似性和差异,研究者团队从 Haemopedia 图集的六个分选的白细胞谱系中获得了bulk转录组分析 (RNA-seq) 数据。该数据集总共包含 76 个 T 细胞、B 细胞、树突状细胞、单核细胞、自然杀伤(NK) 细胞和中性粒细胞样本。然后,他们通过高置信度地绘制蛋白质编码、一对一直系同源基因来整合基因表达矩阵。为了评估这种方法的稳健性,他们对集成表达矩阵进行了主成分分析(PCA)。对于每个谱系,选择了多达 200 个谱系相关基因。样本分布主要由谱系驱动,其次是物种(图 1a)。谱系相关基因的表达在每个谱系中最高,并且发生在所有谱系的物种之间(图 1b)。类似地,基于这些基因的样本Pearson相关系数的聚类主要由谱系驱动,证实在本项研究的分析方法中,谱系同一性主导着物种差异(图 1c)。相应地,关键谱系相关基因的表达在人和小鼠之间高度保守(图 1d),例如中性粒细胞中的CSF3R和CHI3L1、B细胞中的CD19和CD22、T细胞中的CD3分子和CD28、NK中的NKG7和GZMA单核细胞中的MSR1和SERPINB2以及树突细胞中的FLT3和MYCL。人类和小鼠基因表达之间的相关性最高的是中性粒细胞,其次是 T 细胞、B 细胞、单核细胞。NK 细胞和树突状细胞的相关性较弱(图1d)。
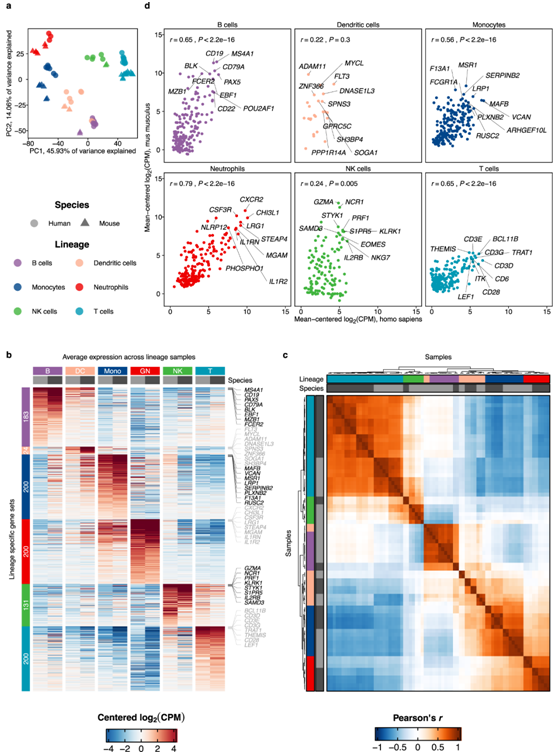
图1. 跨物种白细胞基因表达的综合分析。
(a) 基于谱系特定基因的每物种均值中心 log 2 (CPM) 的主成分分析。(b) 每个物种中每个谱系的顶级谱系特异性基因的一致表达。 (c) 谱系特异性基因表达主导物种效应。(d) 与其他白细胞谱系相比,中性粒细胞在人类和小鼠中表现出最强的谱系特异性基因表达相关性。
02
静息中性粒细胞的转录保守性
为了系统地分析哪些基因在不同物种之间表现出相似和不同的表达,他们整合了通过序列读取存档 (SRA) 获得的静息(未激活)中性粒细胞的转录谱。在这种情况下,静息中性粒细胞定义为在没有疾病或实验操作的情况下从血液或组织中分离出来的中性粒细胞。在总共 84 个人类和 39 个小鼠样本中,他们观察到人类和小鼠的总体基因表达、转录因子表达和谱系相关基因表达具有高度相关性(图2a)。这些结果与从更同质的 Haemopedia 数据集获得的结果非常相似,进一步说明了这种方法的稳健性,即使在集成来自不同来源的多个数据集时也是如此。
接下来,他们关注中性粒细胞谱系相关基因,并根据其表达模式定义了5对GENE: GENE (HUMAN: Mouse)。除了一对一的正交,他们还考虑了高置信度的一对多和多对多正交。
在人和小鼠中高表达的同源基因包括关键的中性粒细胞基因CSF3R(编码G-CSF受体)、CXCR2、NCF4(中性粒细胞胞浆因子4)、转录因子MCL1、SPI1(编码PU.1,末梢粒细胞生成的必需转录因子)和JUNB(在中性时间晚期显著表达的转录因子,在中性粒细胞的炎症反应中起重要作用)(图2b)。由于CSF3R、CXCR2和JUNB的表达随着中性粒细胞的发育而变化,它们表达的一致性可能表明所分析的人类和小鼠中性粒细胞处于相似的发育阶段。在人中性粒细胞中表达较高的同源基因包括FCGR3A和FCGR3B(分别编码CD16A和CD16B),它们都是小鼠Fcgr4的一对多同源基因。该组还包括活化补体受体(C5AR1)和CXCR1、CXCL8(人)/KC(小鼠)受体。在小鼠中性粒细胞中表达较高的基因包括蛋白酶Mmp9、Camp(编码抗菌肽)、Il1b和Retnlg(编码抵抗素样γ)(图 2b)。
值得注意的是,尽管9.8%基因是一对多同源,但1-3类中大多数基因是一对一同源。然而,还鉴定了已知的无一对一同源的中性粒细胞基因(第4类和第5类),包括人类的CXCL8(一种在血液中性粒细胞中大量表达的细胞因子)以及小鼠中性粒细胞中最丰富的趋化因子之一Ccl6(图2b)。
因此,虽然人类和小鼠的静止中性粒细胞保守表达许多关键的中性粒细胞基因和转录因子,但在同一谱系中,即使是结构上高度相关的基因,基因表达也可能在物种之间发生显著差异。
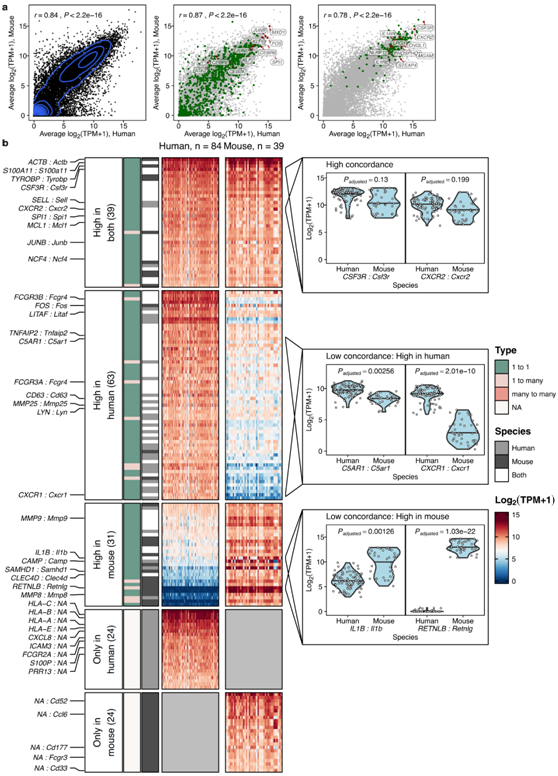
图2. 中性粒细胞基因表达在稳态中的保守性。
(a) 静息人 (x) 和小鼠 (y) 血液中性粒细胞之间基因表达的强相关性。(b)具有直系同源物的中性粒细胞谱系相关基因可以在不同物种之间表现出一致或不一致的表达。
03
核心炎症程序在不同物种之间共同存在
为了确定炎症的变化,他们分析了 11 项研究,涵盖不同条件下的总共 46 个静息和 66 个激活的中性粒细胞样本(图 3a)。基于P值排名,他们从P值最低的前500个基因中选择了log 2差异倍数≥0.5的基因(图 3b)。总共 221 个基因在各个研究中显示出一致的炎症变化:179 个基因上调(“核心炎症程序”),42 个基因下调(图 3c)。这 221 个上调和下调基因的效应大小在所有物种之间都非常一致(图 3c)。
核心炎症基因包括IL-1分子IL1A和IL1B、LPS共受体CD14、粘附分子ICAM1、凝集素受体CD69、CD40、IL4R和CD274(编码PD-L1)(图 3c-d)。炎症中下调的基因包括周期蛋白依赖性激酶CDK5R1、TLR5(编码Toll样受体5,一种必需的病原体识别受体)、CXCR4、CD101和丝裂原激活蛋白激酶家族成员MAP3K15(图3c-d)。
在个体样本的水平上,他们证实这组179个核心炎症基因在健康中性粒细胞中表达较弱或不表达,而在炎症中性粒细胞中受到诱导而高表达(图 3d)。基因集富集分析通过NFKB和KRAS信号传导识别了与细胞凋亡、炎症反应、IL-2和IL-6信号传导、IFN-γ反应以及TNF信号传导相关的通路的富集(图3e)。
总之,这种对静息和活化中性粒细胞的综合分析确定了中性粒细胞的核心炎症程序,该程序在炎症状况和物种间共有。
图3. 核心炎症程序在小鼠和人类中性粒细胞中是保守的。
(a) 综合分析的 11 项研究概述。每项研究独立进行差异表达测试,每项研究中的静息中性粒细胞用作对照。 (b) 对中性粒细胞对激活/炎症反应的综合分析确定了炎症中 179 个持续上调的基因(核心炎症程序)和 42 个下调的基因。(c) 42 个在炎症中下调的基因和 179 个核心炎症基因在各个研究中是共有的。 (d) 核心炎症基因在两个物种的静息中性粒细胞中均不表达,而是在激活后发生诱导。 (e)保守基因集富集分析。
04
使用不同的分析策略和单细胞数据可以检测核心炎症程序
为了验证,他们分析了四个最近的单细胞转录组分析(scRNA-seq)数据集,这些数据集尚未用于推导核心炎症程序。其中包括来自健康对照个体和轻度至中度或重度COVID-19患者的中性粒细胞(数据集1),用G-CSF、IFN-β或IFN-γ刺激的人中性粒细胞(数据集2+3)和感染大肠杆菌的小鼠中性粒细胞(数据集4)。在炎症中性粒细胞中,179个核心炎症基因中的大多数表达增加(图4a)。基于 179 个核心炎症基因创建基因集,并与具有相同表达丰度的随机背景基因进行比较以检测表达变化。在所有情况下都检测到核心炎症基因显著增加,并且与轻度至中度 COVID-19 患者相比,重度患者的核心炎症基因显著增加(图 4b)。然而,在单细胞水平上检测核心炎症程序的表达表明中性粒细胞群体内存在异质性,其特征是存在炎症状态下特定基因组表达异常高或低的细胞群(图4c)。
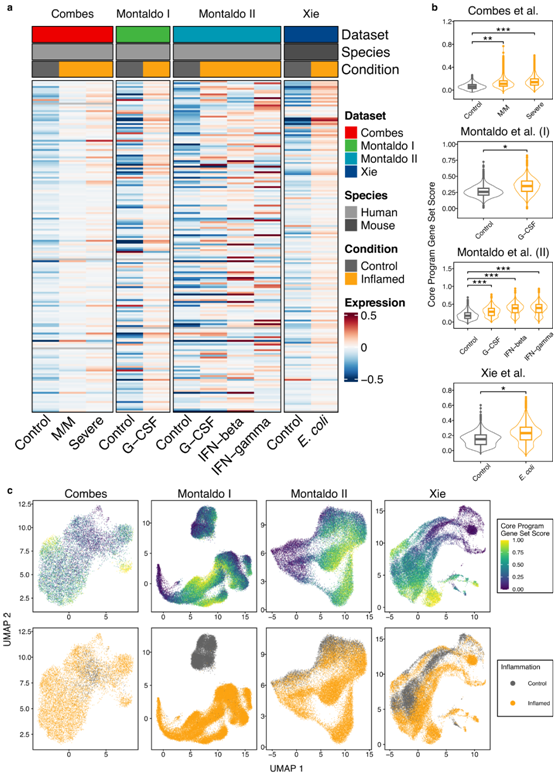
图4. scRNA-seq 中核心炎症基因富集的验证。
(a) 与对照相比,核心炎症基因在发炎样本中表现出更高的表达。 (b) 炎症细胞在核心炎症程序方面表现出较高的基因模块得分。与相似表达的随机参考基因集相比,每个细胞都对核心炎症程序基因的富集进行了评分。 (c) UMAP可视化。
05
核心炎症程序显示跨物种的保守转录调控
为了确定炎症中性粒细胞激活的假定调节因子,他们对每项研究中的上调和下调基因分别应用了转录因子(TF)富集分析。小鼠和人类炎症中性粒细胞的 TF 富集在 TF 活性降低和增加方面高度一致 。
他们比较了TF的预测调节活性及其各自在炎症中的基因表达。该分析强调编码CSRNP1、JUNB、CEBPB、XBP1和ETS2的基因在发炎的中性粒细胞中强烈上调,同时也表现出强烈增加的调节活性(图 5a)。
如果核心炎症程序中的基因倾向于上调,那么这些基因的染色质可及性应该在中性粒细胞成熟、迁移到组织中和暴露于炎症刺激时增加。
为了检验这一假设,他们分析了来自骨髓、血液和急性炎症气囊模型的染色质可及性数据。这些数据是使用测序转座酶染色质可及性分析 (ATAC-seq) 生成的。在 179 个核心炎症程序基因中,29 个在血液中与骨髓中的可及性相比表现出增加,而只有 10 个基因的可及性降低(图 5b)。从血液迁移到膜中的中性粒细胞显示出 78 个基因的可及性增强。与骨髓相比,这种增加显著高于血液中中性粒细胞 29 个基因的增加。重要的是,可及性增加和减少的基因在整个比较中是高度一致的(图5c)。
他们分析了分化的HoxB8中性粒细胞的RNA-seq数据,这些中性粒细胞分别受到或不受酵母聚糖(zymosan)刺激2小时。在活化的中性粒细胞中,核心炎症基因的上调比例明显高于偶然预期(图5e)。
当一起评估预测的保守调控活性和染色质可及性的变化时,JUNB 成为显著受影响的转录因子,它可以控制中性粒细胞激活并在中性粒细胞激活时高度表达。另一方面,CEBPB是介导紧急粒细胞生成的关键转录因子,并且在本项研究中显示出较高的预测调节活性,而染色质可及性的变化有限。为了评估富集分析中确定的两个转录因子对核心炎症程序基因表达的影响,他们在具有 JunB 或Cebpβ基因敲除的分化的 HoxB8 中性粒细胞中重复了相同的分析。CEBPB 显示炎症中性粒细胞的上调以及调节活动的增加。此外,JUNB 在中性粒细胞的炎症反应中起重要作用,它在气囊与血液的比较中也显示具有增加的基序富集。
基于这些分析,他们预测Cebpβ −/−细胞中核心炎症基因的表达会适度减少,而JunB −/−细胞中核心炎症基因的表达会出现更强烈的减少。在静息敲除(JunB−/−和Cebpβ−/−)与野生型细胞的直接比较中,他们观察到JunB−/−细胞(69个基因)中核心炎症程序的下调明显强于Cebpβ−/−细胞(图5e)。将酵母聚糖刺激的敲除细胞与野生型细胞进行比较,再次发现JunB−/−条件下核心炎症基因(51个基因)的显著下调,而Cebpβ−/−条件下则没有。
总之,这些结果表明,与WT细胞相比,成熟和迁移到炎症组织部位容易使中性粒细胞上调核心炎症程序的基因,而Cebpβ,特别是JunB的敲除导致核心炎症基因的诱导较弱。
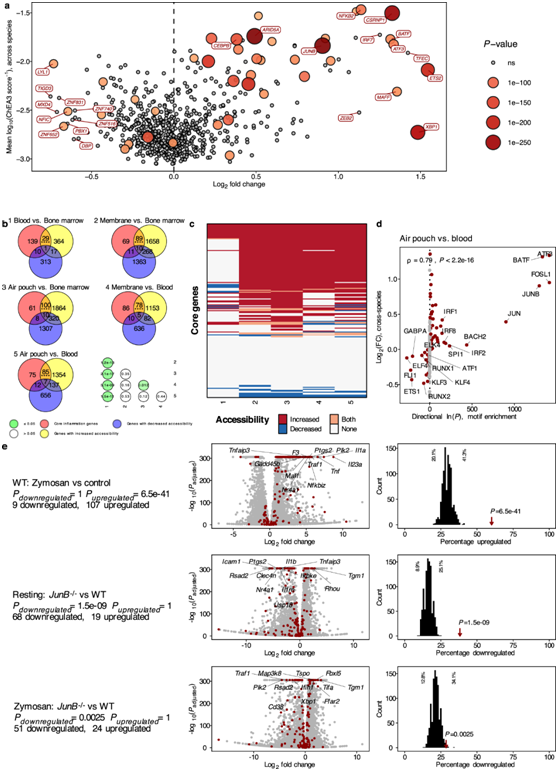
图5. 核心炎症程序中的基因倾向于随着成熟和激活而上调。
(a) 显示的是所有比较中基因表达与调节活性的平均 log 2差异倍数。 (b) 核心炎症程序的成员显示出染色质可及性增加。将炎症反应程序的基因部分与在所描述的比较中显示可及性增加/减少的基因列表进行比较。 (c) 每次比较的核心炎症程序基因可及性分析。(d) 转录因子的子集显示发炎中性粒细胞中基序富集增加和基因表达增加。使用 HOMER 进行基序富集分析。(e) 对用酵母聚糖处理的 HoxB8 细胞进行分析。
06
核心炎症程序的成员可以在激活的人和小鼠中性粒细胞的蛋白质水平上进行验证
为了通过实验验证核心炎症程序的成员,他们通过表面蛋白过滤基因列表,产生 36 个标记(图6a)。根据抗体的可用性,他们开发了一个流式细胞分析组合,包括经典谱系标记(人:CD15,小鼠:Ly6G)和五种预测为部分核心炎症程序的蛋白质:CD14、CD69、CD40、CD274 (PD-L1) 和IL-4R。
他们从外周血中分离出人中性粒细胞,从骨髓中分离出小鼠中性粒细胞,并在添加或不添加GM-CSF + LPS和GM-CSF + IFN-γ的情况下将其培养48小时以上(图 6b)。与未刺激的细胞相比,活化的小鼠中性粒细胞在含有LPS的条件下显著上调预测的核心炎症程序标记物CD14、CD40、CD69、PD-L1和IL-4R,在含有IFN-γ的条件下显著上调除CD69之外的所有标记物(图 6c)。人类中性粒细胞的这些标记物表现出高度一致的增加。在人类中性粒细胞中,CD40的上调仅限于一小部分(约2%)中性粒细胞群体,但在两种刺激的整体水平上都达到了显著水平(图6c)。
炎症状况之间的差异也很明显。在小鼠中性粒细胞中,与GM-CSF和IFN-γ相比,GM-CSF和LPS的组合导致CD14、CD69、IL-4R和CD40的表达更强地增加。PD-L1 的情况正好相反,它主要由 IFN-γ 信号传导驱动。此外,IFN-γ刺激降低了CD69的表达,而LPS则增加了CD69的表达。在人中性粒细胞中,GM-CSF 和 IFN-γ 的组合比 GM-CSF 和 LPS 的组合导致 CD14、CD69、IL-4R 和 PD-L1 的增加更强。
组合扩散图分析显示小鼠和人类中性粒细胞之间存在高度重叠,而细胞分布主要由实验条件驱动(图 6d)。相应地,两个物种的活化的中性粒细胞都表现出炎症反应标记物的持续上调(图 6e)。这些结果证实了预测的激活标记,进一步证实了中性粒细胞炎症反应程序的保守性,同时也揭示了物种和炎症状况之间的差异。
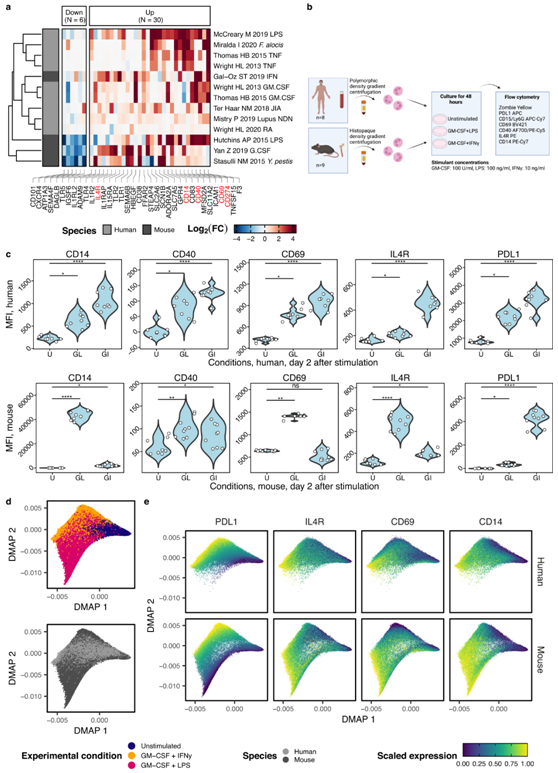
图6. 核心炎症程序在蛋白质水平上的实验验证。
(a) 鉴定炎症特异性蛋白质编码基因。 (b) 实验概述。分别从外周血或骨髓中分离人和小鼠的中性粒细胞,培养48小时,并用流式细胞仪进行分析。(c) 对静息和激活的小鼠和人中性粒细胞进行流式细胞分析。(d) 来自人类和小鼠的中性粒细胞的扩散图。(e) 由标记表达着色的扩散图嵌入突出了由激活标记的表达增加驱动的连续体。
07
中性粒细胞起源和炎症状况影响核心炎症程序的表达
中性粒细胞异质性受组织微环境的影响。为了评估组织来源对炎症中中性粒细胞表型的影响,他们用来自野生型 BL6 小鼠血液、骨髓和脾脏的配对白细胞制剂进行了刺激实验。在流式细胞分析数据的主成分分析中,静息中性粒细胞紧密聚集在一起,但基于IL-4R、CD69和CD40的细微基线表达差异,每个组织仍然可区分(图 7a)。激活的中性粒细胞明显偏离其静息状态的中性粒细胞,并根据组织和炎症状况达到不同的状态(图 7a)。
来自所有组织的中性粒细胞上调CD69和IL-4R,表明这些标记物可以在多种条件下用作中性粒细胞激活标记物(图 7a)。相反,CD40、CD14 和 PD-L1 的表达表现出更大的组织依赖性。CD40(在小鼠中性粒细胞中最为明显)在脾中性粒细胞中显著上调,而在血液中性粒细胞中则不太显著。相反,CD14 和 PD-L1 表达在血液中性粒细胞和骨髓中性粒细胞中诱导程度较高,但在脾中性粒细胞中诱导程度较低。
他们还注意到与激活刺激相关的差异,例如,与 LPS 相比,IFN-γ 更显著诱导 PD-L1。单细胞分析强调了所有器官的连续状态(图 7b),这是由核心炎症标志物表达增加驱动的(图 7c)。重要的是,核心程序已经在骨髓中性粒细胞中诱导,这表明用骨髓中性粒细胞进行的体外和过继转移实验可以描述炎症中中性粒细胞生物学的重要特征。
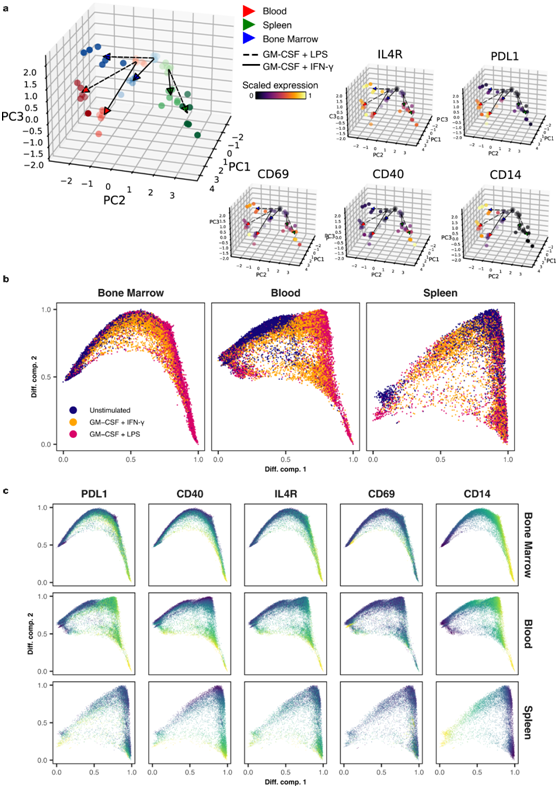
图7. 中性粒细胞起源和细胞因子刺激决定核心炎症程序的表现。
(a) 左:对每个样本的中位标记表达进行的主成分分析(PAC)揭示了由隔离器官(颜色编码)和细胞因子刺激(线段编码)驱动的中性粒细胞的不同表型。右:PCA 图按每个量化标记的表达进行着色。(b) 来自骨髓、血液和脾脏的中性粒细胞的扩散图。(c) 来自骨髓、血液和脾脏的静息和细胞因子刺激的中性粒细胞的扩散图,根据标记表达进行着色。
+ + + + + + + + + + +
结 论
本项研究在对 11 个小鼠和 13 个人类数据集的综合分析中,发现不同物种的中性粒细胞基因表达存在很强的相关性。在炎症中,中性粒细胞表现出显著的转录多样性,但共有核心炎症程序。该程序包括编码 IL-1 家族成员、CD14、IL-4R、CD69 和 PD-L1 的基因。与骨髓相比,血液中核心炎症基因的染色质可及性增加,并且在组织中进一步增加。转录因子富集分析表明 NF-κB 家族成员和 AP-1 复合物是重要的驱动因素,JunB敲除的 HoxB8 中性粒细胞显示静息和激活细胞中核心炎症基因的表达降低。在独立的单细胞验证数据中,I 型或 II 型干扰素、G-CSF 和大肠杆菌激活中性粒细胞会导致核心炎症基因上调。在 COVID-19 患者中,中性粒细胞中核心炎症基因的较高表达与更严重的疾病相关。用 GM-CSF、LPS 和 II 型干扰素进行体外处理可诱导核心炎症成员的表面蛋白上调。本项研究证明了中性粒细胞在稳态中的转录保守性,并确定了异质炎症条件下共有的核心炎症程序。
+ + + + +



 English
English


