文献解读|Exp Mol Med(12.153):人骨髓间充质干细胞单细胞RNA测序分析及功能亚群鉴定
✦ +
+
论文ID
原名:Single-cell RNA sequencing analysis of human bone-marrow-derived mesenchymal stem cells and functional subpopulation identification
译名:人骨髓间充质干细胞单细胞RNA测序分析及功能亚群鉴定
期刊:Experimental And Molecular Medicine
影响因子:12.153
发表时间:2022.04.01
DOI号:10.1038/s12276-022-00749-5
背 景
间充质干细胞(MSCs)主要位于骨髓中。MSCs是多能的,发挥免疫调节功能和表现出三系分化能力,这表明其在组织再生和疾病治疗中具有广泛应用的潜力。然而,MSCs是一群混合细胞,其相对较低的纯度限制了其在临床上的进一步应用。因此,鉴定骨髓间充质干细胞的亚群,明确其不同功能,探讨其相互关系,对骨髓间充质干细胞的基础研究和临床应用具有重要意义。scRNA测序可以通过扫描样本中一个细胞的RNA表达谱,轻松识别细胞类型、状态、功能和关系。scRNA测序提供了对不同类型细胞和组织的生理和病理过程的见解,并且已用于干细胞的亚群和功能研究,但MSC的异质性还有待深入研究。基于这些背景,作者旨在通过 scRNA 测序研究 MSCs 的功能亚群。
实验设计

结 果
01

MSCs的scRNA测序确定不同的亚群
从健康供体的骨髓分离的第1代MSCs,并且细胞质量较好。MSCs对CD29、CD44和CD105呈阳性,而对CD14、CD34和CD45呈阴性,共捕获6998个细胞并将其分为10个簇(图 1a)。系统聚类分析显示这10个聚类之间关系密切(图1)。以CD14和CD163表达为特征的簇9和10具有不同的RNA谱和相对独立的位置,鉴定为来自骨髓的单核细胞/巨噬细胞,(图1a-b)。第1和第3组标记基因较少的簇,以及没有标记基因的簇 7 和 8,认为是过渡亚群。此外,显示更高水平的干性标志物(包括 SOX4、GAS1 和 DPP4)的簇 2预测为干性亚群,而表现出细胞因子和成骨/脂肪形成因子表达的簇 4 确定为功能亚群 (图1c)。簇5和6都表现出增殖和细胞周期相关基因的表达,但分为两个簇,归类为增殖亚群1和2(图1c)。
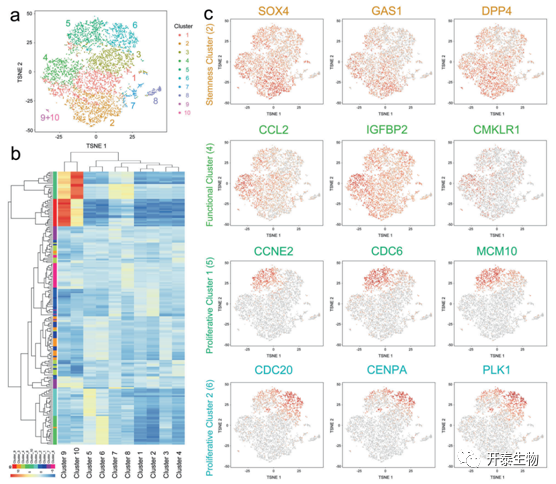
图 1. MSCs的scRNA测序确定不同的亚群
02

MSC亚群的GO和KEGG分析
为了研究这些鉴定的亚群的可能功能,进行了GO和KEGG分析(图2)。对于生物过程类别,干性亚群的标记基因在炎症反应、脂肪细胞分化、骨骼系统发育和细胞周期的负调控中富集,表明这些亚群具有干性维持和多能性分化的特征(图2a)。对于功能亚群,其标记基因主要在炎症和免疫反应中富集(图2b)。此外,有丝分裂细胞周期的G1/S转换在增殖亚群1的生物过程类别中富集,而有丝分裂细胞周期的G2/M转换在增殖亚群2的生物过程类别中富集,这表明这两个增殖簇在细胞周期中的不同阶段(图2c-d)。
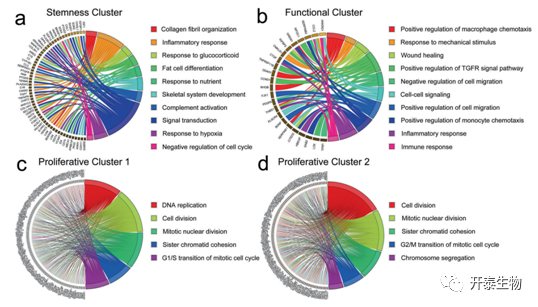
图 2. MSC亚群的GO和KEGG分析
03

MSC亚群的单细胞轨迹分支分析
选择簇1-6来构建一个轨迹分支,该分支包含两个末端,分别对应于两个不同的细胞命运(图3a)。如图3b和c所示,过渡亚群1(簇1)和干性亚群(簇2)位于轨迹的根部。此外,增殖亚群均位于细胞命运1。细胞命运2由部分过渡亚群2(簇3)和功能亚群(簇4)组成。细胞增殖相关基因,如MKI67、MCM4和PCNA在细胞命运1中高表达,IGFBP2、CTGF和TIMP3的水平在细胞命运2中上调,但在细胞命运1中下调(图3d)。作者确定了干性亚群和功能性亚群之间的分化关系,分别特征表型CD26+和CMKLR1+来标记。培养7天后,分离的CD26+MSCs的CD26+比率下降,CMKLR1+比率上升。此外,CD26+比率在分离的CMKLR1+ MSCs中较低,并且在培养7天后进一步降低(图3e)。
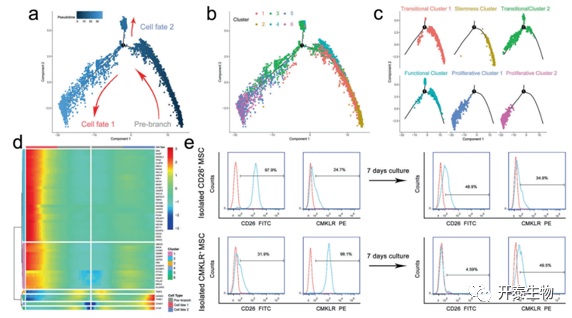
图 3. MSC亚群的单细胞轨迹分支分析
04

CMKLR1+ MSC 功能亚群的免疫调节潜力
通过流式细胞术将MSCs分为CMKLR1+ MSC功能亚群和CMKLR1- MSC亚群,包括干细胞和增殖亚群,以进一步研究它们的潜力。结果表明,CMKLR1+ MSC 功能亚群的增殖率低于含有其他 MSC 的群体(图 4a)。与 scRNA 测序结果一致,免疫相关细胞因子,包括 CCL2、TGF-β、IGFBP2 和 PTX3,在 CMKLR1+ MSC 功能亚群中高度表达。此外,成骨和脂肪生成相关因子(如 GREM1 和 CTGF)的表达在 CMKLR1+ MSC 功能亚群中上调(图 4b)。此外,与抑制 PBMC 增殖相关的 CMKLR1+ MSC 功能亚群的免疫调节潜力强于 CMKLR1- MSC 亚群(图 4c)。MSC免疫调节潜力与样品中 CMKLR1+ MSC 的百分比呈正相关(图 4d)。
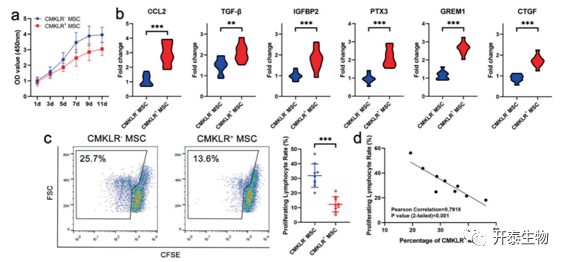
图 4. CMKLR1+ MSC功能亚群的免疫调节潜能
05

CMKLR1+ MSC 功能亚群的分化潜能
进一步研究CMKLR1+ MSC 功能亚群的成骨和成脂分化潜能。ARS 染色结果显示 CMKLR1+ MSCs 的矿化水平较高,表明 CMKLR1+ MSCs 具有更强的成骨分化潜能(图 5a)。ALP 染色和定量测定显示一致的结果(图 5b)。相比之下,ORO 染色显示 CMKLR1+ MSCs 中的脂滴比 CMKLR1- MSCs 中的脂滴少,表明进行脂肪形成分化的能力较弱(图 5c)。使用体内模型评估 CMKLR1+ MSCs 的成骨和成脂分化能力。Masson 染色和 H&E 染色均显示CMKLR1+ MSC 组的新骨形成量远大于 CMKLR1- MSC 组,这也通过组织中 OCN+成骨细胞的数量得到证实(图 5d)。如H&E染色所示,CMKLR1+ MSC组的体内脂肪细胞形成较低。此外,CMKLR1+ MSC 组的 Perilipin-1+ 脂肪细胞也较少(图 5e)。
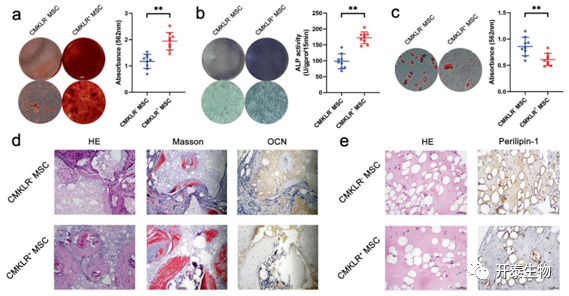
图 5. CMKLR1+MSC功能亚群的分化潜能
06

不同传代间充质干细胞scRNA测序图谱的比较
使用 AGGR 分析,比较同一 MSC 样本的第 1 代和第 3 代之间的 scRNA 测序数据。新的集群 5 和 8 主要由第 3 代的 MSCs 组成。此外,第 3 代的 MSC 在第 4 和 9 组的包含率高于第 1 代的 MSC。相反 ,第 1 代的 MSC 在第 6、7 和 10 组中占主导地位(图 6a 和 b)。通过筛选10 个簇的标记基因,由 CD14 表达定义的簇 10 鉴定为单核细胞/巨噬细胞。簇 1、5 和 9 的标记基因较少,认为是过渡亚群。以细胞周期相关基因表达为特征的簇 3、6 和 7 确定为增殖亚群。包含SOX4、EGR2和IGFBP1等标记基因的Cluster 2鉴定为干性亚群,CCL2、CTGF和GREM1表达的Cluster 4鉴定为功能亚群。显示 P62 表达的簇 8 是新发现的,主要由第 3 代的 MSCs 填充(图 6c)。第 1 代 MSCs 的增殖率高于第 3 代 MSCs 的增殖率(图 6d)。
有趣的是,第 3 代 MSCs 的成骨分化能力强于第 1 代的 MSCs,但成脂分化试验显示相反结果(图6e)。此外,通过CFSE测定显示的免疫调节潜力在第3代的MSCs中也更强(图6f)。对簇8的标记基因的GO分析显示,该MSC亚群与细胞氧化还原稳态、内质网应激、自噬和生长的负调节有关,表明该簇可能是一个衰老亚群(图6g)。此外,与第1代相比,在第3代的MSCs中观察到更多的衰老细胞(图6h)。
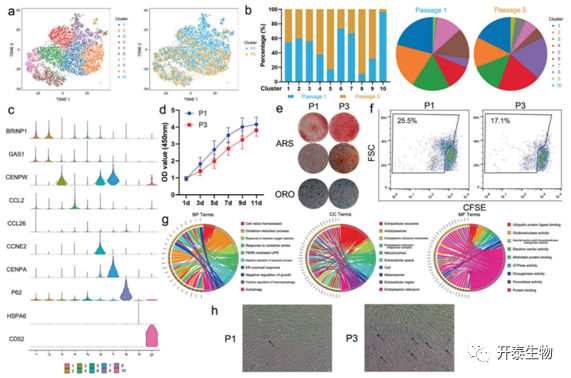
图 6. 不同传代间充质干细胞scRNA测序谱的比较
07

不同来源骨髓间充质干细胞scRNA测序图谱的比较
比较相同传代的两个不同MSC样品(MSC1 P1和MSC2 P1)的scRNA测序数据时,AGGR分析表明两个MSC样品完全分离成两个独立的没有连接的亚群(图7a)。对MSC2 P1的进一步亚群分析显示,鉴定出10个簇,与MSC1 P1的簇数匹配(图7b)。作者鉴定了由DPP4标记的干性亚群、由CMKLR标记的功能性亚群以及由CCNE2和CENPA标记的增殖性亚群1和2(图7c)。尽管MSC2 P1中亚群的标记基因与MSC1 P1中的标记基因并不完全相同,但大多数基因在MSC1 P1和MSC2 P1之间的同一亚群中一致表达(图7d)。此外,在MSC1 P1和MSC2 P1之间,每个亚群的百分比几乎相等(图7e)。

图 7. 不同来源骨髓间充质干细胞scRNA测序图谱的比较
+ + + + + + + + + + +
结 论
作者研究确定了不同传代或来自不同供体的MSCs的scRNA测序谱,并揭示了三个亚群,即干性亚群、功能性亚群和增殖性亚群。发育轨迹分析表明,干性亚种群是根,然后成为功能亚群或增殖亚群。功能亚群具有较强的免疫调节和成骨分化能力,但增殖和成脂分化能力较低。不同传代或不同供体来源的MSCs具有不同的细胞图谱,这可能是其功能不同的原因。本研究为骨髓间充质干细胞在单细胞水平的生物学特性和临床应用提供了新的见解,有助于拓展其在临床上的应用。
+ + + + +



 English
English

