文献解读|Microbiome(15.5):多组学揭示影响重度抑郁症抗抑郁药治疗结果的微生物决定因素
✦ +
+
论文ID
原名:Multi-omics reveal microbial determinants impacting the treatment outcome of antidepressants in major depressive disorder
译名:多组学揭示影响重度抑郁症抗抑郁药治疗结果的微生物决定因素
期刊:Microbiome
影响因子:15.5
发表时间:2023.08.28
DOI号:10.1186/s40168-023-01635-6
背 景
越来越多的证据表明,肠脑轴紊乱可能是重度抑郁症 (MDD) 的潜在原因之一。然而,抗抑郁药对肠道微生物群的影响以及肠道微生物群在影响抗抑郁药功效中的作用仍不完全清楚。
实验设计
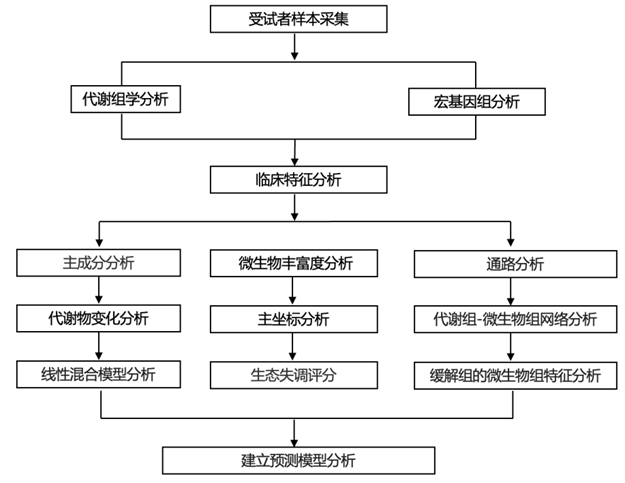
结 果
01
ESC 治疗改善 MDD 血浆代谢物失调
本研究纳入了来自大型队列的110 名 MDD 患者(41 名男性和 69 名女性)接受escitalopram(ESC,一种抗抑郁药) 单一疗法。同时,166 名健康个体(68 名男性和 98 名女性)匹配为健康对照(HC)(图1)。MDD组和HC组之间的年龄、性别和身体质量指数(BMI)没有显著差异。ESC治疗12周后,MDD患者汉密尔顿抑郁量表(HAMD-17)17项评分显著降低。其中,56例患者(50.91%)达到缓解(定义为HAMD-17≤7的缓解者),54例患者(49.09%)仍处于非缓解状态(定义为HAMD-17>7的非缓解者)。缓解(R)组和未缓解(NR)组除受教育程度和基线HAMD评分外,其他基线特征差异均无统计学意义,ESC 治疗后第 2 周和第 12 周,从 MDD 患者身上收集了总共 285 份粪便样本和 321 份血浆样本;从HC身上(在基线时)分别收集了 166 份粪便和血浆样本。所有样本均经过宏基因组测序和非靶向代谢组学分析。
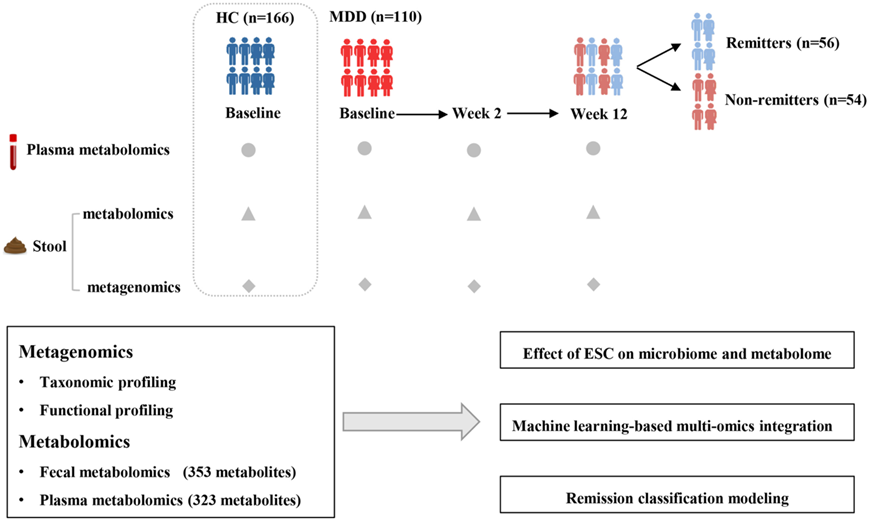
图1. 研究设计概述。
主成分分析(PCA)显示MDD 患者的总体血浆代谢特征与 HC 显著不同(图2A)。与 HC 组相比,MDD 组显示 7 种代谢物富集,37 种代谢物缺失(图 2 B)。MDD患者的特点是有机酸代谢物(大部分属于脂肪酸)水平较高,如3-羟基丁酸、棕榈酸、2-羟基丁酸、棕榈酸和亚油酸,以及氨基酸水平较低酸性代谢物,包括L-酪氨酸、L-苯丙氨酸、L-丙氨酸、L-缬氨酸、L-脯氨酸、L-蛋氨酸和谷氨酸。
他们采用线性混合模型(LMM)分析ESC治疗后血浆代谢组分的变化,分别在治疗2周和12周后确定了4个和8个血浆代谢物的变化(图2C),多种氨基酸代谢物表达上调,包括L-酪氨酸、L-蛋氨酸、L-苯丙氨酸、L-丙氨酸和L-色氨酸。L-色氨酸是神经递质 5-羟色胺 (5-HT)(通常称为血清素)的前体。L-色氨酸具有穿过血脑屏障的能力,血浆色氨酸水平通常是中枢5-HT活性的可靠指标。尽管进行了 ESC 治疗,但没有观察到血清 5-HT 水平升高。然而,另一种肠道微生物衍生的色氨酸代谢物,吲哚-3-丙酸(I3PA)显著上调。最近有报道称 I3PA 可以促进神经再生和修复。相比之下,有机酸(大部分属于脂肪酸)显著下调,包括硬脂酸、油酸、亚油酸、2-羟基丁酸、棕榈油酸、4-脱氧赤藓酸、3-羟基丁酸、苯酚和棕榈酸。上调的代谢物在HC组中富集,而下调的代谢物在MDD组中富集。6个上调代谢物和2个下调代谢物与HC富集代谢物重叠,0个上调代谢物和6个下调代谢物与MDD富集代谢物重叠。这些结果表明 ESC 治疗通过上调氨基酸代谢和下调脂肪酸代谢来改善 MDD 患者血浆代谢物的失调。
有趣的是,“好”代谢物(在HC组中富集的代谢物,如 L-酪氨酸、L-色氨酸和 I3PA)和“坏”代谢物(在MDD组中富集的代谢物,如硬脂酸、油酸和亚油酸)是仅在R组中上调和下调(图 2D)。这些结果表明,R组和NR组在ESC治疗后血浆代谢物的变化是不同的,这可能与ESC的治疗结果有关。值得强调的是,一些代谢物,包括色氨酸和I3PA,在治疗反应中表现出改变,是与肠道微生物群相关的代谢物。这一观察结果有力地表明肠道微生物群参与了ESC的作用机制。
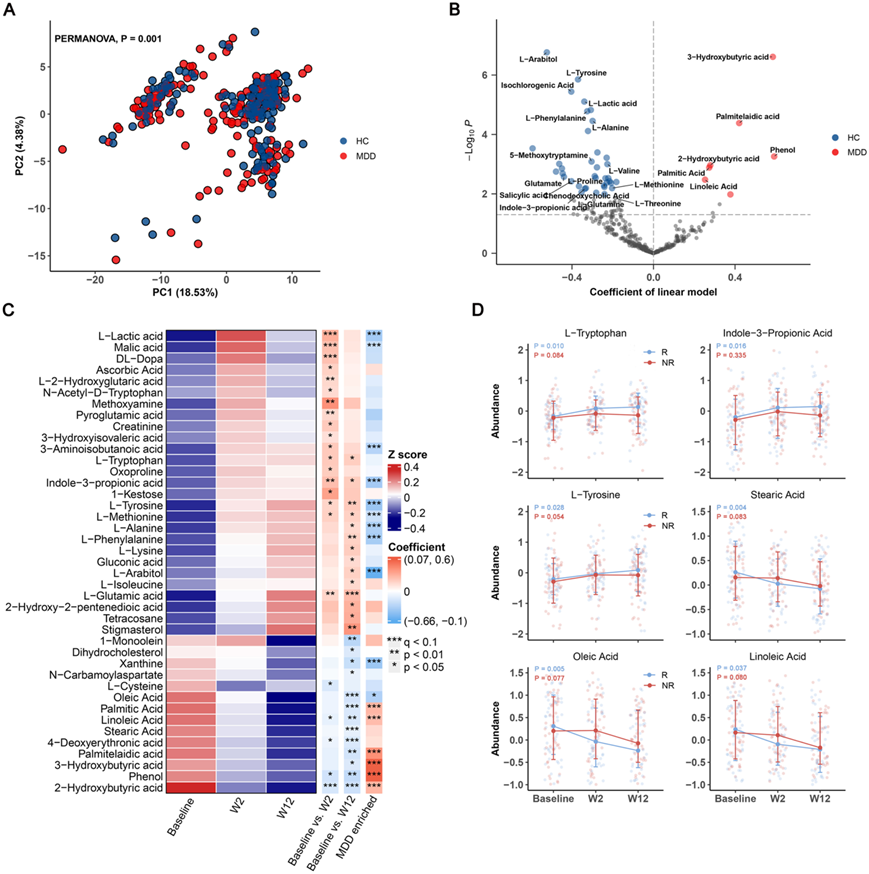
图2. MDD患者血浆代谢组失调,以及ESC治疗对血浆代谢物的影响。
(A) 基于血浆代谢组学特征的主成分分析 (PCA) 显示 MDD 患者和 HC 患者的血浆代谢特征之间存在显著差异。(B) MDD 患者和 HC 之间代谢物水平差异回归系数的火山图。(C) 热图显示 41 种血浆代谢物的平均丰度,根据线性混合模型 (LMM) 确定。(D) 6 种血浆代谢物的纵向变化,表现出 R 组和 NR 组之间的差异趋势。
02
ESC 治疗对肠道微生物群产生抑制作用
接下来,他们重点研究 ESC 对肠道微生物群的影响。ESC处理显著降低了物种水平的丰富度,但没有降低基因水平。经过亚组分析,观察到从基线到第 12 周,NR 组微生物丰富度的下降特别明显。然而,值得注意的是,在基因水平上,从基线到第 2 周观察到微生物丰富度暂时增加在R组中,物种或基因水平的丰富度没有显著变化(图3A)。这些结果表明,ESC 对肠道微生物群的影响在 R 组和 NR 组之间以及短期(基线至第 2 周)和长期(基线至第 12 周)治疗期间之间存在差异。
PERMANOVA 结果显示,肠道微生物组成在第 12 周发生显著变化,但在第 2 周则没有变化(图 3 B)。即使在第 12 周,MDD 患者和 HC 之间的微生物组成在第 12 周时仍然存在明显差异。这表明 ESC 治疗并没有有效地将 MDD 患者的肠道微生物组转变为更健康或更类似于 HC 的状态。然而,HAMD-17 评分与主坐标分析(PCoA)呈负相关,这表明抑郁症状的缓解与肠道微生物群的变化之间存在显著相关性。
他们以HC样本为参考,估计了每个MDD样本的生态失调评分(DS),并计算了Bray-Curtis距离的中值MDD 和 HC 队列之间的关系。在基线和第 12 周,NR 组的 DS 高于 R 组,并且在第 12 周存在显著差异(图3C)。根据研究结果,ESC 并没有改善整体肠道微生物状态,但与 R 组相比,NR 组的肠道微生物群受到更严重的干扰。从基线到第 2 周,观察到 5 个物种的促进作用和 7 个物种的抑制作用。同样,从基线到第 12 周,ESC 处理导致 6 个物种的促进和 9 个物种的抑制(图 3D)。在ESC处理后出现显著变化的物种中,观察到其中几个属于孢子形成细菌,包括Clostridium disporicum、Turicibacter sanguinis、Eubacterium hallii、Coprococcus comes和Clostridium perfringens。。ESC处理后,所有样本中145条通路发生显著改变,其中143条通路下调。进一步的亚组分析显示,NR组有17条通路下调,而R组没有通路改变(图3E)。
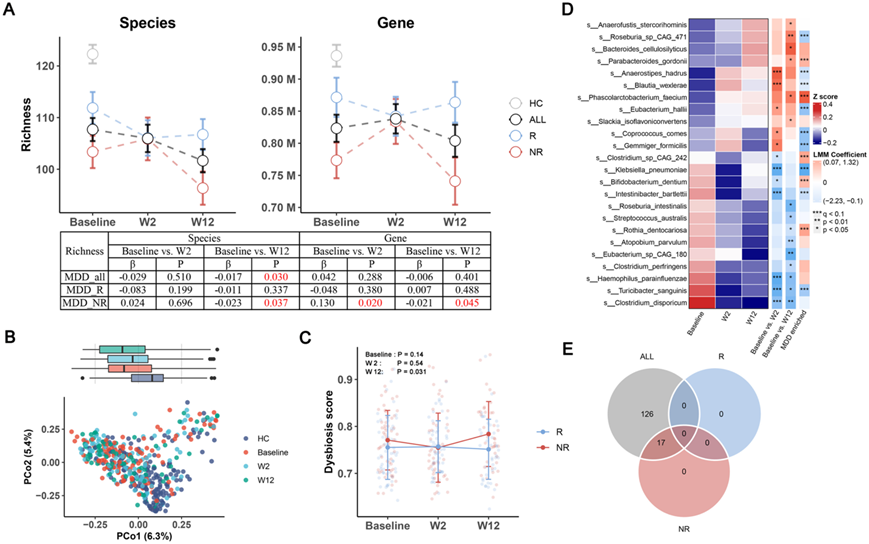
图3. ESC 治疗对肠道微生物组的影响。
(A) ALL、R 和 NR 组从基线到第 12 周的物种和基因水平微生物丰富度的变化。(B) 基于不同群体的宏基因组图谱的主坐标分析(PCoA)图。(C) R 组和 NR 组的生态失调评分 (DS) 从基线到第 12 周的变化。(D) 热图显示了 24 个物种的平均丰度。(E) ESC 干预后 ALL、R和 NR 组中 metaCyc 通路显著下调的维恩图。
03
血浆代谢组和肠道微生物组的整合网络
ESC 治疗影响肠道微生物组和血浆代谢组,这些结果与之前的研究结果一致,表明肠道微生物群可以在调节个体血浆代谢物谱中发挥作用,影响程度根据具体疾病或状况而变化。因此,他们继续探索两组组学数据之间的关联,首先使用分别来自 HC 和 MDD 队列的样本匹配组学数据进行 Procrustes 分析。结果显示,MDD 患者和 HC的血浆代谢组和肠道微生物组之间存在弱相关性(图 4 A)。但是MDD和 HC队列中粪便代谢组和肠道微生物组之间存在更强的相关性。鉴于血浆代谢组和肠道微生物组之间缺乏显著的总体关联,他们推测这种关联更有可能发生在代谢物和肠道微生物群之间的个体水平上,而不是整体的组间关联。在MDD组和HC组之间,由肠道菌群解释的血浆代谢物的方差存在显著差异,其中在MDD人群中解释的方差更高(图4B)。这些结果表明,与HC对照相比,肠道微生物对抑郁症患者的血浆代谢物有更强的影响。总体而言,在血浆代谢物和肠道菌群之间的关联中检测到MDD特异性模式。接下来,他们利用所有MDD样本构建glmmLasso模型,以进一步建立个体血浆代谢物与肠道菌群之间的关联。在 109 种代谢物和 139 个物种之间发现了总共 255 个显著关联(图4C)。其中,ESC处理后改变的19种代谢物与细菌种类相关,且上调的代谢物数量远高于下调的代谢物。例如,L-色氨酸与Parabacteroides goldsteinii 和 Streptococcus thermophilus相关。后者属于色氨酸代谢细菌,其中含有色氨酸酶,可以通过色氨酸代谢维持细菌的生长和生存,这些细菌产生的代谢物可以调节微生物多样性,给宿主带来益处(图4C)。他们发现I3PA与Bacteroides plebeius和Streptococcus cristatus相关,且I3PA与物种丰富度呈显著正相关(图4D)。
这些结果表明 ESC 治疗后血浆代谢物改变与肠道微生物之间存在潜在相关性,其中氨基酸代谢和色氨酸衍生物可能发挥重要作用。
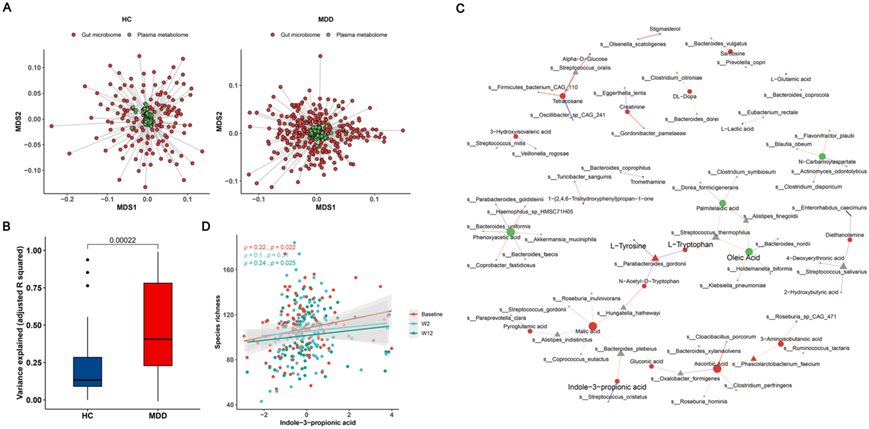
图4. 血浆代谢组和肠道微生物组之间的关联。
(A) Procrustes 分析的多维标度 (MDS)图显示 MDD 和 HC 队列中血浆代谢组和肠道微生物组之间的总体关联。(B) 与HC相比,MDD患者的肠道菌群解释的血浆代谢物差异明显更高。(C)血浆代谢物和微生物物种之间的关联网络。(D) 散点图显示了在三周时 Spearman 物种丰富度与吲哚 3-丙酸 (I3PA) 之间的相关性。
04
不同缓解组的基线微生物组特征
接下来的目标是研究肠道微生物群对抗抑郁功效的预测潜力,旨在比较 R 组和 NR 组在基线时的微生物组特征。尽管 PERMANOVA 分析显示,基线时两个亚组之间的微生物组成没有显著差异(图 5 A),但两个物种中 R 组的微生物丰富度均显著高于 NR 组和基因水平(图 5B)。此外,他们观察到一些孢子形成类群在R组中比NR组更丰富,包括Clostridiaceae、Eubacterium rectale 和C. comes(图5C)。孢子形成菌可以抵抗外界环境刺激,促进肠道菌群重建,恢复肠道内稳态。值得注意的是,核心共生物种E. rectale在R组的丰度在第3周时始终高于NR组,并且其丰度在基线和第12周时与物种丰度呈正相关。E. rectale是一种严格的厌氧菌,可通过从不可消化的纤维中产生丁酸盐和其他短链脂肪酸来促进宿主肠道健康,可维持和改善心理健康。与产孢菌的情况类似,大多数产孢基因在R组的丰度高于NR组(图5D)。22个产孢基因中有18个与物种丰富度呈显著正相关。因此,他们推测微生物产孢可能有助于肠道菌群抵抗ESC诱导的扰动。
为了更好地了解R和NR组在基线时的微生物差异,他们使用Wilcox检验比较了两个亚组之间非冗余基因的丰度,共获得了32231个差异基因。使用冠层聚类算法将差异基因聚类成共丰度组(CAG),然后对CAG进行分类注释,将大多数差异基因标注为Clostridales (78.40%)。与NR组相比,R组显著富集了CAG标记的产丁酸菌,包括Ruminococcus lactaris、 Faecaecalibacterium prausnitzii、E. rectale和Romboutsia。丁酸通过抑制炎症和癌变,加强结肠防御屏障的各个组成部分,减少氧化应激,对胃肠道的平衡产生积极的影响。此外,经CAG注释的有益菌,如Bifidobacterium animalis 和 Lactobacillus sanfranciscens,在R组也得到了富集。这些研究结果证明了R组在基线时整体肠道微生物群状况可能优于NR组。
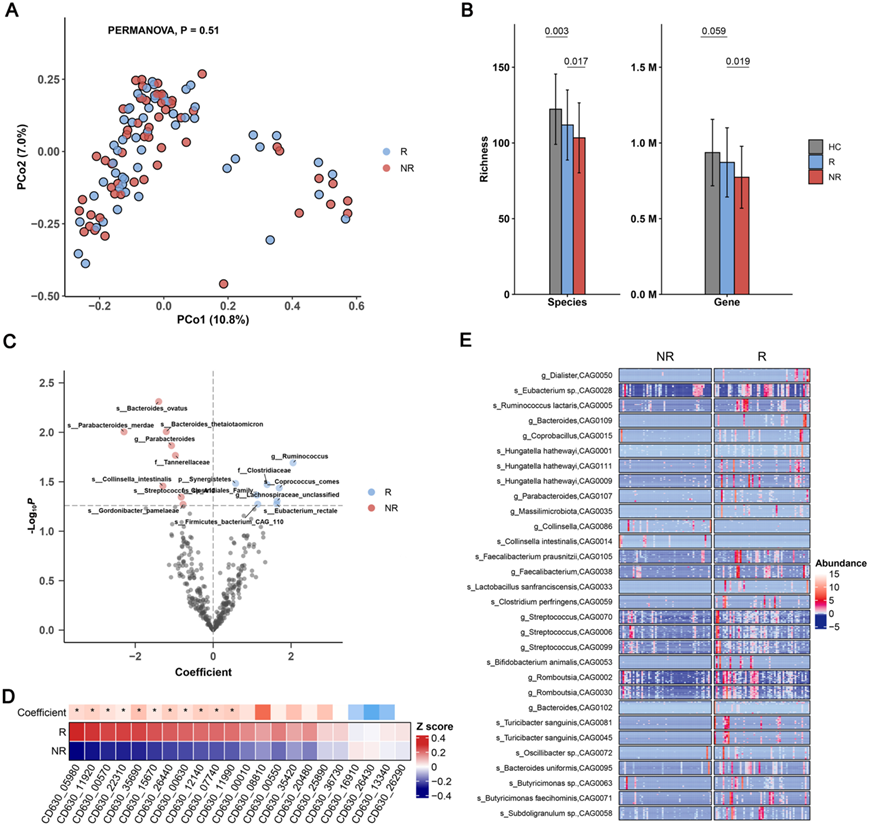
图5. R 组和 NR 组基线时微生物组的比较。
(A) PCoA分析。(B) 以 HC 为参考,R 组和 NR 组基线时微生物物种(左)和基因(右)丰富度差异。(C) 缓解组肠道微生物物种回归系数的火山图。(D) 热图显示了 22 个孢子形成基因的平均丰度,其中 11 个在 R 组中富集,由多元回归模型确定。(E) 基线时 R 组和 NR 组之间差异丰度基因的共丰度组 (CAG) 热图。
05
孢子形成基因作为 ESC 响应 MDD 缓解的预测因子
为了探索基线肠道微生物群对 MDD 患者治疗缓解的预测潜力,他们使用源自基线样本的三个不同特征集(分类群、多样性和孢子形成基因)构建了预测模型。使用受试者工作特征 (ROC) 的曲线下面积 (AUC) 评估模型性能。在建模结果中,微生物类群表现出较低的性能(平均 AUC = 0.61)(图 6 A)。然而,最高的平均预测性能是通过孢子形成基因模型(平均 AUC = 0.736)与十个外环模型(AUC = 0.710,通过合并所有外环测试结果绘制的 ROC)相结合实现的(图 6 B)。鉴于ESC对孢子形成基因的潜在影响,他们还根据孢子形成基因从基线到第2周的变化预测了MDD患者的临床缓解。结果表明,平均AUC和联合AUC分别为0.734和0.701,表明模型的预测性能中等至良好。
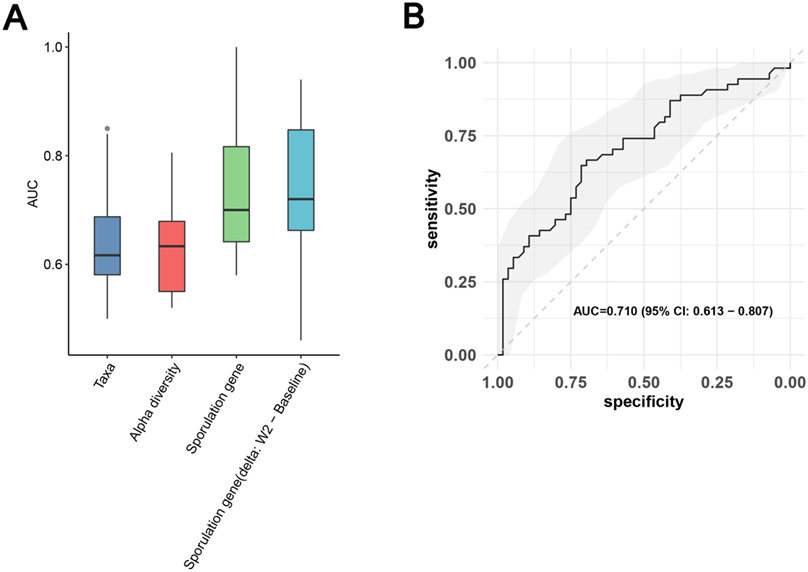
图6. 基线肠道微生物组特征对 MDD 患者临床缓解的预测价值。
(A) 每个特征集10个外环测试结果的AUC箱线图。 (B) 使用基于孢子形成基因的RF模型的10个外环测试结果的串联ROC曲线。
+ + + + + + + + + + +
结 论
本项研究发现,ESC 通过上调缺乏 MDD 的氨基酸和下调富含 MDD 的脂肪酸来改善血液代谢异常。另一方面,ESC的使用对肠道菌群的抑制作用相对较弱,导致微生物丰富度和功能下降。基于机器学习的多组学综合分析表明,肠道微生物群导致血浆代谢物的变化,并与色氨酸等多种氨基酸及其肠道微生物衍生的代谢物I3PA相关。值得注意的是,在第 12 周时,基线微生物丰富度与临床缓解之间存在显著相关性。与非缓解者相比,达到缓解的个体具有更高的基线微生物丰富度、更低的菌群失调评分以及更复杂和组织良好的群落微生物群内的结构和细菌网络。
+ + + + +



 English
English


