文献解读|Cell Host Microbe(30.3):对四个身体部位微生物组的纵向分析揭示了健康和疾病期间的核心稳定性和个体化动态
✦ +
+
论文ID
原名:Longitudinal profiling of the microbiome at four body sites reveals core stability and individualized dynamics during health and disease
译名:对四个身体部位微生物组的纵向分析揭示了健康和疾病期间的核心稳定性和个体化动态
期刊:Cell Host & Microbe
影响因子:30.3
发表时间:2024.03.12
DOI号:10.1016/j.chom.2024.02.012
背 景
人类微生物组由居住在不同身体部位的高度动态的微生物群落组成,参与复杂的宿主-微生物相互作用,显示出特定区域的复杂性。目前的研究往往缺乏对于捕获稳定性特征至关重要的密集纵向采样,从而限制了对宿主-微生物相互作用的基本了解。
实验设计
结 果
01
研究设计的描述
研究团队分析了 86 名参与者的粪便、皮肤、口腔和鼻腔微生物组,历时长达 6 年(图1A)。该队列由 41 名男性和 45 名女性组成,年龄在 29 岁至 75 岁之间(55 ± 9.8 岁),BMI 范围为 19.1-40.8 kg/m2 。该队列的一个独特特征是参与者在每个时间点的多组学表型(图 1 B)。他们进行了非靶向蛋白质组学(302 个蛋白质)、非靶向代谢组学(724 个带注释的代谢特征)、靶向脂质组学(846 个带注释的脂质)和 62 项靶向细胞因子和生长因子分析,以及 51 种临床标志物鉴定,包括 C 反应蛋白 (CRP)、血浆样本中的空腹血糖 (FG)、糖化血红蛋白 (HbA1C)、低密度脂蛋白 (LDL) 和高密度脂蛋白 (HDL)(图 1 A)。血糖控制评估,包括对所有参与者进行年度口服葡萄糖耐量测试,以及对 58 名受试者进行金标准稳态血浆葡萄糖 (SSPG) 检测,将 28 名受试者归类为胰岛素敏感 (IS),将 30 名受试者归类为胰岛素抵抗 (IR) (图 1C)。
皮肤和鼻腔微生物组样本共同呈现三角形分布,主要由三个优势属驱动:表皮杆菌、棒状杆菌和葡萄球菌(图1D)。组内相关系数(ICC)分析证实,微生物个性化在扩增子序列变异(ASV)水平上比在更宽的分类分辨率下更为明显,突出了更精细的分类分辨率下更强的个性化。除了个人和环境因素的影响外,他们还观察到4个身体部位微生物组的不同生态属性(图1E)。粪便菌群表现出最大的丰富度和均匀度,凸显了其本质的复杂性和功能意义。相比之下,尽管皮肤微生物组的丰富度分布与鼻腔微生物组相似,但由于其均匀度低于鼻腔微生物组,因此显示出更偏态的群体。这些通常随着疾病进展发生变化的生态特征与之前在IR相关肠道生态失调(以粪便微生物组的α多样性显著降低为特征)方面的发现一致。
在对单个身体部位纵向观察的基础上,他们将“核心微生物组”定义为随时间推移持续存在的微生物,代表每个身体部位可能不可或缺的属。有趣的是,粪便和口腔微生物组保持着超过25个高度流行的核心属,而鼻腔和皮肤微生物组只有3个核心属(图1F)。

图1. 四个身体部位微生物组的纵剖面。
(A)研究设计。(B)不同组学类型的样本数重叠。(C)应激、胰岛素抵抗和健康样本的比例。(D)微生物组样品按身体部位的均匀流形近似和投影(UMAP)。(E)微生物群落丰富度和均匀度的密度分布。(F)每个身体部位纵向患病率最高的100个微生物群属的排名流行曲线。
02
身体部位微生物群落的不同分类单元的稳定性:个性化干预的潜在途径
接下来,他们研究了不同部位微生物组在属水平上的稳定性,假设稳定性是分类群和部位特异性的,为每个属定义了一个度量“微生物个体度”(DMI),它量化了个体与种群的相似性;高DMI意味着微生物类群具有高度的个体特异性。他们还计算了“科评分”(FS),以评估科内的微生物差异。对粪便、皮肤、口腔和鼻腔微生物组的扩展观察也表明,与不同个体之间观察到的差异相比,个体内和科内的差异显著较小(图2A)。个体内,随着时间的推移,一个属内ASV的完全转化率在鼻腔微生物组中最高,其次是皮肤,粪便和口腔。尽管整体群落稳定,但这一发现强调了微生物组亚属水平上显著的个体内生态动态。
无论相对丰度如何,粪便微生物组的DMI均较高(图2B),尤其是拟杆菌门(图2C),可能是由于其显著的适应性进化和显著的定植抗性。此外,粪便微生物组的FS最低,而科内口腔和鼻腔微生物组的相似性较大,原因可能是共同的生活环境或微生物组的直接交换。
不同身体部位的DMI差异很大,这可能归因于固有的生态位特异性分类复杂性(图2D)。其中鼻腔中的棒状杆菌和粪便中的拟杆菌分别显示最高的DMI。这些结果表明,适应各自生态位的特定微生物类群可能表现出增强的个体化。因此,人体各部位的微生物群落在很大程度上是由生态位特异性相互作用形成的。相比之下,环境菌属如克雷伯菌属和嗜血杆菌属在所有检查的身体部位均显示出较低的DMI,这表明外部环境因素对宿主微生物组的个性产生了相对较弱的影响。

图2. 微生物组的个体在属和身体部位之间存在显著差异。
(A)布雷-柯蒂斯差异性比较。(B) DMI分数。(C)按身体部位和门划分的平均DMI雷达图。(D)代表粪便、皮肤、口腔和鼻腔微生物群的DMI梯形图。
03
微生物特性与稳定性的相互作用:来自纵向多位点微生物组分析的见解
先前的研究表明,微生物组的稳定性是高度特化的。因此,他们探索了微生物特性和身体各部位稳定性之间的关系。总体再定植率与三个身体部位的DMI均显著相关,但口腔微生物组除外(图3A),口腔微生物组本质上保持了较高的再定植率。这种相关性在鼻腔微生物组中最明显(图3A)。纵向数据还可以量化样本对之间在收集日期间隔方面的差异,从而追踪微生物组随时间推移的稳定性,据报道,在IBD相关肠道生态失调中,收集日期间隔的差异较高。随着时间的推移,粪便微生物组的变化更慢,鼻腔部位的变化速度最快(图3B)。
接下来,他们研究了微生物组动力学是否在群落水平和单个分类群的个体内跨身体位点共同关联。层次聚类表明,皮肤和鼻腔部位之间的微生物组动态具有很强的联系,而粪便微生物组的动态与身体其他部位的相关性较低(图3C)。微生物组稳定性的位点间相关性表明系统微生物协调,可能由共同黏膜系统调节。他们发现18.23%的粪便属配对(5671)在个体内显著相关,主要是厚壁菌门(Firmicutes)(图3D)。他们通过搜索样本微生物共线性进一步研究了身体部位之间的微生物相互作用,来自皮肤和鼻腔部位的成员相关性最强。虽然身体部位之间的生态失调微生物组易位已有报道,但本项研究的结果表明,这些易位病例可能不涉及生态位特异性核心类群。此外,与相互依赖程度较低的属相比,相互依赖程度较高的属表现出较低的DMI(图3E),这表明高度个体化的微生物组表现出更大的时间稳定性。
目前已知有三种强干扰事件(感染、接种疫苗和使用抗生素)可导致粪便微生物组破坏。在3个月期间,与IS人群相比,IR人群的粪便微生物组在健康就诊和干扰事件发生后出现了更大的时间变化(图3F)。然而,这种模式在其他身体部位并不一致,这表明对这些事件有特定部位的微生物组反应。
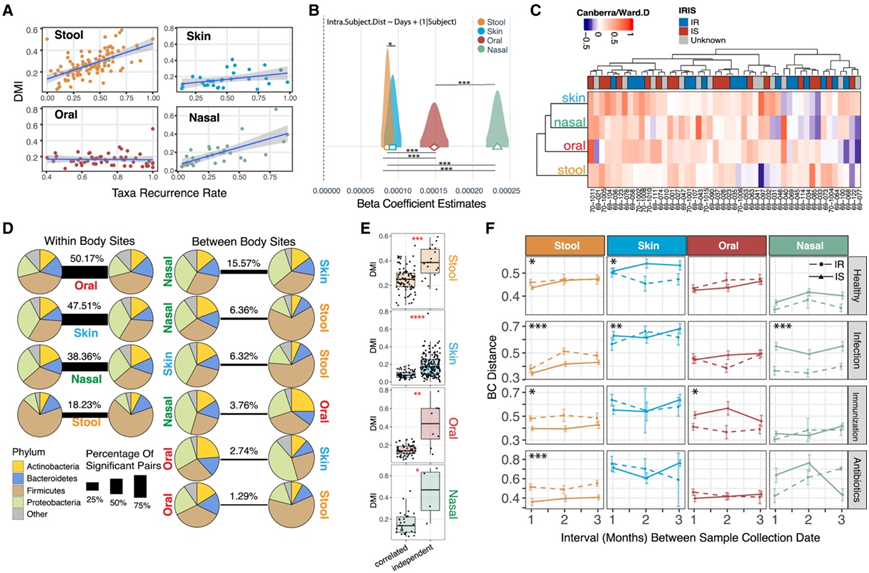
图3. 与个体性和应激事件相关的微生物组的时间稳定性。
(A)大便、皮肤、口腔和鼻腔样本的分类复发与平均DMI的相关性。(B)不相似性与收集日期间隔之间的线性回归。(C)样本对BC距离与采集日期间隔之间基于个体的相关系数。(D)体内和身体部位之间微生物群丰度的相关性。(E)相关属与非相关属的DMI差异。(F)超过3个月的健康和压力事件期间微生物组的变化。
04
宿主免疫系统与身体部位微生物组之间的相互作用:深入了解胰岛素抵抗和炎症
微生物稳定性的动态变化可能与多种宿主调节机制有关,特别是免疫系统。利用贝叶斯模型,他们研究了在所有4个身体部位,62个宿主循环细胞因子/趋化因子、生长因子和微生物组丰度之间的纵向相互作用。基于可信区间,确定了477个粪便、226个皮肤、318个口腔和221个鼻腔中具有身体部位特异性的显著微生物组-细胞因子关联(图4A)。粪便和口腔微生物组显示出比皮肤和鼻腔微生物组更广泛的微生物组相互作用谱(图4A)。有趣的是,与上皮/内皮生长和血管炎症相关的细胞因子(即表皮生长因子[EGF],血管细胞黏附分子[VCAM]-1和白细胞介素[IL]-22)、IL-1家族成员(即IL-1b和IL-1Ra)和瘦素与微生物组的相互作用最多。他们进一步确定了一个细胞因子亚群,包括IL-1b、IL-1Ra、MCP3(趋化因子配体[CCL] -7)和IL-23是通过效应量与微生物组最强的相关细胞因子。
接下来,他们研究了某些门是否更频繁地与细胞因子相互作用,可能影响它们的稳定性和个性。在所有身体部位的细胞因子相关微生物中,厚壁菌门(主要是梭状芽孢杆菌)的成员含量显著过高(图4B)。壁菌门的增加与肥胖相关的肠道菌群失调、炎症性肠病 (IBD)相关的口腔菌群失调和银屑病相关的皮肤菌群失调等病症有关,这些病症都有炎症作为共同因素。有趣的是,细胞因子似乎在塑造个体的核心微生物群和抑制非共生细菌(包括许多变形菌门)的定植方面起着关键作用。在所有四个身体部位,他们发现机会微生物与细胞因子的相关性比核心微生物组更强(图4C)。这种相关性在很大程度上是由变形菌门而不是厚壁菌门驱动的,因为与核心微生物组相比,变形菌门始终构成机会微生物组的更大部分。变形菌通常携带强效脂多糖(LPS)并引发下游免疫级联。之前的研究报道了炎症期间变形菌的丰度增加。本项研究发现,除了鼻微生物组中的Proteobacteria成员外,细胞因子与Proteobacteria丰度的相关性大多为负相关(图4D)。
除细菌属的相对丰度外,细胞因子和趋化因子的宿主反应可能与观察到的细菌属的丰富度有关。因此,他们检测了细胞因子和每个身体部位20个最多样化的属的丰富度之间的相关性。拟杆菌门中几个常见的粪便微生物组属[如普雷沃菌属(Prevotella)、Phocaeicola和副拟杆菌属(Parabacteroides)]的丰度形成一个聚类(column 3)(图4E),主要呈负相关,证明了拟杆菌门成员的相对丰度更有可能与细胞因子呈负相关(图4D)。此外,瘦素和粒细胞-巨噬细胞集落刺激因子 (GM-CSF) 均与BMI呈强相关,它们与丰富度显示出最强的总体相关性(图4E)。这将关于肥胖对肠道微生物组多样性影响的众多研究的结果扩展到其他身体部位。此外,他们发现7个皮肤属与一个细胞因子聚类呈正相关(图4E),表明特定皮肤属(如罗氏菌属、韦荣球菌属和链球菌属)的丰富度与血浆细胞因子水平呈正相关。

图4. 循环细胞因子和微生物群之间的系统联系。
(A)细胞因子-微生物组相关性的混合效应模型分析。(B)细胞因子相关属的门百分比。(C)按属流行率比较的显著细胞因子-微生物组相关系数密度图。(D)各体位和门的相关系数。(E)细胞因子与不同属之间Spearman系数的层次聚类。
05
微生物群与宿主分子高度相关:揭示胰岛素抵抗和炎症的作用
有趣的是,微生物组-宿主分子相互作用网络根据微生物组的内部分子组成而不是身体部位进行划分(图5A),这表明某些分类群主要受内部分子相互作用的影响,而不是影响宿主分子组成。值得注意的是,三种肠道类型驱动分类群:拟杆菌、普雷沃氏菌和未分类的瘤胃球菌科,分别表现出对脂质组、蛋白质组和代谢组区域的明显偏好(图5B)。已证实普雷沃菌与蛋白质之间的密切关系以及拟杆菌与脂类之间的关系。许多类群-分子相互作用在整个身体部位是一致的,皮肤微生物组在微生物-脂质组关联中表现出最广泛的连通性,而粪便微生物组主要与代谢组和蛋白质组相关(图5B)。本项研究表明,多种代谢物(如酒精相关代谢物葡糖醛酸乙酯)与身体所有4个部位的微生物组相互作用,这表明酒精在肠道和口腔微生物组之外具有更全面的影响。值得注意的是,以产生乙醛和乙醇的潜力著称的皮肤奈瑟菌属和克雷伯菌属与血浆葡糖醛酸乙酯水平呈正相关(图5C)。而对酒精敏感的产醋酸菌Faecalimonas则与乙基葡萄糖醛酸呈显著负相关。
他们还观察到微生物组属丰富度(公认的宿主代谢状态指标)和内部血浆分析之间的显著交互作用。这些相互作用在粪便微生物组中最明显,可能是由于其高度丰富(图5D)。有趣的是,他们发现对甲酚葡糖醛酸(一种仅由厌氧肠道微生物组产生的抑菌代谢产物,与胰岛素抵抗相关)与粪便中未分类的Ruminococcaceae和Oscillibacter的丰富度呈正相关。相反,它与通常与代谢有益的属(如Roseburia)呈负相关(图5E)。
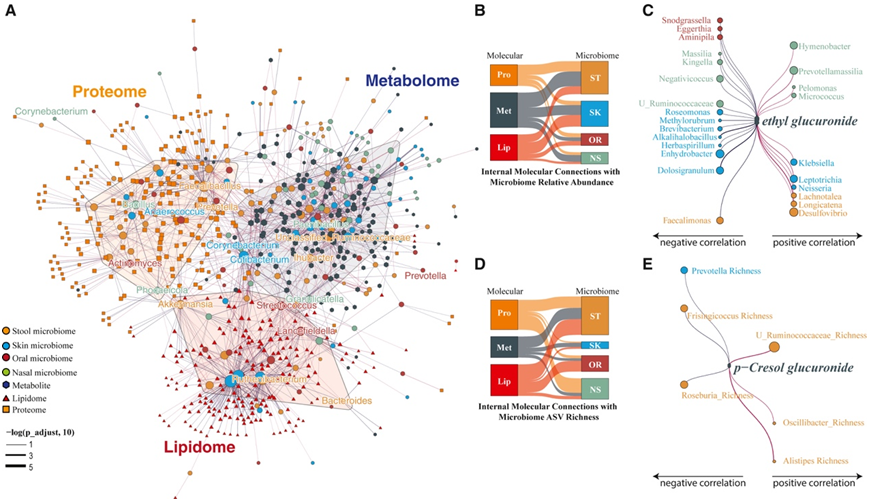
图5. 血浆代谢物、脂质、蛋白质组学和微生物组之间随时间的相互作用。
(A)相关网络显示了微生物组属相对丰度与血浆分析之间的联系。(B)血浆分析-微生物组相对丰度相关性总结。(C)属与代谢物葡萄糖醛酸乙酯之间的相关性。(D)血浆分析-微生物组相对丰富度总结。(E)属与代谢物对甲酚葡萄糖醛酸盐之间的相关性。
06
阐明微生物组介导对临床表型的影响:跨四个身体部位的综合中介分析
接下来,他们利用中介分析研究了微生物、宿主分子和临床表型之间的潜在因果关系。他们在所有研究中心发现了330个涉及微生物类群的定向显著中介效应,其中207个中介效应在IS和IR参与者中检测到(图6A)。与IS相比,他们观察到细胞因子介导的粪便微生物组对血液学参数的影响显著降低(图6B-C),代谢组介导的粪便微生物组对IR个体免疫表型的影响显著降低。此外,在胰岛素抵抗参与者中,没有脂质介导的皮肤微生物组和宿主血浆脂质/胆固醇之间的关联,表明在胰岛素抵抗中,与血液/免疫和脂质/胆固醇稳态相关的特定微生物组-代谢相互作用失调(图6D-E)。相比之下,相对于IS参与者,口腔微生物组通过调节IR中的脂质组和细胞因子介导了很大一部分免疫特征,主要是通过主要口腔核心微生物组(如韦永氏球菌属)之间的负相关。
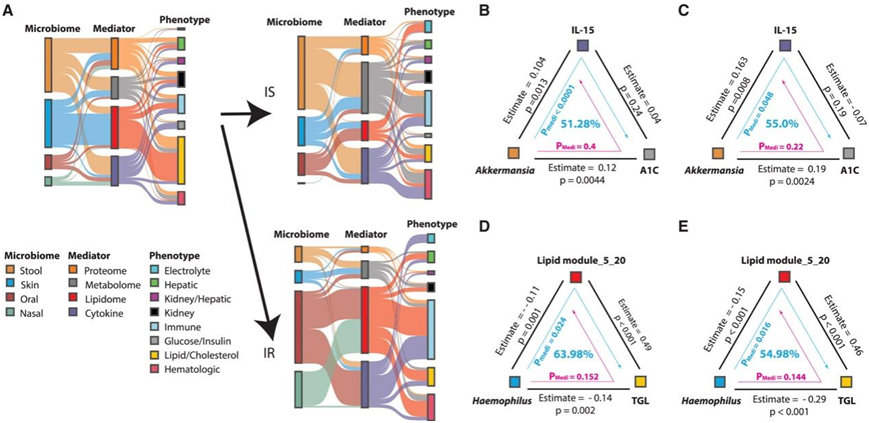
图6. 因果推理分析由内部分子和细胞因子介导的微生物组驱动的表型动力学。
(A)微生物组和表型中介分析。(B) Akkermansia通过血浆IL-15对血红蛋白A1C水平的调节作用。(C) Akkermansia对胰岛素敏感个体血红蛋白A1C水平的调节作用。(D) Haemophilus对血浆甘油三酯水平的调节作用。 (E) Haemophilus对胰岛素敏感个体血浆甘油三酯水平的调节作用。
+ + + + + + + + + + +
结 论
本项研究分析了 6 年来 86 名参与者的四个身体部位的微生物组的微生物组成、时间动态以及与宿主多组学、免疫和临床标记物的关联,发现微生物组的稳定性和个性是身体部位特异性的,并且深受宿主的影响。粪便和口腔微生物组比皮肤和鼻腔微生物组更稳定,这可能是由于它们与宿主和环境的相互作用。本项研究确定了个体特异性和共同的细菌类群,其中个体类群表现出更大的稳定性。有趣的是,微生物组动力学与身体各个部位相关,表明系统动力学受到宿主-微生物-环境相互作用的影响。值得注意的是,胰岛素抵抗个体表现出微生物稳定性以及微生物组、分子标记和临床特征之间关联的改变,表明它们在代谢疾病中的相互作用发生破坏。本项研究提供了多位点微生物动态及其与宿主健康和疾病关系的全面视图。
+ + + + +



 English
English


