文献解读|Mol Ther(12.4):间充质干细胞治疗缺血性急性肾损伤的细胞和分子特征的单细胞分析
✦ +
+
论文ID
原名:Single-cell dissection of cellular and molecular features underlying mesenchymal stem cell therapy in ischemic acute kidney injury
译名:间充质干细胞治疗缺血性急性肾损伤的细胞和分子特征的单细胞分析
期刊:Molecular Therapy
影响因子:12.4
发表时间:2023.08.02
DOI号:10.1016/j.ymthe.2023.07.024
背 景
急性肾损伤(AKI)是一种以肾功能急剧下降为特征的临床综合征。目前还没有有效的临床治疗方法能够减少组织损伤、促进修复或预防AKI后慢性纤维化的发展。间充质干细胞(MSC)在AKI中发挥有益的治疗作用,但其具体的修复机制尚不清楚。
实验设计
结 果
01
IRI-AKI微环境的细胞特征和对MSC治疗的反应
为了全面剖析AKI中MSC处理的肾微环境的细胞和分子特征,研究者团队生成了一个脐带MSC的小鼠缺血/再灌注损伤(IRI)-AKI模型,并分为了IRI后1天和3天(IRI-1 d、IRI-3 d)处理组、假手术(sham)组和MSC处理组,处死进行分析(图1A)。与假手术组相比,肾功能结果显示,IRI小鼠在IRI后1天和3天血清肌酐 (Scr) 和尿素氮 (BUN) 浓度显著升高,而MSC处理组的血清肌酐 (Scr) 和尿素氮 (BUN) 浓度大多显著降低(图1B)。同时,急性肾小管坏死(ATN)评分也表现出类似的趋势(图1C)。在IRI-1 d组观察到严重的肾损伤,包括小管上皮细胞 (TEC) 的空泡变性、刷状边界的部分脱离、细胞排列紊乱和许多铸型形成(图1D)。IRI-3 d组的病理病变的严重程度有所降低,而MSC处理组病理病变数量最少(图1D)。肾组织的苏木精-伊红(H&E)染色和CD45免疫荧光染色也显示,IRI-1 d和IRI-3 d组肾间质免疫细胞浸润高于sham组,而MSC处理小鼠肾间质免疫细胞浸润减少(图1D)。
接下来,他们进行单细胞转录组分析(scRNA-seq),获得13个样本的102162个细胞(图1F)。无偏聚类和细胞注释显示了9种细胞亚型,包括TEC、远端小管细胞、插层细胞/主细胞、Henle环细胞、内皮细胞和系膜细胞,以及免疫细胞类型,如T细胞、B细胞和骨髓细胞(图1E)。鉴定基因的表达和每种细胞类型的典型标记(图1G-H)。在IRI期间,TEC和免疫细胞的比例发生了显著变化:在IRI-1 d和IRI-3 d组中,TEC数量减少,在MSC处理组中增加,而髓细胞呈相反的趋势(图1I)。这些结果表明,AKI诱导免疫细胞浸润和TEC功能障碍或死亡,而MSCC处理触发TEC再生并阻断免疫浸润,从而减轻肾损伤。
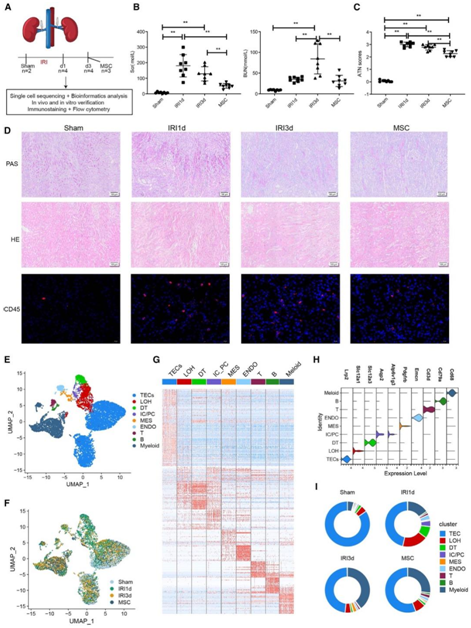
图1. 在小鼠急性肾损伤模型和MSC处理中进行的单细胞转录组分析。
(A) IRI-AKI模型、scRNA-seq和功能实验总结。(B)代表性肾功能指标生化检测。(C)急性肾小管坏死(ATN)评分。(D)小鼠IRI-AKI和MSC处理肾脏中CD45的PAS染色、H&E染色和免疫荧光染色。(E-F)按细胞类型(E)和处理组(F)分布的102、162个优质肾细胞。(G)每种细胞类型中差异表达基因(DEG)表达水平的热图。(H)小提琴图,显示各细胞类型中典型标记物的表达。(I)不同样本组中每种细胞类型的比例。
02
IRI诱导AKI期间小管上皮的分子多样性
观察到受损肾脏中的TEC数量受到MSC的调节,他们进一步分析了MSC处理诱导的TEC的不同转录组表型。TEC的亚聚类揭示了四种主要亚型:以Slc34a1高水平表达为特征的正常TEC;表达Havcr1(编码肾损伤分子1,KIM-1)的损伤TEC;促纤维化TEC,表达Pdgfb和Zeb2(纤维化标志物)和Nfkb1、C3、Cxcl1和Il34(炎症标志物);和肾干/祖上皮细胞,其特征是高水平的Pcna(增殖标志物)、Prom1(编码干细胞标志物CD133)和Epcam(编码上皮细胞粘附分子)(图2A-C)。使用scRNA-seq数据比较假肾和IRI肾中的TEC亚型显示,正常TEC在IRI后1天和3天耗尽,而损伤TEC和促纤维化TEC的比例增加。此外,相对于IRI-1 d和IRI-3 d组,MSC处理组表现出更高比例的肾干细胞/祖细胞和更低比例的损伤和前纤维化TEC(图2D)。基因集变异分析(GSVA)进一步揭示了促纤维化TEC和损伤TEC在炎症和纤维化途径上的富集,包括TNF-α信号、缺氧、TGF-β信号、IL-6-JAK-STAT3和纤维化,这与它们的促纤维化和促炎症特性一致(图2E)。
Western blotting验证了MSC处理对肾损伤的保护作用,与IRI-3 d组相比,IRI后KIM-1水平增加了约25.9倍,而MSC处理后的KIM-1水平显著降低了约30%。TGF-β1、磷酸化NF-kB、caspase-3和p53也出现了类似的趋势(图2F)。此外,免疫染色显示,与IRI-3 d肾组织相比,MSC处理的肾组织中vimentin和a-SMA水平降低,表明肾上皮纤维化表型减少(图2G)。透射电镜(TEM)观察线粒体结构,IRI-3 d组线粒体数量减少,线粒体分裂、肿胀、变形、嵴断裂,经MSC处理后这些现象明显减弱(图2H)。
这些结果表明MSC通过抑制促炎和促纤维化趋化因子的表达和减少纤维化来减轻肾损伤。
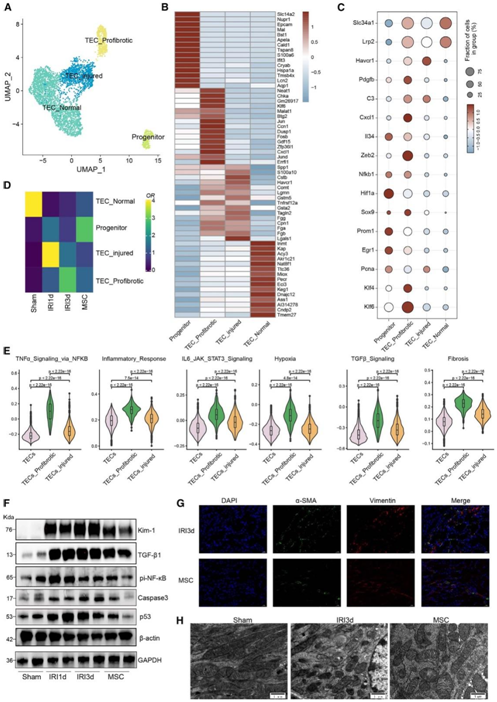
图2. MSC处理抑制TEC炎症和转分化。
(A)假手术、IRI-AKI和MSC处理肾脏的TEC亚聚类。(B) TEC亚群中前15个基因的表达。(C) TEC亚群中代表性标记基因的表达。(D)各处理组细胞的相对百分比分布和富集情况。(E)小提琴图显示TEC亚聚类的通路富集。(F) Western blotting显示IRI-AKI和MSC处理的肾脏中KIM-1、TGF-β1、pi-NF-κB、caspase-3和p53蛋白的水平。(G)肾切片的多重免疫染色显示IRI-AKI (d3)和MSC处理的肾脏中纤维化标志物α-SMA(绿色)和vimentin(红色)的表达。(H)具有代表性的电镜图像显示假手术-、IRI-AKI (d3)-和MSC处理肾脏的线粒体形态变化。
03
MSC诱导修复过程中TEC的转录变化
为了研究MSC诱导的修复过程,他们通过Monocle进行了单细胞轨迹分析。这表明肾干/祖上皮的分化遵循两个可选的轨迹:修复轨迹-产生正常TEC,或纤维化轨迹-产生促纤维化TEC(图3A)。他们还对沿肾干细胞/祖上皮分化轨迹发生的基因表达变化进行了轨迹分析,以探索损伤/恢复过程中细胞的动态变化。
他们确定了四种不同的模式(模块1-4)(图3B),代表细胞命运和/或轨迹上的点。此外,在IRI模型中,包括Tacstd2、Cldn7、Sox9、Prom1和Pcna在内的几个基因在MSC处理期间表现出差异表达,这表明它们可能在决定上皮分化轨迹中发挥作用(图3B-C)。
对模块1-4中排名前50位的基因进行基因本体(GO)分析,发现特定通路的富集差异。例如,在模块1中,肾上皮ATP代谢富集,代表正常的TEC,而在模块2中,肾脏发育、肾小管发育和小管形成富集,代表肾干/祖细胞分化。模块3中,对损伤的反应上调,代表损伤状态;模块4中,血管生成和上皮细胞凋亡的调控上调,代表纤维化状态(图3D)。scRNA-seq数据分析也显示,MSC处理组的Pcna和Prom1显著上调(图3E),Western blotting分析证实了这一点(图3F)。这些发现表明MSC处理通过促进肾干/祖细胞的增殖和分化来减轻肾损伤。

图3. MSC处理通过增强肾干/祖上皮分化促进组织修复。
(A)轨迹分析揭示的潜在肾干/祖上皮细胞分化途径。(B)热图显示了沿肾干/祖细胞轨迹的两个分支动态基因的表达。(C)轨迹分析显示代表性干细胞和纤维化基因的动态表达。(D)GO分析。(E)假手术、IRI-AKI和MSC处理肾脏中Pcna和Prom1 (Cd133)的mRNA水平。(F)假手术、IRI-AKI和MSC处理的肾脏中中PCNA和CD133的Western blotting和半定量分析。
04
髓细胞浸润及细胞间相互作用与促纤维化TEC
鉴于MSC显著降低骨髓细胞比例的结果,他们根据前8个差异表达基因(DEG)(图4B)鉴定出9种骨髓细胞亚型(图4A): 3种树突状细胞亚型,Ear2+中性粒细胞、Ly6c2+单核细胞、Cxcr2+中性粒细胞、Arg1+巨噬细胞、Trem2+巨噬细胞和CD81+常驻巨噬细胞(图4B)。损伤组/处理组的比较显示,IRI-1 d组和IRI-3 d组中性粒细胞和单核细胞(Cxcr2+和Ly6c2+亚群)的比例(相对于假对照组)增加了2- 4倍,然后在MSC处理后下降(图4C)。scRNA-seq结果还显示,与IRI-3 d组相比,MSC处理组的抗炎Tre2 +巨噬细胞的频率增加(图4C)。流式细胞分析证实,与假手术组相比,IRI-1 d组Ly6c2+CD11b+单核细胞比例增加(图4D)。此外,与IRI-3 d组相比,MSC处理组巨噬细胞/单核细胞总数的百分比有所下降(图4E)。
有趣的是,他们发现促纤维化和受损TEC的丰度与Cxcr2+中性粒细胞的丰度呈正相关。这一发现促使他们进一步分析TEC和骨髓细胞亚群中的配体-受体相互作用(图4F)。例如,促纤维化和损伤的TEC高水平表达编码炎性细胞因子的mRNA,如Il34、Osm、C3和Cxcl1,而单核细胞和中性粒细胞表达编码相应受体的mRNA,即Csf1r、Lifr和Il6st、C3ar1和Cxcr2(图4G)。
这些结果阐明了IRI肾脏中炎症单核细胞募集/浸润的潜在细胞间相互作用机制,并强调了MSC治疗可能针对的相互作用。
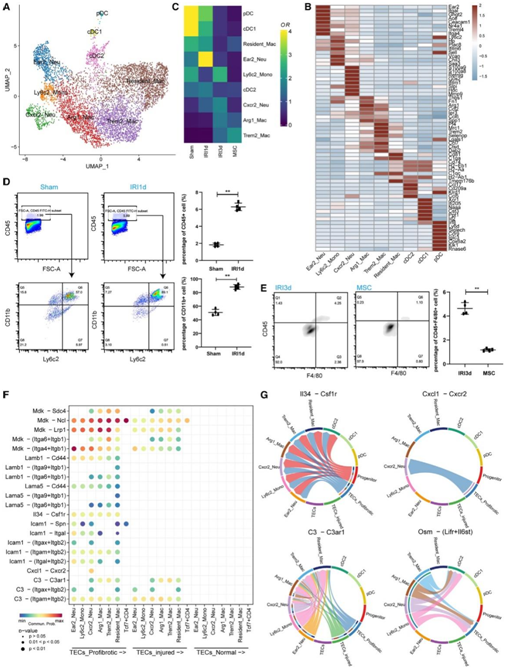
图4. 骨髓间充质干细胞处理抑制炎症单核细胞的浸润。
(A)来自假手术、IRI-AKI和MSC处理肾脏的骨髓细胞亚聚类。(B)前8个DEG在9个髓细胞亚群中的表达。(C)假手术组、IRI-AKI处理组和MSC处理组中每种髓细胞类型的相对贡献。(D)流式细胞术分析假手术组、IRI-AKI处理组Ly6c2+CD11b+单核细胞频率。(E)流式细胞术分析IRI-3 d和MSC治处理组CD11b+F/480+巨噬细胞频率。(F)热图显示骨髓细胞和TEC(配体-受体相互作用对)之间的细胞间相互作用。(G) Circos图显示髓细胞-TEC免疫相互作用网络。
05
通过阻断Th17细胞浸润减少MSC处理小鼠肾纤维化
他们还对淋巴细胞进行了亚聚类分析,并生成了7种细胞亚型(图5A),在AKI和MMSC处理后的小鼠中显示了不同的频率(图5B)。根据DEG分析,他们将这些细胞亚型鉴定为NK细胞、增生性Mki67+ CD8 T细胞、Gzmk+ CD8 T细胞、Tcf7+ CD4 T细胞、Th17细胞、Cd28+ CD4 T细胞和B细胞(图5C)。
与假手术对照组相比,IRI-1 d组和IRI-3 d组Th17细胞增加了2- 3.4倍,而MSC处理组的Th17细胞减少(图5B)。值得注意的是,Th17细胞的丰度与损伤和促纤维化TEC的频率呈正相关,而与正常TEC的频率呈负相关(图5D)。
伪时间分析显示,在IRI-AKI刺激下,Tcf7+ CD4 T细胞向Th17细胞分化(图5E-F)。此外,几种配体受体对(IL18-IL18r1, Ccl2-Ccr2和Cxcl16-Cxcr6)可能有助于炎症单核细胞募集Th17细胞(图5G)。Th17细胞也表达高水平的Tgfβ1/3和Il17a RNA,提示促纤维化TEC之间存在细胞间相互作用(图5G)。配体-受体对基因在TEC和免疫细胞亚群中的典型表达如图5H所示。免疫染色显示MSC处理降低了IL17A的分泌(图5I)。细胞分析显示,MSC处理组Th17细胞的比例减少了约50%(图5J)。最后,酶联免疫吸附试验(ELISA)分析显示,MSC组TGF-β1水平也受到显著抑制(图5K)。这些结果提示MSC通过阻断Th17细胞浸润来减轻肾纤维化。
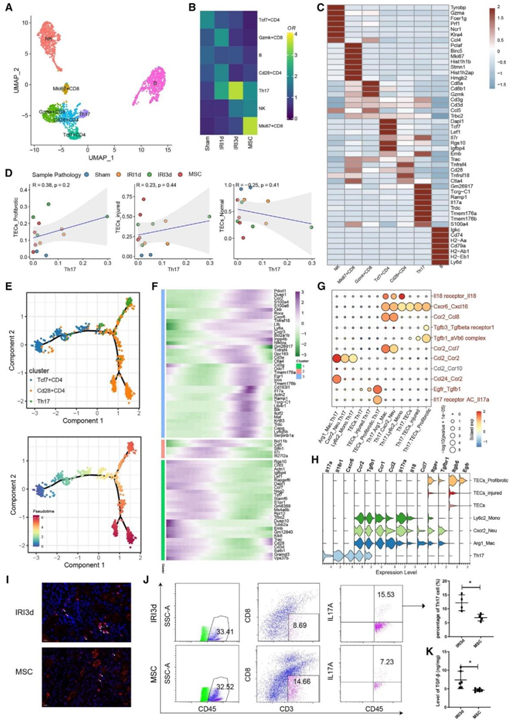
图5. MSC处理抑制Th17细胞的活化和TGF-β1的分泌。
(A)假手术、IRI-AKI和MSC处理的肾淋巴细胞亚聚类。(B)假手术、IRI-AKI和MSC处理组中各淋巴细胞亚型的相对贡献。(C)各淋巴细胞亚型中前7个差异表达基因的表达情况。(D) Spearman相关分析显示Th17细胞丰度与TEC亚型丰度之间的关系。(E)轨迹分析揭示的CD4 T细胞潜在分化途径。(F)热图显示沿着CD4 T细胞轨迹的动态基因的表达。(G)免疫细胞亚群和TEC亚群的相互作用分析显示显著的受体配体对。(H) TEC和免疫细胞亚群中配体受体对基因的表达。(I) IRI-AKI (d3)-和MSC处理小鼠肾切片中Th17细胞标记物IL17A(红色)的代表性免疫荧光染色。(J)流式细胞术图显示在IRI-3d和MSC处理的肾脏中CD45+CD3+CD8-IL17A+Th17细胞的频率。(K)用ELISA测定的经IRI-3 d和MSC处理的肾脏中TGF-β1水平。
06
MSC来源的miR-26a-5p沉默Zeb2表达
为了验证本研究的scRNA-seq结果,他们对处理组(IRI后1、3和7天)和假手术的小鼠进行了bulk RNA-seq。这些分析表明,与假手术组相比,三个IRI组表达了更高水平的IRI,编码促纤维化标志物Zeb2、Egfr、Pdgfb和Twist1,以及炎症标志物Cxcl1、Il34和Nfkb1(图6A)。
接下来,他们对实验中使用的MSC分泌的细胞外囊泡(EV)进行了纯化和表征。TEM结构分析显示典型的碗状囊泡(图6B),western blotting显示MSC-EV表达EV标记物,包括CD9、TSG101和CD63,但不表达细胞标记物calnexin(图6C)。荧光显微镜显示TEC细胞系(HK2细胞)有效地内化了1,10-二十八烷基-3,3,30,30-四甲基吲哚高氯酸盐(Dil)标记的MSC-EV(图6E)。
他们的scRNA-seq和bulk RNA-seq结果显示,IRI后促纤维化标志物Zeb2表达增加,而MSC下调其表达。因此,他们推测MSC是否通过EV调控Zeb2的表达。Western blotting显示,缺氧再氧化(H/R)损伤导致ZEB2蛋白水平升高4倍,在再氧化过程中用20 mg/mL MSC-EV处理细胞,ZEB2蛋白水平明显降低(图6F)。
已发表的MSC-EV的microRNA测序结果,miR-26a-5p在MSC-EV中高度富集。qPCR分析显示,miR-26a-5p在MSC中的水平比HK2细胞高4倍,并且在MSC-EV中进一步显著富集(图6D)。为了确定miR-26a-5p在细胞间的转移是否由EV介导,他们随后将cy3标记的miR-26a-5p模拟物转染到MSC中,并从培养上清中提取EV。将EV与HK2细胞孵育后,在细胞中检测到内化的cy3标记的miR-26a-5p(图6G)。
接下来,荧光素酶报告基因检测显示,miR-26a-5p模拟物相对于对照(NC)组降低了28.84%Zeb2荧光素酶报告基因活性(图6H)。为了在蛋白水平上证实这些发现,在H/R之前将miR-26a-5p模拟物直接转染到HK2细胞中(图6I-J)。转染细胞提取物的Western blotting显示,H/R上调了ZEB2水平,但miR-26a-5p模拟物导致相对于基础水平降低60%,pi-NF-kBd蛋白中也c出现类似的趋势(图6K)。
总体而言,这些数据表明miR-26a-5p抑制促纤维化标志物ZEB2的水平,并表明来自MSC-EV的miR-26a-5p可能能够保护TEC免受H/R诱导的纤维化。
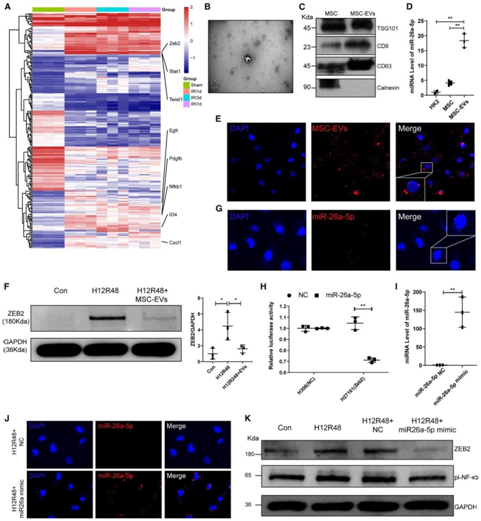
图6. 来自MSC-EV的miR-26a-5p在体外抑制促炎/纤维化基因的表达。
(A)热图显示假手术、IRI-1d、IRI-3d和IRI-7d中促纤维化和炎症标志物的表达。(B)电镜表征MSC-EV。(C) Western blotting 表征MSC-EV。(D) PCR检测HK2细胞、MSC和MSC-EV中miRNA-26a-5p的表达。(E)Dil标记的细胞外囊泡(红色)由HK2细胞内化。(F) Western blotting 分析。(G)在MSC-EV处理的HK2细胞中检测内化Cy3-miR-26a-5p(红色)。(H)在293T细胞中共转染miR-26a-5p或阴性对照(NC)与Zeb2 30 UTR报告基因(H27161)或对照报告基因(H306)后的荧光素酶报告基因检测结果。(I)通过PCR检测miR-26a-5p mimic在HK2细胞中的转染效率。(J)在HK2细胞中检测转染cy3标记的miR-26a-5p模拟物(红色)。(K) Western blotting显示HK2细胞H/R +/-外源性miR-26a-5p处理后ZEB2和pi-NF-kB蛋白水平。
07
抑制miR-26a-5p导致MSC-EV对IRI小鼠的保护作用减弱
最后,他们在IRI-AKI模型中转染miR-26a-5p抑制剂(miR-26a-5pIN-MSC)和阴性对照(miR-26a-5pNC-MSC)。IRI后3天肾组织的组织学染色显示,miR-26a-5pIN-MSC处理的小鼠肾损伤水平高于miR-26a-5pNC-MSC(图7A)。此外,免疫组织化学染色显示,miR-26a-5pIN-MSC处理也导致ZEB2和TGF-b1水平升高(图7A)。
为了确定miR-26a-5pIN-MSC对随后免疫细胞活化的影响,他们进行了流式细胞术分析,结果显示miR-26a-5pIN-MSC组中Th17细胞的比例显著增加(图7B)。与miR-26a-5pNC-MSC组相比,使用miR-26a-5pIN-MSC处理的小鼠肾脏中TEC脱落和TEC扩张(通过ATN评分评估)显著增加(图7C)。肾组织的Masson和Sirius染色也显示miR-26a-5pIN-MSC组肾纤维化面积更大(图7C)。
最后,免疫组织化学染色显示miR-26a-5pIN-MSC-处理小鼠的TEC中ZEB2和TGF-β1水平较高;上皮标志物E-cadherin的表达在这组中降低(图7D)。
综上所述,这些结果表明MSC-EV在体内通过靶向miR-26a-5p/ZEB2通路发挥其治疗作用,从而抑制纤维化。

图7. 来自MSC-EV的miR-26a-5p在体内抑制肾脏炎症和纤维化。
(A) PAS染色和免疫组织化学染色(ZEB2、TGF-b1)对IRI-3d肾组织+/- miR-26a-5p抑制剂处理。(B)流式细胞术图显示IRI-3 d肾组织+/- miR-26a-5p抑制剂处理中Th17细胞的比例。(C) PAS染色和Masson染色。(D)免疫组织化学染色代表性图像。
+ + + + + + + + + + +
结 论
本项研究通过在有/无MSC的IRI模型中进行无偏倚的scRNA-seq,探讨了MSC治疗AKI的潜在机制。揭示了肾小管上皮细胞(TEC)和免疫细胞的转录组多样性,并强调了涉及肾干细胞/祖细胞分化的修复轨迹。本项研究结果表明,表达促纤维化因子如Zeb2和Pdgfb的促纤维化TEC促进炎症单核细胞和Th17细胞向损伤肾组织募集,诱导TGF-β1分泌和肾纤维化。最后,除了激活肾祖细胞/干细胞的修复特性外还发现MSC来源的miR-26a-5p通过抑制ZEB2表达和抑制纤维化TEC及其随后的免疫细胞亚群募集来介导MSC的治疗效果,这些发现可能有助于优化未来AKI的治疗策略。
+ + + + +



 English
English


