文献解读|Nat Genet(30.8):胃癌的多祖先基因组和转录组分析
✦ +
+
论文ID
原名:Multiancestry genomic and transcriptomic analysis of gastric cancer
译名:胃癌的多祖先基因组和转录组分析
期刊:Nature Genetics
影响因子:30.8
发表时间:2023.03.13
DOI号:10.1038/s41588-023-01333-x
背 景
胃癌是全球第三大癌症相关死亡原因,其发病率在不同地区有所不同,东亚、东欧和南美洲发病率最高,北美最低。除了种系变异外,各种环境风险因素,包括慢性幽门螺杆菌或 Epstein-Barr 病毒 (EBV) 感染,以及生活方式因素,包括高盐摄入、饮酒和吸烟,都是危险因素。胃癌有两种主要的组织学亚型:肠癌亚型和弥漫性胃癌(也称为粘性差疾病),它们具有不同的流行病学和临床表现。然而,尚未进行全面的分子研究来确定与胃癌地理和流行病学多样性相关的体细胞驱动因子。
实验设计
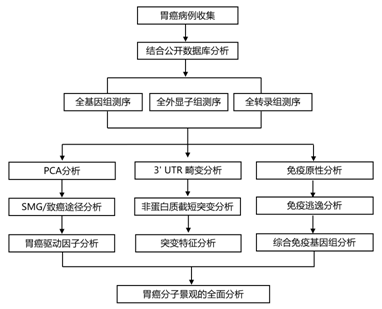
结 果
01
从多祖先群体中获取胃癌基因组
研究者团队获得了 697 例日本胃癌病例的基因组,并对 81 例进行了全基因组测序,对 603 例进行了全外显子组测序,对 520 例进行了全转录组测序。他们收集了来自癌症基因组图谱(TCGA) (https://portal.gdc.cancer.gov/projects/TCGA-STAD)的442例(多祖先)病例和来自东亚队列(中国、韩国、新加坡和越南)的318例病例的全基因组、全外显子组和转录组数据(图S1a),种系变异的主成分分析(PCA)证实了样本的祖先(图S1b)。
在编码区,每个病例的非沉默体细胞单核苷酸变异(SNV)和插入缺失的中位数分别为 88 和 5。总共 180 个病例,包括 176 个微卫星不稳定(MSI)和 4 个非 MSI 肿瘤,归类为高突变病例。与非超突变病例相比,超突变病例中的拷贝数改变(CNA)并不常见。弥漫性组中CNA的发生率低于肠癌组和EBV阴性组(图1a)。
由于超突变病例的突变背景较高,因此在非超突变组和超突变组中分别鉴定出了显著突变基因(SMG)(图1b-c)。
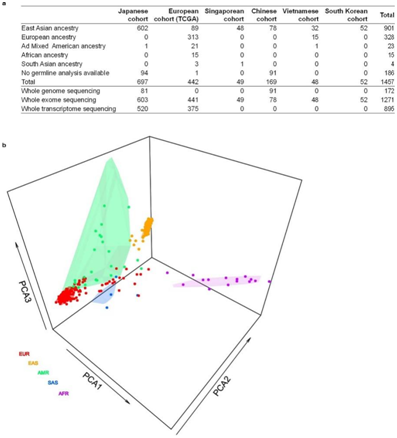
图S1.实验设计。
(a)实验设计表。(b)种系变异的主成分分析 (PCA)。
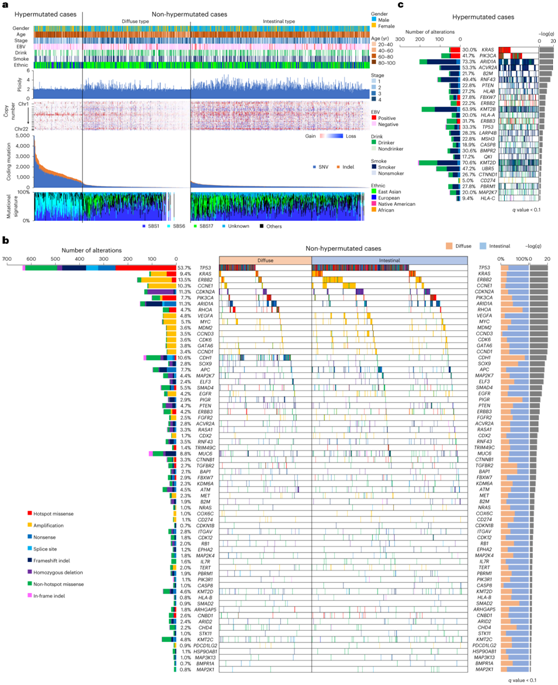
图1. 胃癌的基因组图谱。
(a) 拷贝数和突变的情况。每列代表一个单独的肿瘤。(b) 弥漫型和肠型非超突变肿瘤中 SMG 的情况。 (c) 超突变肿瘤中 SMG 的景观。
02
非高突变胃癌的驱动因子
在非超突变胃癌中,有 13 条致癌途径与 SMG 相关(图2a-d)。这些途径包括受体酪氨酸激酶 (RTK)、RAS、磷脂酰肌醇 3-激酶 (PI3K)、丝裂原激活蛋白激酶 (MAPK)、WNT、转化生长因子-β (TGFβ) 和细胞粘附途径,所有这些途径都与细胞增殖有关。在 EBV 阳性病例中,PI3K/MAPK 通路的改变频繁发生。PD-L1、PD-L2和JAK2在 EBV 阳性病例中扩增得更频繁,表明这些基因有助于在 EBV 感染期间逃避宿主免疫监视。CTNNB1的激活改变在 EBV 阳性病例中富集,而APC 的失活改变在 EBV 阴性病例中更为频繁,这表明 WNT 通路中的驱动事件在不同亚型中存在差异。跨血统比较显示,MDM2、CDKN2A、ARID2、PTEN和MUC6在欧洲血统病例中更频繁地改变,而TP53改变在东亚血统病例中丰富(图2e)。VEGFA和TERT扩增显著同时发生(图2f)。弥漫型病例中的特征性SMG包括CDH1、RHOA、聚合免疫球蛋白受体(PIGR)、SOX9、TGFBR2和BAP1(图2c)。
PIGR是一种弥漫性驱动基因,具有复发性和广泛分布的失活突变(图3a),与CDH1显著共改变(图2f)。PIGR参与上皮细胞中可溶性免疫球蛋白A的胞吞作用,并与极性完整性和粘膜免疫有关。此外,PIGR突变下调再生结肠上皮中白细胞介素-17 (IL-17)信号。SOX9是另一个扩散型驱动基因,其特征是反复出现移码插入和纯合缺失(图3a)。在2.2%的非高突变病例中,TRIM49家族(TRIM49/ 49b / 49c)反复出现热点突变(图3b)。TRIM49蛋白含有RING和SPRY结构域,可能参与自噬蛋白的降解。S327R/G/C热点替换位于SPRY域,且几乎互斥(图3b)。
ARHGAP5中具有热点 E489K 突变的所有 6 例病例均具有高EGFR扩增(图3c)。
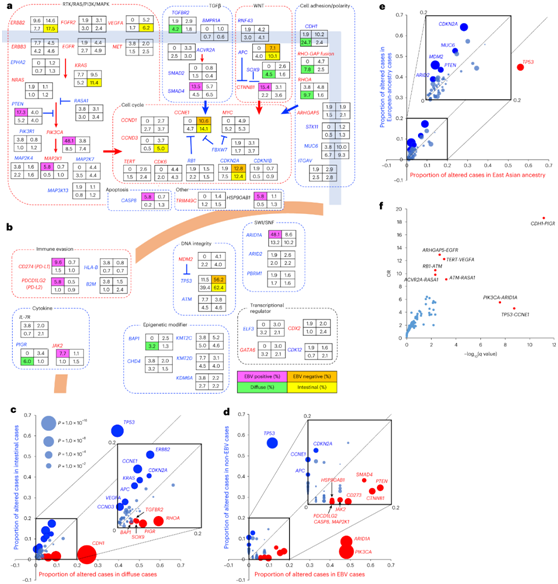
图2. 非超突变胃癌中 SMG 的情况。
(a) 非超突变胃癌的致癌信号传导途径。 (b) 非超突变胃癌的核内致癌途径。(c-e) 非高突变胃癌在弥漫型和肠型之间、EBV 阳性和 EBV 阴性病例之间以及东亚和欧洲血统病例之间之间的 SMG 存在显著差异。 (f) 非超突变病例中 SMG 显著共同改变。
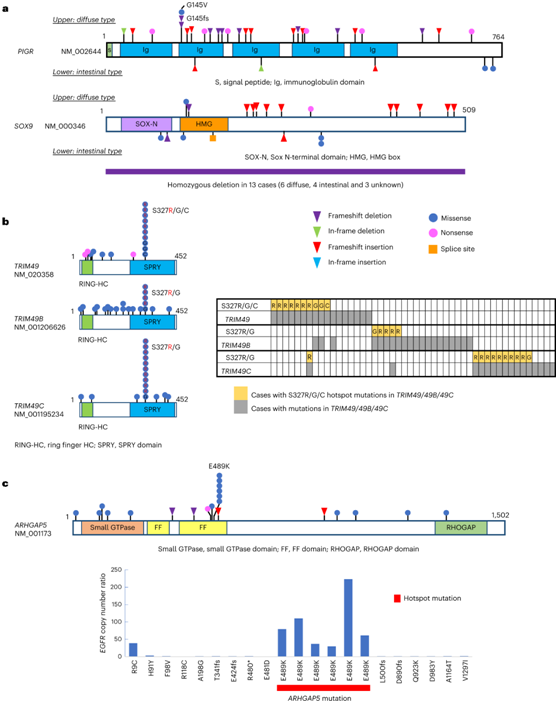
图3. 非超突变胃癌中PIGR、SOX9、TRIM49和ARHGAP5突变的分布。
(a) PIGR和SOX9突变的分布。 (b) TRIM49/49B/ 49C的热点突变。(c) ARHGAP5突变的分布。
03
胃癌中的融合和 3' UTR 畸变
(本研究中3例,0.3%)融合主要在弥漫型中检测到,并且与CDH1、RHOA和ARHGAP5突变相互排斥(图S4a)。13 例 RTK 通路相关融合(占总病例的 1.5%),包括涉及FGFR(两例中为FGFR2-TACC2、FGFR2-ATE1和FGFR3-TACC3)、NRG(CD74-NRG1/2、SLC12A2-NRG2)的融合和ADK-NRG3)、EPHB(ATG3-EPHB1和KDM1A/TOMM20-EPHB2)、CEP55-RET和BRAF-DPP6主要在肠型中检测到。在 7 例病例中检测到涉及RSPO3的融合(5例为PTPRK-RSPO3,5例为PTK7/CD44-RSPO3),并且通常与具有APC/CTNNB1/AXIN/RNF43突变的肿瘤相互排斥(图S4a)。2例检测到SLC12A7-TERT,其余病例未检测到TERT启动子热点突变。随着基因表达的增加,CD274 (PD-L1)和PDCG1LG2 (PD-L2)的3'非翻译区(UTR)的结构畸变(包括基因融合)反复出现(图4a-b,图S4b-d)。PD-L1的3' UTR畸变在高突变病例中显著富集(图4c),表明这些畸变也有助于逃避宿主免疫监视。对其他可靶向的3'UTR结构改变的检测发现,FGFR2的复发性3 ' UTR改变与表达增加相关(图4d)。

图S4. 胃癌中的转录组改变。
(a) RHO-GAP 融合体的互斥分布,例如非超突变病例中的CLDN18 - ARHGAP26和CDH1/RHOA/ARHGAP5突变(上)。非超突变病例中WNT 通路(APC、CTNNB1、AXIN1/2和RNF43)突变和RSPO3融合的互斥分布(下)。(b)典型PD-L1、PD-L2和FGFR2 3' utr异常病例的RNA-seq读取深度。异常病例(红色虚线圈)的3'UTR归一化读深度全部或部分低于正常病例。(c) PD-L1/2和FGFR2编码外显子高表达,基因的3 ' UTR外显子表达降低。(d)基因融合阳性和基因融合阴性病例的编码表达比较。
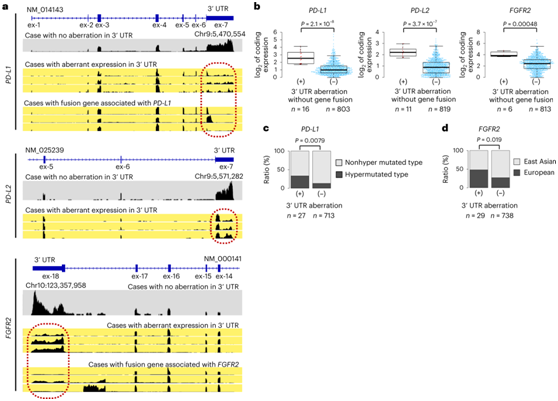
图4. PD-L1、PD-L2和FGFR2的异常表达。
(a) PD-L1、PD-L2和FGFR2 3'UTR异常的典型病例的RNA-seq读取深度。 (b) 3'UTR畸变阳性和阴性病例之间编码表达的比较。(c) 超突变和非超突变病例之间PD-L1 3'UTR改变病例的数量比较。(d) 欧洲和东亚血统病例之间FGFR2 3'UTR改变病例数的比较。
04
弥漫型胃癌中的非蛋白质截短CDH1变异
他们将SAVNet 算法用于检测导致 791 个可进行配对转录组测序的样本中剪接改变的体细胞变异。该分析确定了 2263 个可能改变基因剪接模式的变异。其中,77 个变体影响 SMG,包括TP53(21 个变体)、CDH1(20 个变体)和ARID1A(7 个变体)。在134个CDH1突变中,41个(30.6%)发生在剪接点,并且独特地富含框内剪接改变(图5a)。90.2%(37/41)的剪接改变集中在六个剪接点上,其中包括32个框内剪接改变(图5a)。CDH1在细胞外区域有5个钙粘蛋白重复序列(EC1-EC5),作为一种拉链状的细胞间粘附装置,介导Ca2+依赖性的反式和顺式亲同源二聚化(图5a)。
最常见的剪接改变(#1,p.V157_Q177del)预测通过破坏疏水相互作用和二聚体中的链交换来影响CDH1反式二聚化,这是由于粘附臂(DWVIPP)中四个残基(VIPP)的截短(图5b)。另一个剪接改变(#3,p.V329_E336del)的特征是失去了一个增强细胞间粘附的顺式相互作用域(图5c)。对非沉默体细胞CDH1突变(包括剪接改变)的进一步定位显示,78.3%(105/134)的突变是非蛋白质截短的,而HDGC的种系CDH1突变以截短突变为主。体细胞CDH1改变在乳腺癌中也很常见。然而,这些改变包含更少的剪接改变和更多的截短突变(图5a)。非蛋白截短突变高度集中在以下四个功能区域(图5c):(1和2)EC1和EC2之间的两个Ca2+结合位点以及EC2和EC3重复序列,(3)反式二聚化界面,(4)EC1的疏水核心。
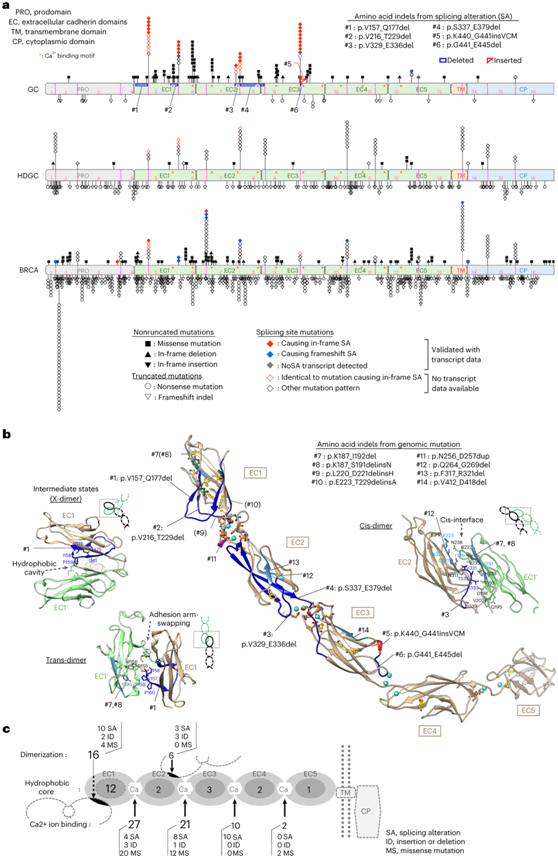
图5. 胃癌中的CDH1突变。
(a) 代表CDH1结构域和CDH1突变分布的示意图。 (b) 使用小鼠CDH1(PDB3q2v)作为模板建模的人CDH1蛋白中非蛋白截短突变的分布。(c) 每个功能区域中检测到的非蛋白质截短突变数量的汇总图。
05
突变特征与驱动突变之间的关系
突变特征根据疾病亚型、EBV 感染状态和血统而变化(图6a-d)。SBS18 COSMIC 突变特征(可能归因于活性氧的损伤)和 SBS16(未知病因)是弥漫性亚型的特征(图6b)。比之下,SBS3(与基于同源重组的 DNA 损伤修复缺陷相关)在肠道亚型中更为常见(图6b)。SBS28(病因不明)、SBS11(与替莫唑胺治疗相关)和SBS12(病因不明)在EBV阳性病例中更为常见(图6c)。SBS16更常导致弥漫型和东亚血统的病例,并与饮酒有关(图6d)。
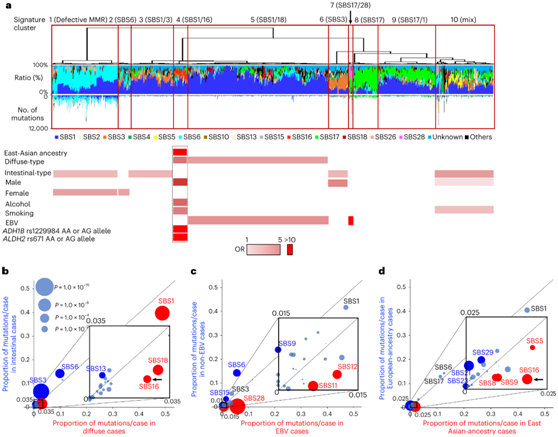
图6. 胃癌突变特征图谱。
(a)通过 COSMIC 突变特征的贡献对胃癌病例进行聚类,显示了十四个主要突变特征。(b-d) 弥漫型和肠道型之间、EBV 阳性和 EBV 阴性病例之间以及东亚和欧洲血统病例之间突变特征的显著不同贡献。
他们将重复出现的相同突变的序列背景与COSMIC突变特征的序列背景进行了比较。从特征上看,RHOA(扩散型SMG的标志性特征)的热点突变三核苷酸背景与SBS16相似(图7a)。特别是,RHOA Y42C 热点突变是弥漫型胃癌中最常见的突变,涉及 ATA > ACA 替换,这是 SBS16 的首选三核苷酸背景。种系变异(ADH1B/ALDH2)和生活方式(饮酒)协同促进人类癌症中特定驱动突变(RHOA Y42C)的发生,并可以部分导致东亚人群弥漫型胃癌的较高发病率(图7b)。
总的来说,突变特征根据亚型、EBV 感染状态和血统而有所不同。对于东亚血统的病例,这些结果表明饮酒与RHOA突变之间存在联系。
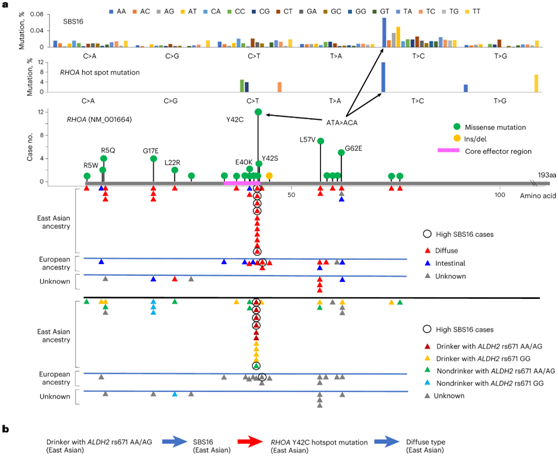
图7. SBS16 和RHOA Y42C 热点突变之间的相关性。
(a) SBS16和RHOA热点突变之间相似的替代模式。 (b) ALDH2基因型、饮酒量、SBS16、RHOA Y42C热点突变、弥漫型和东亚血统之间的相关性总结。
06
免疫原性和免疫逃逸以及胃癌的综合免疫基因组分析
编码抗原呈递MHC复合物成分的HLA和B2M突变在高突变病例中更为常见(图8a)。HLA-LOH的频率在高突变和非高突变病例之间没有显著差异(图8a)。NLRC5、JAK1/2和 IFNγ 通路其他成分(IFNGR1/2和IRF1)的失活突变是 ICI 的获得性耐药机制,在超突变病例中也更频繁地发生(图8a)。总的来说,这些的数据表明,超过 70.3% 的超突变病例存在与免疫逃避相关的突变。
整合遗传和基因表达特征有助于结合肿瘤突变负荷 (TMB) 和 T 细胞炎症基因表达谱 (GEP) 对病例进行联合分类。HLA拷贝丢失病例在TMBhighGEPhigh免疫热组显著富集(图8b)。免疫活性(TMBhighGEPhigh)组预后较好,而免疫沉默(TMBlowGEPlow)组预后最差(图8c)。评估了SMG改变与免疫环境之间的关系,其表现为免疫细胞的转录分解和细胞裂解活性指标(CYT、IFN和EXPAND)(图8d)。
在具有较高 EXPAND 溶细胞活性的病例中, PIK3CA突变和染色质重塑因子(BAP1、ARID1A、PBRM1、KDM6A和ARID2)的改变显著富集。相比之下,ERBB2扩增以及KRAS和 WNT 通路成分(SOX9、APC、CTNNB1和RNF43)的突变与较低的 EXPAND 溶细胞活性显著相关。
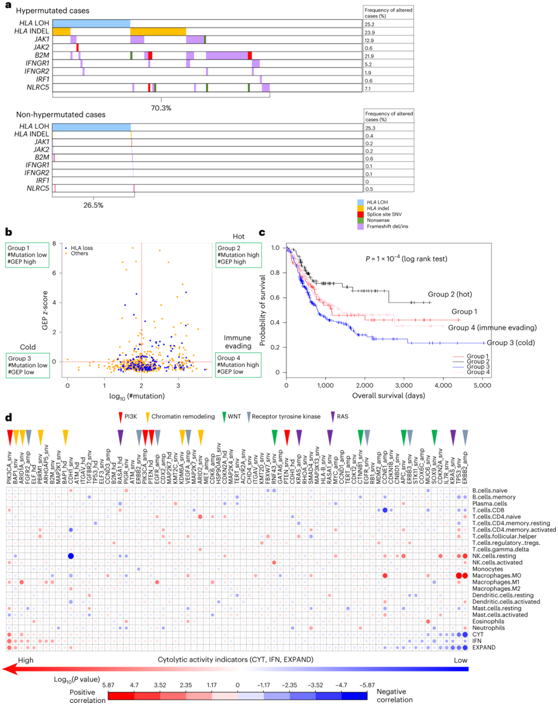
图8. 胃癌的免疫驱动景观。(a) 抗原呈递机制和 IFNγ 途径成分的遗传改变。
(b) 根据肿瘤突变负荷(TMB)和T细胞炎症基因表达谱(GEP)联合对病例进行分类,以表征免疫基因组亚型。(c) TMBhigh GEPhigh组中的病例富含抗 PD-1 治疗的反应者,显示出明显优于其他患者的预后。 (d) 基因突变和免疫特征之间的关联。
+ + + + + + + + + + +
结 论
本项研究报告了胃癌驱动事件的广泛、多祖先景观,涉及 1335 例病例。鉴定出 77 个SMG,包括ARHGAP5和TRIM49C,还确定了亚型特异性驱动因子,包括PIGR和SOX9,它们在疾病的弥漫性亚型中富集。SMG 还根据 Epstein-Barr 病毒感染状态和血统而变化。非蛋白质截短的CDH1突变的特点是剪接改变,靶向局部细胞外结构域,并且独特地发生在散发性弥漫型病例中。在东亚血统的胃癌患者中,饮酒或新陈代谢与RHOA突变的发生之间存在联系。此外,还确定了在免疫逃避中具有潜在作用的突变。总体而言,这些数据提供了对不同亚型和血统的胃癌分子景观的全面见解。
+ + + + +



 English
English


