文献解读|Cell Rep Med(14.3):表观遗传编程介导产前地塞米松暴露的后代肠道微生物群异常和疾病易感性
✦ +
+
论文ID
原名:Epigenetic programming mediates abnormal gut microbiota and disease susceptibility in offspring with prenatal dexamethasone exposure
译名:表观遗传编程介导产前地塞米松暴露的后代肠道微生物群异常和疾病易感性
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.02.20
DOI号:10.1016/j.xcrm.2024.101398
背 景
产前地塞米松暴露(PDE)可导致成年后代对各种疾病的易感性增加,但其对肠道微生物群组成的影响以及与疾病易感性的关系仍不清楚。
实验设计
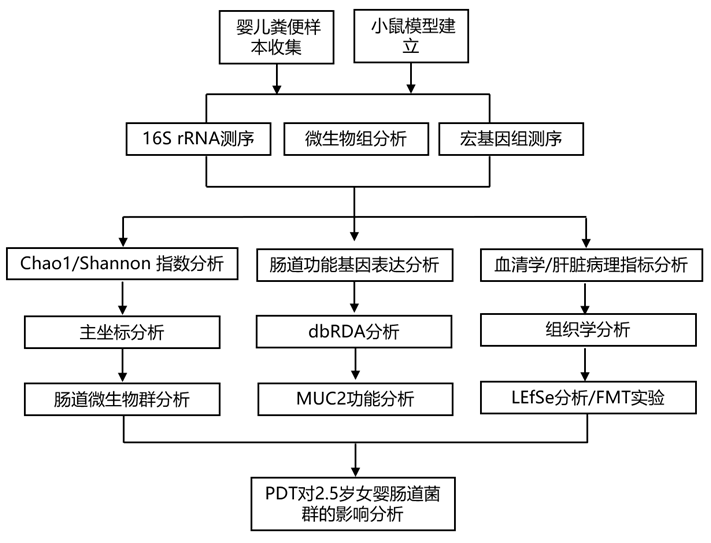
结 果
01
6月龄婴儿PDT肠道菌群组成的变化
为了在临床上探讨接受产前地塞米松治疗 (PDT)对婴儿肠道微生物群的影响,研究团队收集了76名6个月龄婴儿的粪便,并进行了16S rRNA基因扩增子测序以进行肠道微生物群分析。在6个月龄的婴儿中,肠道菌群变化与PDT(图1A)、出生时性别和母亲抗生素暴露显著相关,但与母亲年龄、胎龄、分娩方式、喂养方法或婴儿益生菌暴露无关(图1A)。
接下来,他们比较了PDT组和CON组之间的肠道微生物群特征。分别对男婴和女婴的数据进行分析。与对照(CON)组相比,PDT组男女婴儿肠道菌群Chao1指数和Shannon指数均显著降低(图1B-F)。女婴和男婴肠道菌群的群落结构在PDT组和CON组之间也存在显著差异)(图1G)。在PDT女性组中,13个细菌属(包括Akkermansia, Bacteroides和Parabacteroides)的相对丰度降低,而11个细菌属(包括Klebsiella)的相对丰度增加(图1H)。在PDT男性组,Parabacteroides、Lachnoclostridium、拟杆菌属等8个细菌属减少,而9个细菌属(包括Atopobium)增加(图1L)。通过实时qPCR进一步证实了女婴中pdt相关的A. muciniphila减少(图1J)。
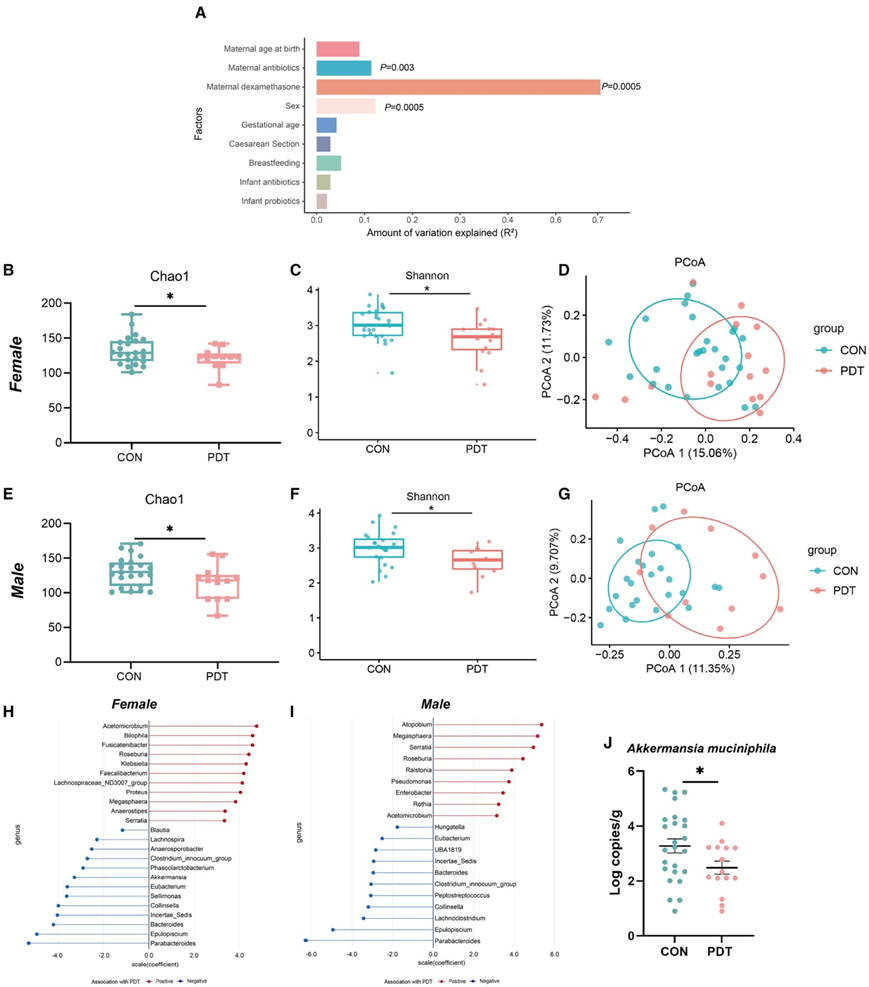
图1. PDT对6月龄婴儿肠道菌群组成的影响。
(A) 通过 envfit 测试通过各种因素解释 6 个月婴儿的微生物组差异。(B-E) 女性和男性婴儿肠道微生物群的 Chao1 指数。(C-F) 女性和男性婴儿肠道微生物群的香农指数。 (D-G) 基于女性和男性婴儿肠道微生物群的 Bray-Curtis 距离的主坐标分析 (PCoA) 图。(H-I) 在雌性和雄性婴儿中,通过 MaAsLin2 调整其他混杂因素后,属水平上与 PDT 相关的细菌。(J)每克粪便样本中的Akkermansia muciniphila拷贝数。
02
PDE雌性子代大鼠肠道菌群定植及组成的变化
妊娠大鼠从妊娠第9天(GD9)至妊娠第20天注射0.2 mg/(kg·d)地塞米松或等量生理盐水。GD20 的怀孕大鼠或其后代在出生后第 2 周(PW2)或 PW12 用 2% 异氟烷麻醉并安乐死。他们收集了 PDE 后代大鼠出生后不同时间点的粪便并进行了 16S rRNA 基因扩增子测序。在雌性子代大鼠中,与 CON 组相比,PDE 组的肠道菌群 Chao1 指数在 PW2 和 PW12 时显著下降(图2A-D),但在 PW4 和 PW6 时没有变化(图 2B-C)。PDE 组的肠道微生物群Shannon指数没有变化(图 2E-H)。PDE组与CON组在PW2(图2I)、PW6(图2K)和PW12(图2L)时的肠道菌群分布存在显著差异,但在PW4时差异不显著(图2J)。线性判别分析效应大小(LEfSe)分析显示PDE组在4个时间点细菌种类发生了变化(图2M-P)。他们进一步关注PDE雌性后代大鼠在出生后不同时间点肠道菌群属和种的动态进化。在属水平上,与CON组相比,在PDE组PW6时的乳杆菌属(图2Q)、PW2和PW12时的拟杆菌属(图2R)、PW6和PW12时的葡萄球菌属(图2S)的相对丰度降低。
在物种水平上,与CON组相比,PDE组在PW6和PW12处的罗伊氏乳杆菌(图2T)和在PW2和PW6处的L. johnsonii的相对丰度下降(图2U),而PDE组在PW2和PW6处的Klebsiella pneumonia的相对丰度增加(图2V)。这些结果表明,PDE导致子代大鼠在PW2、PW6和PW12时一些肠道细菌的持续变化,并且大多数变化是显著的。有趣的是,PDE组在PW4时这两种细菌都没有改变。
婴儿期是肠道菌群定植的关键阶段。PDE雌性子代大鼠肠道微生物组成的变化可能是由于微生物定植的肠道微环境异常所致。为此,他们分别给CON组和PDE组大鼠灌胃有益菌代表种丁酸梭菌(Clostridium butyricum)或致病菌代表种鼠柠檬酸杆菌(Citrobacter rodentium)。结果表明,与CON组相比,丁酸梭菌在肠道中的定植率显著降低(图2W),而更多的C. rodentium成功定植肠道(图2X)。结果表明,PDE雌性子代大鼠肠道微环境偏向致病菌而非有益菌定植。
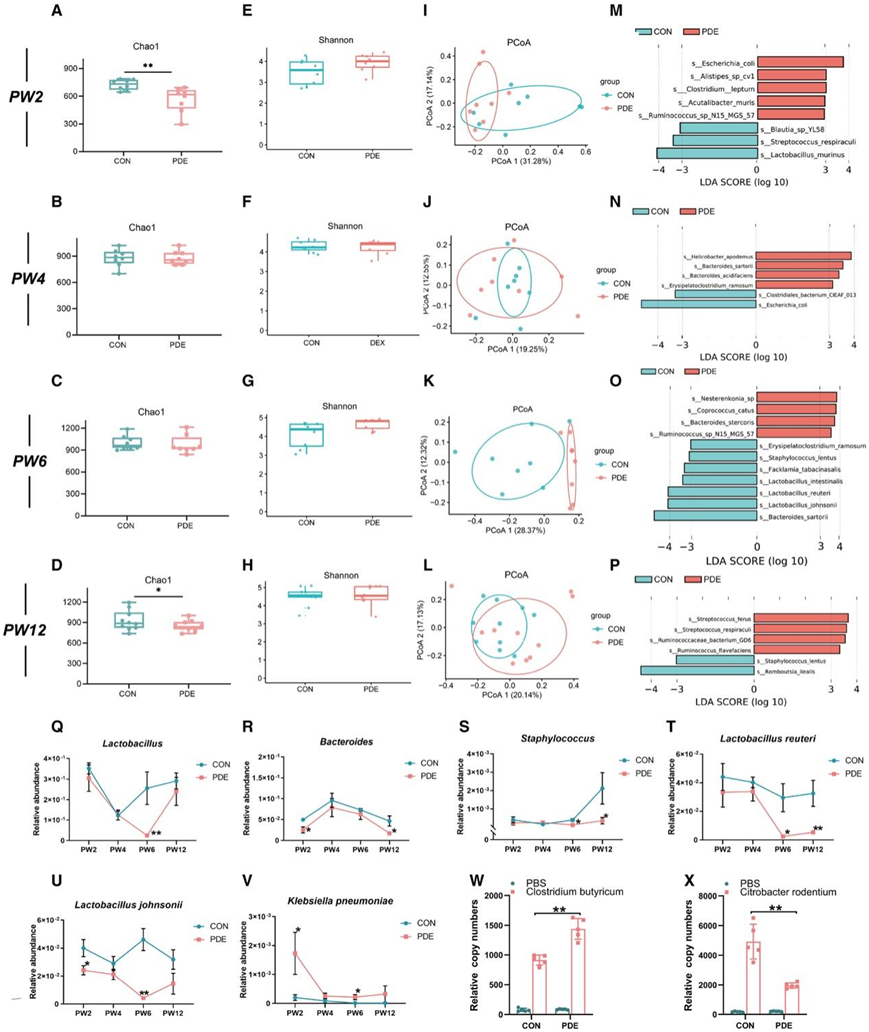
图2. PDE对雌性子代大鼠生后不同时间点肠道菌群定植及组成的影响。
(A–D) 第 2 周、第 4 周、第 6 周和第 12 周肠道微生物群的 Chao1 指数。(E–H) 第 2 周、第 4 周、第 6 周和第 12 周肠道微生物群香农指数。(I–L) 基于 PW2、PW4、PW6 和 PW12 肠道微生物群 Bray-Curtis 距离的 PCoA 图。(M–P) PW2、PW4、PW6 和 PW12 物种水平肠道微生物群的 LEfSe 分析。(Q-S)粪便中乳酸菌、拟杆菌和葡萄球菌的相对丰度。 (T-V)粪便中Lactobacillus reuteri、Lactobacillus johnsonii和 Klebsiella pneumoniae的相对丰度。(W) PW5 雌性子代大鼠粪便中丁酸梭菌的相对拷贝数。(X) PW5雌性子代大鼠粪便中啮齿类柠檬酸杆菌的相对拷贝数。
03
抑制 PDE 雌性子代大鼠结肠粘蛋白介导的肠道微生物群变化
为了找出PDE雌性子代大鼠肠道微环境异常的原因,他们检测了PW2和PW12结肠组织中多种功能基因的表达,包括粘蛋白合成基因(Muc2)、肠道屏障功能基因(Tjp1和Cldn1)和炎症相关基因(Il6、Il1b和Tnf)。PW2时,与CON组相比,PDE组结肠组织中Muc2和Tjp1的表达水平显著降低(图3A),而炎症相关基因的表达水平没有显著变化(图3A),表明肠道屏障功能受损。
他们通过基于距离的冗余分析(dbRDA)进一步评估了 PW2 时肠道功能基因的表达水平与肠道微生物群整体变化之间的相关性。结肠Muc2表达比其他功能基因更能解释肠道菌群变异,占变异的55.6%(图3B)。同时,PDE 组中 Muc2 的结肠蛋白水平也显著降低(图3C-D)。高碘酸希夫(PAS)染色显示结肠中杯状细胞的数量没有变化,但粘蛋白密度降低(图3E-G)。PW12时,与CON组相比,PDE组结肠组织中所有功能基因中仅Muc2的表达量下降(图3H)。结肠Muc2表达仍然是肠道微生物群变异最具特征性的功能基因,第 12 周的效应大小为 28.7%(图3I)。与 CON 组相比,PW12 时结肠组织中 Muc2 的蛋白水平和粘蛋白密度降低(图3J-N)。这些结果表明,Muc2 是 PDE 雌性子代大鼠肠道微生物群的主要调节因子,其下调可能导致肠道微生物群定植的异常肠道微环境。
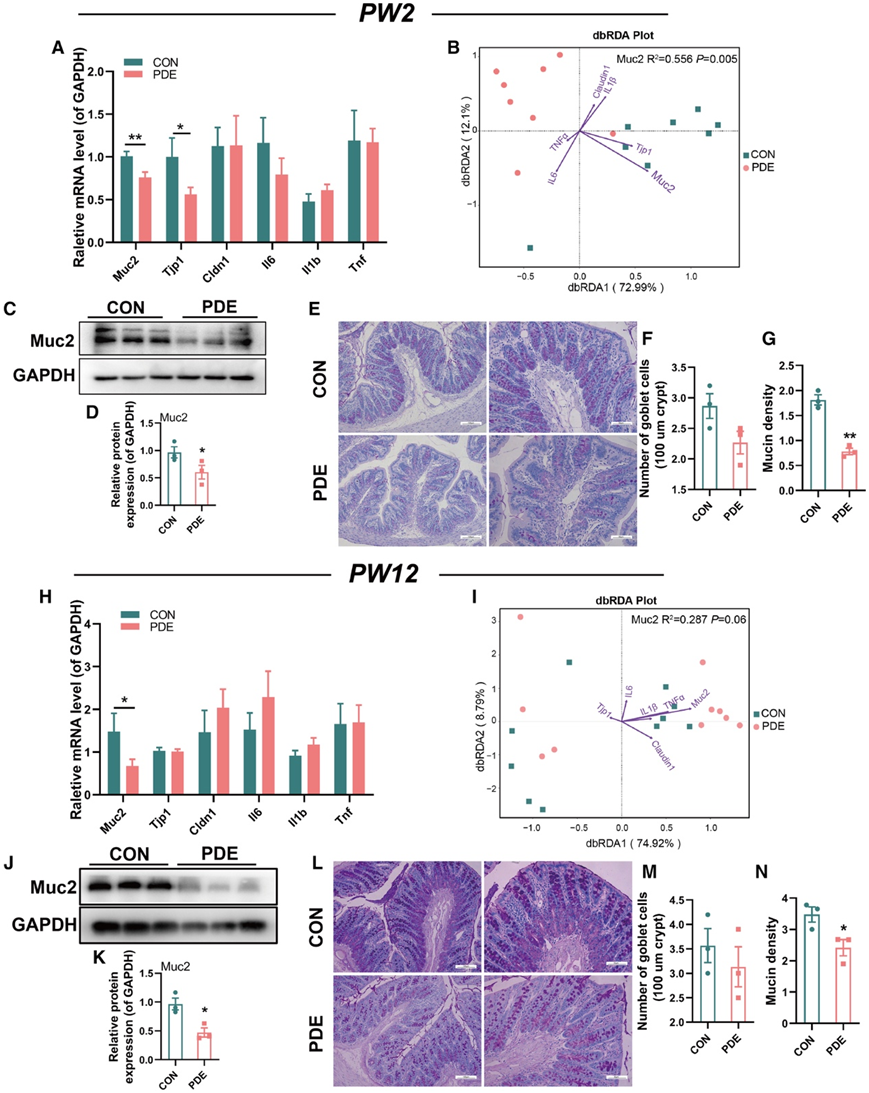
图3. PDE对出生后不同时间点PDE雌性子代大鼠结肠功能的影响及其与肠道菌群的关系。
(A,H) PW2 和 PW12 时结肠Muc2、Tjp1、Cldn1、Il6、Il1b和Tnf的 mRNA 表达。 (B,I) dbRDA 图显示了第 2 周和第 12 周结肠基因表达与肠道微生物群变化之间的关系。(C,D,J,K)PW2 和 PW12 时 Muc2 的蛋白质水平。(E,L) PW2 和 PW12 结肠的 PAS 染色。(F,G,M,N) 使用 ImageJ 分析 PW2 和 PW12 中的杯状细胞数量和粘蛋白密度。
04
PDE对雌性子代大鼠出生前后结肠Muc2表达的抑制作用
PDE 组胎儿肠道中 Muc2 的 mRNA 和蛋白水平均显著降低(图4A-D)。这些结果表明 PDE 雌性胎鼠肠道增殖受到抑制、肠道分化失调以及 Muc2 下调。为了研究PDE雌性后代出生前后Muc2持续下调的宫内编程机制,他们筛选并检测了能够调节胎儿肠道中Muc2表达的多种转录因子。在调节因子中,与对照雌性后代相比,PDE 雌性后代在出生前后的 CDX2 mRNA 和蛋白水平显著降低(图4B-H)。地塞米松可以通过激活 GR(核转录因子)来调节组蛋白脱乙酰酶 (HDAC) 的表达。然后他们检测了GR的核易位以及胎儿肠道中一系列HDAC的表达变化。与CON组相比,PDE组GR向细胞核的易位增加(图4 I-J),并且只有HDAC11的mRNA和蛋白水平显著上调(图4K-L)。他们进一步筛选了CDX2启动子区域的组蛋白乙酰化修饰位点,发现CDX2启动子区域的H3K14ac水平在GD20、PW2和PW12的PDE组中降低(图4M-O),而H3K9ac和H3K27ac的水平在出生前后并没有一致变化(图4M -O)。
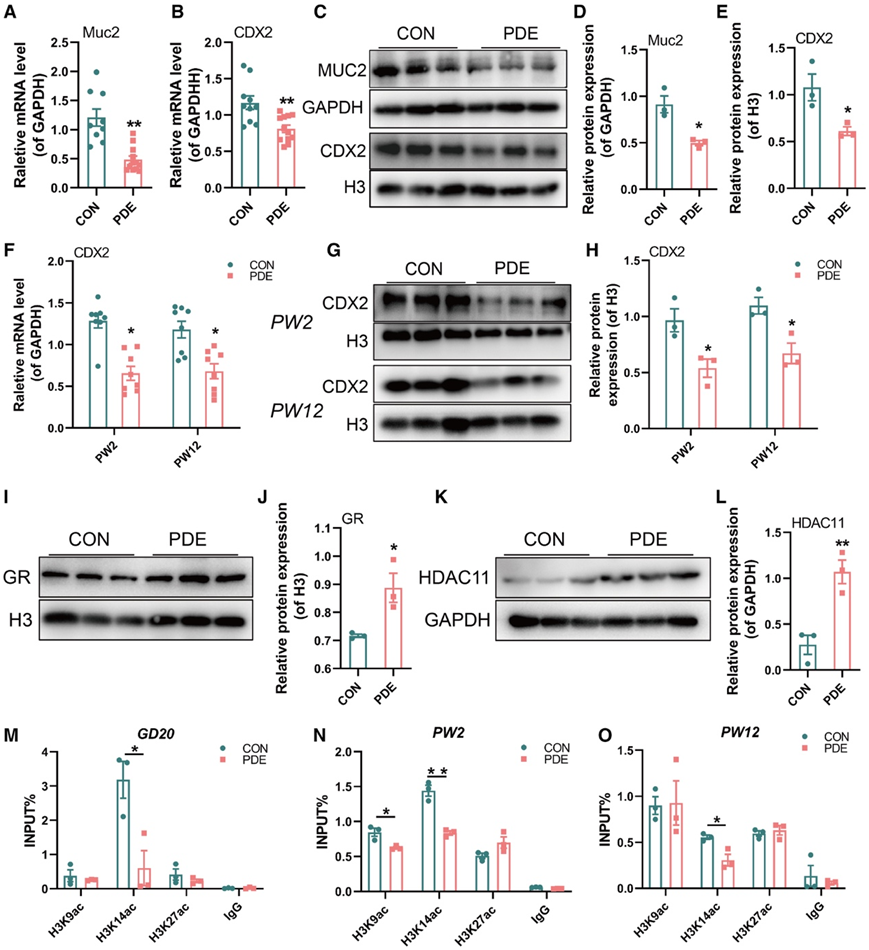
图4. PDE对雌性子代大鼠出生前后结肠Muc2和CDX2表达的影响。
(A-B) GD20 时Muc2和CDX2的 mRNA 表达。(C–E) 使用 ImageJ 分析 GD20 时 Muc2 和 CDX2 的蛋白质水平。(F) PW2 和 PW12 时的CDX2 mRNA 水平。(G-H) PW2 和 PW12 时细胞核中 CDX2 蛋白水平。 (I-J) GD20 时细胞核中的 GR 蛋白水平。(K-L) GD20 时的 HDAC11 蛋白水平。(M-O) GD20、PW2 和 PW12 时 CDX2 启动子区域中的 H3K14ac、H3K9ac 和 H3K27ac 水平。
05
地塞米松通过表观遗传修饰抑制杯状细胞中MUC2的表达
杯状细胞是产生粘蛋白的主要肠道细胞,他们使用人类杯状细胞系 LS174T 细胞来确定地塞米松对 MUC2 表达的影响并阐明其分子机制。与CON组相比,MUC2的mRNA表达以浓度依赖性方式降低,并且在1000和2500 nM的浓度下降低达到显著性(图5A)。然后用1000 nM地塞米松处理细胞72 h,进行进一步的机制研究。与MUC2的mRNA水平相似,地塞米松处理的细胞中CDX2的mRNA水平(图5B)以及MUC2和CDX2的蛋白水平均显著降低(图5C-E)。PAS染色还显示,与对照细胞相比,地塞米松处理的细胞中粘蛋白的产生减少(图5F-G)。GR siRNA处理部分逆转了地塞米松引起的CDX2和MUC2表达下降,表明GR在地塞米松诱导的MUC2下调中起作用(图5I-J)。染色质免疫沉淀(ChIP)-PCR证实地塞米松能显著促进GR与CDX2启动子区的结合(图5K)。综上所述,地塞米松可通过诱导GR核易位,促进其与CDX2启动子区直接结合,抑制LS174T细胞中CDX2和MUC2的表达。
接下来,他们开始验证地塞米松抑制LS174T细胞中CDX2表达的表观遗传机制。与CON组相比,地塞米松组的HDAC11 mRNA和蛋白水平升高(图5L-N),CDX2启动子区的H3K14ac水平降低(图5O)。免疫共沉淀 (coIP) 实验证实了地塞米松处理的细胞中 GR 和 HDAC11 之间的相互作用增强(图 5 P)。此外,GR siRNA处理逆转了地塞米松处理细胞中 CDX2 启动子区域中 HDAC11 表达的增加和 H3K14ac 水平的下降(图5Q-R),并且 HDAC11 siRNA处理部分逆转了地塞米松处理细胞中 CDX2 启动子区域 H3K9ac 水平的降低以及 CDX2 和 MUC2 表达的下调(图5O-T)。这些结果表明,地塞米松通过激活GR并随后募集HDAC11,促进HDAC11修饰CDX2启动子区域,导致CDX2启动子区域中H3K14ac水平降低,最终降低CDX2和MUC2表达。
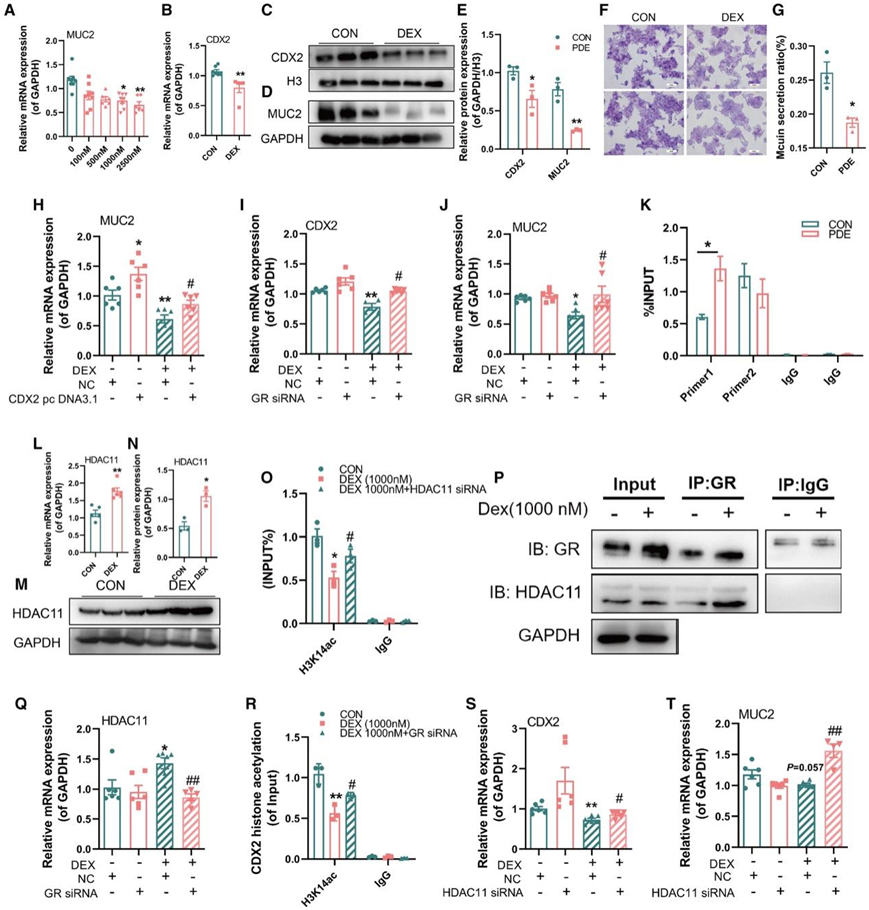
图5. 地塞米松对LS174T细胞MUC2表达的影响及其表观遗传机制。
(A)不同浓度地塞米松处理后LS174T细胞中MUC2 mRNA的表达。(B) CDX2 mRNA 表达。(C-E) 使用 ImageJ 分析 CDX2 和 MUC2 蛋白水平。(F-G)LS174T细胞的PAS染色,使用ImageJ分析粘蛋白分泌率。(H)用地塞米松(DEX)处理或用DEX+NC/CDX2 pc DNA3.1共同处理的LS174T细胞的MUC2 mRNA表达。(I-J)用DEX处理或用DEX+NC/GR siRNA共同处理的LS174T细胞的CDX2和MUC2 mRNA表达。(K) 通过 CHIP 将 GR 蛋白与 CDX2 启动子区域中推定的 GR 结合位点特异性结合。(L-N) HDAC11 mRNA 和蛋白质水平。(O)用DEX处理或用DEX+NC/HDAC11 siRNA共同处理的LS174T细胞的CDX2启动子区域中的H3K14ac水平。(P)通过coIP分析GR和HDAC11之间的相互作用。(Q-R)用 DEX 处理或用 DEX+NC/GR siRNA 共同处理的 HDAC11 表达和 H3K14ac 水平。(S-T)用DEX处理或用DEX+NC/HDAC11 siRNA共同处理的CDX2和MUC2表达。
06
PDE雌性子代大鼠肠道微生物群的改变介导胆汁淤积性肝损伤的易感性
他们检测了雌性子代大鼠20周龄时与胆汁淤积性肝损伤相关的血清学和肝脏病理指标的变化。与 CON 组相比,PDE 组的血清总胆汁酸 (TBA)、丙氨酸转氨酶 (ALT)、天冬氨酸转氨酶 (AST) 和碱性磷酸酶 (ALP) 水平显著升高(图6A-D)。H&E染色显示PDE组肝细胞水肿,部分细胞核固缩、排列紊乱,肝索结构模糊(图6E)。这些结果证实PDE雌性子代大鼠在成年期存在胆汁淤积性肝损伤。此外,PDE 雌性成年大鼠的血清胆汁酸特征是初级胆汁酸水平升高(例如胆酸 [CA]、鹅去氧胆酸 [CDCA]、α-鼠胆酸 [α-MCA]、β-鼠胆酸 [α-MCA])。酸[β-MCA]、甘氨胆酸[GCA]和甘氨鹅脱氧胆酸[GCDCA])和次级胆汁酸(例如GDCA和GDUCA)(图6I)。他们还在第 20 周进行了肠道微生物群分析。α多样性指数没有变化(图6F),但PDE组和CON组之间的肠道微生物群分布有显著差异(图6G)。有趣的是,一些胆汁酸代谢细菌(L. reuteri 和L. johnsonii)的丰度显著下降(图 6 H)。这些结果表明,PDE 诱导的成年雌性子代大鼠胆汁淤积性肝损伤可能与肠道微生物群改变导致血清初级和次级胆汁酸升高有关。
然后,他们进行了粪便微生物群移植 (FMT) 实验,以验证肠道微生物群改变在 PDE 雌性成年子代大鼠胆汁淤积性肝损伤中的作用。16周龄Wistar大鼠经口灌胃混合抗生素(1 mg/mL新霉素、1 mg/mL氨苄青霉素、0.5 mg/mL甲硝唑和0.5 mg/mL万古霉素)2周,以产生假性不育大鼠。然后在第18周时用PDE雌性子代大鼠(p-PDE组)或对照子代大鼠(p-CON组)的粪便细菌悬液连续灌胃假不育大鼠2周,并在第20周处死。与供体的肠道微生物群特征相似,PDE受体大鼠的α多样性指数与对照受体大鼠相比没有显著变化(图6 J),但各组之间肠道微生物群的群体分布不同(图6K)。PDE 受体大鼠中L. johnsonii的肠道丰度也有所降低(图6L)。
此外,与对照组大鼠相比,血清TBA、ALT、AST在PDE受体大鼠中均有不同程度的升高,而各组间血清ALP水平无明显变化(图6M-P)。H&E染色显示肝细胞水肿,组织紊乱,肝索结构模糊(图6Q)。目标代谢分析显示,与对照组相比,PDE受体大鼠血清初级胆汁酸(CA、CDCA、α-MCA和β-MCA)水平显著升高(图6R)。此外,PDE组供/受体大鼠结合胆汁酸与游离胆汁酸的比值(如牛磺酸去氧胆酸[TDCA]/二氯乙酸[DCA])均有不同程度下降(图6S),伴随着肠道菌群中胆盐水解酶(BSH)基因丰度的减少(图6T)。这些结果表明,肠道菌群的改变有助于成年PDE雌性后代大鼠的胆汁淤积性肝损伤。
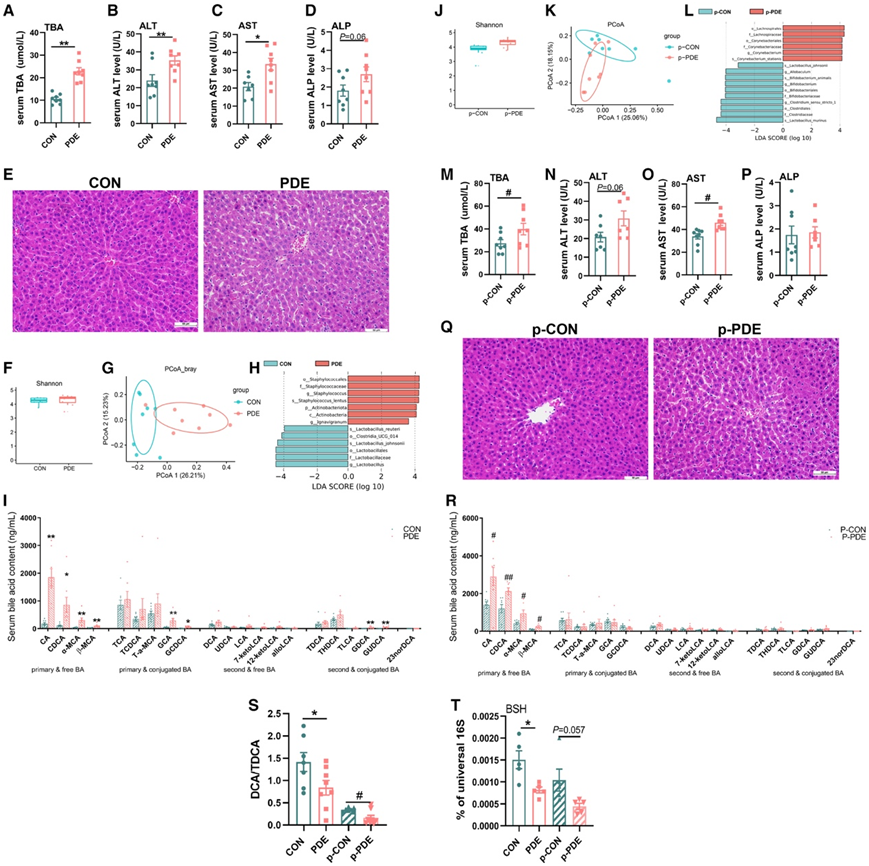
图6. 肠道菌群改变增加PDE雌性子代大鼠胆汁淤积性肝损伤的易感性。
(A–D) 对照组和 PDE 组的血清 TBA、ALT、AST 和 ALP 水平。(E) 对照组和 PDE 组的肝脏 H&E 染色。(F–H) 对照组和 PDE 组肠道菌群的 Shannon 指数、基于 Bray-Curtis 距离的 PCoA 图以及 LEfSe 分析。(I) 对照组和 PDE 组的血清胆汁酸代谢谱。(J–L)香农指数、基于 Bray-Curtis 距离的 PCoA 图以及 p-对照组和 p-PDE 组肠道微生物群的 LEfSe 分析。(M-P) p-对照组和 p-PDE 组的血清 TBA、ALT、AST 和 ALP 水平。(Q) p-对照和 p-PDE 组的肝脏 H&E 染色。(R) p-对照组和 p-PDE 组的血清胆汁酸代谢谱。(S) 血清 TDCA 与 DCA 的比率。(T) 粪便 BSH 表达。
06
后续PDT雌性后代2.5岁时肠道菌群组成和胆汁酸代谢的变化
为了探讨 PDE 雌性大鼠中异常肠道微生物群的持续存在是否也存在于 PDT 婴儿中,他们对 6 个月龄的雌性婴儿进行了随访至 2.5 岁,并收集了他们的粪便样本并进行了 16S 扩增子和宏基因组测序。16S扩增子测序结果显示,与CON组相比,PDT组的Chao1指数和Shannon指数显著下降(图7A-B),两组肠道菌群的群落结构可以分开(图7C)。MaAsLin2分析显示,在校正了多种混杂因素[如给药方式、喂养方式、体重指数(BMI)、抗生素和益生菌暴露]的影响后,PDT组参与胆囊酸代谢的细菌如Bacteroides和Blautia,仍显著减少(图7D)。与CON组相比,PDT组Bacteroides、Parabacteroides、Blautia和Akkermansia的丰度出现了不同程度的持续下降(图7E-H),并且随着婴儿年龄的增长,Bacteroides和Parabacteroides的组间差异更加突出。
最后,他们分析了2.5岁女婴的粪便胆汁酸。与CON组相比,PDT组粪便中初级胆汁酸CA水平升高,次级胆汁酸DCA水平降低(图7I)。在分化细菌的丰度与粪便中胆汁酸的水平之间进行了Spearman相关性分析,Bacteroides丰度与GDCA、DC呈正相关,与CA呈显著负相关(图7J)。乳酸菌丰度与石胆酸(LCA)水平呈正相关。总的来说,PDT雌性后代从6个月大到2.5岁,肠道微生物群组成的改变持续存在,并与胆汁酸代谢异常有关。
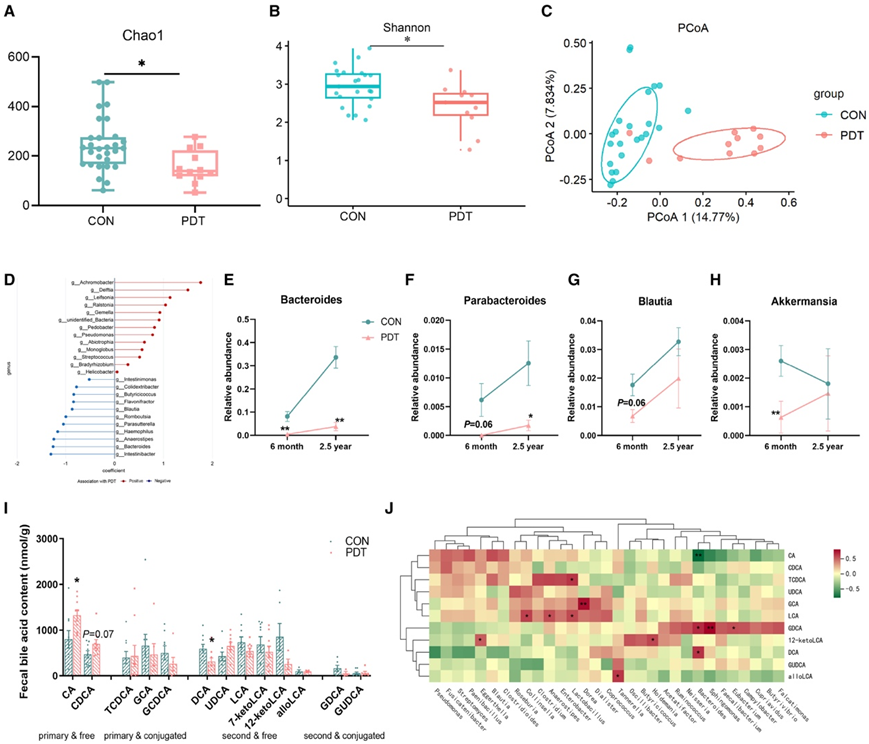
图7. PDT对2.5岁女婴肠道菌群的影响。
(A) 2.5 岁女婴肠道菌群 Chao1 指数。(B) 2.5 岁女婴肠道微生物群香农指数。(C) 基于 2.5 岁女婴肠道微生物群 Bray-Curtis 距离的 PCoA 图。(D) 通过 MaAsLin2 调整其他混杂因素后与 PDT 相关的属水平的细菌。(E-H) 6 个月至 2.5 岁女婴粪便中拟杆菌属、副拟杆菌属、布劳氏菌属和阿克曼氏菌的相对丰度。(I) 2.5 岁女婴粪便胆汁酸谱。(J) 细菌与粪便中胆汁酸的相关热图。
+ + + + + + + + + + +
结 论
本项研究发现PDT的 6 个月大婴儿的肠道微生物群存在性别差异,这种变化在女婴中持续到 2.5 岁,并且胆汁酸代谢发生改变。PDE 雌性子代大鼠肠道微生物群的定植和组成异常,并且对胆汁淤积性肝损伤的易感性增加。PDE 后代肠道微生物群定植异常可归因于出生前后 CDX2 表达减少导致 Muc2 表达受到抑制。结合动物和细胞实验,本项研究进一步证实地塞米松可以通过激活GR/HDAC11信号和调节CDX2表观遗传修饰来抑制Muc2表达。这项研究证明了宫内肠道发育不良的 PDT 后代的异常肠道微生物群和疾病易感性。
+ + + + +



 English
English


