文献解读|Cell Rep(8.8):原发性结直肠癌和转移进展的蛋白质组学特征确定了基于蛋白质组的亚型和特征
✦ +
+
论文ID
原名:Proteogenomic characterization of primary colorectal cancer and metastatic progression identifies proteome-based subtypes and signatures
译名:原发性结直肠癌和转移进展的蛋白质组学特征确定了基于蛋白质组的亚型和特征
期刊:Cell Reports
影响因子:8.8
发表时间:2024.02.19
DOI号:10.1016/j.celrep.2024.113810
背 景
结直肠癌 (CRC) 是男性和女性中第三大常见癌症,也是美国癌症相关死亡的第三大原因。CRC的转移进展仍然知之甚少,这给治疗带来了重大挑战。目前尚不知晓原发性 CRC (pCRC) 与转移性 CRC (mCRC) 分别具有哪些相同的分子特征和通路。
实验设计
结 果
01
富含癌基因/抑癌基因的结构变异 (SV)
本项研究通过全基因组测序在 32 个 CRC 样本中鉴定出 16757 个 SV(图 1 A),其中包括 9183 个(54.8%)插入、3436 个(20.5%)易位、2188 个(13.1%)缺失、1158 个(6.9%)倒位、792 个(4.7%)个重复,以及 2984 个基因(5'UTR、CDS、3'UTR)中的 7586 个 SV 断点。基因特异性SV事件在pCRC和mCRC之间无显著差异。在COSMIC癌症基因普查的723个癌相关基因(CAG)中,12个SV影响138个(19.1%)CAG,而非CAG仅影响4.9%(2846/58290)(图1B)。mCRC在cag中的SV计数略高于pCRC(图1C)。
鉴定出了前 30 个经常受 SV 影响的基因的 Oncoprint 和前 12 个基因的拷贝数(图1D-F)。其中,11 个基因(MARCROD2、FHIT、CCSER1、RBFOX1、PTPRD、WWOX、CSMD1、PDE4D、PRKG1、GPC6和NAALADL2)属于 ICGC/报告中常见脆弱位点 (CFS) 中受 SV 影响的前 21 个基因。CFS是特定的染色体区域,在阻碍DNA合成的条件下,在中期染色体上优先形成间隙或断裂,人类基因组中的两个位点(FRA3B/FHIT和FRA16D/WWOX)最容易形成病变。FHIT是队列中第三高的cfs相关基因。FHIT是一种肿瘤抑制因子,调节凋亡途径和细胞周期,FHIT表达缺失会导致基因组不稳定,并与侵袭性和不良预后等多种临床特征相关。尽管FHIT mRNA的表达在SV影响和SV未影响的样本之间没有显著变化(图1F),但在RNA和蛋白质水平上,FHIT-SV影响组的SV事件、肿瘤突变负担(TMB)和DNA双链修复过程/反应途径评分更高(图1G-I)。
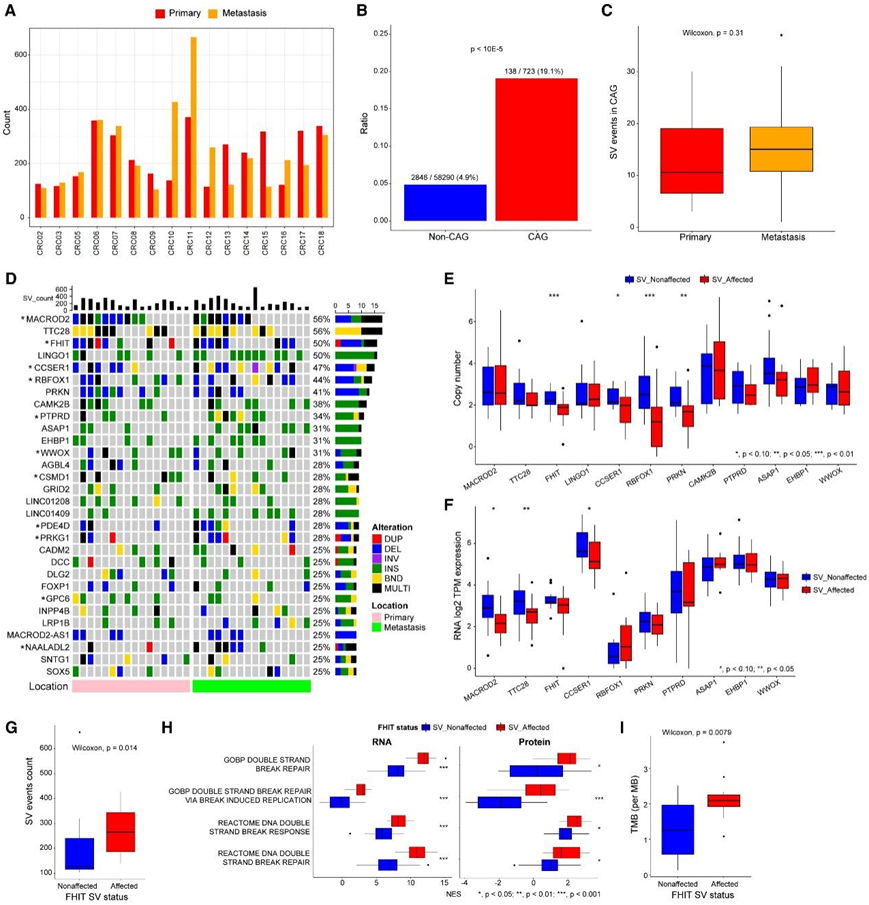
图1. SV景观和下游对分子通路的影响。
(A) 涉及基因的 SV 事件数。(B) CAG 和非 CAG 的 SV 事件频率。(C) 受 SV 影响的 CAG 的箱线图,比较 pCRC和 mCRC 。(D) 第 1 组中 30 个SV 影响基因的 Oncoprint。(E) 按 SV 状态分组的前 12 个受 SV 影响的基因的拷贝数箱线图。(F) (E) 中基因的 mRNA 表达水平。(G) 按FHIT位点 SV 状态分组的全基因组 SV 事件数。(H) 从转录组(“RNA”)和蛋白质组(“蛋白质”)数据获得的单样本 GSEA 的归一化富集得分箱线图。(I) FHIT基因座 SV 受影响组和非受影响组之间 TMB的箱线图。
02
转移灶的复发性体细胞拷贝数改变(SCNA)涉及已知的癌基因和肿瘤抑制基因
有 35 个独特的病灶扩增(图 2 A)和 8 个独特的病灶缺失(图 2 B)。mCRC特有的病灶事件涉及几个已知的CAG位点,如MYC (8q24.21)或FHIT (3p14.2)。复发灶峰涉及831个pCRC基因和1173个mCRC基因(图2C),其中648个pCRC和mCRC共有,525个是mCRC特有的。分子复合体检测(MCODE)分析发现了几个功能聚类,包括主要组织相容性复合体(MHC) I类/抗原呈递途径和磷脂酰肌醇3-激酶(PI3K)-Akt信号。当关注CAG时,有7个基因特异于pCRC, 11个特异于mCRC, 12个为两者共有(图2C)。几个已知的CRC cag,如EGFR,包括在共有基因列表中。MYC是一种已确定的结直肠癌癌基因,通过病灶峰分析,MYC对mCRC具有特异性(图2C-D)。
为了了解多水平的基因组改变,他们总结了从单核苷酸变异(snv)到大规模基因组变异的基因组改变,这些基因在超过31%的样本中含有基因组改变(图2E)。在这39个基因中,有24个基因主要受到sv的影响,包括大插入、易位或缺失,并且有报道称各种基因具有肿瘤抑制作用,如MACROD2、FHIT、CCSER1等。KRAS、CFAP47、MUC16和TTN主要受错义突变的影响。共现性和排斥性分析显示FLRT2和MACROD2是互斥的,而APC与NRK和FHIT的共现性显著较高(图2F)。为了阐明基因组改变对mRNA表达的影响,他们比较了基因组改变组和非基因组改变组之间的转录物表达(图2G)。在主要受SNV_INDEL影响的15个基因中,他们的数据集中量化了12个基因的mrna。
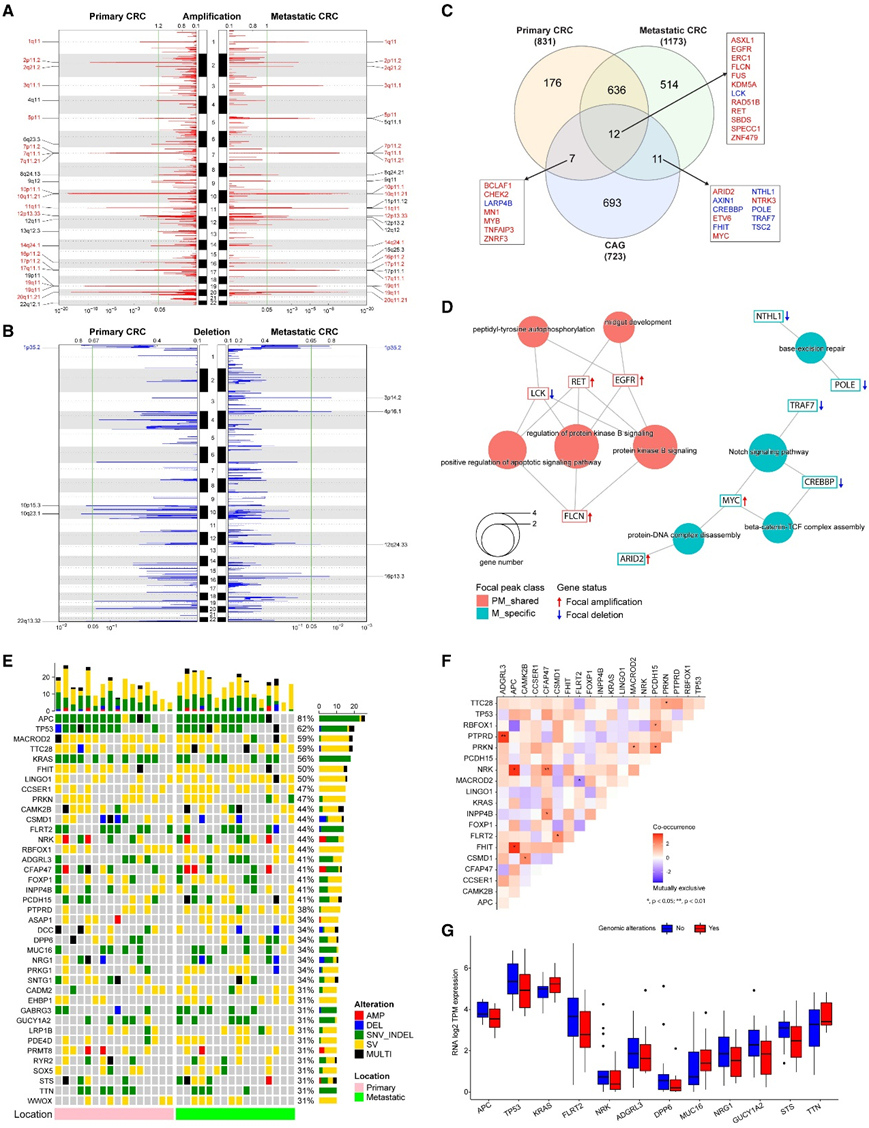
图2. 复发性体细胞拷贝数畸变和整合基因组改变。
(A) 病灶峰放大图。左侧显示 pCRC,右侧显示 mCRC。(B) 病灶峰缺失图。(C) 参与重复病灶峰的基因的维恩图。(D) pCRC-mCRC 共有 CAG(12 个基因)和 mCRC 特异性 CAG(11 个基因)中 GOBP 富集结果的网络图。(E) 队列 1 中具有 10 个或更多事件的整合基因组改变的 Oncoprint。(F) 12个及以上样本中涉及的前19个基因的共现和互斥性分析。(G) 在主要受小 SNV、插入缺失或其他改变影响的 15 个基因中,有 12 个基因在 mRNA 水平上进行了定量。
03
转录组和蛋白质组分析揭示缺氧、干性和致癌特征
为了识别转录组和蛋白质组中的共同特征,他们使用在任何成对比较(正常与 pCRC 与 mCRC)中具有 4 倍或更大表达变化的显著差异表达基因(DEG)和差异表达蛋白(DEP) 绘制了热图。这 1220 个 mRNA 和 312 个蛋白质通过 k 最近邻 (k-NN) 聚类分为 3 个特征:特征 1(正常高,pCRC/mCRC 低)、特征 2(正常低、pCRC/mCRC 高)和特征 3 (正常/pCRC 低,mCRC 高)(图 3A)。Metascape 的通路富集分析揭示了结直肠癌中的各种失调途径,包括细胞粘附、上皮间质转化(EMT)、间充质干细胞分化、适应性免疫系统和药物代谢途径。转录组和蛋白质组的特征 1 显示 pCRC 和 mCRC 中细胞粘附、细胞外基质 (ECM) 组织的一致下调以及 EMT 的增加。转录组和蛋白质组的特征 2 显示致癌途径上调。转录组和蛋白质组的特征 3 揭示了 mCRC 中药物代谢途径的上调。
通过 Ingenuity Pathway Analysis (IPA) 进行信号通路富集分析确定了 mCRC 中富集的几种致癌途径;例如,ERK/丝裂原激活蛋白激酶 (MAPK) 和 PTEN 信号传导(图 3 B)。他们通过对 AKT、mTOR 和 ERK 等关键调节因子进行免疫组织化学(IHC)评分来验证这些通路(图 3C)。在蛋白质组水平上,肝受体X(LXR)/RXR信号通路最为显著(图3B),IHC证实CRC中RXR上调和LXR下调(图3C)。LXR 是一种核受体,激活后可诱导细胞凋亡和 AKT 抑制并且在癌症中下调。据报道,磷酸化 RXRα 是一种核受体和 PPARγ 的异二聚体伴侣,可在结肠癌组织和结肠癌细胞系中积累。RXRα 的积累会损害 PPARγ 信号传导并导致肿瘤生长和细胞凋亡抑制。队列1和队列2 的 IHC 评分分别显示 RXR 上调和 LXR 下调(图 3 C)。在转录组水平上,HIF1α信号通路是第二重要的途径,他们通过免疫组化证实了CRC中的蛋白过表达(图3C)。
为了找到pCRC和mCRC中共享的上游调控因子,作为潜在的抑制靶点,他们在IPA软件中进行了上游调控因子分析,使用了来自DepMap数据库的53个结肠癌细胞系中具有平均CRISPR-Cas9基因效应评分低于- 0.5(较低的值意味着对基因的依赖性更强)的RNA标记2(与正常结肠组织相比,pCRC和mCRC中显著上调)中的基因。该分析确定了17个可靶向基因,其中10个与细胞周期相关(图3D)。由于这些基因在高基因效应评分的pCRC和mCRC中均上调,因此针对这些靶点的抑制分子,在晚期CRC治疗中有极大的应用前景。
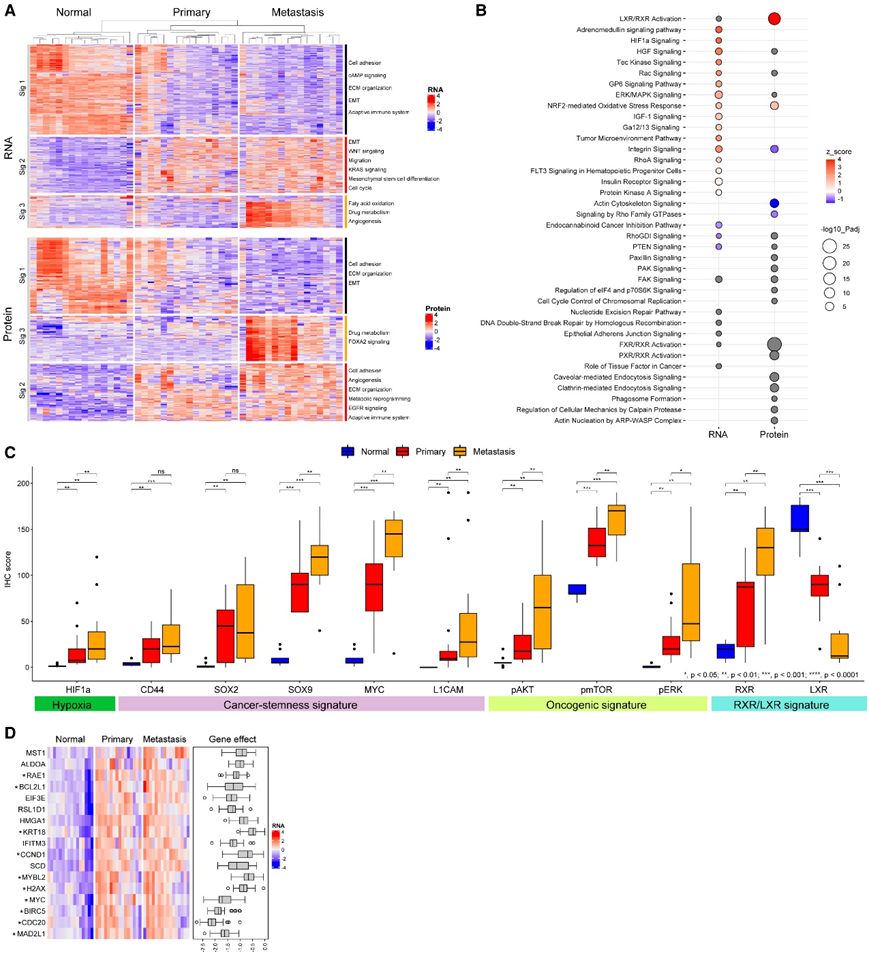
图3. 转录组和蛋白质组分析。
(A)显著 DEG 基因绘制的转录组和蛋白质组热图。(B) 典型途径富集的气球图。(C) 队列1的免疫组织化学评分的箱线图。(D) 控制 RNA 特征的上游调控因子热图 。
04
基于蛋白质组的聚类将 pCRC 和 mCRC 分为独特的亚型
由于发现队列显示了蛋白质组学在分析 pCRC 和 mCRC 以及描述转移进展方面的前景,他们进行了测序,并定量了整个队列中 5377 个蛋白质。尽管所有 258 个 pCRC 和 mCRC 样本均以无偏差方式一起分析,但无监督聚类将 135 个 pCRC 分为 3 个聚类 (P1–P3),将 123 个 mCRC 分为 3 个聚类 (M1–M3)(图 4 A)。这些发现表明,pCRC 和 mCRC 可以根据其蛋白质组谱进行差异亚型。
分析了每个蛋白质组亚型中APC、TP53、KRAS、PIK3CA、NRAS和BRAF的突变频率(图 4 B)。TP53突变在 M2 和 M3 中比在 M1 中显著更频繁。相反, M1 中的KRAS突变明显高于 M2 或 M3。PIK3CA突变在 P2 中的发生率明显高于其他 pCRC。此外,他们观察到右侧 pCRC 的临床结果往往较差,似乎在 P2/P3 原发肿瘤和 M1/M2 转移瘤中富集(图 4 C)。
为了了解 CRC 亚型如何从原发进展到转移,他们使用 68 个匹配的 pCRC-mCRC 对创建了桑基图(图 4 D)。令人惊讶的是,pCRC 和 mCRC 亚型之间没有简单的联系。每种 pCRC P1-P3 亚型的原发肿瘤均可进展为任何 mCRC M1-M3 亚型的转移瘤。这一发现表明,CRC 在进展过程中表现出蛋白质组亚型可塑性,而主要致癌基因的潜在突变在 pCRC 和 mCRC 之间几乎没有变化。这也表明原发性癌症和转移性癌症的蛋白质组学分析对于更好的疾病分层和治疗选择可能是必要的。
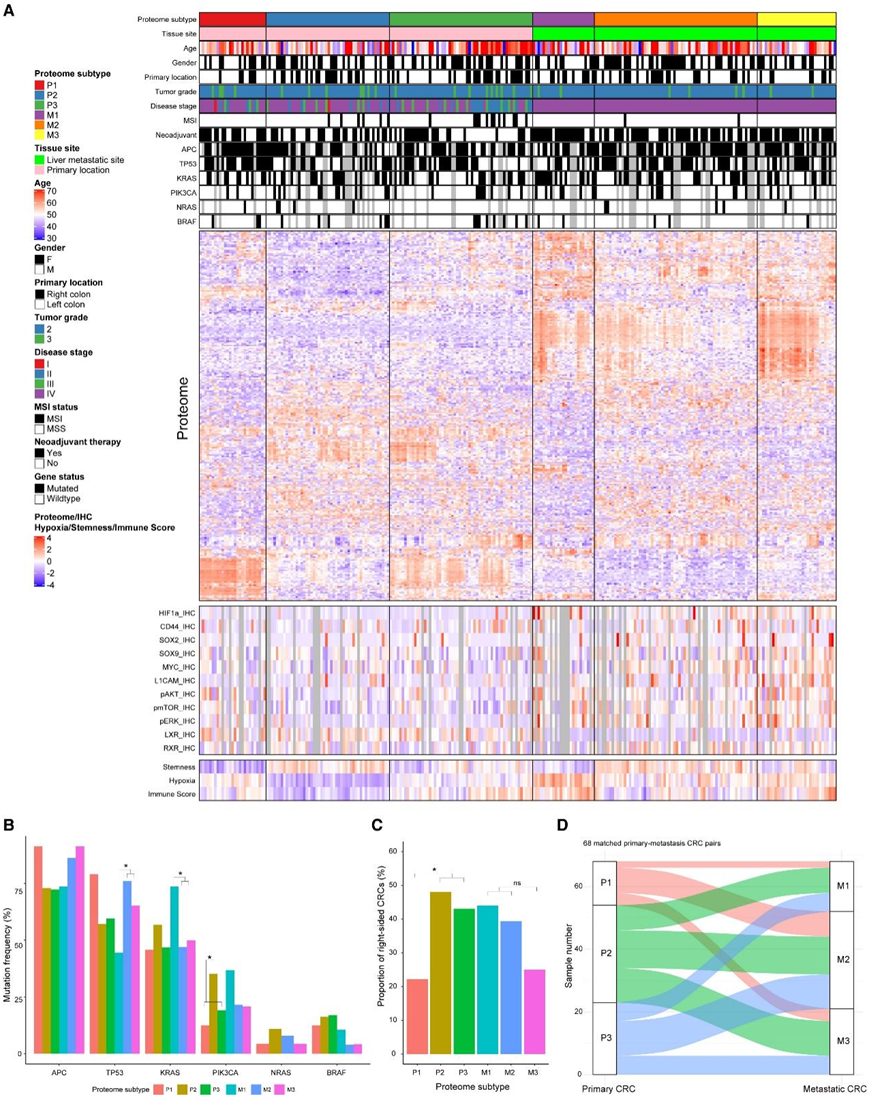
图4. 队列2的无监督聚类揭示了 6 个亚型。
(A) 临床属性和蛋白质组数据的汇总热图。(B) 每个蛋白质组亚型的突变频率的条形图。(C) 每个蛋白质组亚型中右侧 CRC 频率的条形图。(D) 来自队列 2 的 68 个匹配的 pCRC-mCRC 样本的 Sankey 图。
05
缺氧特征与 EMT 和代谢重编程相关
为了表征 CRC 的缺氧特征,他们重点关注 EMT 和代谢适应,因为这些是在缺氧条件下观察到的癌症的关键特征。首先,他们研究了蛋白质组缺氧特征与 EMT 和代谢适应途径之间的相关性(图 5 A)。正如预期的那样,HIF1α IHC 评分、EMT 和代谢途径与 Hallmark 缺氧评分显著相关。
低缺氧评分的 CRC 和高缺氧评分的 CRC(中位缺氧评分作为阈值)之间的差异表达(DE)分析揭示了 805 个显著失调的蛋白质,其丰度变化为 2 倍或更大(304 个上调,501 个下调)(图 5B)。
由于EMT似乎在缺氧高CRC中富集(图5A-C),他们对EMT诱导转录因子(ZEB1、TWIST和SNAI)进行了免疫组化评估。ZEB1在缺氧高的肿瘤中显著上调,而SNAI1/2和TWIST1无差异(图5D)。
接下来,他们研究了EMT信号和转化生长因子β (TGF-β)信号之间可能的相互作用。EMT特征评分与TGF-β信号传导呈显著正相关(图5A-E)。而SMAD2和SMAD4的表达与EMT特征评分呈负相关。因此,他们专注于非smad依赖性TGF-β信号,即MAPK和PI3K/AKT通路。他们发现PTEN/AKT/mTOR和MAPK通路在缺氧高蛋白质组亚组crc中发生激活(图5F)。将这些蛋白的表达与霍尔马克EMT特征评分进行比较,显示出相同的趋势(图5G)。
然后他们研究了结直肠癌如何通过代谢适应缺氧条件,即能量供应低。他们专注于 ATP 产生途径;即糖酵解、TCA 循环和脂肪酸氧化。在高缺氧组和低氧组之间进行了 GSEA,发现高缺氧肿瘤中糖酵解和脂肪酸代谢途径富集,而氧化磷酸化和 TCA 循环途径下调(图5 H)。与该基因集富集结果一致,高缺氧组与低氧组相比,葡萄糖转运蛋白和糖酵解相关酶的蛋白表达增加(图5I-J)。在缺氧高的 CRC 中,TCA 循环酶表达水平下调(图 5 K)。
尽管 TCA 循环更有效地产生 ATP(Warburg 效应),但癌症可以适应优先使用有氧糖酵解而不是 TCA 循环来产生 ATP。本项研究的蛋白质组学研究结果证实,缺氧亚型 CRC 细胞通过有氧糖酵解转向产生 ATP,特别是在易缺氧的转移性病变中,导致转移进展过程中对癌症微环境的缺氧适应(图5 L)。
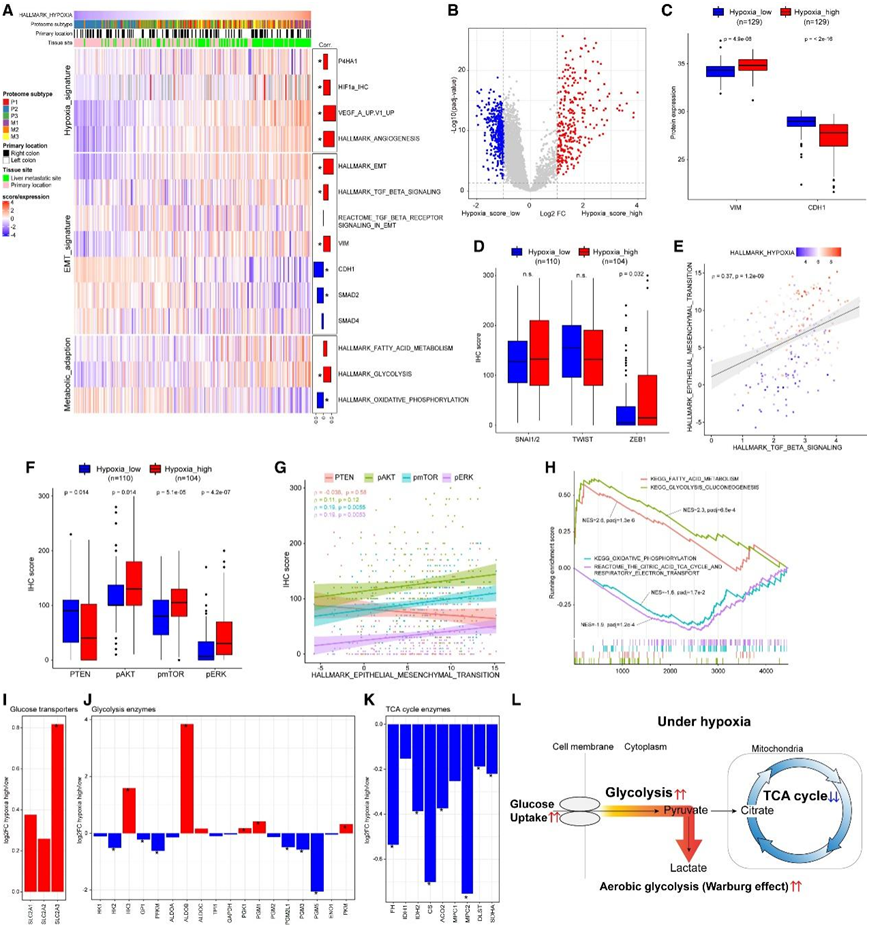
图5. CRC的缺氧特征。
(A) 热图显示缺氧特征与 EMT 特征和代谢重编程的相关性。(B) 缺氧高 CRC和缺氧低 CRC之间的 DE 分析火山图。(C) EMT 标记的箱线图。波形蛋白和 E-钙粘蛋白在高缺氧组中显著失调。(D) EMT 诱导转录因子的 IHC 评分箱线图。(E) TGF-β 信号传导和 EMT 特征的相关图,显示出显著的正相关性。(F) 非 Smad TGF-β 信号通路成员表达的箱线图。(G) 非 Smad TGF-β 信号传导和 EMT 特征的相关图。(H) 队列2(缺氧高/低)中代谢重编程相关途径的富集图。(I) 葡萄糖转运蛋白表达比率的条形图(缺氧高/低)。(J) 糖酵解相关酶表达比的条形图(缺氧高/低)。(K) TCA 循环相关酶表达比的条形图(缺氧高/低)。(L) 缺氧条件下 CRC 代谢重编程图表。
06
癌症干性与致癌途径激活、端粒维持和耐药表型相关
为了系统地表征 pCRC 和 mCRC 的基于蛋白质组的癌症干性,而不是依赖于 CD44 或 SOX2 等单一蛋白质标记,他们计算了全面的蛋白质组干性评分,并在干性评分高组和低组之间进行 DE 分析。该分析鉴定出 1,089 个蛋白质显著失调,丰度变化为 2 倍或更大,其中包括 860 个上调蛋白质和 229 个下调蛋白质)(图 6A)。具有 Hallmark 通路的 GSEA 发现在干性高的肿瘤中上调的致癌通路(例如 MYC 靶点)失调(图 6 B)。IHC 验证了干性高肿瘤中 MYC 的过度表达(图 6 C)。此外,G2M 检查点和细胞周期途径在干性高的肿瘤中发生激活(图 6B-D),这通过 IHC 细胞增殖标记物 Ki67 表达增加得到验证(图 6E)。由于具有高干性特性的癌症通常表现出治疗耐药性,因此他们研究了药物转运蛋白的表达。本项研究的蛋白质组数据集中量化的 15 种药物转运蛋白中的大多数在干性高的 CRC 中高度上调,例如ABCB7、ABCC1、ABCD3、ABCE1 和 ABCF3(图 6 F)。
由于高干性CRC显示DNA修复途径和端粒维持途径上调(图6B-H),他们使用TelNet数据库和ssGSEA算法检测了端粒维持机制。端粒酶依赖性延长(TEL)和选择性端粒延长(ALT)途径都与干性评分呈正相关,其中ALT与干性的相关性更强(图6I-J)。TEL通路似乎只在pCRC中上调,而ALT通路在pCRC和mCRC中均富集(图6K-L)。ALT/TEL评分比显示M2亚型具有较高的ALT通路评分(图6M),与M2在mCRC中具有最高的干性评分一致(图6N)。alt -高的肿瘤,如肉瘤,与DAXX/ATRX下调有关,同时,他们发现这些蛋白在mCRC中缺失,特别是在M2亚型中(图6O)。
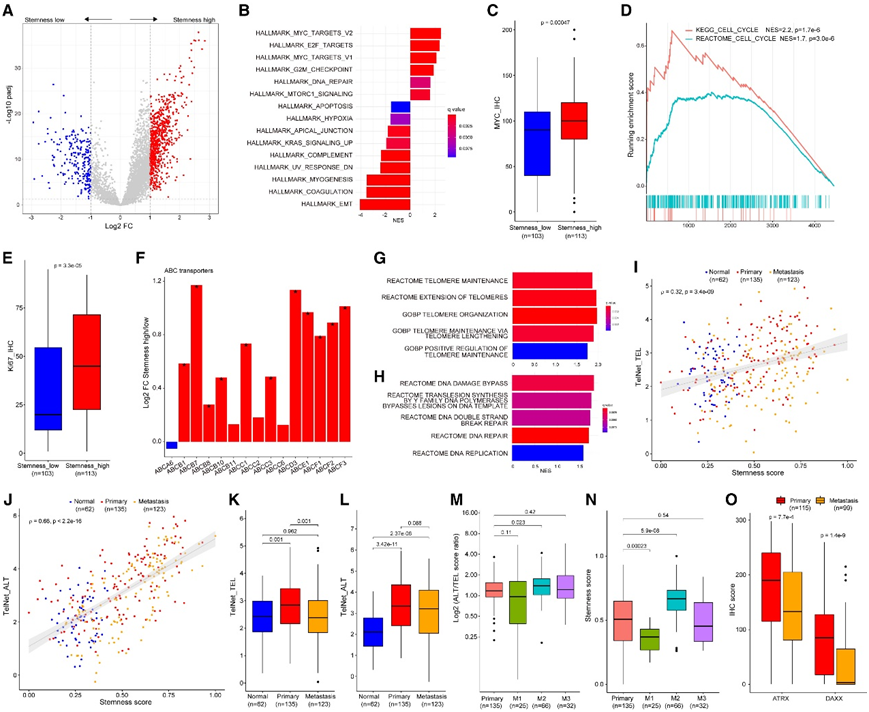
图6. 癌症干细胞特征。
(A) 对队列 2 中干性低组和干性高组进行差异表达分析。(B) 具有 Hallmark 基因集的 GSEA 条形图,比较队列 2 中干性低和干性高组。(C) MYC IHC 评分的箱线图。(D) 细胞周期相关的KEGG和 REACTOME 的富集图。(E) Ki67 指数的箱线图,显示干性高组中的肿瘤细胞增殖显著高于干性低组。(F) 队列 2 中干性低组和干性高组之间 ABC 转运蛋白表达比率的条形图。(G) MSigDB c2 和 c5 基因集的 GSEA 结果条形图。(H) GSEA 结果与 MSigDB REACTOME 基因集的条形图。(I) TEL评分和干性评分的相关图显示显著的正相关。(J) ALT 得分和干性得分的相关图显示,与 TEL 得分和干性得分之间的相关性相比,ALT 得分与干性得分具有更强的相关性。(K) 按组织类型划分的 TEL 评分箱线图。(L) 按组织类型划分的 ALT 评分箱线图。(M) 按组织类型和蛋白质组亚型划分的 ALT/TEL 得分比的箱线图。(N) 按组织类型和蛋白质组亚型划分的干性评分的箱线图。(O) 按组织类型划分的 ATRX 和 DAXX IHC 评分的箱线图。
07
免疫冷肿瘤的特点是抗原加工途径受到抑制和生存率低,尤其是在转移环境中
为了阐明免疫冷肿瘤的癌症免疫逃避机制,他们在肿瘤组织免疫细胞浸润的 IHC 评估的协助下进行了综合蛋白质组学分析。免疫评分与抗原呈递机制(APM)呈正相关,包括 MHC I 类和 II 类途径(图 7A)。GSEA证实了抗原呈递途径的显著下调(图7B)。肿瘤细胞中MHC I类/II类蛋白表达与CD4+和CD8+ T细胞计数、CIITA(MHC II类转录调节因子)和IRF1(MHC I类分子和CIITA的转录调节因子)相关(图7C)。为了研究调节性T细胞或浸润性巨噬细胞对免疫微环境可能的调节作用,他们分析了FOXP3+(调节性T细胞标志物)和CD68+(泛巨噬细胞标志物)细胞计数与免疫评分的相关性,但未发现显著相关性。IRF1蛋白的表达与许多参与抗原加工过程的蛋白(包括免疫蛋白酶体)呈正相关,如TAP1、TAP2、TAPBP、ERAP1、PSMB8和PSMB9,而IRF1蛋白的表达与传统蛋白酶体的催化亚基(PSMB5、PSMB6和PSMB7)呈负相关(图7D)。与IRF1和CIITA转录因子受IFNγ- jak - stat通路调节的报道一致,IRF1和CIITA与这些蛋白和通路呈正相关(图7C),提示刺激IFNγ信号通路可能对免疫-冷结直肠癌具有治疗价值。在6种基于蛋白质组的亚型中,M1 mCRC中HLA-ABC、HLA-DP/DQ/DR、CD3和IRF1的蛋白表达最低(图7E)。根据IHC结果,M1亚型是免疫冷的,但有趣的是,M1也有最高的缺氧评分。这种表型表明,缺氧条件可能会积极抑制肿瘤微环境中的免疫防御。相比之下,P3亚型(pCRC)表现出免疫热,IRF1、CIITA和HLA-DP/DQ/DR蛋白表达显著升高(图7E)。
他们基于免疫特征评估患者结果分层。具有高密度CD4+或CD8+ T细胞的pCRC在总生存率方面的临床结果略好(图7F-G),而具有高密度T细胞的mCRC的结果明显更好。这一观察结果强调了转移性组织活检评估的必要性,以便更好地对患者进行分层。
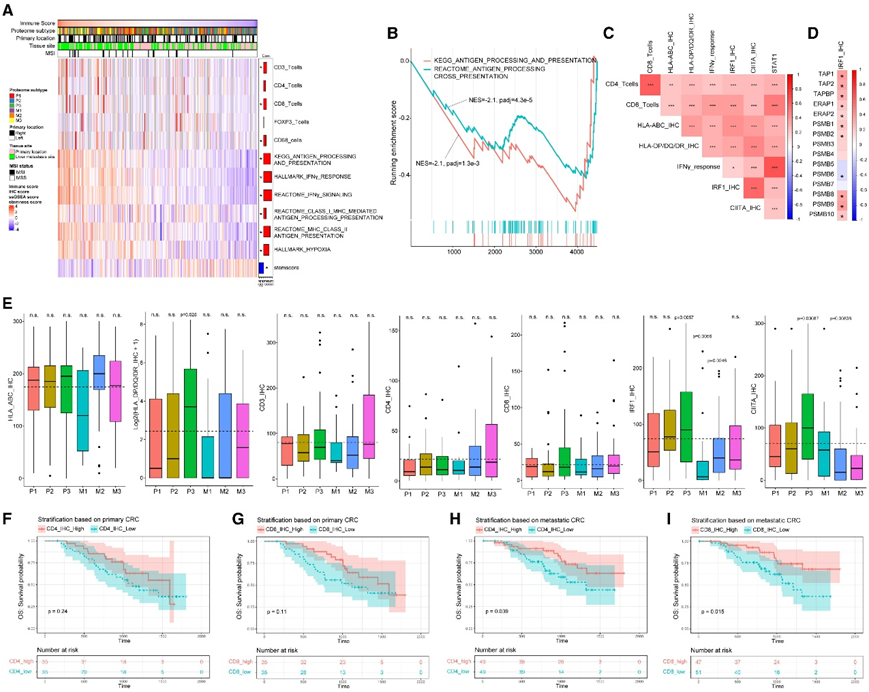
图7. 免疫冷肿瘤的表征。
(A) 具有免疫特征和临床属性的热图。(B)包含来自 KEGG 和 REACTOME 的抗原处理和呈递的富集途径。(C) 涉及抗原加工机制的 IHC 评分的相关图。(D) IRF1 IHC 评分和抗原加工机制蛋白表达的相关图。(E) HLA-ABC、HLA-DP/DQ/DR、CD3、CD4、CD8、IFR1 和 CIITA 的 IHC 分析结果箱线图。(F)按pCRC的CD4表达水平分层的Kaplan-Meier生存曲线分析。(G)按pCRC的CD8表达水平分层的Kaplan-Meier生存曲线分析。(H)按 mCRC 的 CD4 表达水平分层的 Kaplan-Meier 生存曲线分析。(I)按mCRC的CD8表达水平分层的Kaplan-Meier生存曲线分析。
+ + + + + + + + + + +
结 论
本项研究对原发性 CRC 和肝转移进行了多组学分析。基因组改变,例如结构变异或拷贝数改变,在癌基因和抑癌基因中富集,并且在转移中增加。对 135 个原发性 CRC 和 123 个转移性 CRC 进行无监督的基于质谱的蛋白质组学分析,发现了不同的蛋白质组亚型,原发性 CRC 和转移性 CRC 各有 3 个亚型。综合分析表明,缺氧、干性和免疫特征是这 6 种亚型的特征。缺氧结直肠癌具有高度上皮间质转化特征和代谢适应。具有干性特征的 CRC 显示出高致癌途径激活和替代端粒延长 (ALT) 表型,尤其是在转移性病变中。肿瘤微环境分析显示,通过调节主要组织相容性复合体 (MHC) I/II 类和抗原加工途径来逃避免疫。这项研究描述了原发性和转移性 CRC 的特征,并提供了转移进展的大型蛋白质组学数据集。
+ + + + +



 English
English


