文献解读|Nat Genet(30.8):宫颈鳞状细胞癌的多组学分析确定了具有生物学和临床相关性的细胞生态系统
✦ +
+
论文ID
原名:Multiomic analysis of cervical squamous cell carcinoma identifies cellular ecosystems with biological and clinical relevance
译名:宫颈鳞状细胞癌的多组学分析确定了具有生物学和临床相关性的细胞生态系统
期刊:Nature Genetics
影响因子:30.8
发表时间:2023.11.20
DOI号:10.1038/s41588-023-01570-0
背 景
宫颈癌是女性癌症死亡的第四大原因,2020 年全球有 342000 人死亡。宫颈鳞状细胞癌 (CSCC) 是宫颈癌最常见的组织学类型。根据 T 细胞浸润模式,可将肿瘤免疫表型 (TIP) 分为三种不同的肿瘤免疫表型 (TIP):排除的TIP显示免疫细胞位于肿瘤基质而不是上皮;沙漠TIP缺乏免疫浸润。这些 TIP 是免疫治疗反应的决定因素,但这些 TIP 的分子机制仍然难以捉摸。
实验设计
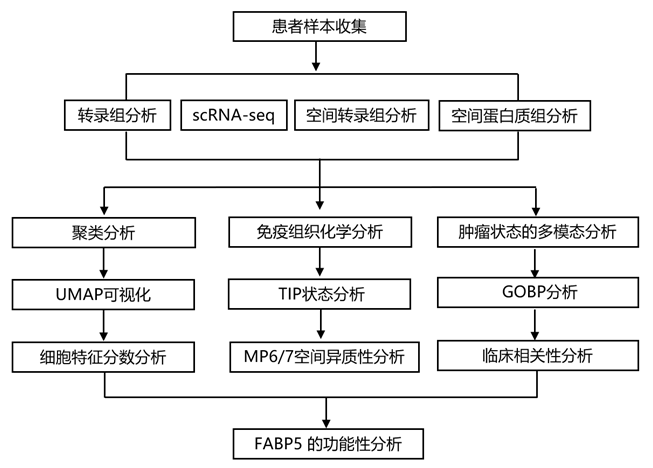
结 果
01
CSCC单细胞表达图谱
为了全面解码 CSCC 生态系统,研究团队首先利用来自健康捐赠者(HD)的 14 个未经治疗的肿瘤和 3 个正常子宫颈样本进行了单细胞转录组分析(scRNA-seq)(图1a)。总共获得了 163880 个细胞,并构建了一个细胞图谱,其中包含源自 14 个主要细胞类型的 50 个细胞亚型,并用特征标记注释(图1b)。
恶性上皮细胞的转录异质性与肿瘤免疫微环境 (TIME)形成特定的相互作用,决定肿瘤的命运。因此,他们着手评估 CSCC 鳞状上皮细胞的细胞状态多样性。20168个恶性鳞状细胞根据其肿瘤起源表现出明显的肿瘤间异质性聚类(图1c)。通过对每个恶性细胞应用非负矩阵分解(NMF),确定了八个不同的元程序(MP1-8) ,反映了不同肿瘤之间瘤内异质性的常见模式(图1d)。
值得注意的是,鉴定出了代表鳞状分化不同阶段的三种MP(MP6、MP7和MP8),其特征基因主要由上皮标记物组成,例如角蛋白、粘蛋白和富含脯氨酸的小蛋白家族(图1d)。MP6(上皮细胞角蛋白)在泛癌研究中表现出与 HNSCC_epi2 特征高度一致。但与上皮衰老 (Epi-Sen) 相似度较低,富含角化相关基因,强调了其鳞状细胞癌的特异性。MP8 (Epi-Sen) 与 HNSCC_epi1 状态和泛癌 Epi-Sen相似,表现出与人乳头瘤病毒 (HPV) 相关的衰老特征。MP7 (Epi-Imm) 具有多种免疫细胞相关分子(HLA-DRB、B2M和IDO1),表明其免疫相关上皮状态。 MP6与癌症相关成纤维细胞(CAF)含量呈正相关,与免疫细胞(CD4_Th-CXCL13、CD8_Tex-GZMK和CD4-MKI67)含量呈负相关(图1e)。
为了更好地表征 CSCC 中恶性细胞的异质性和可塑性,他们根据相应特征基因的表达评分将每种肿瘤细胞分为不同的 MP 相关亚型。均匀流形近似和投影(UMAP)空间可视化分析显示,这些 MP 相关肿瘤亚群表现出与其各自的 MP 活性高度一致(图1f-g),进一步突出了在 CSCC 中观察到的瘤内异质性。
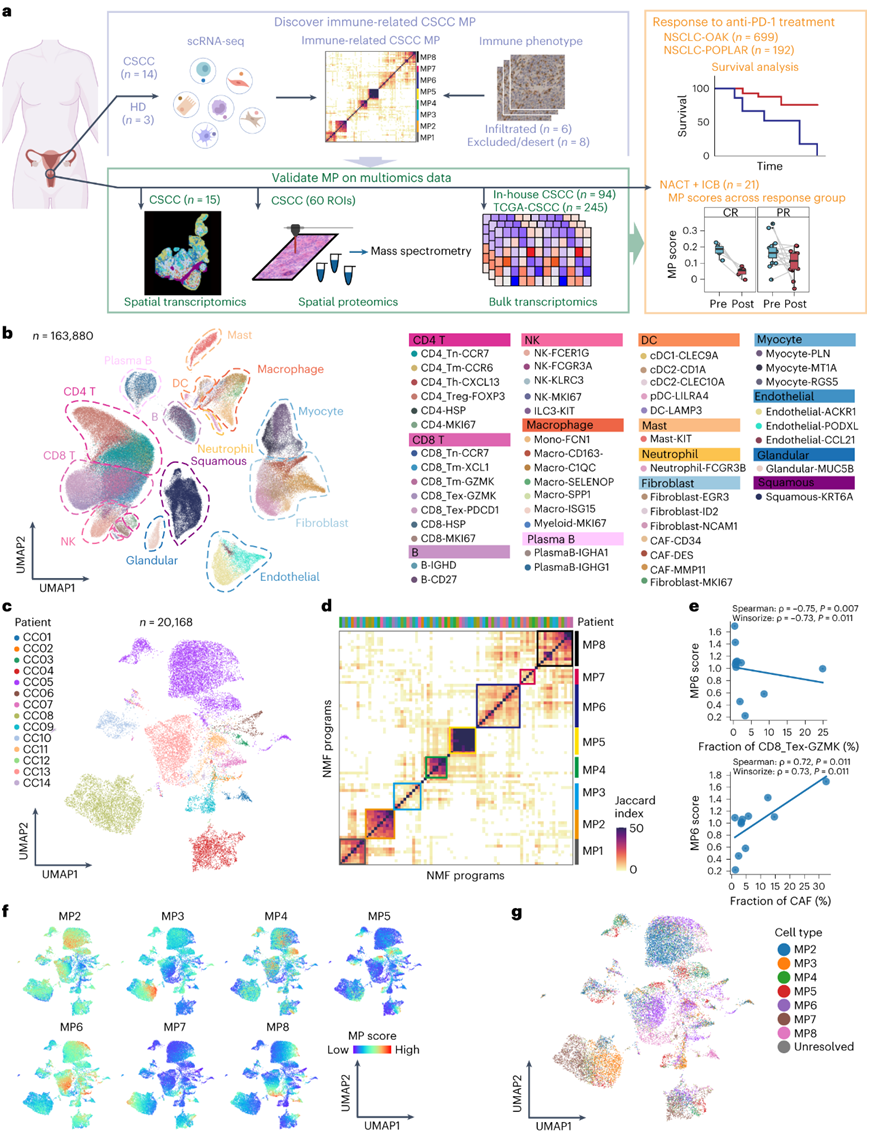
图1. scRNA-seq 揭示的细胞图谱为探究 CSCC 异质性提供了基本视角。
(a) 实验流程方案。 (b) 通过 scRNA-seq 分析的 163880 个细胞的 UMAP 图。 (c) 由患者着色的 20168 个肿瘤细胞的 UMAP 图。 (d) 在所有分析的 CSCC 患者的肿瘤细胞中识别出的 NMF 程序之间的成对相似性的层次聚类。 (e) 散点图显示每个患者的 MP6 特征分数与 CAF 和 CD8_Tex-GZMK 细胞分数之间的相关性。(f) 肿瘤细胞的 UMAP 图。(g) 肿瘤细胞的UMAP图,其按根据MP特征分数识别的细胞类型着色。
.
02
MP6 和 MP7 与不同的 TIP 相关联
除了丰度之外,CD8 + T 细胞的空间分布对于时间分层和免疫治疗反应至关重要。为了评估MP和TIP之间的关系,他们根据CD8+ T细胞分布的位置为每个肿瘤分配了TIP:(1)浸润TIP,CD8+ T细胞穿透肿瘤上皮;(2)排除TIP, CD8+ T细胞主要嵌入周围基质;(3)沙漠TIP, CD8+ T细胞缺失(图2a)。随后将肿瘤分类为浸润性或排除性/沙漠性TIP(图2b)。从scRNA-seq推断,浸润的TIP显示出更多的CD8+ T细胞(图2c-d)。此外,基于观察到的细胞数量与预期细胞数量之比的密度估计和免疫细胞富集突出了明显的tip特异性差异,特别是在T细胞状态中(图2e-g)。特别是CD8_Tex-GZMK、CD8_Tex-PDCD1和CD8-MKI67细胞,它们具有细胞毒能力,但共同表达抑制受体和衰竭标志物,在浸润肿瘤中富集,而在排除/沙漠肿瘤中缺失。
重要的是,排除/沙漠的CSCC表现出较高比例的MP6细胞,而浸润的CSCC具有较高比例的MP7细胞(图2h-i),证明了肿瘤MP与TIP的关系。
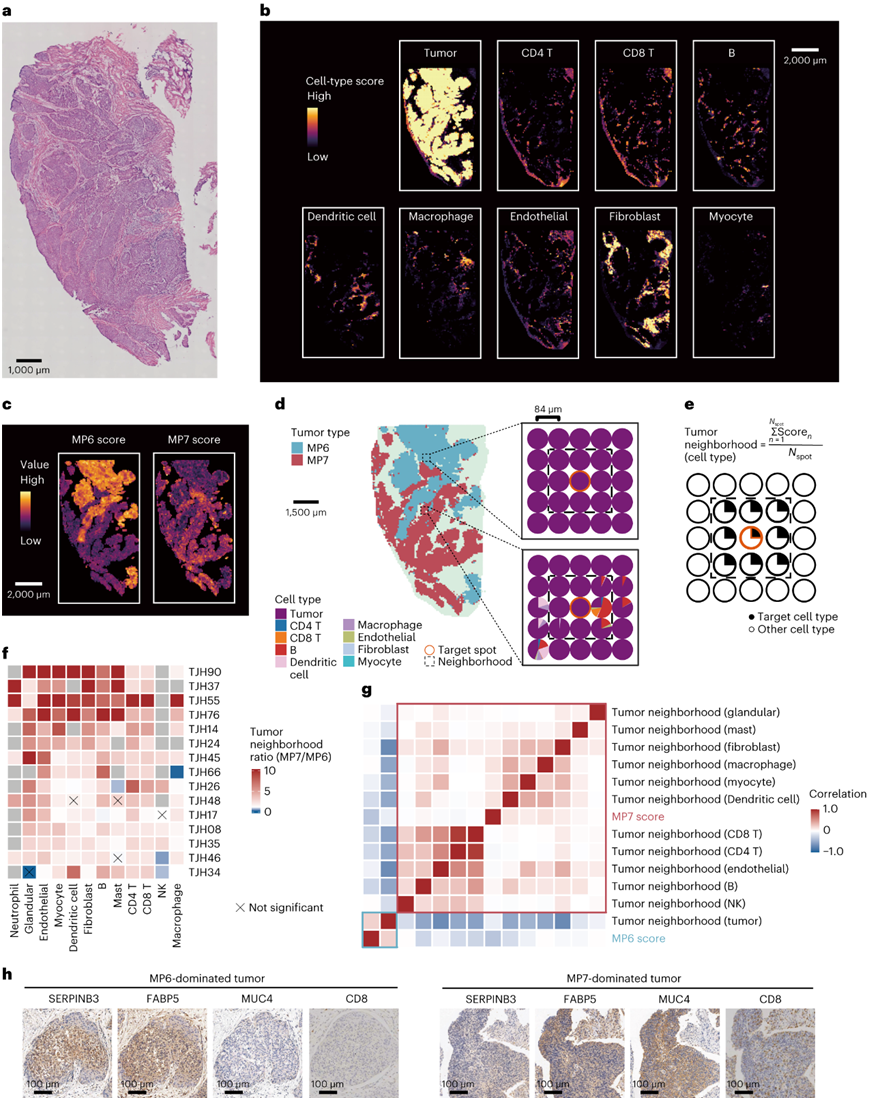
图2. MP7 与大量偏向细胞毒性/耗竭状态的肿瘤浸润 T 细胞相关。
(a) 具有浸润或排除/沙漠 TIP 的 CSCC 基质 (str) 和上皮 (epi) 区域 CD8 的代表性 IHC。(b) CSCC 中基质 (strCD8) 和肿瘤上皮 (epiCD8) 位置中 CD8 阳性细胞比例的散点图。(c) 每个样品中基质细胞类型的组成。 (d) 箱线图显示不同 TIP 之间每个基质细胞的百分比。 (e) T 细胞和 NK 细胞的 UMAP 图。 (f) 相对核密度显示 UMAP 空间中渗透 TIP 中每个细胞聚类的富集(红色)和耗竭(蓝色)。 (g) 热图显示 T细胞、先天淋巴细胞 (ILC) 和 NK 细胞聚类中的平均 T 细胞状态模块得分(左),以及通过观察到的细胞数与预期细胞数的比率估计的不同 TIP 中各种细胞的富集度 (Ro/ e)(右)。 (h) 不同TIP中MP6和MP7肿瘤细胞的组成。 (i) 小提琴图显TIP 的肿瘤细胞中的 MP6(上)和 MP7(下)特征分数。
03
TIME 邻近 MP6 和 MP7的空间分析
为了进一步评估空间分辨率下 MP6、MP7 和免疫细胞浸润之间的关系,他们进行了空间转录组学分析 (Stereo-seq),并整合了15 个 CSCC 的空间转录组数据(图3a-b)。他们用 MP6 和 MP7 特征基因对肿瘤点进行评分,并应用层次聚类将每个切片中的肿瘤点分别分类为 MP6 或 MP7(图 3c)。
为了研究与 MP6 和 MP7 区域相关的 TIME 细胞的组成,他们通过计算相应点周围的平均细胞类型得分来定义细胞邻域得分(图3d-e)。在本研究所有空间转录组学分析数据中,MP7 点均表现出较高的免疫细胞邻域评分,包括 CD4 T、CD8 T 细胞、B 细胞、巨噬细胞和树突状细胞(图3f)。此外,MP6 的相关性分析、MP7和细胞邻域评分表明MP7与免疫细胞邻域存在明显的正相关性,而MP6与免疫细胞邻域存在负相关性(图3g)。
他们检测了区分各种 MP 和 TIP 的标记基因的表达。具有高 SERPINB3 和 FABP5 的肿瘤(MP6 显性肿瘤)显示出稀疏的 MUC4 染色,并且重要的是,缺乏 CD8 T 细胞浸润。相比之下,具有高MUC4的肿瘤(MP7显性肿瘤)显示出较少的SERPINB3和FABP5阳性肿瘤细胞,但有大量的CD8 T细胞浸润(图3h)。

图3. 空间转录组学证明 MP6 和 MP7 与免疫细胞浸润呈负相关。
(a-b) 代表性载玻片 TJH34 中的H&E 染色和按细胞类型评分着色的斑点的空间分布。(c) 载玻片TJH34的肿瘤点中MP6和MP7特征得分的代表性空间表达。(d) MP6或MP7肿瘤点附近的TIME细胞组成。 (e) 计算肿瘤邻域评分的示意图和公式。 (f) 热图显示所有 15 张幻灯片中 MP7 和 MP6 点 (MP7/MP6) 之间各种 TIME 细胞类型的平均邻域分数的比率。 (g) 热图显示幻灯片 TJH34 内每个肿瘤点中 MP6、MP7 的特征分数和各种 TIME 细胞类型的邻域分数之间的 Pearson 相关系数。 (h) MP6和MP7为主的肿瘤区域的SERPINB3、FABP5、MUC4和CD8的IHC。
04
MP6 中激活转化生长因子 β 信号传导
具有MP6状态的肿瘤细胞表现出在角化过程中富集的基因表达模块(包括FABP5、SPRR1B、SERPINB3、KRT6B和S100A8)(图4a)。相比之下,MP7肿瘤细胞表现出与抗原呈递(包括HLA-C、HLA-DRB1、HLA-DPB1和CD74)、免疫应答(包括B2M、LCN2和CXCL10)、免疫抑制分子(包括IDO1、CD274、CD276和BTN3A1)和多种粘蛋白(包括MUC1、MUC16和MUC20)富含抗原加工和呈递以及炎症反应途径(图4a-b)。
为了确定 RNA 水平升高是否会导致蛋白质的一致增加,他们对具有不同程度 TIL 的空间定义的肿瘤感兴趣区域 (ROI) 应用了高灵敏度质谱 (MS)。通过激光捕获显微切割 (LCM) 分离出60 个空间不同的 ROI,包括 20 个免疫丰富的 ROI 和 40 个免疫较差的 ROI,用于蛋白质组学分析。他们在所有 ROI 中,对超过 2194 种蛋白质进行了定量(图4c)。MP6特异性基因,如FABP5、SERPINB3、KRT6B和S100A8,在免疫不良的ROI中较高,与转录组数据一致(图4d)。此外,尽管在空间蛋白质组学数据中仅检测到 25 个 MP7 特异性蛋白中的 3 个,但 B2M 和多个 MHC 分子在免疫丰富的 ROI 中升高(图4d)。PROGENy 的通路活性评估显示转化生长因子β(TGFβ)通路在MP6细胞中升高(图4e)。对空间转录组和蛋白质组数据的 PROGENy 分析表明 MP6 斑点和免疫不良 ROI 中的 TGFβ 信号传导持续增强(图4f-g)。值得注意的是,PROGENy TGFβ信号优先位于MP6肿瘤区域的外围(图4g),表明TGFβ途径可以改变肿瘤周围的微环境,例如CAF和免疫细胞。
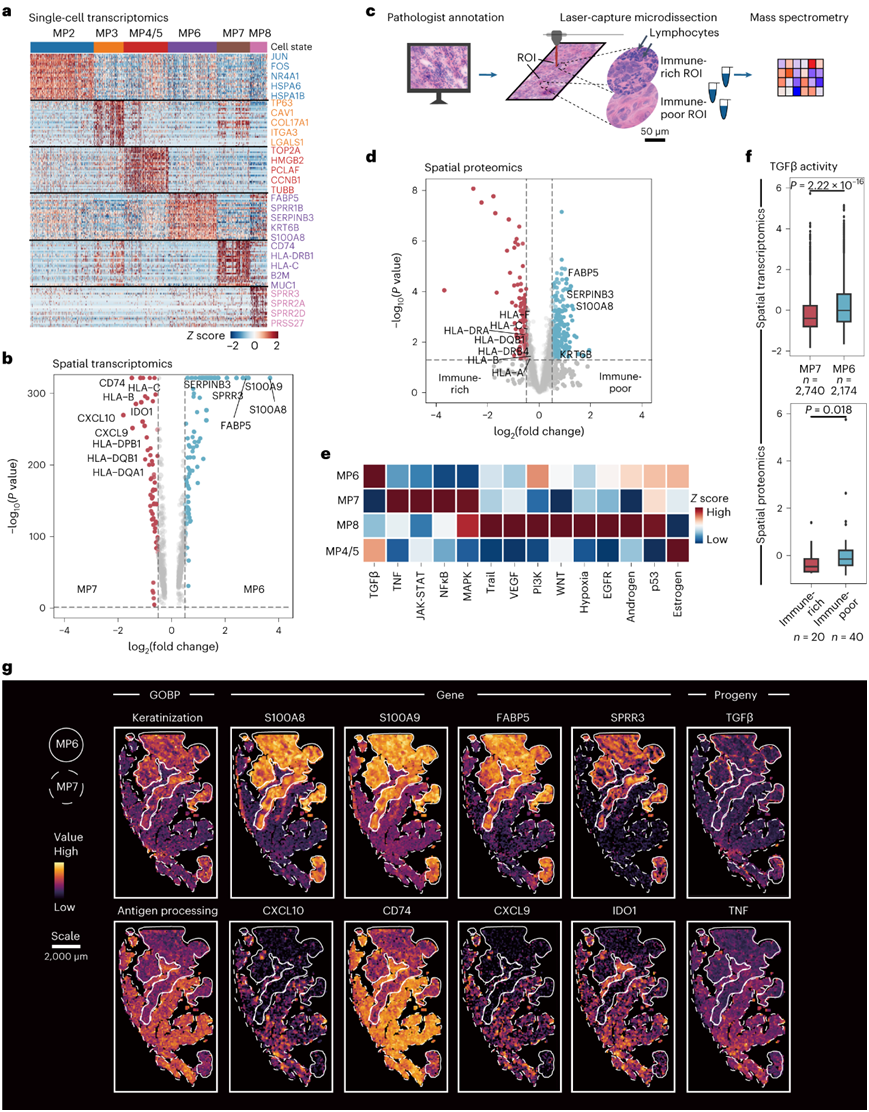
图4. 肿瘤状态的多模式分析表明 MP6 肿瘤中存在 TGFβ 信号传导。
(a) 热图显示 使用 scRNA-seq 分析的肿瘤细胞类型中前 30 个 DEG 的表达。(b) 火山图显示通过空间转录组学分析的 MP6(蓝色)和 MP7(红色)点之间的 DEG。 (c) 解决 CSCC 空间蛋白质组学的工作流程。 (d) 火山图显示 免疫丰富和免疫较差的ROI之间不同表达的蛋白质。(e) 通过 scRNA-seq 分析的各种肿瘤细胞类型的 PROGENy 通路活性热图。 (f) 箱线图,比较空间转录组数据集中的 MP6 和 MP7 肿瘤点(上)和空间蛋白质组数据集中免疫丰富或免疫较差的 ROI(下)之间的 TGFβ 通路活性。(g) TJH34中GOBP通路的空间分布、特异性基因表达及PROGENy通路活性。
05
CAF 对 MP6 点实施免疫封锁
然而,人们对CAF亚型与肿瘤细胞的空间分布和关联知之甚少。在这里,他们鉴定了七个成纤维细胞亚聚类,其中三个(CAF-CD34、CAF-DES和CAF-MMP11)在CSCC中优先表达(图5a-b)。他们将CAF描述为炎症性CAF(表达白细胞介素-1激活的信号)或肌成纤维细胞(myCAF,表达TGFβ激活的信号)。通过使用这些功能性CAF信号,显示高白细胞介素-1激活信号的CAF-CD34细胞是炎症性CAF,显示高水平TGFβ激活信号的CAF-MMP11细胞是myCAF(图5a)。同时,PROGENy分析证实了CAF-MMP11中激活的TGFβ信号传导(图5c)。CAF-MMP11表现出先前与TGFβ诱导的反应性基质相关的基因表达模式(包括MMP11、POSTN、CTHRC1、COL8A1、COL10A1),以及参与上皮-间充质转化和细胞外基质组织的途径(图5d-e)。此外,CAF-MMP11细胞表现出高水平的LRRC15(图5f),其存在与对抗肿瘤免疫反应的抑制作用直接相关。因此,他们将这种特定的细胞群指定为免疫抑制性CAF。
MP6评分与免疫抑制性CAF细胞在时间上的比例呈正相关,并在MP6肿瘤细胞点周围观察到活化的TGFβ信号传导(图4g)促使研究它们在空间转录组学中的原位空间相互作用。因此,他们以空间分辨率对MMP11基因模块(包括CTHRC1、POSTN、INHBA、SFRP2、SULF1、COL8A1、COL11A1和LRRC15)在成纤维细胞斑点上的表达进行了评分。与MP6肿瘤细胞相邻的成纤维细胞表现出免疫抑制CAF信号升高(图5g)。同时,CytoSPACE显示,MP6周围的成纤维细胞,特别是在肿瘤-间质边界区域,主要是CAF-MP11,而在MP7周围的成纤维细胞中没有观察到这种优势(图5g)。通过评估成纤维细胞邻域中MP6或MP7信号的表达,他们观察到免疫抑制CAF评分与MP6之间显著正相关,但与MP7无关(图5h)。

图5. 周围的免疫抑制性 CAF 有助于形成 MP6 肿瘤周围的免疫排斥微环境。
(a) 按细胞亚型、样本类型和报告的 CAF 特征的模块分数着色的成纤维细胞的 UMAP 图。 (b) 每种成纤维细胞类型的样品来源的组成。(c) scRNA-seq 中各种成纤维细胞亚型的通路活性热图。 (d) 热图显示 通过 scRNA-seq 分析的成纤维细胞类型的DEG。(e) HALLMARK 和GO分析中最富集通路的条形图。 (f) 成纤维细胞中LRRC15的表达分析。 (g) 成纤维细胞斑点中免疫抑制性 CAF 特征分数(左)和百分比(右)的空间分布。 (h) 散点图显示免疫抑制性 CAF 的基因特征评分与成纤维细胞点附近的 MP6(左)或 MP7(右)评分之间的 Pearson 相关性。
06
MP6/7 评分具有临床相关性
为了进一步探索肿瘤状态特异性与免疫表型的关联,他们应用 BayesPrism 在转录组分析 (RNA-seq)数据中使用 scRNA-seq 作为参考来导出肿瘤细胞特异性基因谱,并对 MP6 和 MP7 身份进行反卷积分析。正如预期的那样,在MP6/7评分高的肿瘤中,免疫激活(包括抗原呈递和趋化因子过程基因)和免疫逃避(包括免疫检查点相关基因)减少,免疫细胞减少,免疫排斥相关细胞类型(间充质干细胞、肌细胞和角质形成细胞)增加(图6a)。此外,他们使用免疫组织化学染色(IHC)和多重免疫荧光检测了在本项研究RNA-seq队列中随机选择的20个CSCC的免疫细胞浸润(图6b)。CD8+T细胞浸润与MP6/7评分呈负相关(图6c)。在宫颈癌新辅助卡瑞利珠单抗联合化疗临床试验(NACI)治疗一个周期后,MP6/7评分明显下降,病理完全缓解(pCR)组下降最明显(图6d)。
在两个大型 ICB 治疗队列(OAK 和 POPLAR;抗 PD-L1 抗体或多西他赛)的鳞状 NSCLC 亚型中,低 MP6/7 评分与免疫治疗组的更好生存相关(图6e-f)。
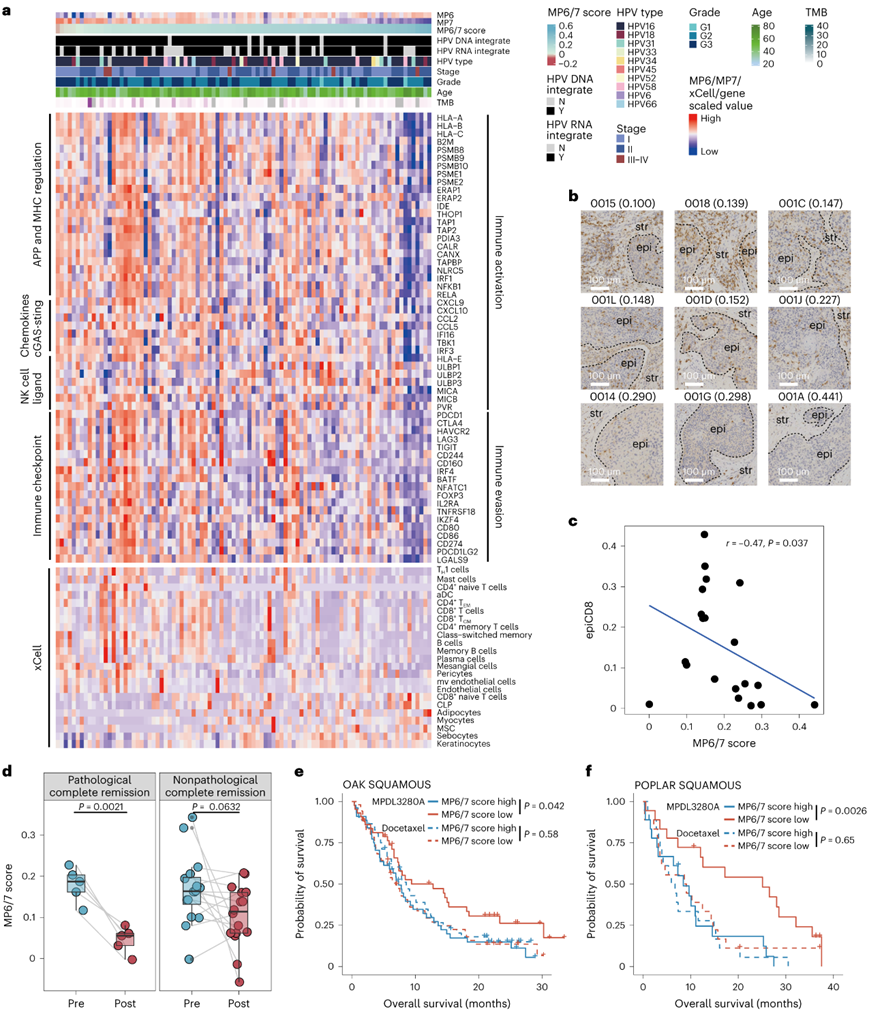
图6. 多个 CSCC 数据集中存在 MP6 肿瘤细胞表型和免疫浸润的反比关系。
(a) 使用内部 CSCC 数据集通过 xCell 推断的免疫激活、免疫逃避相关基因和细胞组成的缩放值热图。 (b) 代表性CSCC中基质(str)和上皮(epi)区域的CD8的IHC染色。 (c) 散点图,代表从RNA-seq推断出的epiCD8和MP6/7评分之间的Spearman相关性。 (d) CSCC 中 NACT 一个周期前和后 MP6/7 分数的变化。(e-f)生存分析。
07
FABP5调控 MP6 状态维护
接下来他们研究了 MP6 状态的定义特征。除了角化基因外,该程序还包括 SERPINB3 和 S100A8/A9,这两者都与 CSCC 的晚期和不良预后相关。有趣的是,得分最高的差异表达转录物和蛋白质之一是FABP5 /FABP5(图4a-d),它编码与各种类型的癌症相关的脂肪酸结合蛋白。沉默 FABP5 导致宫颈癌和 HNSCC 细胞系中 MP6 特征最显著减少,蛋白质水平大幅下降(图7a-b)。值得注意的是,FABP5-IN-1(一种选择性 FABP5 抑制剂)抑制了 CSCC 患者源性类器官(PDO) 的形成,同时减少了 S100A8/A9 和 SERPINB3(图7c-d)。
此外,FABP5的基因缺失和药理抑制显著降低了转录组和蛋白质水平上的TGFβ表达,尤其是TGFβ2亚型,以及多个细胞系中的下游信号传导(图7e-h)。因此,MP6 肿瘤中 TGFβ 的产生和下游信号传导至少部分是通过 FABP5 介导的。他们进一步利用FABP5 敲除 (ko-FABP5) 的 TC-1 肿瘤细胞的条件培养基,以培养鼠成纤维细胞(L929 细胞)。来自亲本 TC-1 细胞的上清液刺激 L929 成纤维细胞向免疫抑制性 CAF 样细胞的状态转变,并伴有 TGFβ 诱导基因(包括LRRC15、POSTN、BMP7和ID1/3 )表达升高。引人注目的是,他们发现在该条件培养基对TGFβ诱导基因的诱导显著降低(图7i)。这些结果表明 MP6 肿瘤产生 FABP5 依赖性 TGFβ 活性,促进 CAF 状态转变,从而驱动免疫排斥。
最后,他们检测了 FABP5 抑制是否会影响体内肿瘤生长和 T 细胞浸润。正如预期的那样,FABP5-IN-1 显著降低了肿瘤负荷并增加了 T 细胞浸润(图7j-l)。ko-FABP5几乎完全阻止了C57BL/6小鼠(小鼠B1除外)中的肿瘤形成,但在免疫缺陷的BALB/c-nu小鼠中则不然(图7m-n)。
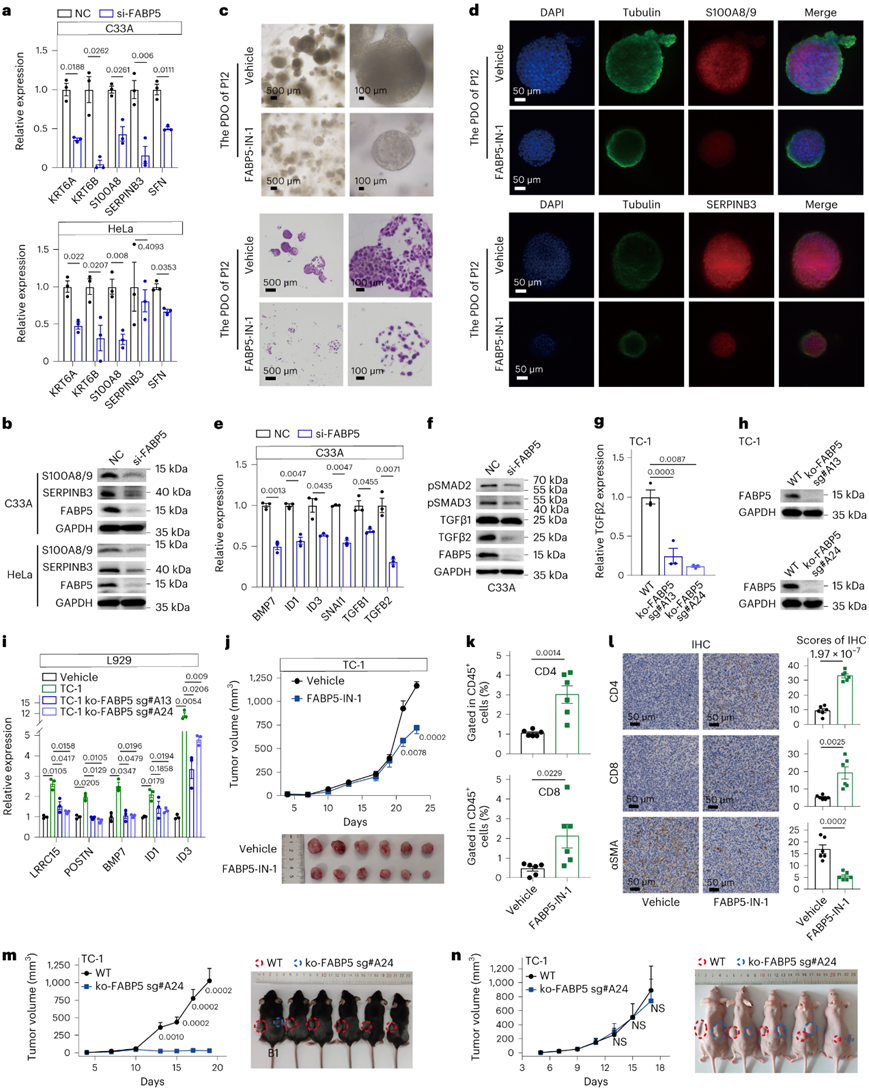
图7. FABP5 对于 MP6 状态维持至关重要,并有助于激活 TGFβ 以及与免疫抑制性 CAF 的相互作用。
(a) 用小干扰RNA敲低FABP5(si-FABP5)48小时后,通过定量PCR(qPCR)对C33A和HeLa细胞中的MP6基因进行定量。 (b) 免疫印迹分析。(c) 形态学分析(上)和 H&E 染色(下)。 (d) 免疫荧光分析。(e-i) 免疫印迹和qPCR分析。(j) 肿瘤生长曲线(上)和肿瘤大小(下)。(k) 流式细胞分析。 (l) 免疫组化分析。(m-n) 肿瘤生长曲线和肿瘤大小分析。
+ + + + + + + + + + +
结 论
本项研究进行了多组学分析,包括单细胞转录组分析、空间转录组学和空间蛋白质组学分析,结合遗传和药理学扰动,系统地开发了 CSCC 瘤内表达异质性的高分辨率和空间分辨图。三种肿瘤状态[上皮细胞角蛋白、上皮免疫(Epi-Imm)和上皮衰老],概括了鳞状细胞分化的不同阶段,显示出不同的肿瘤免疫微环境。上皮细胞角蛋白恶性细胞和免疫抑制性癌症相关成纤维细胞之间的双向相互作用通过转化 FABP5 介导的生长因子 β 通路信号形成免疫排斥微环境。在 Epi-Imm 肿瘤中,恶性细胞通过干扰素信号传导与自然杀伤细胞和 T 细胞相互作用。
+ + + + +



 English
English


