文献解读|Cell Rep Med(14.3):多模式免疫表型分析揭示了塑造胰腺癌的微生物与 T 细胞相互作用
✦ +
+
论文ID
原名:Multimodal immune phenotyping reveals microbial-T cell interactions that shape pancreatic cancer
译名:多模式免疫表型分析揭示了塑造胰腺癌的微生物与 T 细胞相互作用
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.02.01
DOI号:10.1016/j.xcrm.2024.101397
背 景
肿瘤微环境(TME)是一个复杂的生态系统,由细胞外基质和不同的恶性和非恶性细胞群组成,其中不同成分之间的相互作用调节肿瘤进展和对治疗的反应。微生物已成为肿瘤 TME 的一个组成部分。然而,微生物存在的决定因素仍然不明确。
实验设计

结 果
01
微生物和 CD8 + T 细胞在 TME 内空间共定位
为了了解TME内微生物的空间分布,研究团队对人实体肿瘤进行了多重免疫组化,以鉴定CK19癌细胞和细菌,检测基于脂多糖(LPS;革兰氏阴性)和脂磷胆酸(LTA;革兰氏阳性)。PDAC和肺腺癌 (LUAC)分析显示,LPS在两种肿瘤类型中的分布有显著差异(图1A-D)。虽然在癌细胞内检测到一小部分LPS,但大多数LPS定位于癌细胞周围基质内的细胞(图1E)。
接下来,他们根据CK19癌细胞周围免疫细胞类型的密度对肿瘤区域进行分类,研究了肿瘤中微生物与免疫浸润之间的关系(图1F)。LPS在胰导管腺癌(PDAC)中分布的空间异质性不是由CD20+ B细胞、CD68+巨噬细胞或FOXP3+调节性T细胞(Treg)定义的(图1G)。相比之下,LPS在PDAC肿瘤中的分布与CD8+ T细胞浸润有关(图1H-L)。在LUAC的CD8 T细胞富集区也观察到较高水平的LPS(图1J)。这些结果表明CD8+ T细胞和肿瘤中的微生物之间存在机制联系。
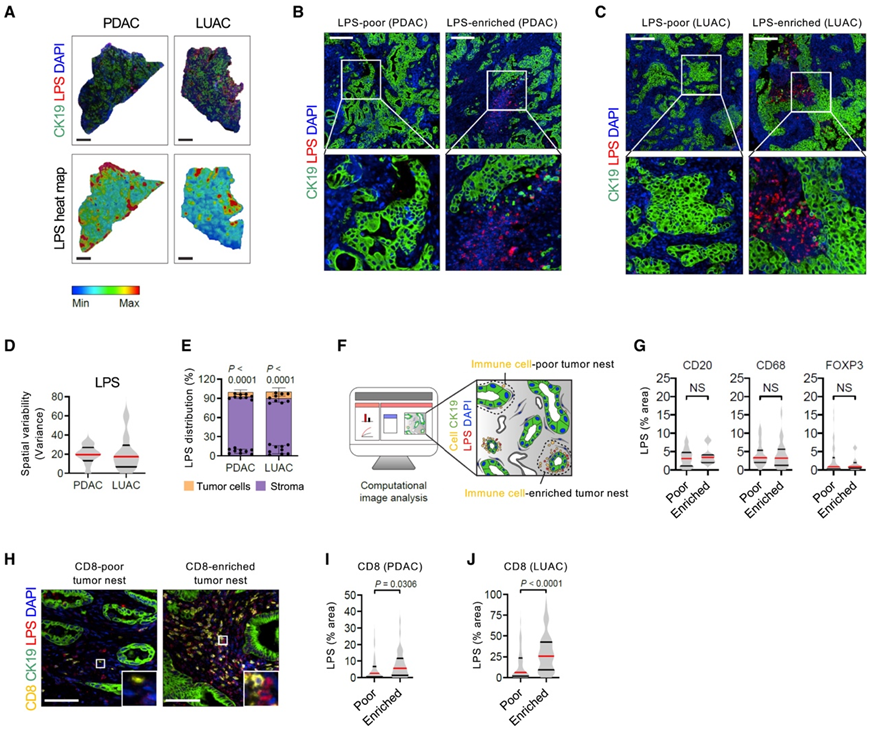
图1. 人类实体瘤中的微生物分布具有空间异质性并与CD8 + T细胞浸润相结合。
(A) CK19(绿色)、LPS(红色)和细胞核(DAPI,蓝色)(上)的免疫荧光 (IF) 图像以及 LPS 的热图(下)。 (B-C) 缺乏 LPS(左)和富含 LPS(右)区域的 IF 图像。(D) LPS 的空间方差。(E) LPS 在 CK19 +肿瘤细胞(黄色)和基质细胞(紫色)中的分布。(F) 研究设计。(G) LPS 的定量。(H)免疫荧光分析。(I) PDAC 肿瘤巢中 LPS 的定量。(J) LUAC 肿瘤巢中 LPS 的定量。
02
微生物-CD8+ T细胞富集鉴定不同的肿瘤基质群落
接下来,他们研究了基于CD8+ T细胞浸润定义的肿瘤巢的细胞和分子结构。CD8+ T细胞浸润在多种人类实体肿瘤中存在显著差异,并观察到患者间和患者内部的变异性。在PDAC中,CD8+ T细胞的空间分布是局灶性和异质性的,而在CD8+ T细胞变异最小的LUAC中,CD8+ T细胞的空间分布在很大程度上是均匀的。基于这些发现,他们将研究重点放在PDAC上,并将肿瘤巢分类为CD8+ T细胞富集(“热”)或不富集(“冷”)(图2A-B)。热肿瘤巢显示出显著更高的 Treg和 CD68 +骨髓细胞密度(图 2 C-D)。
他们使用 激光捕获显微切割 (LCM) 分析了从热肿瘤巢和冷肿瘤巢中专门分离的上皮和基质的 RNA(图 2 E)。差异表达基因(DEG)分析表明,冷和热基质明显沿着主成分2(PC2)聚集,而冷和热上皮聚集程度较小(图2F)。与LPS对富含CD8 + T细胞的肿瘤区域的定位增加一致(图1),热瘤巢具有更高的16S rRNA存在(图2G)。这些结果表明PDAC的转录异质性是有空间定义的,并且与肿瘤中的微生物和CD8 T细胞分布模式有关。
他们确定了冷和热肿瘤基质之间有 601 个 DEG,冷和热肿瘤上皮之间有 31 个 DEG。冷肿瘤基质中富含与上皮-间质转化(EMT)、MYC靶点、E2F靶点、肌生成、G2M检查点、转化生长因子β (TGF-β)信号传导、缺氧和糖酵解相关的基因。相比之下,热肿瘤基质显示与异体移植排斥、干扰素γ (IFNγ)反应、白细胞介素6 (IL-6)/JAK/STAT3信号传导、IFNα反应、炎症反应和补体相关的基因富集。与热肿瘤上皮相比,冷肿瘤上皮富含与E2F靶点、MYC靶点、G2M检查点、氧化磷酸化、DNA修复、MTORC1信号传导和脂肪形成相关的基因。与微生物存在的增加相一致, GO分析揭示了协调宿主对细菌反应的基因的诱导(图2H-I)。
与冷肿瘤上皮相比,热肿瘤上皮显示出更高水平的介导微生物免疫应答的受体,包括PIGR和CD74(图2J-N)。具体来说,PIGR通过促进IgA和免疫复合物的聚合异构体的胞吞作用来促进对微生物的体液免疫反应,CD74是一种参与抗原呈递的分子,据报道可以结合肠道微生物,包括幽门螺杆菌。
综上所述,这些结果表明,利用微生物和免疫网络特征(包括与获得性免疫抑制相关的分子)能够区分PDAC中热肿瘤和冷肿瘤基质群落。
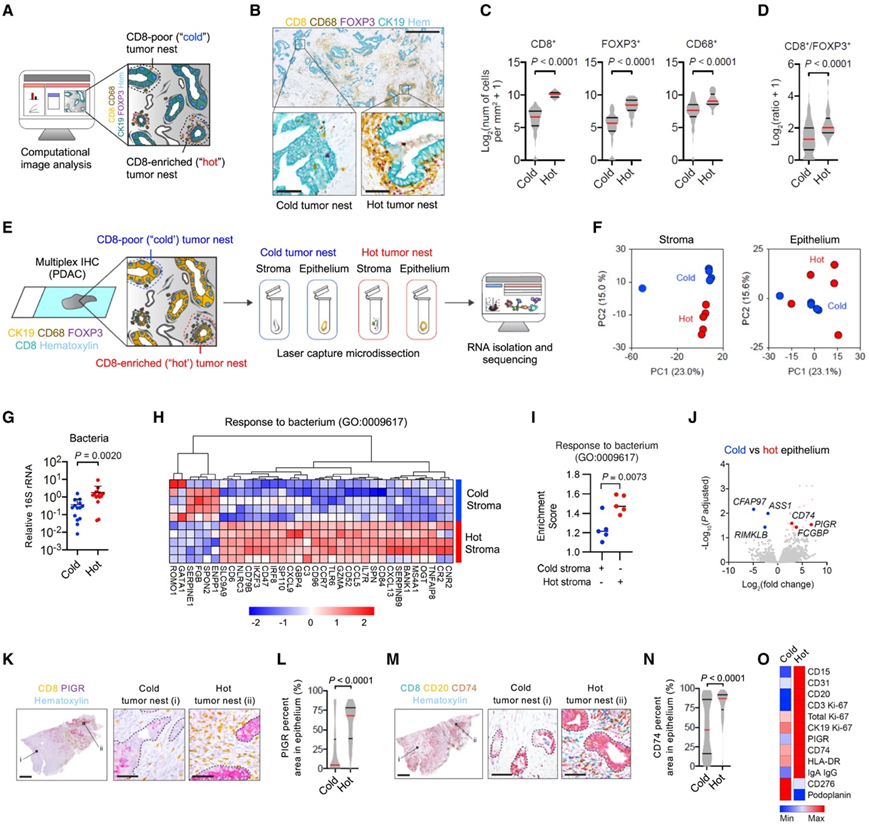
图2. T 细胞和微生物共定位定义了人类胰腺癌中不同的细胞邻域。
(A) 实验设计。(B)组织学分析。 (C) CD8 +(左)、FOXP3 +(中)和 CD68 +(右)细胞的定量。(D) CD8 +细胞与 FOXP3+细胞的比率。(E)实验设计。(F) 主成分分析(PCA)。(G) 16S rRNA 水平。(H-I) 热图和富集评分,显示热基质和冷基质中与细菌反应相关的基因 (GO: 0009617)。 (J) DEG 的火山图。(K) CD8(黄色)、PIGR(紫色)和细胞核(蓝色,苏木精)的多重免疫组织化学图像。(L) PIGR 的量化。(M) CD8(青色)、CD20(黄色)、CD74(紫色)和细胞核(蓝色,苏木精)的多重免疫组织化学图像。(N) CD74 的定量。(O) 细胞标记物和蛋白质的总结。
03
肿瘤中的微生物多样性与 T 细胞浸润有关
基于上述的发现,证明了微生物和 T 细胞之间的空间耦合,以及协调宿主对人类肿瘤 T 细胞富集区域中细菌的反应的基因富集,他们接下来研究了癌症中免疫细胞和微生物之间的关系。为此,他们利用小鼠 PDAC 细胞系,根据 T 细胞浸润建立免疫学热 TME 和冷 TME(图 3 A)。正如预期的那样,原位注射到同基因小鼠体内的PDAC细胞系可以根据CD8+ T细胞和FOXP3+ Treg的存在进行区分(图3B)。PDAC肿瘤也显示CD8+ T细胞的空间分布不均(图3C)。与在人类肿瘤中的发现一致,热肿瘤巢中有更多的微生物存在(图1),小鼠热肿瘤中也显示出更高水平的16S rRNA(图3D)。然而,从冷肿瘤和热肿瘤小鼠收集的粪便中,16S rRNA水平没有显著差异(图3D),表明胃肠道微生物丰度与T细胞浸润PDAC肿瘤或肿瘤内微生物存在无关。
为了证实T细胞浸润与肿瘤内微生物存在之间的关联,他们分析了另外五种同源PDAC细胞系(图3E-F)。他们对肿瘤和粪便进行了16S rRNA量化,以及流式细胞分析和免疫组织化学来量化多种免疫细胞群和免疫调节标志物的存在。正如预期的那样,主成分分析(PCA)和分层聚类揭示了两种不同的免疫浸润模式(T细胞富集和不富集)(图3E-F)。此外,肿瘤中16S rRNA水平与T细胞浸润呈正相关(图3G)。肿瘤中16S rRNA水平也与巨噬细胞的存在、CD86及抗原递呈相关分子的表达呈正相关。另一方面,16S rRNA水平与巨噬细胞CD206的表达和肿瘤重量呈负相关。
接下来,他们对从同基因小鼠分离的冷和热PDAC肿瘤进行mRNA测序(图3H)。PCA显示冷瘤和热瘤沿PC1明显聚集(图3I)。与人类PDAC的发现相似,小鼠PDAC的热肿瘤显示了与免疫激活相关的基因的富集。相比之下,冷肿瘤表达的是代谢过程、缺氧和细胞周期调节中富集的基因。热肿瘤还显示了与细菌应答相关的基因、细胞标记物(Cd20、Cd3e、Cd68)、趋化因子和受体(Cxcl13、Ccl19)以及肿瘤上皮标记物(Cd74、Pigr)的富集(图3J-M)。综上所述,这些结果证明微生物与PDAC肿瘤免疫表型之间的耦合。
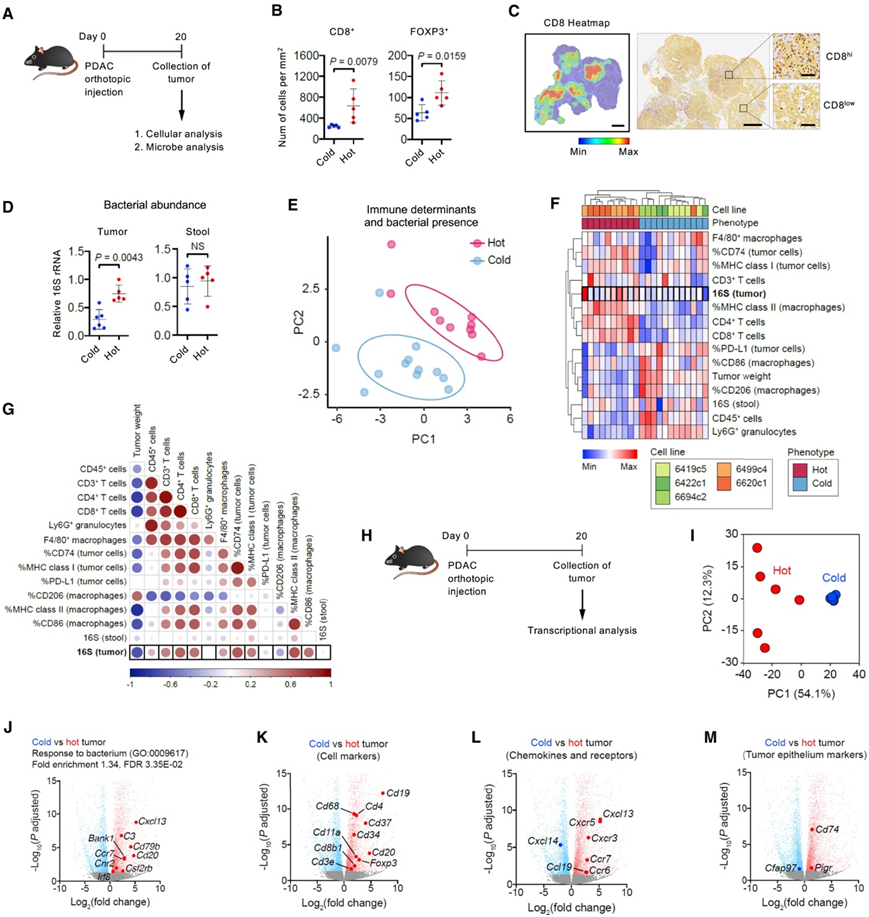
图3. 肿瘤微生物与小鼠 PDAC 中的 T 细胞浸润有关。
(A)实验设计。(B) 肿瘤内 CD8 +和 FOXP3 + T 细胞的定量。(C)小鼠热PDAC肿瘤中CD8 T细胞代表性热图(左)和组织学分析(右)。(D) 冷和热原位肿瘤(左)和粪便(右)中的 16S rRNA 水平。(E-G) 小鼠原位注射冷和热PDAC细胞系。热图中显示的免疫和细菌决定因素的主成分分析及相关图。(H)实验设计。(J–M) 火山图分析。
04
肿瘤内微生物组成和多样性分析
通过对原位注射到小鼠体内的热肿瘤和冷肿瘤进行 16S rRNA 基因测序,他们检测了肿瘤中细菌的组成(图 4 A)。正如在人类 PDAC 和 LUAC 中所见,革兰氏阴性菌在热肿瘤和冷肿瘤的肿瘤微生物组中占主导地位(图 4 B)。接下来,他们使用线性判别分析 (LDA) 和基于操作分类单位 (OTU) 丰度的比较热图进行了维度分类比较,结果揭示了细菌群落优势的显著差异(图 4C-D)。他们在不同的分类水平上发现了细菌群落的差异(图4E)。热肿瘤中节杆菌属和芽孢杆菌属水平和甲基杆菌科水平较高。冷肿瘤在属水平上以Salirhabdus为主,在科水平上以Oxalobacteraceae为主。
然后,他们使用不同的方法检测了肿瘤微生物α-多样性,定义为肿瘤样本中的物种数量,肿瘤微生物组α-多样性在热肿瘤中明显高于冷肿瘤(图4F)。为了研究细菌群落之间的系统发育关系,他们使用β多样性生成了主坐标分析(PCoA),该分析揭示了来自热肿瘤和冷肿瘤的OTU之间的不同聚类(图4G)。相比之下,无瘤小鼠和荷瘤小鼠粪便中的肠道微生物群α-多样性显著降低,热瘤小鼠与冷瘤小鼠之间没有差异(图4H)。此外,肠道微生物β-多样性区分了无瘤小鼠和有瘤小鼠,但在热瘤小鼠和冷瘤小鼠之间相似(图4I)。因此,肠道微生物群的丰度、多样性和组成会由 PDAC 改变,但不一定是 T 细胞浸润肿瘤的决定因素。此外,这些数据表明 PDAC 中的肠道和肿瘤微生物组是不耦合的,不同的肿瘤内微生物群落由浸润性 T 细胞的存在或不存在来定义。
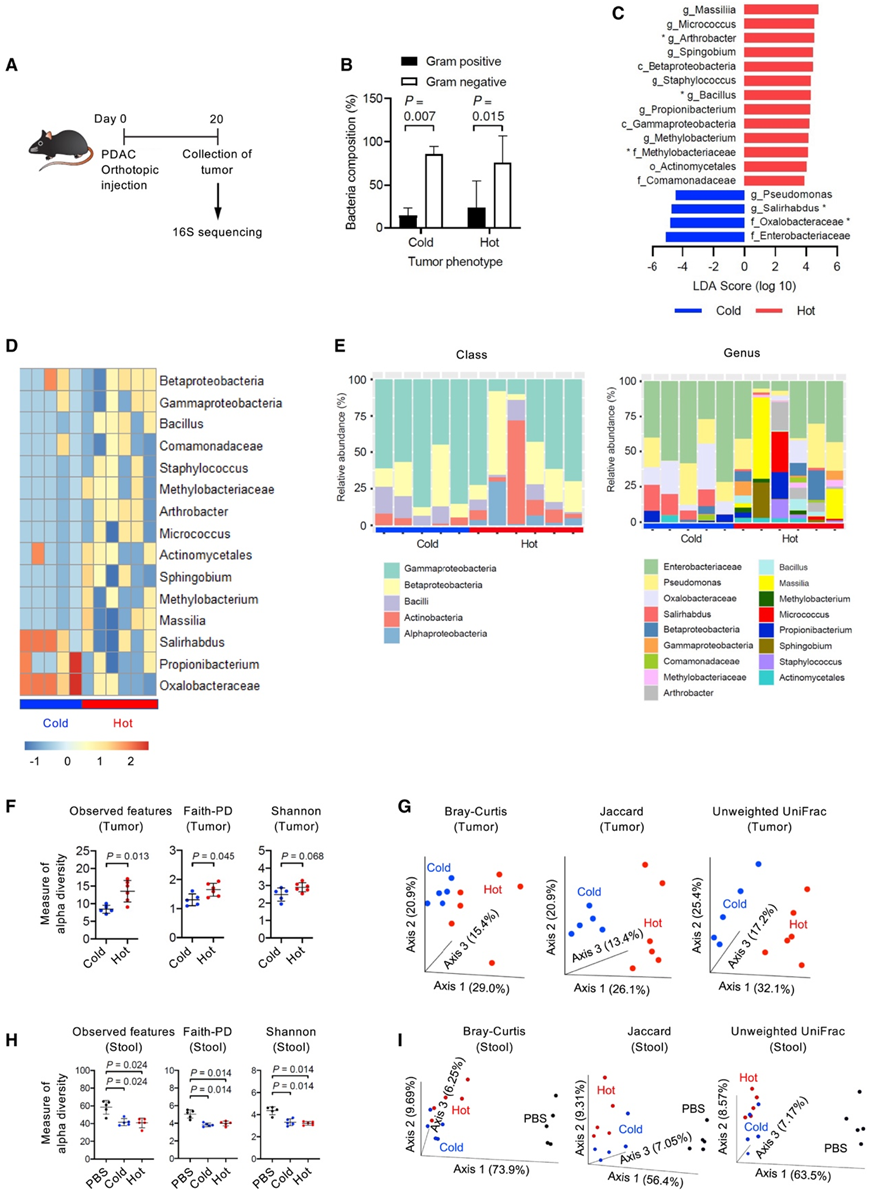
图4. 肿瘤内微生物组成和多样性区分T细胞富集和T细胞缺乏的肿瘤。
(A)实验设计。(B) 冷肿瘤和热肿瘤中革兰氏阴性菌和革兰氏阳性菌的组成百分比。(C) 线性判别分析。(D) 属水平细菌特征的热图。(E) 纲和属水平的分类组成。(F) 肿瘤中的α-多样性。(G) 肿瘤的主坐标分析 (PCoA)。(H) 粪便中的α-多样性。(I)粪便PCoA。
05
肿瘤微生物群落受 T 细胞调控
为了探究肿瘤内 T 细胞和微生物之间的因果关系,他们在小鼠体内原位注射了形成冷肿瘤和热肿瘤的 PDAC 细胞,然后用由甲硝唑、头孢曲松和万古霉素组成的三联抗生素混合物治疗(图 5 A)。抗生素治疗有效地消除了热肿瘤和粪便中的细菌(图5B),但不影响CD8+ T细胞或Treg浸润到肿瘤中(图5C-D)。在冷肿瘤中,细菌丰度显著低于热肿瘤中的细菌丰度(图 5B),抗生素治疗不会进一步降低细菌丰度(图 5E),并且不会影响 CD8+ T 细胞或 Treg 的存在(图 5F)。抗生素治疗不同地改变了冷肿瘤和热肿瘤的转录谱(图5G)。在热肿瘤中用抗生素下调的基因与胰腺分泌、炎症反应和先天免疫相关,而在冷肿瘤中下调的基因与胰腺分泌、MAPK信号通路和细胞增殖的正向调节相关(图5H)。抗生素对肿瘤生长的影响也不同,冷肿瘤的肿瘤重量减少,但热肿瘤的肿瘤重量没有减少(图 5I-J)。与微生物的免疫调节潜力一致,抗生素治疗降低了热肿瘤中肿瘤内CD19+ B细胞的密度(图5K)。此外,抗生素降低了肿瘤内巨噬细胞上主要组织相容性复合体(MHC) II类分子的表达水平,同时免疫抑制标志物CD206的表达增加(图5L-M)。总之,这些数据表明,癌症中的T细胞监测可以独立于肿瘤内和肠道微生物群发生。
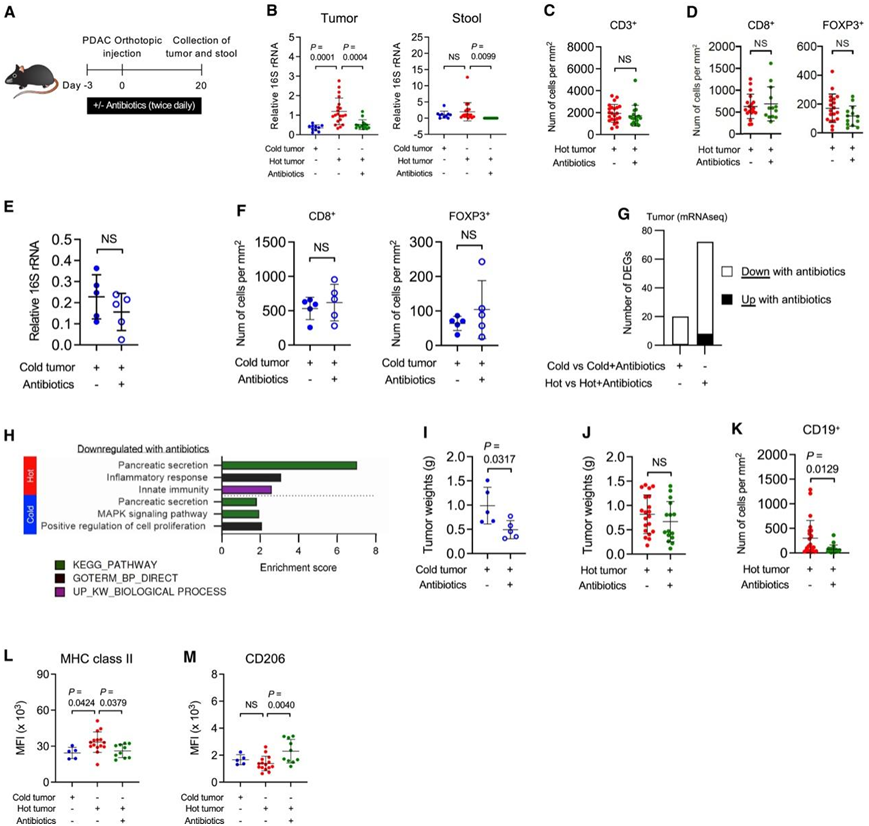
图5. T 细胞浸润肿瘤的发生与肠道和肿瘤微生物无关。
(A)实验设计。(B)小鼠肿瘤和粪便中的 16S rRNA 水平。(C-D)小鼠热肿瘤中的CD3+和 CD8+以及 FOXP3+ T 细胞的定量。(E)小鼠肿瘤中的 16S rRNA 水平。(F)对使用和不使用抗生素治疗的小鼠冷肿瘤中的CD8 +和 FOXP3 + T 细胞进行定量。(G) DEG 的数量。(H) 条形图显示指定基因集中 DEG 的过度代表性分析。(I-J) 第 20 天的肿瘤重量。 (K) 肿瘤内 CD19 +细胞的定量。(L-M)平均荧光强度 (MFI) 。
接下来他们考虑了肿瘤中微生物存在依赖于 T 细胞的可能性。为了检验这一假设,对有或没有 T 细胞耗竭的小鼠进行了原位注射,形成热肿瘤的 PDAC 细胞(图 6A)。正如预期的那样,在 T 细胞耗竭的热肿瘤中,与 T 细胞以及骨髓细胞群相关的基因减少。PCA 显示,有或没有 T 细胞的冷肿瘤和热肿瘤各自明显聚集(图 6 B)。这些发现表明 T 细胞在定义 PDAC 肿瘤转录谱中发挥着重要作用,但也表明其他决定因素导致了冷肿瘤和热肿瘤之间的转录差异。与 T 细胞在调节微生物对 PDAC 反应中的作用一致,基因本体富集分析显示,与冷肿瘤相比,在热肿瘤中协调宿主对细菌反应的基因有所增加,而当 T 细胞耗竭时,热肿瘤中的基因显著减少(图6C)。此外,与微生物相关的基因 Pigr 和 Cd74 在PDAC 的热肿瘤细胞中表达增加(图 2)。T细胞缺失的肿瘤重量更大(图6D),在没有T细胞的热肿瘤中,16S rRNA水平降低(图6E)。相比之下,对粪便中检测到的16S rRNA水平没有影响(图6F)。这些发现表明,PDAC肿瘤中的微生物-T细胞偶联是由T细胞而不是微生物引导的。
接下来,他们对有和没有 T 细胞的热肿瘤进行了维度分类学比较,结果揭示了相似的细菌群落(图 6G)。与此一致的是,有和没有 T 细胞的热肿瘤之间的肿瘤微生物 β 多样性也相似(图 6 H)。相反,在没有 T 细胞的情况下,热肿瘤中的肿瘤微生物 α 多样性显著降低(图 6 I)。这些结果表明,T 细胞指导肿瘤中的微生物积累,但不影响肿瘤微生物的组成。
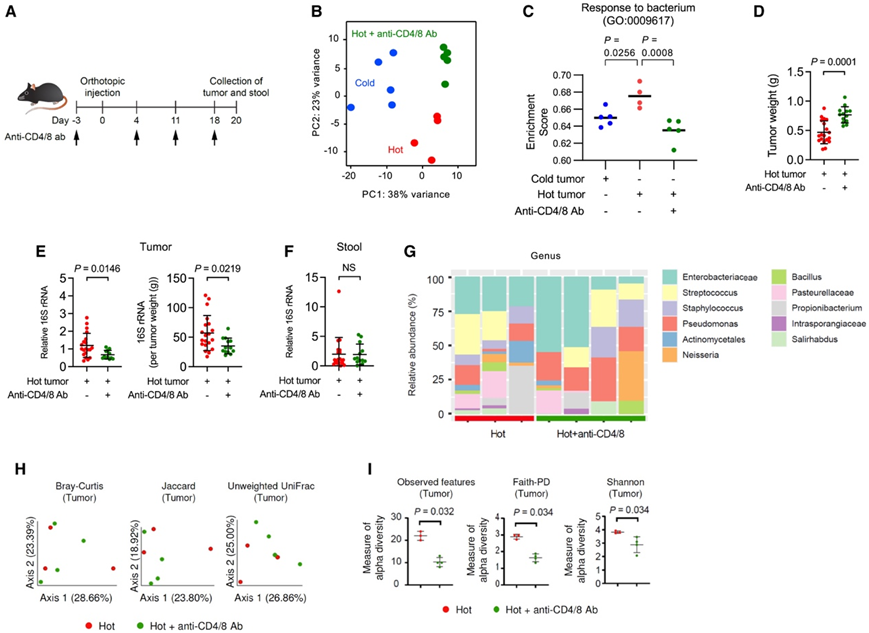
图6. T细胞促进肿瘤内微生物的积累,但不影响微生物组成。
(A)实验设计。(B) mRNA 测序数据的主成分分析。(C) 与细菌反应相关的基因相对表达的富集评分 (GO: 0009617)。(D–F) 原位注射冷肿瘤细胞或热 (2838c3) 肿瘤细胞的小鼠在第 20 天的肿瘤重量以及肿瘤和粪便中的 16S rRNA 水平并使用或不使用抗 CD4/CD8 抗体进行治疗。 (G) 属水平的分类组成。(H) 肿瘤的 PCoA。(I)肿瘤中的α-多样性。
+ + + + + + + + + + +
结 论
本项研究利用空间分析技术证明细菌和免疫细胞的异质性在空间上是耦合的。胰腺癌的小鼠模型重现了人类中观察到的免疫-微生物空间耦合。不同的肿瘤内生态位由 T 细胞定义,T 细胞富集和 T 细胞缺乏的区域显示出独特的细菌群落,分别与免疫活性和静止表型相关,但独立于肠道微生物组。肿瘤内细菌的消除会减慢缺乏 T 细胞的肿瘤中的肿瘤生长,并改变富含 T 细胞的肿瘤中的表型和髓系细胞和 B 细胞的存在,但不影响 T 细胞浸润。相反,T细胞耗竭会破坏肿瘤的免疫状态并减少肿瘤内的细菌。本项研究结果建立了癌症中微生物和 T 细胞之间的耦合,其中空间限定的免疫微生物群落对肿瘤生物学有不同的影响。
+ + + + +



 English
English


