文献解读|Food Chem (9.231):茶多酚和表没食子儿茶素没食子酸酯通过调节肝脏代谢和重建肠道微生物群改善高脂血症
✦ +
+
论文ID
原名:Tea polyphenol and epigallocatechin gallate ameliorate hyperlipidemia via regulating liver metabolism and remodeling gut microbiota
译名:茶多酚和表没食子儿茶素没食子酸酯通过调节肝脏代谢和重建肠道微生物群改善高脂血症
期刊:Food Chemistry
影响因子:9.231
发表时间:2022.10.14
DOI号:10.1016/j.foodchem.2022.134591
背 景
由于不当的生活方式和饮食习惯,全世界范围内高脂血症的患病率逐渐增加。高脂血症是一种复杂的持续性代谢紊乱疾病,同时表现出血管壁增厚、超重、肥胖和高血糖等症状。目前,高脂血症通常是使用药物治疗或膳食补充剂来改善。茶多酚(TP)和表没食子儿茶素没食子酸酯(EGCG)是茶叶中的主要活性物质。研究表明,TP对重塑肠道菌群和保护肠道屏障功能具有积极作用。因此,人们把TP和EGCG用于高脂饮食诱导大鼠的降血脂功能研究。尽管TP对各种代谢物和脂质的研究较多,但对TP和EGCG改善不同肠道菌群的代谢途径知之甚少。本研究通过代谢组学、脂质组学和肠道微生物组学分析了TP和EGCG对高脂血症小鼠肝脏代谢物和脂质含量、肠道微生物组成的影响,阐述其对高脂血症的改善作用,为茶多酚对高脂血症的干预治疗提供靶点和思路,为实现茶叶的附加值提供理论依据。
实验设计
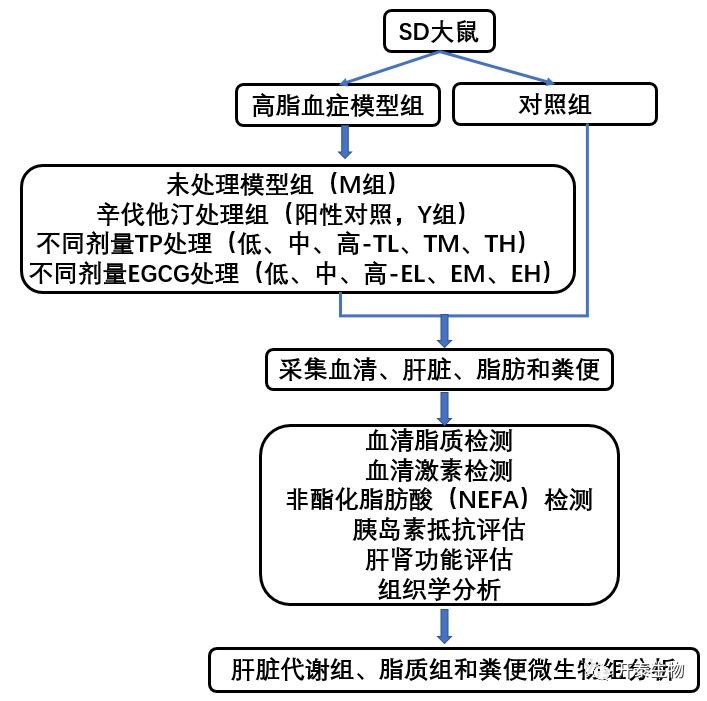
结 果
01

茶多酚和EGCG对肥胖大鼠体重的影响
在高脂饮食诱导第8周时,高脂血症模型组(M组)大鼠体重显著高于对照组,第12周时,M组大鼠体重较对照组大鼠体重增加约20%(图1B,C)。TP和EGCG干预可以减少大鼠体重增加(Y组除外),和M组相比,不同剂量的TP和EGCG处理组大鼠体重显著降低(图1B,C)。这表明TP和EGCG可以有效减轻高脂血症大鼠的体重。
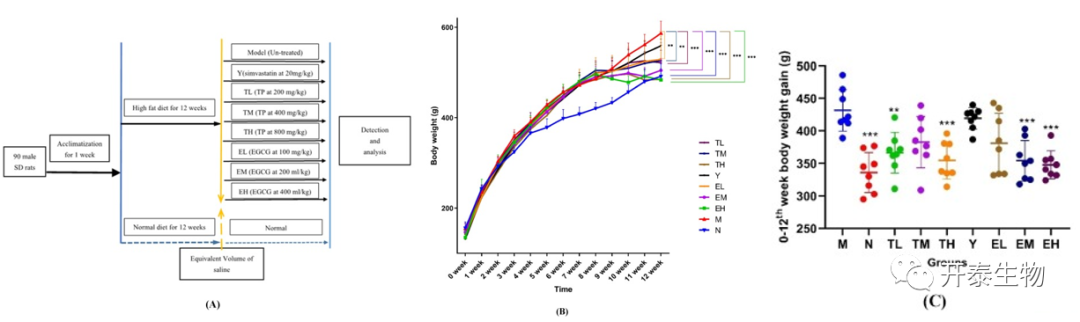
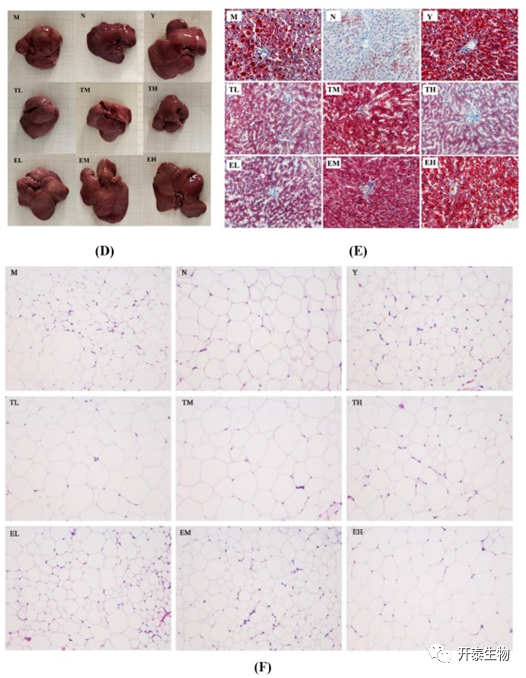
图1 实验设计和不同组之间的体重变化、肝脏和脂肪组织学分析
02

血脂分析
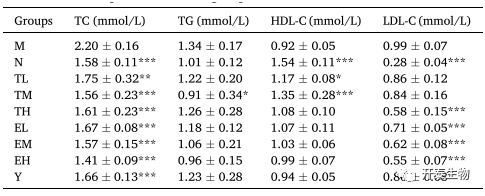
高脂饮食诱导可造成血脂异常,表现为甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)含量增加。和对照组相比,M组的TG、TC和LDL-C含量分别增加了0.39、0.33和2.54倍,HDL-C含量下降0.4倍(表1)。TP、EGCG和辛伐他汀处理显著降低TC含量,但对于TG含量没有明显的改善作用(TM组除外)。此外,和M组相比,所有组中LDL-C含量均显著下降(TL和TM除外,无显著差异),但TL和TM组中HDL-C含量分别提高了27.17%和46.74%,这表明,中剂量的TP(TM组)在减脂方面更具优势。
表1 不同组间的血脂水平
03

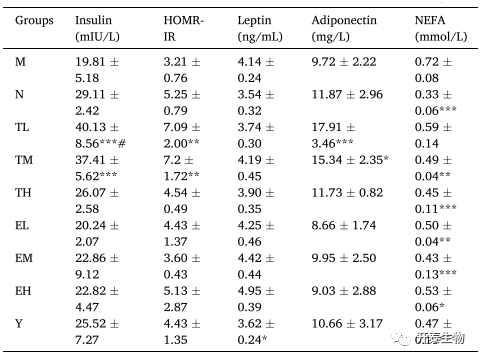
血清激素、NEFA和胰岛素抵抗评估
表2列出了不同组间血清激素(脂联素、瘦素、胰岛素)、NEFA含量和胰岛素抵抗的评分结果。和M组相比,所有的处理组中脂联素含量显著增加(EL和EH组除外)。和对照组相比,M组中的瘦素含量增加,而辛伐他汀处理后瘦素含量下降,TP和EGCG处理则对瘦素含量没有显著影响。M组中胰岛素含量降低,这可能和胰岛素分泌异常有关。TP和EGCG处理可以提升胰岛素水平,TL和TM组胰岛素含量几乎增加了2倍。以上结果表明,TP在改善高脂血症大鼠血清脂联素和胰岛素水平方面的效果更好。
在M组、TL组和TM组之间,空腹血糖含量无显著差异,M组胰岛素含量显著低于对照组,说明高脂饮食没有造成胰岛素抵抗或者血糖异常,高脂饮食可能会造成胰岛素分泌不足。从HOMR-IR评分来看,对照组、TL组和TM组之间无显著差异,说明和对照组相比,TL组和TM组没有产生胰岛素抵抗,适量的TP具有刺激胰岛素分泌的功效。
和对照组相比,M中血清NEFA含量显著增加。但是和M组相比,TP、EGCG和辛伐他汀处理后,NEFA含量显著降低。这表明TP、EGCG和辛伐他汀可以缓解高脂血症大鼠NEFA的累积。
表2 血清激素、NEFA和胰岛素抵抗评估
04

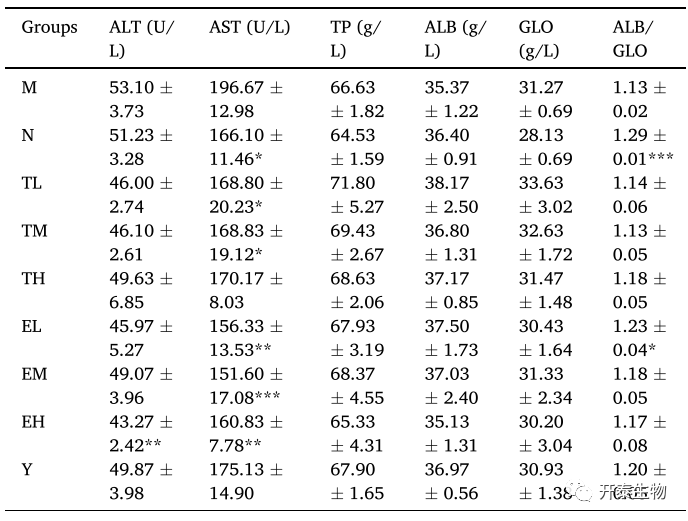
肝功和肾功评估
高脂饮食可以增加脂肪变性、肝炎和血清ALT、AST含量(表3)。和对照组相比,M组ALT、AST含量显著增加,而TP、EGCG和辛伐他汀处理可以抑制ALT、AST的增加。TL、TM和所有剂量的EGCG处理可以降低AST含量。和对照组相比,M组中白蛋白/球蛋白的比例下降;而和M组相比,EL组中白蛋白/球蛋白的比例增加。这表明,高脂饮食导致肝脏蛋白合成功能异常。
表3 不同组间的肝功评价参数
05

肝脏和脂肪组织学分析
M组大鼠肝脏组织中,脂滴数量多,体积大(图1D,E)。TP和EGCG处理后,脂滴比例显著降低。但不同剂量的EGCG处理组之间,脂滴没有明显区别。和Y组相比,TL和TH组展现出更好的减缓脂质累积的效果(图1F),这表明TP处理可以限制脂质在肝脏中的积累。
06

肝脏代谢组和脂质组分析
6.1 脂质组
作者通过脂质组学探究TP和EGCG对脂质代谢的改善作用。采用偏最小二乘判别法(PLS-DA)分析M组和对照组肝脏脂质变化情况,发现与高脂血症大鼠脂质代谢功能障碍风险增加的潜在标志物。在正(图2A)和负离子(图2B)模式下,M组和对照组明显分为两个集群。以VIP > 1、FDR < 0.05和P < 0.05为标准,一共筛选出109种脂质,这些脂质可分为甘油酯、甘油磷脂、脂肪酰基、鞘脂类和类固醇。和对照组相比,M组中增加了32种脂质,包括2种TG和3种二酰甘油。此外,M组中的5种胆甾醇酯也增加。
对于TP和EGCG处理,Venn图显示2个剂量的TP处理至少减少了3种脂质,它们都是磷脂酰肌醇(PI)。EGCG改善了46种脂质(图3A),其中65%是与高脂血症相关的潜在生物标志物。在这些改善的脂质中,50%是脂肪酸及其共轭物,只有一种氨基脂肪酸(3-氨基辛酸)减少,而EM和EH组的不饱和脂肪酸增加。此外,EL处理仅涉及3种代谢物的调节,它们是FA 19:0、FA 18:4、ST 21:1;O3。EM处理改善其他16种代谢物,其中5种不饱和脂肪酸 (FA 18:4、FA 17:4;O、16:1(7Z)(16F)、NA 23:4、NA 24:4)增加, 1种不饱和脂肪酸 (FA 22:5)减少。EH与EM组都调节14种代谢物。所有EGCG组中只有一种直链脂肪酸(FA 19:0)升高(图3B)。


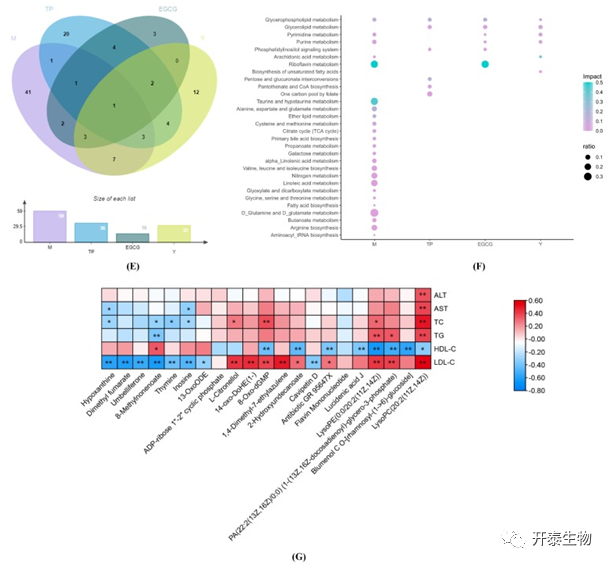
图3 不同组间的脂质组、代谢组分析
6.2 代谢组
作者使用非靶向代谢组方法分析肥胖大鼠体内水溶性代谢物的分布。PLS-DA分析M组和对照组代谢物中的标志物,可见两组呈现明显分离,表明高脂饮食诱导引发了代谢紊乱(图4A,B)。同样,以VIP > 1、FDR < 0.05和P < 0.05为标准,筛选出59种内源代谢物作为生物标志物,主要有脂肪酸、胆汁酸、羧酸类、氨基酸、甘油磷脂和异戊烯醇脂质(图3C)。这些潜在的生物标志物参与嘌呤代谢、嘧啶代谢、丙酸代谢、初级胆汁酸合成、类固醇激素合成、柠檬酸循环、半胱氨酸和甲硫氨酸代谢、甘油磷脂代谢、醚脂代谢、丙氨酸、天冬氨酸和谷氨酸代谢、牛磺酸和亚牛磺酸代谢、核黄素代谢等代谢通路(图3D)。
TP和EGCG对高脂血症大鼠的代谢产物有明显的调节作用,其作用与辛伐他汀相似。Venn图(图3E)显示了不同处理组的相关代谢物,TP和EGCG组分别改善了36种和16种代谢物。此外,处理组共有21个潜在生物标志物得到不同程度的改善,在21个生物标志物中,仅有升高的嘌呤核苷酸在所有处理组中得到改善。TP处理下调了7种代谢物,包括ADP-核糖1”-2”环磷酸、8-OXO-dGMP、抗生素GR 95647X、赤芝酸J、LysoPE(0:0/20:2[11Z,14Z])和LysoPC(20:2 [11Z,14Z])。EGCG显著增加次黄嘌呤、富马酸二甲酯、8-甲基壬酸、胸腺嘧啶、肌苷、黄素单核苷酸的含量,显著降低8-OXO-dGMP、PA(22:2(13Z,16Z)/0:0)和LysoPC(20:2(11Z,14Z))的含量。通路分析表明(图3F),TP影响嘧啶代谢、核黄素代谢、嘌呤代谢,而EGCG可通过降低甘油磷脂PA(22:2(13Z,16Z)/0:0)和LysoPC(20:2(11Z,14Z)来缓解甘油磷脂代谢。此外,EGCG和辛伐他汀也参与嘌呤和嘧啶代谢。甘油脂质代谢的调节与EGCG组的血脂改变密切相关。图3G展示了TP和EGCG处理后ALT、AST、血脂与肝脏代谢物之间的强相关性。
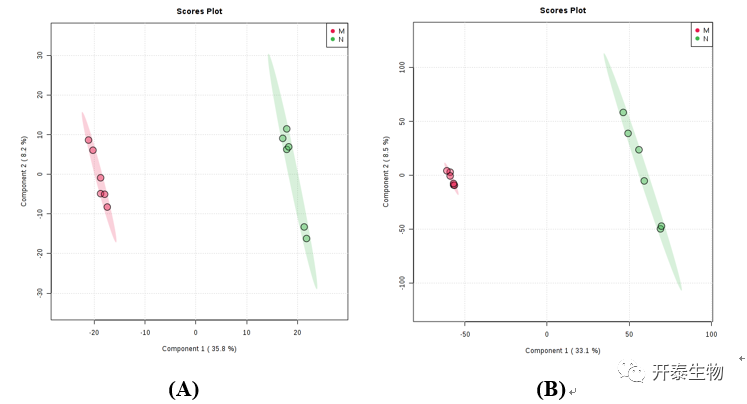
图4 M组和对照组PLS-DA分析
07

肠道菌群分析
由于高脂血症通常存在肠道菌群紊乱,因此作者分析了高脂诱导大鼠肠道菌群的变化情况。对照组和M组之间的α多样性无显著差异。和M组相比,TM和TH组的Chao1多样性指数和OTUs指数下降,可能是由于TM和TH组中的优势菌群为拟杆菌(图5A-C)。PCA分析表明,M组和对照组的位置发生分离。与M组相比,TM组和TH组出现显著的位移(图5D)。肠道微生物群落组成结果表明,在门水平上前5个为拟杆菌、厚壁菌、变形杆菌、疣微菌、螺旋体门。M组中的50.41%和33.23%菌群分别被分类为拟杆菌和厚壁菌。TM组中拟杆菌和厚壁菌分别占74.14%和8.55%。其他TP处理组拟杆菌的相对丰度也高于M组(图5E)。TM组的厚壁菌/拟杆菌(F/B)比率最低,TL、TH和EH组的F/B比值也降低(图5G)。为了进一步探究M组、TP组和EGCG组之间的肠道菌群差异,作者分析了属水平上前10个显著变化的菌群(图5F)。鉴定出的大鼠属细菌包括拟杆菌、普氏菌、乳酸杆菌、阿克曼氏菌。结果表明,高脂诱导的高脂血症破坏了肠道微生物群的平衡,导致F/B比值增加,有益菌数量减少,而TP和EGCG具有改善功能。
接着,作者采用Lefse分析和相应的分叶图在属水平上检测各组的生物标志物(图3H)。与对照组比较,高脂血症大鼠出现肠道菌群紊乱,出现Turicibacter菌和普氏菌属丰度增加,瘤胃球菌、Clostridium菌和密螺旋体属菌群丰度降低。基于高脂血症引起的肠道菌群显著变化,TP和EGCG分别改善了9个和10个已鉴定的菌属。在这些属中,粪球菌属和Paraprevotella菌属在被TL组中得到改善,而Parabacteroides菌属、粪芽孢菌属、萨特氏菌属、拟杆菌属、嗜胆菌属和阿克曼氏菌属是TM组的优势菌群;TH处理增加了瘤胃球菌丰度,EGCG处理主要增加Butyricimonas、Allobaculum、Holdemania、脱硫弧菌、Dorea、布劳特氏菌、链球菌、Odoribacter和普氏菌属的丰度。作者采用Spearman相关分析探究肠道微生物群与其他参数之间的关系。结果表明,M组的生物标志物普氏菌属与ALT和AST呈正相关,而Turicibacter与TG水平呈正相关。TM增加的拟杆菌、Parabacteroides、嗜胆菌与ALT呈负相关,而Coprobacillus与HDL-C水平呈正相关。TH中的瘤胃球菌升高与LDL-C水平呈负相关。EGCG增加的Dorea与AST、TC水平呈负相关(图5I)。这表明TP和EGCG在调节高脂血症大鼠肠道菌群方面发挥有益功能。
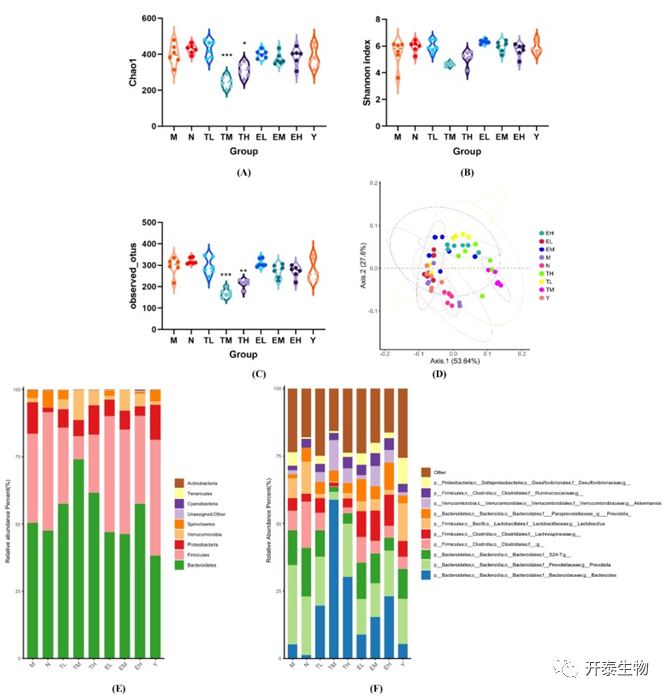
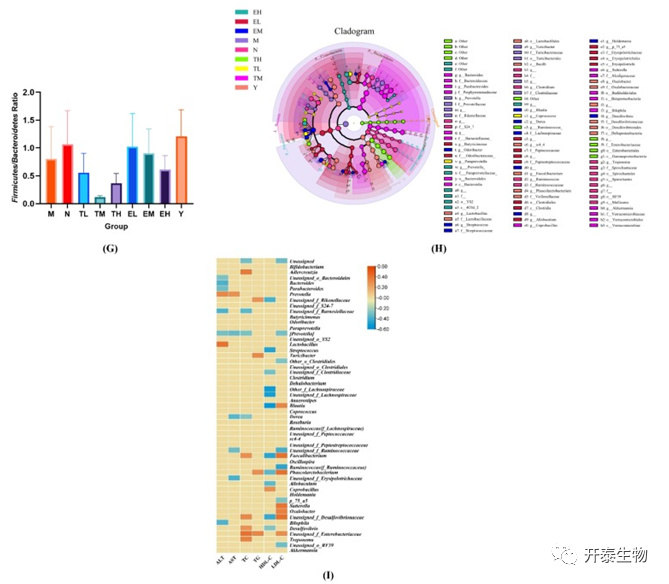
图5 不同组间肠道菌群分析
+ + + + + + + + + + +
结 论
本研究结果表明,高脂诱导的高脂血症可导致肝脏脂质代谢紊乱和肠道菌群失衡,饮食补充TP和EGCG可显著降低体重,并改善高脂血症引发的血清激素和脂质代谢异常。同时,TP和EGCG可以增加肠道有益菌数量,从而改善肠道健康,最终改善高脂血症。本研究为今后在饮食中补充不同的膳食多酚(TP或EGCG)来治疗高脂血症提供了有价值的科学依据和理论基础。
+ + + + +



 English
English

