文献解读|Genome Biol(17.906):增强的染色质可及性有助于哺乳动物的 X 染色体剂量补偿
原名:Enhanced chromatin accessibility contributes to X chromosome dosage compensation in mammals
译名:增强的染色质可及性有助于哺乳动物的 X 染色体剂量补偿
期刊:Genome Biology
影响因子:17.906
发表时间:2021.11.1
DOI号:10.1186/s13059-021-02518-5
背 景
X 染色体的精确基因剂量对于正常发育和细胞功能至关重要。在小鼠中,XX 雌性体细胞显示其单个活性 X 染色体的转录 X 染色体上调,而另一个 X 染色体则处于非活性状态。此外,失活的 X 染色体在内细胞团和生殖细胞的发育过程中通过 X 染色体重新激活而重新激活,这可以通过将体细胞重新编程为多能性来在体外进行研究。染色质过程和基因调控网络如何进化以在体细胞状态和 X 染色体重新激活期间调节 X 染色体剂量仍不清楚。
实验设计
结 果01
单个小鼠活性 X 染色体显示增强的染色质可及性
研究者团队通过染色质转座酶可及性测序(ATAC-seq) 检测了失活 X 染色体 (Xi) 的雌性小鼠胚胎成纤维细胞 (MEF) 中的染色质可及性(图1A-B)。这些细胞来源于携带 X 连锁 GFP 报告基因的 Musculus 雌性 (Mus) 与Castaneus雄性 (Cast) 之间的杂交,能够进行等位基因特异性分析。与常染色体相比,Xi 显示染色质可及性中值峰值在整个染色体范围内减少(图1C)。出乎意料的是,活性染色体(Xa) 显示出相对于常染色体增强的染色质可及性(图1 D-F)。具体而言,Xa 在整体范围内的可及性是同一等位基因上所有常染色体的中位数的 1.33 倍(图1D)。这些结果表明,染色质可及性增加 1.33 倍有助于 X 染色体对常染色体基因剂量补偿。
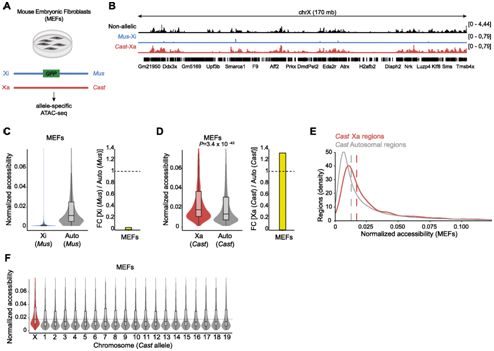
图1. 女性 MEF 中 Xa 的染色质可及性增强
02

活性 X 染色体上增强的染色质可及性通过重新编程为多能性而逆转
他们评估了重编程期间和雌性 XX 小鼠 iPSC 中的等位基因特异性染色质可及性,将 MusX 染色体等位基因失活(Xi- Mus、Xa -Cast)MEF 重编程为诱导性多能干细胞 (iPSC),分别在第 8、9、10 和 12 天分离 SSEA1+ 重编程中间体以及 iPSC,并应用等位基因特异性 ATAC-seq(图2A)。他们发现在 XX iPSC 中女性 MEF 细胞 Xa 上增强的染色质可及性消失(图2B)。他们还通过分析 X 染色体可及性计数和重编程期间与常染色体的等位基因染色质可及性比率,观察到雌性 XX 小鼠 iPSC 在 Xa 上缺乏增强的染色质可及性(图2C-D)。Xa 上增强的染色质可及性在重编程的第 8 天和第 9 天仍然存在,并在第 10 天和第 12 天减少,但在 iPSC 中消失了(图2D)。有趣的是,另一个 X 染色体等位基因 Xi 上染色质可及性的重新获得似乎与 Xa 上染色质可及性增强的丧失同时发生(图2D)。这些结果表明细胞感知 Xa 的数量并可能相应地调整染色质可及性水平。
为了在多能干细胞中进一步测试这一点,他们分析了来自两个 XX mESC 系(雌性),名为 CM1 和 CM2,以及两个 XY mESC 系(雄性),名为 CM3 和 CM7,由Mus雌性与Cast雄性之间的杂交。虽然雌性 mESC 中的两个 X 染色体等位基因都显示出与常染色体相同的可及性水平,类似于 XX iPSC 的 X 染色体状态(图2E-F),但发现雄性 XY mESC 的X- Mus染色体上的染色质可及性比常染色体增加 1.4 倍。
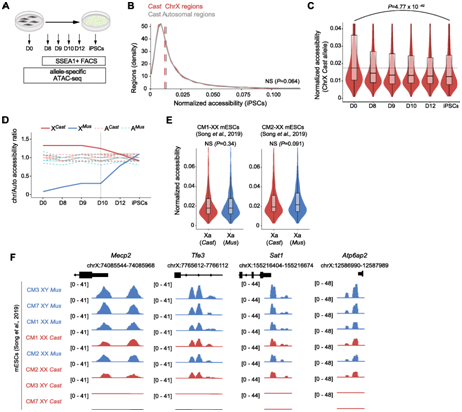
图2. Xa 上的染色质超可及性在重新编程在多能性期间发生逆转
03

X 染色体再激活 (XCR)的转录动力学分析
为了确定 XCR 和 iPSC 重编程期间转录变化的动态,他们进行了等位基因特异性 单细胞RNA测序 (scRNA-seq) (图3A)。他们分析了 Xi-Mus/Xa-Cast MEF、SSEA1+ 重编程中间体和 iPSC。t-分布式随机邻域嵌入 (tSNE) 将细胞排列成反映重编程进程的几个组(图3B-C)。正如预期的那样,他们检测到多能性相关基因的激活,包括Pecam1和Zfp42的早期激活,随后是Nanog、Tet1和Esrrb,以及重编程后期的其他基因,例如Dppa3 / 4和Prdm14(图3D)。
接下来,他们将细胞分为 6 个聚类,通过重新编程伪时间对细胞进行排序,并分析了基因表达,检测到从 MEF 特异性状态到间充质-上皮过渡状态(C1 细胞)的逐渐转变,这是成功重编程的第一步(图 3 E-F),随后是增殖状态和早期多能性标记物的激活,例如Zfp42、Pecam1和Nanog(C2 细胞)(图3D-F)。
之后,他们又使用两个独立的转基因可重编程干细胞盒 (STEMCCA) 小鼠系统对第 16 天未分类重编程群体进行了 10X Genomics scRNA-seq 分析,他们的重编程中间点与参考数据集的相应时间点聚集在一起(图3G)。他们还进行了基因特征富集分析,将MEF、上皮细胞、多能细胞、神经细胞、衰老细胞和滋养细胞六个不同特征的活性映射到集成数据集中。
在将多态性 MEF 转化为 iPSC 期间,量化了 439 个 X 连锁基因的等位基因表达。Mus衍生的 X 连锁 GFP 表达和 Xi 与常染色体等位基因比率 (X -Mus/A) 都揭示了Xist RNA 沉默启动后多能性诱导过程中,染色体范围内的 Xi 发生了再激活(图3H-J)。
为了在阐释细胞异质性后定义 XCR 的转录动力学,他们将 X 连锁基因的 Xi/Xa 等位基因比率确定为假时间的函数,并使用 k 均值聚类通过再激活动力学对基因进行分类(图3 K)。这揭示了存在 5 个不同的基因组,将其命名为逃逸基因、早期、中期、晚期和极晚期再激活基因。此外,他们检测到新的逃逸基因,包括Ddx3x、Sat1和兼性逃逸基因1810030O07Rik,作为最活跃的逃逸基因(图3 K),他们还检测到新的早期基因,包括Uba1、Timp1、Ofd1、Fundc1和Egfl6。
综上所述,这些结果在 iPSC 重编程期间以等位基因特异性单细胞分辨率建立了 XCR 的精确转录动力学。
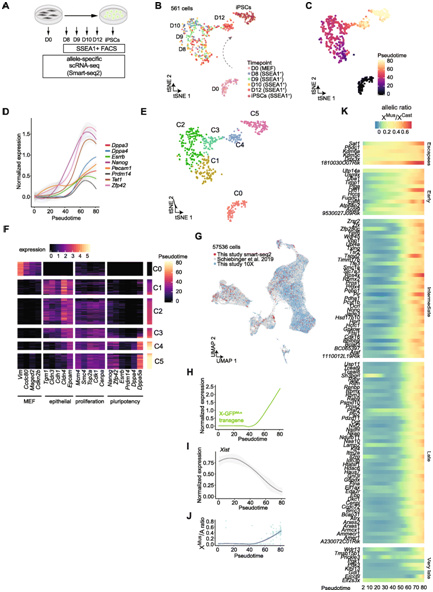
图3. iPSC 重编程过程中 XCR 的等位基因特异性 scRNA-seq 分析
04

染色体上调 (XCU) 消失在多能性诱导过程中与 XCR 耦合
他们分别计算了每个等位基因的 X/A 比率,X -Mus /A 和 X -Cast /A,并进行了重编程伪时间分析,发现了X 染色体下调 (XCD)(即 MEF 的 Xa 上 XCU 的消失)发生在 iPSC 重编程过程中。X- Cast基因的中值表达比 MEF 中的常染色体 (C0) 高 1.35 倍,而低于 iPSC 中的常染色体 (C5)(图4A)。当 XCR 发生在另一个等位基因上时,XCD现象最为明显。XCD 也与 Xa 染色质超可及性缺失一致(图2)。分析表明 XCD 发生在重编程期间,主要伴随 XCR 和 Xa 上染色质可及性增强的丧失,表明 X 连锁基因剂量补偿可能在重编程为 iPSC 期间受到严格调节。
接下来,他们在每个基因的基础上检查了 XCD 的时间,发现大多数基因在重编程期间从 Xa 表达减少,当 XCR 发生在伪时间 50 左右时显著减少(图4B)。
与 MEF 中的常染色体相比,Xa 的转录爆发频率显著增加(增加了1.19 倍)(图4C),然而,还观察到 MEF 中 Xa 相对于常染色体的爆发大小降低(减少 0.82 倍)。
他们接下来研究了 X 染色体丢失对 iPSC 中剩余 X 染色体等位基因基因表达剂量的影响。XX iPSC 的两条 X 染色体的表达水平与常染色体相似。然而,出乎意料的是,一个X的缺失 (XO) 细胞上调了它们唯一的 Xa,而不管哪个 X 染色体变成了非整倍体(图4 D)。XO 细胞在其唯一的 X 染色体上经历了转录爆发的变化,这可能有助于 XCU。
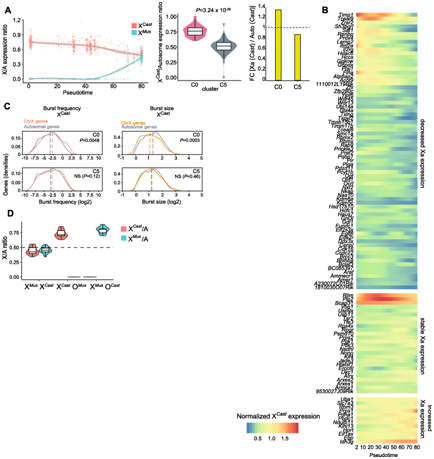
图4. iPSC重编程过程中XCU的擦除和X染色体非整倍体后XCU的诱导
05

XCR 期间染色质的变化
他们首先计算了常染色体和 X 连锁区域的染色质可及性比率。在常染色体上,双等位基因染色质可及性在整个重编程过程中保持不变(图5A)。与常染色体不同,他们观察到 X 染色体上从单等位基因到双等位基因的染色质可及性在整个染色体范围内的转变(图5A)。XCR 期间染色体范围染色质可及性的重新获取发生在重编程的后期,增强子和启动子均如此,与启动子相比,增强子的开放时间稍早(图 5B)。
接下来,他们开始定义 XCR 期间 Xi 上染色质可及性的详细动力学,使用k均值聚类根据等位基因染色质可及性比率的变化对 X 连锁区域进行聚类。该分析揭示了 Xi 上的一组特定区域,这些区域在重新编程期间的不同时间获得可及性(图5C)。在基因启动子上也观察到染色质可及性的区域特异性时间变化,包括Acot9,在重编程的第8天可及,Enox2,在重编程的第12天可双等位可及(图5D)。在 XCR 期间,Xi 染色质可及性的变化存在区域特定的时间顺序。
为了深入了解可能驱动 XCR 的推定 TF,他们分析了与在 XCR 期间逐渐可及的顺式调控元件相关的 TF 基序。这表明,在不同时间在 Xi 上打开的染色质区域因不同的 TF 基序集而富集,包括结合非多能 TF KLF14、SP2 和 MAZ 的基序,作为重编程第 8 天最富集的基序,存在于50-60% 的已分析 X 连锁区域(图5E)。他们还发现多能性TF-KLF4(从重编程第10天开始)和c-MYC(从第12天开始)的基序富集(图5E)。

图5. Xi 在重新编程为 iPSC 期间重新获得染色质可及性
06

iPSC 重编程过程中的基因调控网络
他们通过将单细胞调控网络推理和聚类 (SCENIC) 应用于scRNA-seq 数据,重建了在 iPSC 重编程期间活跃的基因调控网络 (GRN) 。根据靶基因的活性,预测这些调控可能参与重编程。基于转录因子 (TF)(调节子)活性的聚类细胞显示出3种不同的状态:体细胞、中间状态和多能状态(图6A)。体细胞调控如Pbx1在最早的多能性标记激活之前迅速关闭,而关键的多能性相关调控如Zscan10在之后发生激活(图6B)。他们还确定了其他几种TF,它们的调节活性对于重编程期间的细胞身份可能很重要,例如 Tead4(图6C)。他们根据 X 连锁目标的数量对调节子进行排序(图6 D),这揭示了一个 TF 列表,包括 ZFP42、TFDP1 和 ZSCAN10 作为最佳候选者,其次是 KLF3、ATF3 和 MAZ,它们的基序也在染色质区域中富集,在重编程期间变得双等位基因可及(图5E)。通过降低回归系数对调节子进行排序表明 Zfp42、Hcfc1 和 Trp53 调节子的活性与 Xi 的转录再激活最相关(图6E)。
此外,Hcfc1 和Trp53,其调节子活性与重编程伪时间和 XCR 相关(图6 E)。总之,他们重建了小鼠 iPSC 重编程的 GRN 并确定了 XCR 的候选转录调节因子。
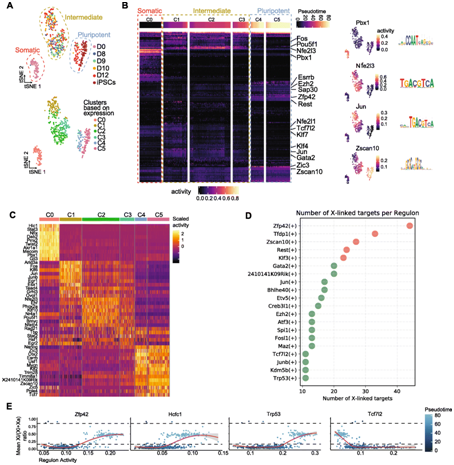
图6. 单细胞基因调控网络推断揭示了 iPSC 重编程过程中 XCR 的候选调控因子
+ + + + + + + + + + +
结 论
本项研究使用全基因组方法、等位基因特异性 ATAC-seq 和单细胞 RNA-seq,在雌性胚胎成纤维细胞中和重编程为多能性期间,表明与常染色体相比,上调的哺乳动物活性 X 染色体上的染色质可及性增加。进一步表明,活动 X 染色体上增加的可及性通过重新编程发生消除,伴随着转录 X 染色体上调的消除和增加的转录突发频率的丢失。此外,他们描述了重编程和 X 染色体重新激活过程中的基因调控网络,揭示了调控状态的变化。这项研究揭示了内在补偿机制的存在,这些机制涉及调节染色质可及性,以抵消哺乳动物细胞中由进化或体外 X 染色体丢失和 X 染色体失活引起的 X 至常染色体基因剂量失衡。
+ + + + +



 English
English

