文献解读|Cancer Cell(50.3):急性髓系白血病的蛋白质基因组亚型
✦ +
+
论文ID
原名:The proteogenomic subtypes of acute myeloid leukemia
译名:急性髓系白血病的蛋白质基因组亚型
期刊:Cancer Cell
影响因子:50.3
发表时间:2022.03.03
DOI号:10.1016/j.ccell.2022.02.006
背 景
急性髓系白血病(AML)是一种临床和遗传异质性疾病,其特征是未成熟白血病母细胞浸润骨髓,导致骨髓衰竭。基因组研究已经确定了 AML 的驱动事件:突变和细胞遗传学畸变。了解特定 AML 的个体基因组特征对于治疗分层的决策非常有价值。
实验设计
结 果
01
蛋白质组 AML 亚型及其生物学特征的发现
研究团队对两组初治患者进行了分析:由 177 名患者组成的发现队列和由 75 名患者组成的独立验证队列。在发现队列中,通过无标记质谱法对 177 名未经治疗的 AML 患者的富含聚蔗糖的骨髓母细胞中的蛋白质表达进行了定量分析。该队列包括新发、继发性和治疗相关AML,它涵盖了所有欧洲白血病网(ELN)细胞遗传学风险类别,其结果与先前发表的具有代表性的AML队列相似(图1A)。他们计算了患者之间的成对距离,并进行了无监督的层次聚类,以识别相似患者的一致蛋白质组亚组(图 1 B)。这种数据驱动的方法揭示了六个不同的蛋白质组亚组(聚类 [C] 1-6)。比较聚类分析表明,C1 和 C2 具有共同的特征,主要是高表达的线粒体蛋白和线粒体相关过程,与所有其他聚类不同。因此,他们将这些聚类合并起来,形成一个更大的亚群。通过对所有患者进行基因集变异分析 (GSVA) 确认了该合并聚类的独特线粒体谱,并分析了五个合并聚类之间差异调节的通路的富集谱 (图1C),他们将合并后的聚类称为 Mito 聚类(C-Mito)。
为了更详细地了解已确定的蛋白质组 AML 亚型之间的蛋白质组差异,他们探索了转录因子和激酶的表达模式。他们发现蛋白质组亚型中这些蛋白质类别的表达存在显著差异(图 1D-E)。例如,信号转导子和转录激活子 (STAT) 家族的转录因子在 C-Mito 中表达较弱(图 1D)。C-Mito 中丙酮酸脱氢酶激酶 (PDHK) 的显著上调等表明该 AML 亚型存在特定的代谢通路(图 1 E)。
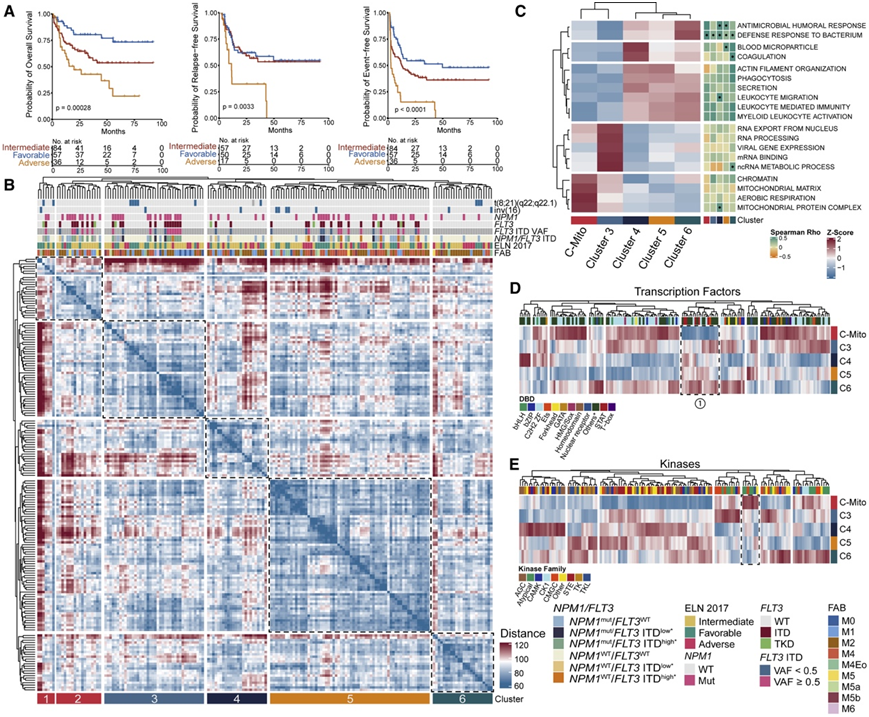
图1. 蛋白质组 AML 亚型。
(A) 按细胞遗传学风险的 ELN 分类分层的生存概率。(B) 患者与患者距离的无监督层次聚类。 (C)基因集变异分析 (GSVA) 评分的聚类上调和下调。(D) 转录因子的聚类上调和下调。(E) 人类激酶的聚类上调和下调。
02
多组学整合揭示了 AML 的蛋白质组学景观
为了更全面地探究患者间的变异性并了解不同分子层之间的关系,他们接下来进行了综合多组学因素分析(MOFA)。该分析确定了驱动多个数据层(即蛋白质和基因表达、突变、细胞遗传学)变化的协调生物过程。MOFA 总共确定了 28 个导致患者之间差异的潜在因子 (LF) (图 2 A),其中 LF1 解释了所有数据层中的最大方差,LF28 解释了最小方差。
最主要的因子 (LF1) 在所有数据层中都很活跃,代表了与NPM1突变和HOX基因特征相关的 AML 异质性的明确特征维度,反过来表明NPM1突变和强表达的HOX依赖性基因同时出现在大量的 AML 病例。MOFA 将已识别的NPM1突变与HOX基因转录组特征联系起来(图 2B-C)。NPM1突变的AML存在HLA I类偏倚,而本项研究的数据表明,NPM1突变与特定的HLA相关RNA和蛋白质谱之间可能存在分子联系(图2B)。接下来,他们使用MOFA来关注仅反映在蛋白质组中的患者间变异性,其中最主要的因子是LF6,其含量揭示了与线粒体相关的基因驱动LF6-Mito的变异(图2D)。值得注意的是,患者沿LF6-mito的固有顺序表明,LF6-mito在很大程度上检测到分配给C-Mito的患者(图2E)。他们通过量化LF6-mito与线粒体主成分(PC1-Mito)之间的关联进一步证实了LF6的线粒体特征,该关联是基于线粒体注释的蛋白质计算得出的,揭示了显著的相关性(图2F)。
为了进一步证实无法通过转录组检测到具有蛋白质组C-Mito特征的患者,他们基于蛋白质组和转录组的线粒体注释基因进行了独立主成分分析(pca)(图2G),并发现转录后调控可以导致转录本和蛋白质表达水平的显著解偶联。
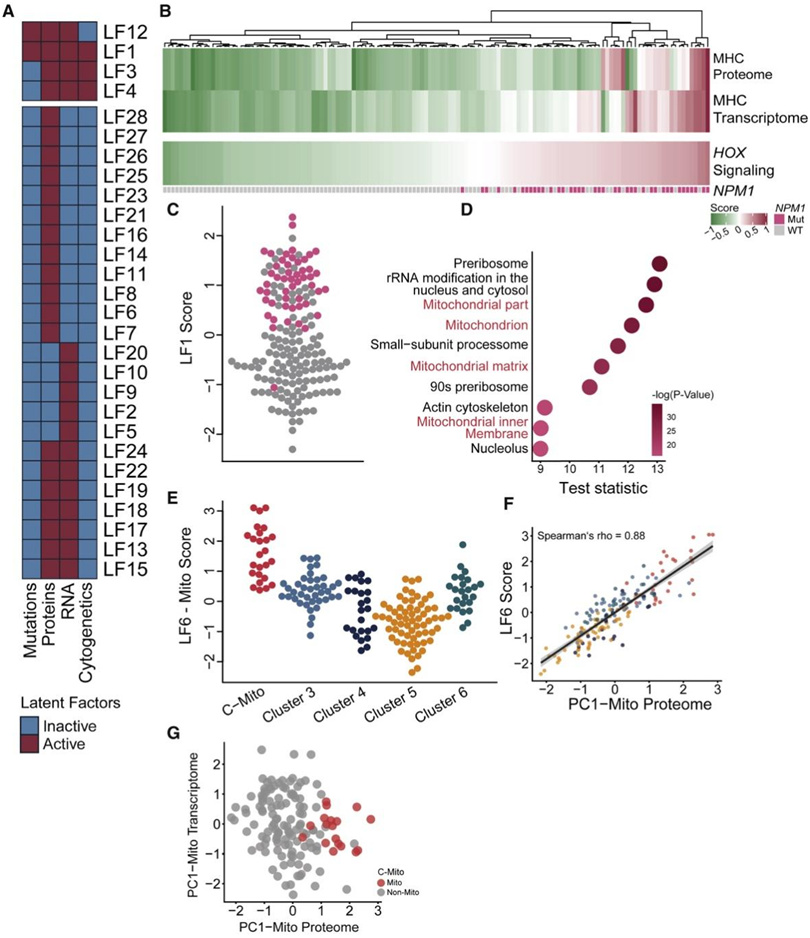
图2. AML的蛋白质组学特征。
(A) 28 个因素驱动所有数据层的变化。(B) LF1- NPM1/HOX的患者特异性富集评分,其中每条线对应于一名患者,颜色编码路径和患者特异性标准化富集评分。(C) LF1- NPM1/HOX评分按NPM1突变状态进行颜色编码。(D) LF6-Mito 因子权重的通路分析表明 LF6-Mito 富含与线粒体过程相关的通路。(E) 显示每个蛋白质组聚类的 LF6-Mito 分数;LF6-Mito 评分很大程度上将分配至 C-Mito 和 C5 的患者分开。(F) 每个患者的 LF6-Mito 评分(y 轴)与线粒体蛋白质组的第一个 PC(x 轴)的散点图。(G) 仅注释线粒体的基因的蛋白质组和转录组的主成分分析(PCA)。
03
蛋白质组 AML 亚型的临床和基因组特征
在确定了五种蛋白质组 AML 亚型及其特定的蛋白质组特征后,他们探讨了它们的临床相关性。临床相关性分析显示,确定的五种蛋白质组 AML 亚型中的两种具有预后相关性。属于C-Mito的患者表现出较短的总生存期(OS)(图3A),并且两个C-Mito亚群具有独立且显著的生存表型。在一项包括患者年龄和细胞遗传学ELN风险类别的多变量分析中,C-Mito亚组的差异作为一个较差的风险因素,独立地影响了OS(图3B)。Mito组和非Mito组的基本患者特征相似,因为两组之间在年龄、性别分布或同种异体干细胞移植率方面没有显著差异。相比之下,在细胞遗传学风险组和突变谱方面观察到差异(图3C)。令人惊讶的是,尽管以较短的OS为特征,但根据ELN风险分类,C-Mito富集了有利的风险疾病特征,而非mito AML则富集了不利的风险特征,包括继发性AML的富集(图3C)。遗传学上,他们观察到与非Mito组相比,C-Mito组的NPM1突变频率有更高的趋势(图3C)。
与C-Mito相比,C5患者的OS时间比非C5患者更长(图3D),多因素分析确定C5是一个独立的有利危险因素(图3E)。遗传上,C5表现出DNMT3A突变频率的增加,这可能会影响C5组患者的蛋白质组和疾病结局(图3F)。
总的来说,C5是最大的蛋白质组学聚类,与C-Mito相比,它缺乏一个独特的蛋白质表达特征,表明该聚类内一定程度的异质性。
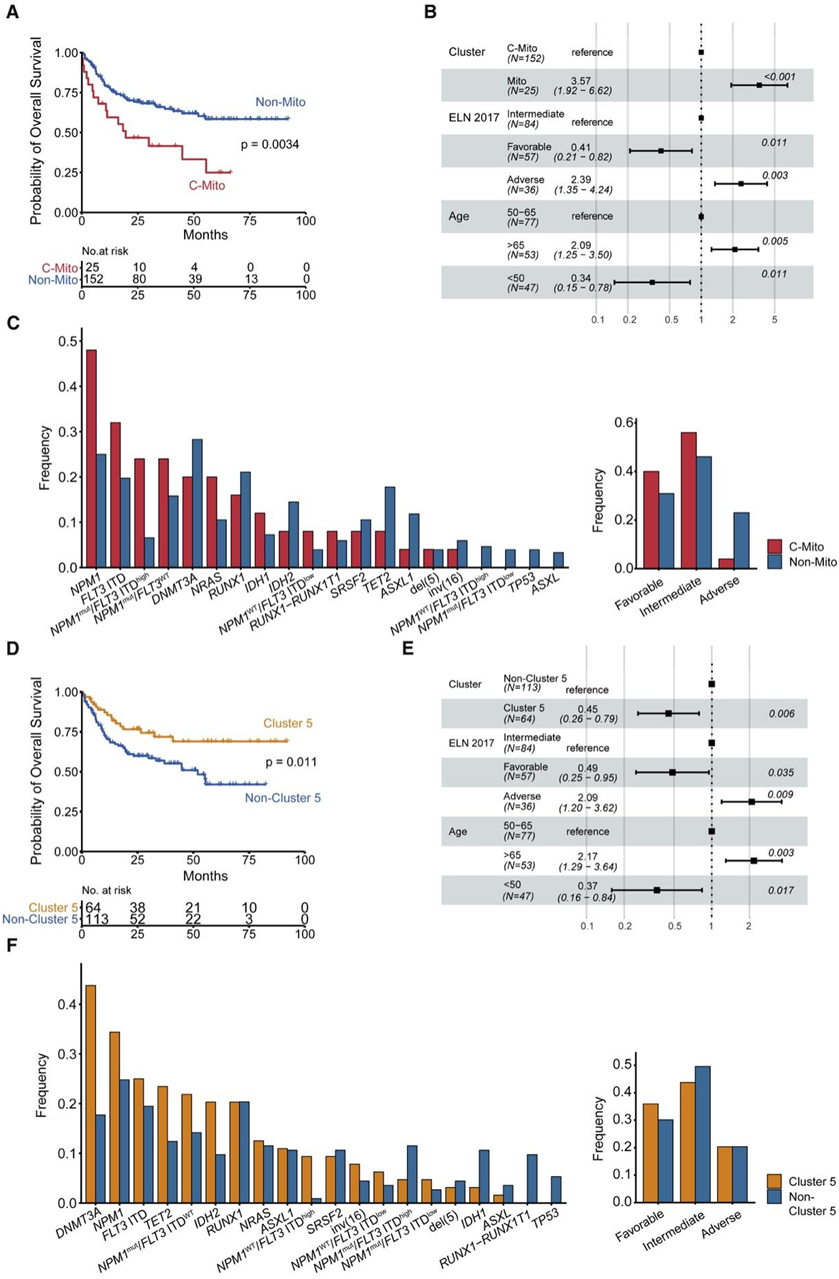
图3. AML蛋白质组亚型与强化诱导治疗后生存率的关系。
(A) C-Mito 和非 Mito 患者总体生存的 Kaplan-Meier 模型。 (B) 基于多变量 Cox 回归分析的 HR 的森林图,了解发现队列中患者的总体生存率。(C)(左图)C-Mito 组和非 Mito 组中细胞遗传学和分子遗传学特征的分组频率。(右图)C-Mito 组和非 Mito 组中 ELN 细胞遗传学风险类别的分组频率。(D) C5 和非 C5 患者总体生存的 Kaplan-Meier 模型。(E) 基于多变量 Cox 回归分析的 HR 的森林图,了解发现队列中患者的总体生存率。(F)(左)C5 和非 C5 组中细胞遗传学和分子遗传学特征的频率。(右)C5 和非 C5 组中 ELN 细胞遗传学风险类别的分组频率。
04
在独立患者队列中验证 Mito-AML 亚型
在验证队列中,定量蛋白质组数据的基于距离的层次聚类分析揭示了三个独立的聚类(图 4 A)。比较聚类富集分析验证了 C-Mito(频率 20%)和该聚类中NPM1突变的富集(图 4 A-B)。值得注意的是,在验证队列中,通过无监督聚类和通路分析确定为C-Mito的15例患者中,有14例在本项研究的预测模型分类为C-Mito(图4C)。
为了进一步阐明驱动 Mito 分类器的预测性跨队列 Mito 特征,他们计算了特征中每种蛋白质对验证队列中所有患者分类的贡献。在对 C-Mito 预测贡献最大的五种蛋白质中,两种蛋白质与线粒体(CYFIB 相关 Rac1 相互作用蛋白 B [CYRIB])和线粒体的 39S 核糖体蛋白 L19 (MRPL19) 以及另两种与核孔复合物(核孔复合体蛋白 88 [NUP88],核蛋白 TPR)有关,代表 C-Mito 的预测特征,也是建立诊断标记物组的第一步(图 4 D)。
他们进一步使用验证队列来确认C-Mito患者在接受强化诱导治疗时的不良预后。对于发现队列,C-Mito患者的OS明显短于非mito患者,无论是预测的C-Mito患者(图4E),还是通过无监督聚类确定为C-Mito的患者(图4F-G)。
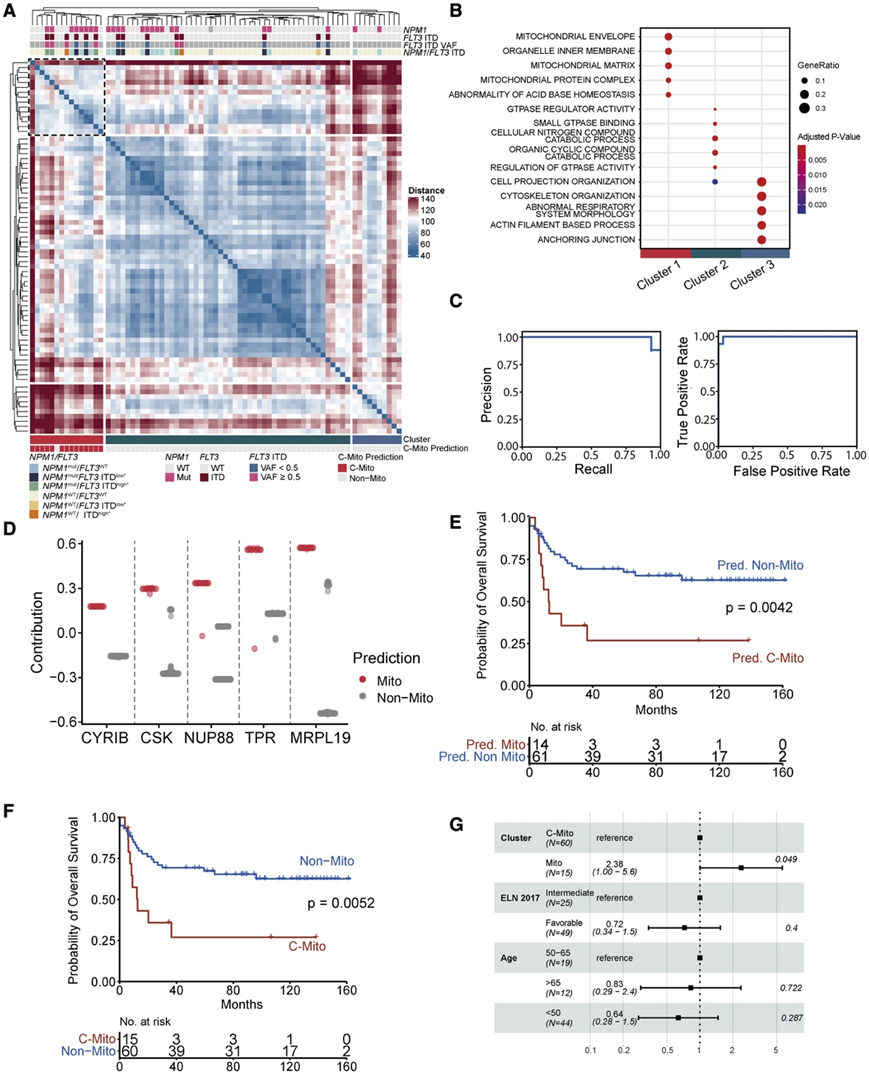
图4. 验证队列和基于机器学习的 C-Mito 预测。
(A) 患者与患者距离的无监督分层聚类。(B) 使用每个聚类与其余患者之间差异表达蛋白质的通路分析来表征三个蛋白质组聚类。(C) C-Mito 分类器的精确率与召回率以及受试者工作特征 (ROC) 曲线,该分类器在发现队列中进行训练并在验证队列中进行测试。(D) 验证队列中五种最相关的蛋白质对 C-Mito 患者分类的贡献的蜂群图。(E) 通过使用在发现队列上训练的分类器预测为 C-Mito 和非 Mito 的验证队列患者的总体生存 Kaplan-Meier 模型。(F) 基于层次聚类的验证队列中 C-Mito 和非 Mito 患者总体生存的 Kaplan-Meier 模型;Mito 患者的总生存期再次显著缩短。(G) 基于验证队列中患者总生存期的多元 Cox 回归分析的 HR 的森林图。
05
Mito-AML 定义的蛋白质组网络
为了进一步了解 C-Mito 的生物学特性,他们提取了在将 C-Mito 与所有其他蛋白质组聚类进行比较时表现出显著表达差异的前 100 个蛋白质。这些蛋白质大多数属于三个生物类别之一,即线粒体、核膜和染色质调节因子(图 5 A)。通过叠加先前发表的蛋白质相互作用以获得表征 C-Mito 的蛋白质相互作用网络,揭示了这些蛋白质的强互连性。对于线粒体,C-Mito 的特点是几乎所有线粒体蛋白都高表达,包括呼吸复合物 I-V,根据本项研究的 MOFA 分析,这种现象仅在蛋白水平而非 RNA 水平上观察到(图 5B-E)。
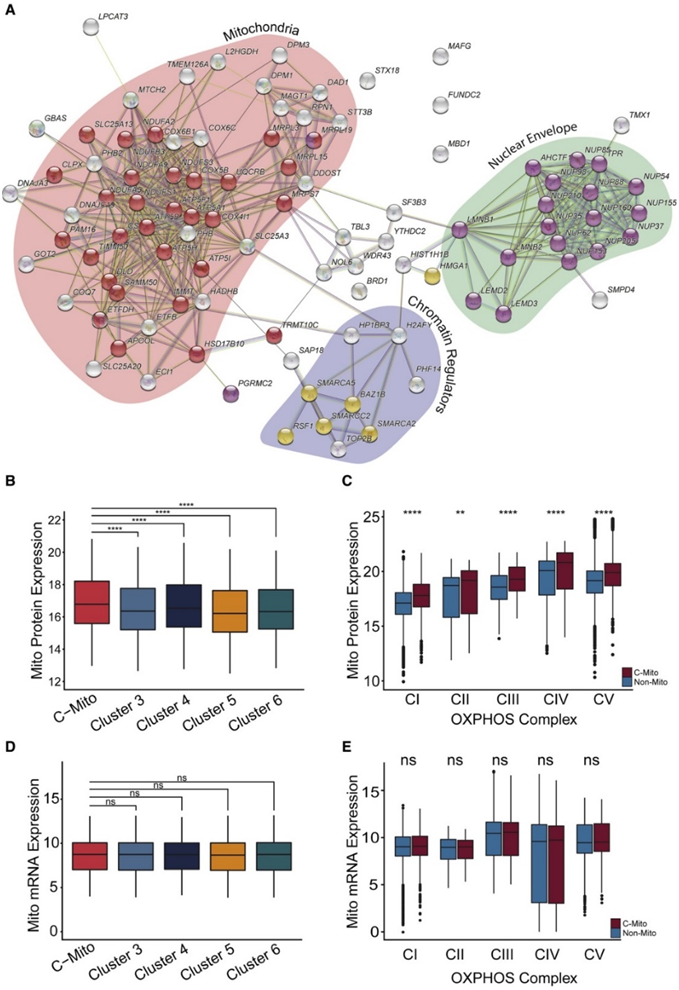
图5. Mito-AML 定义的蛋白质组网络。
(A) C-Mito 患者与非 Mito 患者中前 100 个差异上调的蛋白质的 StringDB 网络。(B) 按蛋白质组聚类分层的线粒体蛋白质的表达。(C) C-Mito 分层的蛋白质组中 OXPHOS 复合体亚基的表达。(D) 线粒体基因的 mRNA 表达 (GO:0,005,739),按蛋白质组聚类分层。 (E) OXPHOS 复合体亚基的 mRNA 表达,通过 C-Mito 分层。
06
Mito-AML 的线粒体复合物 I 依赖性
鉴于本项研究的蛋白质组学方法已将 Mito-AML 确定为高风险 AML 亚型,他们研究了该亚型是否具有特定的病理机制特征。为此,他们对 25 种急性白血病细胞系中的蛋白质表达进行了分析,以研究蛋白质组分析是否可以区分 Mito 和非 Mito AML 细胞系,以及他们是否可以使用这些模型进行功能研究。在这些细胞系中,通过无标记质谱法对蛋白质表达进行定量,从而鉴定出 8,573 种蛋白质。无监督聚类将 14 个细胞系鉴定为 Mito-high,11 个细胞系鉴定为 Mito-low(图 6A)。
他们首先整合了来自公开可用的 CRISPR-Cas9 功能丧失筛选的功能基因组数据,以阐明 Mito-high 与 Mito-low 细胞系的脆弱性。对于 DepMap CRISPR 数据集中的 10 个 AML 系,他们有可用的蛋白质组数据,其中 6 个分别属于 Mito-high 类别,4 个属于 Mito-low 类别。 CRISPR 筛选显示,与 Mito-high 系相比,Mito-low 系对线粒体复合物 I 基因的依赖性更强(图 6 B),而属于复合物 II-V 的基因则没有显示差异(图 6 C)。除了复合体 I 之外,参与 DNA 修复、组蛋白乙酰化和哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路的基因在 Mito-high 细胞系中具有更强的依赖性(图6 B)。
除了复合体 I 之外,参与 DNA 修复、组蛋白乙酰化和哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路的基因在 Mito-high 细胞系中具有更强的依赖性(图6 B)。因此,他们分析了Mito-high 和 Mito-low 细胞系对复合物 I 抑制剂 mubritinib 和鱼藤酮,以及对 Venetoclax 和 Venetoclax/azacitidine 联合治疗的体外敏感性,所有这些也都针对线粒体呼吸。这揭示了 Mito-high AML 系对这些药物的显著的超敏反应(图 6D)。
此外,他们进行了 Seahorse 代谢分析,发现 Mito-high AML 系表现出更强的复杂 I 依赖性呼吸(图 6 E)。与这些结果一致,与 Mito-low 细胞相比,venetoclax 治疗导致 Mito-high 细胞的耗氧率下降幅度更大(图 6 F)。发现队列的主要样本进一步验证了更强的复杂 I 依赖性呼吸(图 6 G)。最后,通过流式细胞分析比较24 小时处理后膜联蛋白 V-/7-氨基放线菌素 D-(7AAD-) 细胞的分数,证实了 Mito-AML 患者母细胞对 Venetoclax 离体敏感性的增加(图 6 H)。总之,这些结果表明 Mito-AML 细胞的线粒体呼吸具有特定的线路,这使得它们更容易受到针对该代谢途径的药物的影响。
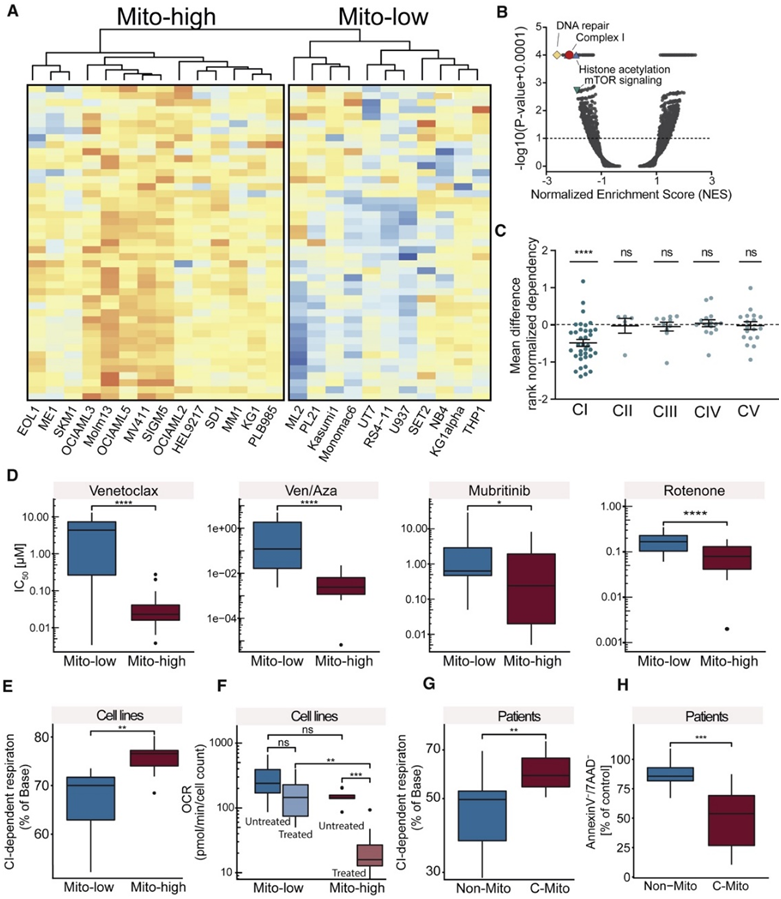
图6. Mito-AML 的代谢线路和治疗相关的靶点。
(A) 基于 45 种 OXPHOS 相关蛋白表达的急性白血病细胞系的层次聚类。(B) 火山图描绘了 CRISPR (Avana) 21Q2 数据中可用的 Mito-high 与 Mito-low 细胞系中全基因组差异 CERES 依赖性评分的基因集富集。(C) 散点平均值 ± SD 点图描绘了 OXPHOS 复合物 I-V 中 Mito-high 与 Mito-low 细胞系的平均差异等级归一化 CERES 依赖性评分。(D)显示了 Mito-high AML 细胞系和 Mito-low AML 细胞系的半数抑制浓度 (IC50)。 (E) 使用 Seahorse 96 细胞外通量分析仪对 AML 细胞系中的呼吸链复合物 I 依赖性进行定量。(F) 用 2 μM venetoclax 处理 24 小时后测量的细胞系耗氧率。(G) 使用 Seahorse 96 细胞外通量分析仪对主要患者样本中的复合物 I 依赖性进行量化。(H)Annexin V−/7AAD− 的量化。
+ + + + + + + + + + +
结 论
本项研究通过蛋白质组学分析,以阐明 AML 的分子病理生理学,从而为未来的诊断和治疗方法提供信息。除了深入的定量蛋白质组学分析之外,本项研究的分析还包括细胞遗传学分析,确定了五种蛋白质组 AML 亚型,每种亚型都反映了跨越基因组边界的特定生物学特征。其中两种蛋白质组亚型与患者的结果相关,但没有一种亚型与特定的基因组畸变完全相关。值得注意的是,一种仅在蛋白质组中捕获的亚型(Mito-AML)的特点是线粒体蛋白高表达,在强化诱导化疗后缓解率降低,总生存期缩短。功能分析表明,Mito-AML 在代谢上与更强的复杂依赖性呼吸有关,并且对 BCL2 抑制剂 Venetoclax 处理更敏感。
+ + + + +



 English
English


