文献解读|(10.514):单细胞转录组分析揭示小鼠中MicroRNA-126在时空水平上的胚胎内皮异质性和多功能性
✦ +
+
论文ID
原名:Single-Cell Transcriptome Analysis Reveals Embryonic Endothelial Heterogeneity at Spatiotemporal Level and Multifunctions of MicroRNA-126 in Mice
译名:单细胞转录组分析揭示小鼠中MicroRNA-126在时空水平上的胚胎内皮异质性和多功能性
期刊:Arteriosclerosis Thrombosis And Vascular Biology
影响因子:10.514
发表时间:2022.03
DOI号:10.1161/ATVBAHA.121.317093
背 景
血管内皮细胞 (ECs) 是血管的内层,直接响应与血管张力、细胞粘附、抗血栓形成、平滑肌相关的物理和化学信号,但由于动静脉差异以及所处器官微环境的不同,导致其在分子水平、细胞水平和生理功能上均表现出明显差异。ECs 的异质性在转录组学和表观基因组学水平上得到了进一步的表征,但胚胎期是否存在内皮异质性以及何时存在需要进一步研究。作为血管内皮细胞特有的 microRNA,microRNA-126调节血管生成和血管完整性。
基于此,作者想要评估发育ECs在时空水平上的转录异质性,并揭示特异性敲除内皮富含的microRNA-126(miR-126)时胚胎ECs聚集的变化。
实验设计
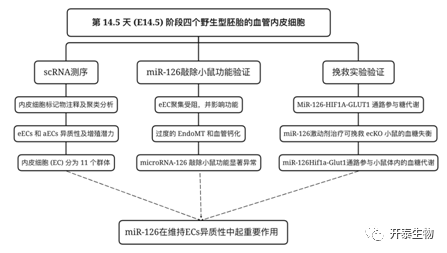
结 果
01

胚胎 ECs 可分为 11 个群体
收获第 14.5 天 (E14.5) 阶段四个野生型胚胎,获得 5806 和 6278 个 eEC(胚胎内皮细胞)并整合在一起。通过聚类分析确定了 11 个簇,并且从 M1和 M2分离的细胞得到了很好的整合(图 1A)。在各种器官或组织中建立的内皮细胞标记用于注释每个簇(图 1B)。脉管系统中的 EC 由血管 EC 和淋巴 EC 组成。大血管中的内皮细胞进一步分类为动脉内皮细胞和静脉 ECs。Foxf1 在肺 ECs38中高度表达,肾 EC 表达更高的基因Pbx1,Npr3 是心内膜的标记基因。Stab 2、Gata4 和 Oit3 在肝 ECs中高度表达。来自心脏的部分 aEC 与定义为心内膜的 eEC 重叠,这与心脏中 EC 的解剖分布一致。某些基因(肌肉中的 Actb、Fabp4和肠道 EC 中的 Apq710)分别在簇 0 和簇 1 中富集(图 1B)。作者推测簇 0 为肌肉 eEC,簇 1 为肠ECs 池。利用已发表的成年小鼠数据集,作者在图 2B 中用红色字体突出显示了一些基因,与 aECs 相比,这些基因在 eECs 中的表达相对较高。
总的来说,11 个异质的 eEC 簇按层次组织,就像脉管系统的解剖结构一样。eEC 包括淋巴 EC和血管 EC。血管 EC 包括大血管 EC和微血管 EC。作者还将一个簇确定为间充质转运的 ECs。
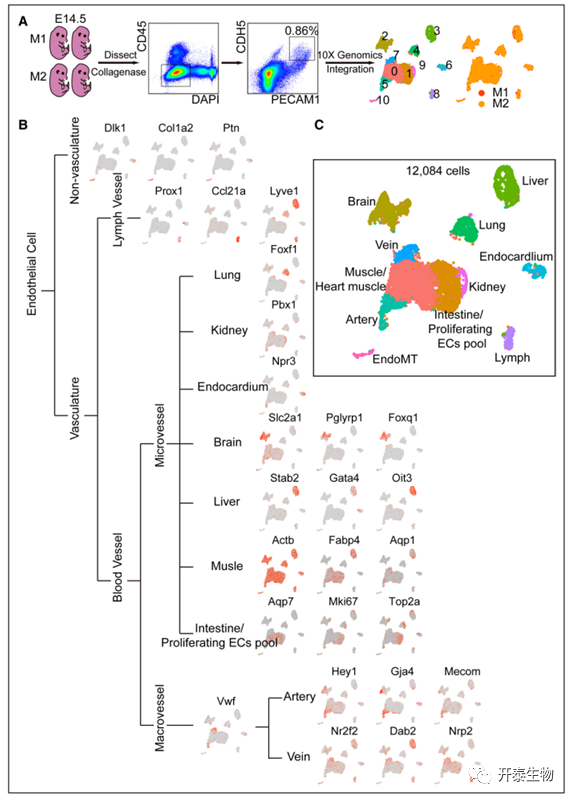
图 1. 胚胎第 14.5 天的内皮细胞 (EC) 分为 11 个群体
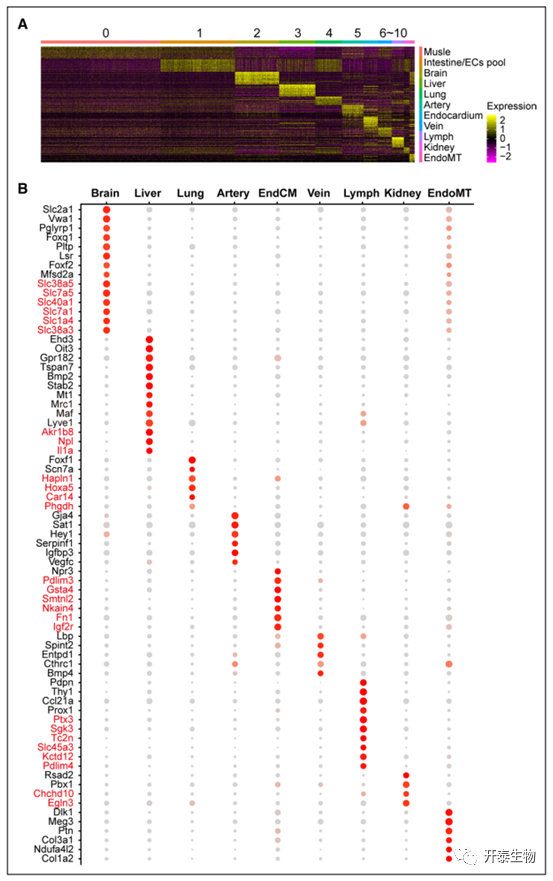
图 2. 在每个胚胎内皮细胞 (eEC) 群中高度且专门表达的基因
02

胚胎 EC 在组织中是异质的,具有很高的增殖潜力
大血管标志物 Vwf 和 Vcam1 在一些动脉和静脉 EC 簇中富集,定义为动脉/静脉。毛细血管内皮细胞表达大血管和毛细血管标记,定义为毛细血管动脉/静脉。一些 EC 亚群表达Serpina1e 和 Alb(图 3A-C),在肝细胞中高度表达,作者将它们定义为器官浸润性 EC。
通过将 eECs 与 aECs (成人血管内皮细胞)整合,作者揭示胚胎期组织内以及 eECs 和 aECs 之间的异质性。大多数组织在大多数类型的 EC 中显示出相同的比例(图 3A-D 和 3E)。然而,eECs 在心脏 eECs和淋巴 eECs中显示出较高的增殖率。eEC 和 aEC 之间差异表达基因主要参与有丝分裂细胞周期、管形态发生和细胞增殖。增殖细胞在所有组织中显示出超过一半的比例。

图 3. 胚胎内皮细胞 (eECs) 组织中仍存在血管异质性,其增殖潜力高于成人 ECs (aECs)
03

敲除miR-126影响eECs聚集,eECs异常主要与缺氧有关
与对照相比,miR-126-ecKO 胚胎显示出血管渗漏和皮下胚胎水肿和更高的致死率。胚胎淋巴和出生后视网膜中 ECs 的迁移和发芽受损,如血管面积减少(图 4A-B)。所有这些血管异常表明 miR-126-ecKO 小鼠脉管系统中的血管生成减少。
大多数EC的比例在 miR-126-ecKO 和同窝对照胚胎之间具有可比性(图 4C-D)。仅在 miR-126-ecKO eECs 中富集到10 个 GO 条目中有 5 个与缺氧有关(图 4E)。作者发现与缺氧相关的基因包括 Hif1a在miR-126 敲除后明显上调,并且心脏 ECs 中的表达谱高于同窝对照。在 miR126-ecKO 小鼠的胚胎皮肤和出生后视网膜区域发现过度血管生成(图 4F),意味着 miR-126 对胚胎期血管网络的稳态至关重要,敲除 ECs 中miR-126 会影响血管生成。

图 4. 敲除 microRNA-126 (miR-126) 扰乱了胚胎内皮细胞在发育过程中的聚集
04

敲除 miR-126 干扰肝脏 eEC 聚集以影响葡萄糖代谢和纤维化
来自肝脏的 eEC中簇 5 和 6 在 miR-126ecKO ECs 中变化最大(图 5A 和 B)。第 5 组和第 6 组中 DEG与葡萄糖调节和缺氧相关的多个GO 条目相关(图 5C)。miR-126-ecKO 小鼠对葡萄糖和丙酮酸的耐受性降低(图 5F-G)。结果表明 miR-126 在葡萄糖调节中的潜在功能。肝缺氧可能导致纤维化, miR-126-ecKO 小鼠的胶原纤维增加(图 5E)。
由 miR-126 缺乏引起的肝脏 eEC 杂乱无章,导致成年期肝纤维化和葡萄糖代谢异常。
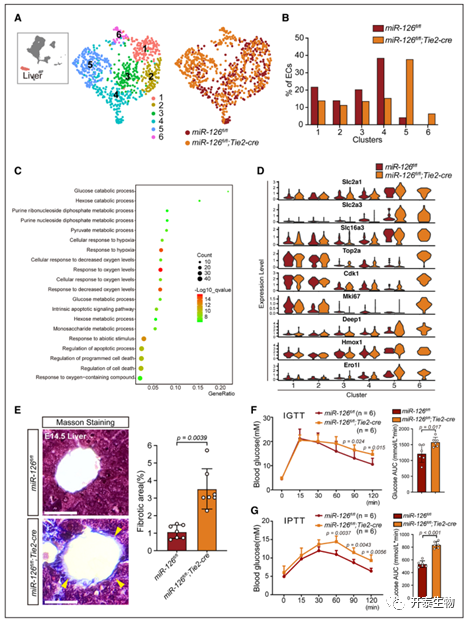
图 5. 敲除内皮细胞 (ECs) 中的 microRNA-126 (miR-126) 会扰乱血糖代谢并诱导肝组织纤维化
05

敲除 eEC 中的 miR-126 导致过度的 EndoMT 和血管钙化
间充质转运的 EC中簇 3 和簇 4 在 miR-126-ecKO eECs 中变化最大(图 6A-B)。第 3 组中 DEG与细胞外基质组织和骨骼系统发育相关的条目相关(图 6C)。富含细胞外基质和软骨的基因也在簇 3 中高度表达(图 6D)。miR-126 敲除 eECs 中存在过量的 EndoMT (内皮-间充质转化)(图 6E)。染色表明 miR126-ecKO 小鼠脑和肺中的血管钙化增加(图 6F)。
这说明 miR-126 的敲除通过内皮到软骨的转变导致血管钙化。

图 6. Tie2-cre 介导的 ECs 特异性miR-126-ecKO胚胎中的内皮间质转化和血管钙化增加
06

MiR-126-HIF1A-GLUT1 通路参与糖代谢,用 miR-126 Agomir (激动剂)治疗可挽救 miR-126-ecKO 小鼠的血糖失衡
miR-126 在 ECs 中敲除时,肝 ECs 部分上调了与缺氧相关的基因。上调的缺氧相关基因最终诱导了GLUT1和 GLUT3的上调。最后,上调的 GLUT1 导致血糖代谢紊乱。HIF1A 和 GLUT1 在 miR126 缺陷型 eEC 中均表达更高(图 7A-B)。当 miR-126 敲除时,HIF1A 和 GLUT1 在肝 ECs 中均上调(图 7C-D)。
miR-126 敲除小鼠的血糖代谢破坏(图 5E),重要的是要知道恢复 miR-126 是否能恢复缺陷。通过尾静脉注射用 miR126-3p agomir 治疗,显示miR-126 敲除小鼠的血糖耐受性显著恢复(图 7E-F)。结果表明miR-126Hif1a-Glut1通路参与了小鼠体内的血糖代谢。
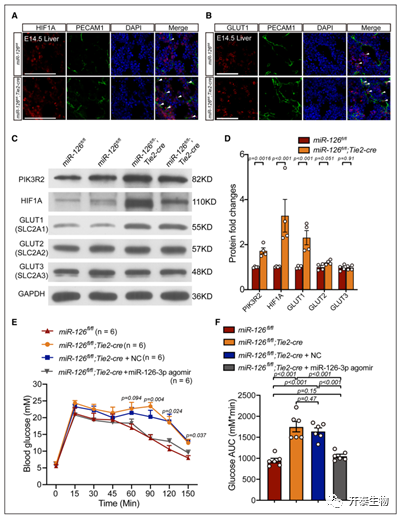
图 7. HIF1A-GLUT1 通路在 microRNA-126 ECs中上调,miR-126-3p agomir 恢复糖代谢
+ + + + + + + + + + +
结 论
研究表明,EC的异质性早在胚胎阶段就已经确定。在发育过程中,ECs 特异性 microRNA-126 敲除小鼠中的常规胚胎 ECs 聚集可能受损,并且出现的异常胚胎ECs簇最终导致糖代谢紊乱、过度的肠套叠血管生成和内皮-间质转化增加。miR-126的缺乏破坏了胚胎ECs的分化和多样化,表明miR-126在维持ECs异质性中起重要作用。
+ + + + +



 English
English

