文献解读|Cell(64.5):灵长类动物妊娠的多组织代谢组图谱
✦ +
+
论文ID
原名:A multi-tissue metabolome atlas of primate pregnancy
译名:灵长类动物妊娠的多组织代谢组图谱
期刊:Cell
影响因子:64.5
发表时间:2024.02.01
DOI号:10.1016/j.cell.2023.11.043
背 景
怀孕会导致女性新陈代谢发生巨大变化;然而,人们对这种代谢重编程的复杂性仍然知之甚少,尤其是在灵长类动物中。
实验设计
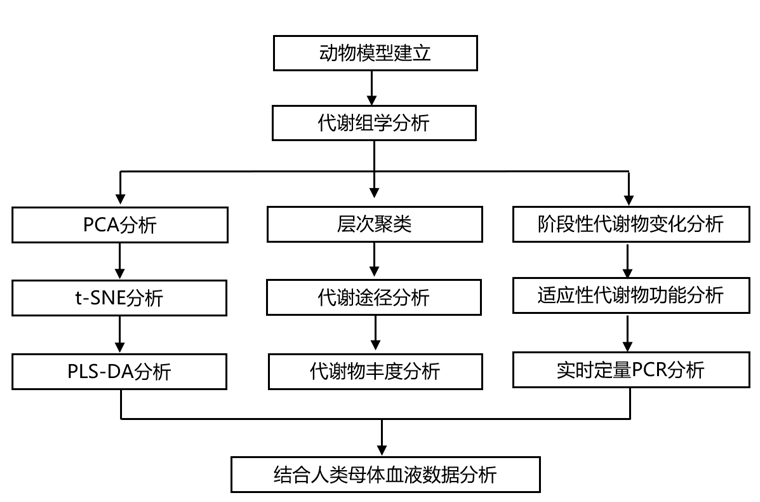
结 果
01
妊娠猴不同阶段组织代谢组学分析
为了研究妊娠期间组织的代谢适应,研究者团队分析了不同妊娠阶段的食蟹猴组织。他们收集了10个系统的23个组织,包括子宫、卵巢、胎盘、乳腺、胸腺、心尖、左心室、左心房、右心室、右心房、胰头、胰颈、胰体、胰尾、肝脏、肾脏、肾上腺、脊髓、腓肠肌、股四头肌、腹部皮肤、头皮皮肤和血清(图 1 A)。子宫胎盘系统的总重量和百分比重量在整个怀孕期间增加,而胸腺的总重量和百分比重量在妊娠中期(MP) 和妊娠晚期 (LP)阶段下降。他们使用液相色谱-质谱 (LC-MS) 分析了 273 个样品的非靶向代谢组学(图 1 A)。通过主成分分析 (PCA) 分析数据,发现样本根据其阶段进行分布(图 1 B)。 T 分布随机邻域嵌入 (t-SNE) 显示样本也根据组织来源进行分离(图 1 C)。偏最小二乘判别分析 (PLS-DA) 还表明,组织样本可以根据其器官系统的起源(图 1 D)进行聚类。所有这些分析都证实了本项研究代谢组学数据的可靠性和稳健性。
为了量化不同阶段每个组织的整体代谢组变化,他们分析了未怀孕(NP)、MP 和 LP 阶段中代谢物特征的数量,并以怀孕早期(EP)阶段作为基线。结果表明,每个组织根据阶段表现出独特的代谢反应(图 1 E)。在组织水平上,许多代谢物特征也表现出特定阶段的趋势。
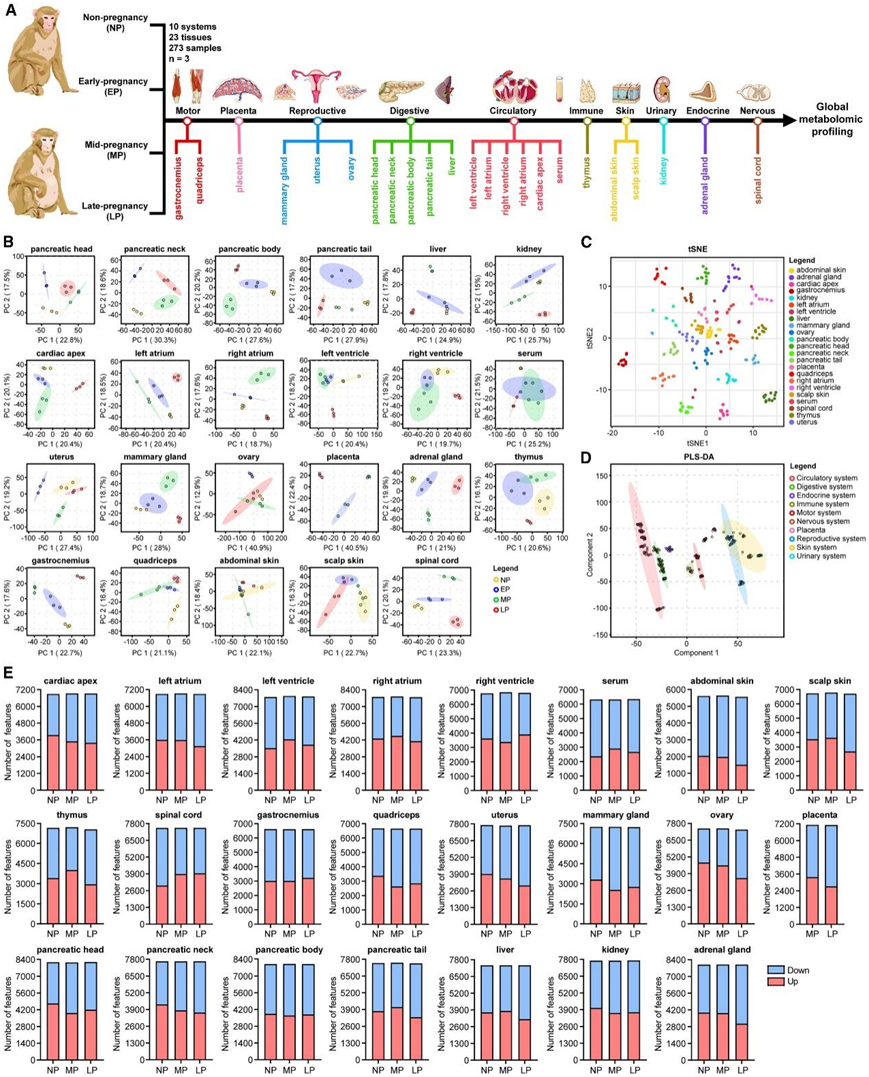
图1. 非靶向代谢组学可以根据妊娠阶段、组织或系统对单个样本进行稳健聚类。
(A) 实验设计。(B) 主成分分析 (PCA)。(C) 非线性 T 分布随机邻域嵌入 (t-SNE) 降维算法根据来源组织对各个样本进行聚类。(D) 线性偏最小二乘判别分析 (PLS-DA) 根据各个样本的起源器官系统对它们进行聚类。(E) 相对于 EP 的 NP、MP 和 LP 处每个组织中代谢物特征的数量。
02
组织之间的代谢耦合在怀孕期间进化和减少
为了阐明四个阶段 23 个组织之间的代谢耦合,他们使用 Spearman 相关热图和网络图来可视化结果(图 2)。相关热图显示了生物三重复之间以及心脏组织、骨骼肌、皮肤和胰腺组织内的高度相关性,进一步支持了本项研究数据的稳健性(图2A -D)。肝脏在所有四个阶段也与肾脏代谢相关(图 2A-D),表明这两个器官之间存在代谢耦合。
此外,热图清楚地表明,23个组织之间的代谢耦合在不同阶段是动态进化的。例如,在非妊娠状态下,骨骼肌代谢组与心脏组织、脊髓、肾上腺和子宫等各种组织高度相关(图2A),但在EP和MP中,骨骼肌代谢组与心脏组织的相关性降低(图2B-C)。通过LP,与其他组织相比,骨骼肌与脊髓的相关性更强,表明神经肌肉耦合增加(图2D)。
胎盘与子宫高度相关(图2B),它与子宫形成相互交换营养的绒毛。在非妊娠状态下,子宫最初与心脏组织和骨骼肌相关性最强(图2A),但在EP和MP中,子宫与胎盘高度相关(图2B-C)。然而,通过 MP 和 LP,胎盘与心脏、卵巢和肝脏组织的相关性变得更强(图 2C-D),而子宫在 LP 中进一步漂移,与头皮皮肤相关(图 2D)。
卵巢与非怀孕状态下的皮肤组织高度相关(图2A),这可能是由于上皮细胞的富集所致。然而,这些相关性在怀孕期间减弱,卵巢与胎盘的相关性变得更强(图2B-D)。为了更全面地可视化怀孕期间的非线性代谢组变化,他们为每个阶段构建了相关网络图。相关网络图显示,皮肤(黄色,左)、胎盘(粉红色,顶部)、心脏组织(红色,右)以及子宫和卵巢(蓝色,底部)之间的代谢耦合在怀孕期间发生了巨大的变化(图2E-H)。与高度相互耦合和各向同性的非怀孕状态相比,组织之间的代谢耦合在怀孕期间和整个怀孕期间减少(图2E-H),通过LP达到高度解耦和更加各向异性的状态(图2H)。相关网络图还显示了胎盘的出现与代谢偶联中的一个相变是如何重合的,以及胎盘与EP中子宫和其他组织的偶联是如何通过MP和LP转移到卵巢和心脏组织的(图2G-H)。多组织代谢组学表明,女性组织之间广泛的代谢相互耦合因怀孕而受到严重破坏,并在怀孕期间急剧重新编程。
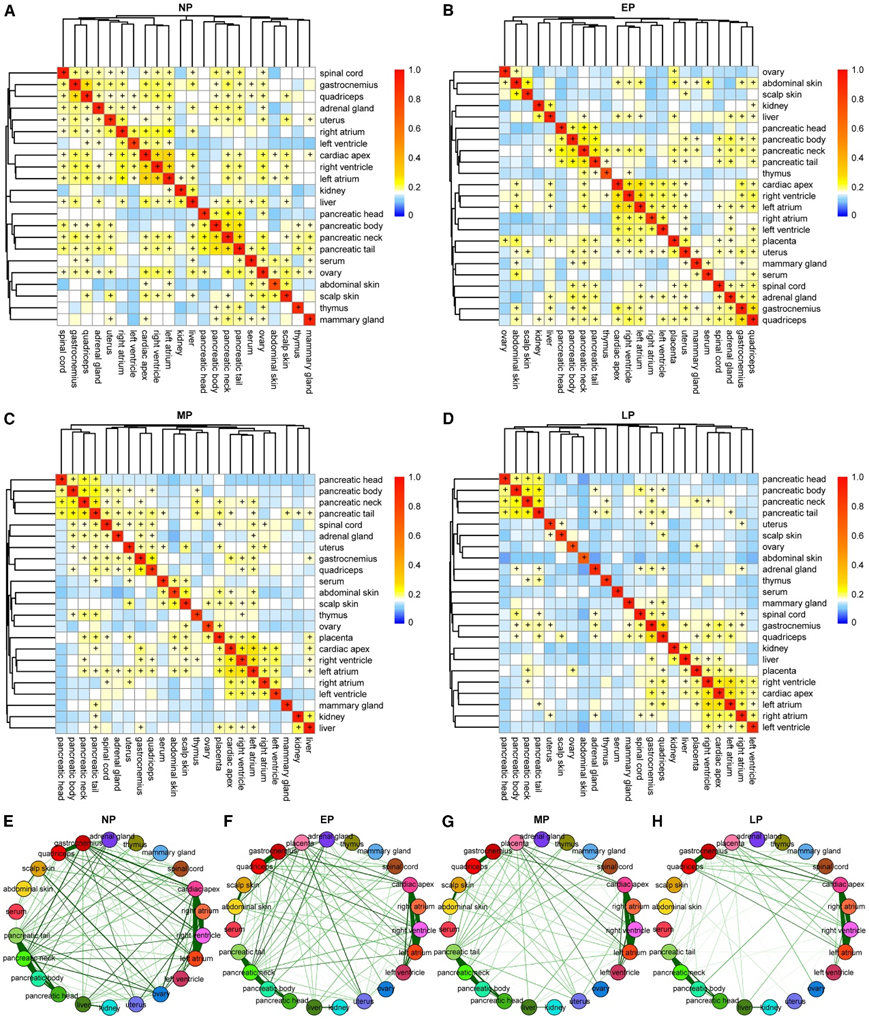
图2. 相关分析显示,妊娠期间母体组织之间的代谢耦合急剧演变和减少。
(A-D) 相关热图显示了NP、EP、MP 和LP 阶段组织之间的代谢耦合。(E-H) 相关网络显示了NP、EP、MP 和LP 阶段组织之间代谢耦合的非线性演化。
03
怀孕期间每个母体组织的代谢途径发生变化
为了进一步研究正在重新编程的确切代谢途径,他们首先检测了多种代谢物的阶段性变化。由于胎盘对妊娠很重要,但仅从EP开始存在,因此他们选择EP作为比较基线。 MetaboanalystR 参考小分子通路数据库 (SMPDB) 分析了显著富集的途径。为了量化代谢重编程的程度,他们分析了每个组织在每个妊娠阶段显著改变的代谢途径的数量(图3A)。在 NP 和 EP 之间,心尖、胰颈、卵巢、左心房、子宫和胸腺的代谢途径比其他组织有更显著的改变(图3A)。平均而言,与怀孕期间的其他组织相比,胰腺组织、生殖组织(子宫和卵巢)、胎盘和心脏组织显示出最多数量的扰动代谢途径(图3A)。
为了揭示各妊娠期各组织代谢途径的大规模变化,他们计算了98种SMPDB途径中每一种发生显著变化的组织数量。相对于EP,每个阶段有一半或更多的组织发生了8条代谢途径的变化(图3B-C)。此外,母体的嘧啶、谷氨酸、嘌呤、酪氨酸和卟啉代谢在怀孕期间表现出惊人的适应性(图3B)。
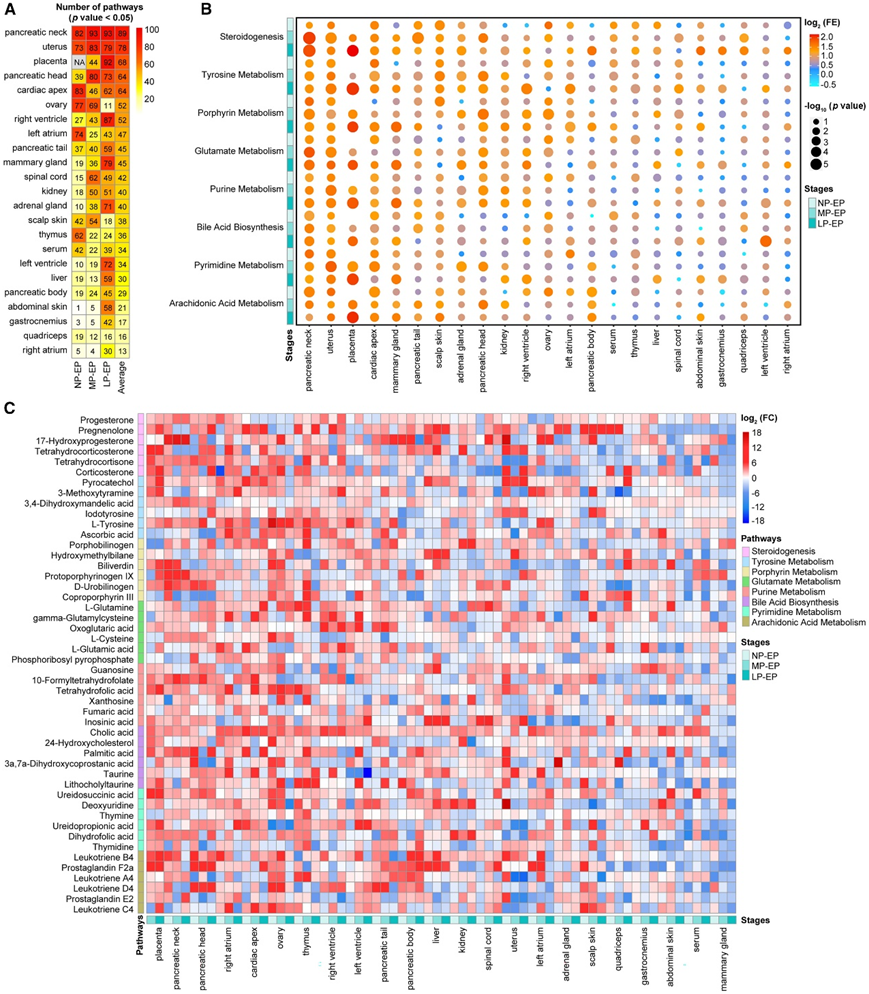
图3. 怀孕期间多种代谢途径在多个母体组织中经历重塑。
(A) 热图显示了 23 个组织中 NP、MP 和 LP 相对于 EP 显著变化的代谢途径数量。(B) 气泡图显示在 NP、EP、MP 和 LP 之间的所有转换中,一半或更多组织中显著变化的八种代谢途径。(C) 热图显示23 个组织中 NP、MP 和 LP 相对于 EP 的代谢物变化。
除了整个怀孕期间共有的这八种代谢途径之外,在怀孕的至少一个阶段,许多(如果不是全部)母体组织中的途径也发生了变化。从 NP 到 EP(图 S3 A),鞘脂代谢,包括1-磷酸鞘氨醇、L-磷酸二氢鞘氨醇、二氢鞘氨醇和鞘氨醇,在不同妊娠阶段的大多数组织中均增加(图S3B)。鞘脂异常与人类妊娠失败有关,并且这些鞘脂也是早孕期潜在的先兆子痫 (PE)的生物标志物。此外,胰腺组织中的类固醇生物合成从 EP 到 MP 发生显著变化(图 S3 A,中间气泡图),已知这与人类妊娠期间的胰岛素抵抗和胰腺 β 胰岛功能有关。此外,雄激素和雌激素代谢以及雌酮代谢也从 EP 变为 LP(图 S3 A-B)。从 EP 到 LP,多个组织中的脂肪酸代谢途径也发生了显著改变(图 S3 A-B)。因此,富集分析揭示了每个组织中已知和以前未知的与妊娠相关的几个核心代谢途径。
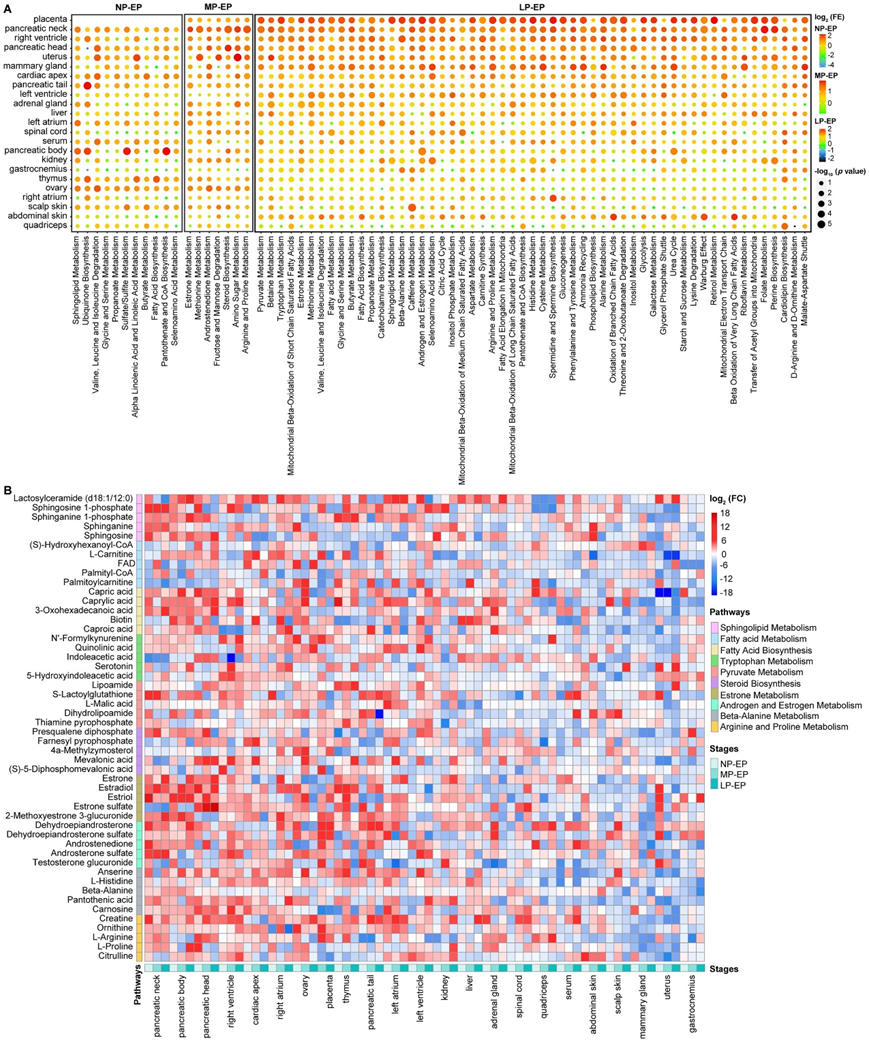
图S3. 相对于 EP,在 NP、MP 和 LP 中超过一半或更多母体组织发生显著变化的其他代谢途径。
(A) 气泡图显示,在 NP、EP、MP 和 LP 之间的至少一种转变中,一半或更多组织的代谢途径发生显著变化。(B) 热图显示23 个组织中 NP、MP 和 LP 相对于 EP 的代谢物。
04
妊娠期间多个母体组织共有的妊娠适应性代谢物
他们可视化了每个组织中每个阶段的差异代谢物数量(图4A),每个母体组织都有数千个 m/z 特征,这些特征在怀孕期间持续变化(图 4 A)。然而,在整个妊娠期间,所有 23 个母体组织中只有 91 种差异代谢物是共有的(图 4 A),这可能是由于 LP 的代谢解偶联所致(图 2 H),他们将这些妊娠适应性代谢物称为妊娠适应性代谢物。
在这 91 种妊娠适应性代谢物中,他们观察到多种类固醇激素,正如通路富集分析所预期的那样。与 NP 相比,MP 和 LP 期间胎盘、血清、子宫、胰腺组织、肾脏、脊髓和骨骼肌中的孕酮持续增加(图 4 B)。MP 和 LP 期间多个组织中的孕烯醇酮也持续增加,包括胎盘、脊髓、心脏组织、肝脏和肾脏(图 4 C)。硫酸脱氢表雄酮是一种由肾上腺皮质合成的弱雄激素,在多个组织中也持续增加,例如胎盘、脊髓、心脏和胰腺组织(图 4D)。有趣的是,皮质酮在整个怀孕期间的多个组织中也有所增加,包括胎盘、心脏组织和血清(图 4 E)。
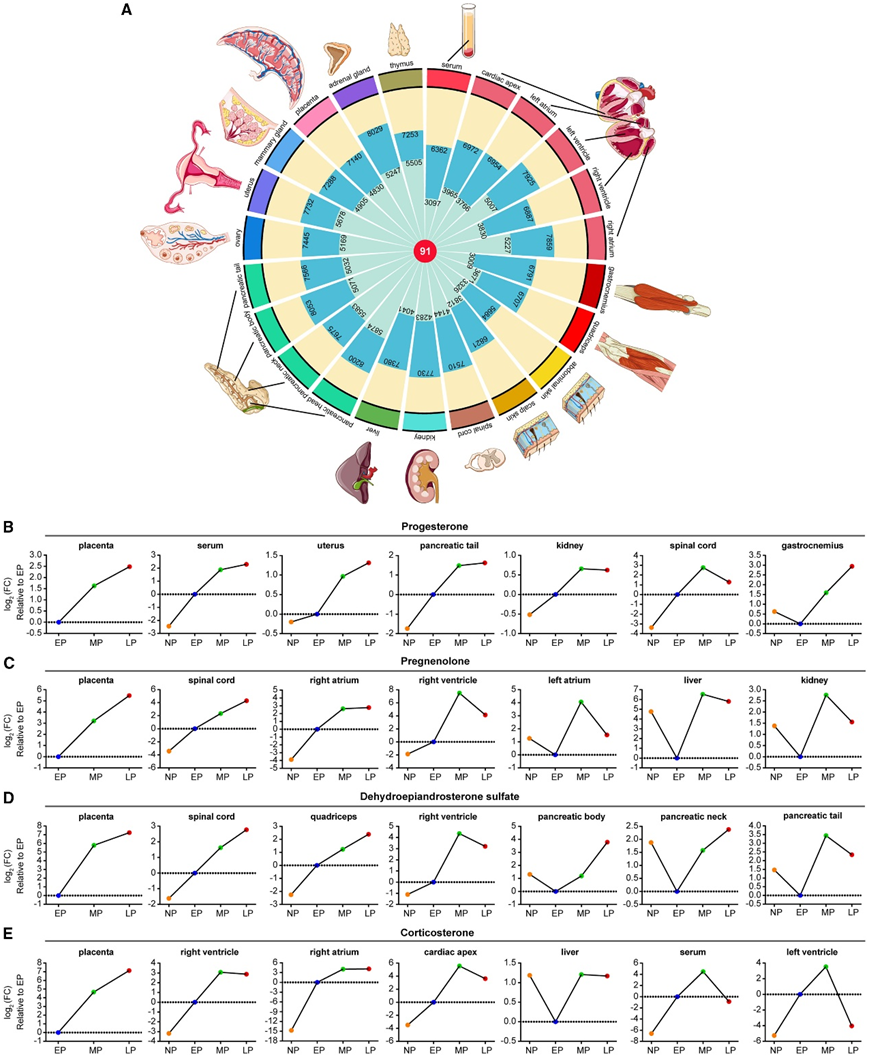
图4. 妊娠期间多个母体组织共有的适应性代谢物。
(A) 图表显示每个组织中 MP 和 LP 相对于 EP的差异代谢物数量。(B) NP、MP 和 LP 七个组织中黄体酮丰度。(C) NP、MP 和 LP 七个组织中孕烯醇酮丰度。(D) NP、MP 和 LP 七种组织中硫酸脱氢表雄酮丰度。(E) NP、MP 和 LP 七个组织中皮质酮丰度。
棕榈酰肉碱 (PC) 是众所周知的脂肪酸氧化中间体,与 NP 相比,EP 和 MP 期间肝脏、胰腺组织、心脏组织、肾脏、肾上腺、血清中的含量增加(图5A)。白三烯D4 (Leukotriene D4, LTD4)是花生四烯酸形成的炎症介质,MP和LP期间胎盘、卵巢、脊髓、心脏组织和胰腺组织中LTD4含量较EP升高,EP期间心尖、血清、胸腺、子宫、肝、肾和股四头肌中LTD4含量较NP升高(图5B)。胆色素原是细胞色素和过氧化氢酶中血红素基团的前体,在怀孕期间在多个组织中增加,这些组织包括胰腺组织、心脏组织、乳腺、肾脏、肾上腺、头皮皮肤和卵巢(图5C)。鹅氨酸是β -丙氨酸代谢的产物,具有细胞保护功能,可在肾脏代谢,在胎盘、心脏组织、胰腺组织、卵巢、血清、头皮皮肤、脊髓和胸腺中呈不同阶段的增加(图5D)。
除了上述23个组织共有的8种差异代谢物外,其他83种妊娠适应性代谢物也在妊娠期间表现出持续的变化(图5E)。从 EP 到 LP,胎盘、肾上腺、肝脏和心脏组织中的 N2-琥珀酰-L-鸟氨酸持续增加(图 5 E)。从 EP 到 LP,肾上腺、胸腺、肝脏、左心室和脊髓中的L -磷酸鞘氨醇持续增加(图 5 E)。雌二醇是怀孕期间的一种主要雌激素,也能促进血管适应,从 EP 到 LP,心脏组织中的雌二醇持续增加(图 5 E)。

图5. 怀孕期间持续变化的关键代谢物。
(A) 7 个组织中 NP、MP 和 LP 相对于 EP 的棕榈酰肉碱丰度。(B) NP、MP 和 LP 7 个组织中 LTD4 丰度。(C) 7 个组织中 NP、MP 和 LP 相对于 EP 的胆色素原丰度。(D) 7 个组织中 NP、MP 和 LP 相对于 EP 的鹅丝氨酸丰度。(E) 热图显示23 个组织中的 83 个其他差异代谢物丰度。
05
妊娠适应性代谢物皮质酮对人滋养层分化的调节作用
在人胎盘中,细胞滋养层(CTB) 细胞是未分化的增殖细胞群,可产生绒毛外滋养层 (EVT) 和合体滋养层(STB)。鉴于到灵长类动物胎盘中皮质酮在妊娠各阶段的持续增加(图4E),以及胎盘在人类妊娠期间的重要性,他们利用人类滋养细胞干细胞(hTSC)模拟evt和stb的分化,研究皮质酮在胎盘发育中的迄今未知的功能。培养hTSC,使其增殖,并根据需要诱导分化(图6A)。皮质酮处理后,hTSCs的增殖标志物MKI67和PCNA降低(图6B)。此外,皮质酮上调evt中HLA-G和MMP2的表达(图6C),上调stb中CGB和PSG1的表达(图6D)。有趣的是,皮质酮增加hTSC中的HLA-G和MMP2,表明皮质酮可以单独诱导hTSC分化,且偏向evt(图6B)。
免疫荧光结果证实,在 hTSC 中,皮质酮可以下调 Ki67 并诱导 HLA-G 蛋白(图 6 E),与基因表达分析一致。在完全分化的STB中,他们发现CGB蛋白在STB中表达更高(图6E),并且皮质酮治疗后人绒毛膜促性腺激素(hCG)分泌水平显著增加3倍以上(图6F)。综上所述,这些结果表明,灵长类动物胎盘中皮质酮在妊娠各阶段的持续增加(图4E)在促进hTSC分化为EVT和STB以及hCG产生方面发挥功能性作用,从而调节胎盘组织的发育、生长,以及整个怀孕期间的功能。
考虑到PC在EP和MP时在心脏、胰腺和肝脏中显著增加,但在LP中普遍减少(图5A),他们想知道它是否也介导了妊娠期间的细胞命运适应,例如妊娠诱导的心脏生长、胰岛生长、肝脏生长和肌肉再生。
为了获得足够的人类祖细胞来验证这一假设,他们诱导女性人类胚胎干细胞(hESC)分化为人类心脏、胰腺、肝脏和肌肉祖细胞,并用PC进行测试。从ISL1和TNNT2表达的剂量依赖性增加可以看出,PC促进了心肌细胞 (CM)的分化(图6G),表明PC可以调节妊娠期间心脏的生长。从PAX4和RFX6表达的增加(图6H)可以看出,PC还促进了胰岛β细胞的分化和分化,表明它可以调节妊娠期间胰岛β细胞的生长。对于LPC, PC可以诱导肝祖细胞最终分化为表达白蛋白的肝细胞,从ALB表达的急剧增加中可以观察到,PC不影响肝祖细胞特化因子,提示其可以调节妊娠期间肝脏的生长和再生(图6I)。对于肌肉祖细胞,PC以剂量依赖的方式增加分化肌细胞转录因子MYOG,表明它可以调节妊娠期间母体肌肉的生长和再生(图6J)。
综上所述,这些结果表明,在EP和MP时,PC在多个组织中的持续增加(图5A)可能在EP期间具有调节器官生长和再生的功能作用,但PC的这些作用在LP期间减弱。
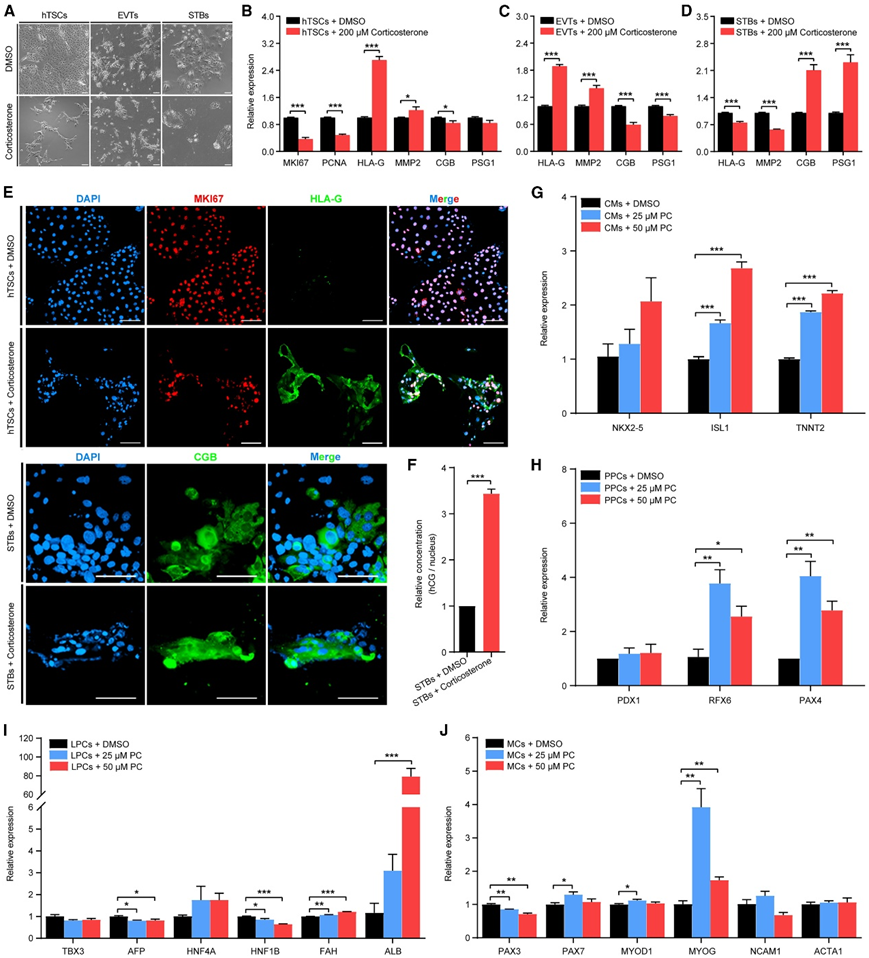
图6. 皮质酮和棕榈酰肉碱对人体组织祖细胞的功能影响。
(A) 相差图像显示用 DMSO 和 200 μM 皮质酮处理后人滋养层干细胞 (hTSC)、绒毛外滋养层 (EVT) 和多核合体滋养层 (STB) 的形态。(B)用 DMSO 和 200 μM 皮质酮处理后,对 hTSC 中MKI67和PCNA、HLA-G和MMP2以及CGB和PSG1的mRNA 表达水平。(C)用 DMSO 和 200 μM 皮质酮处理后,对 EVT 中HLA-G和MMP2以及CGB和PSG1的 mRNA 表达水平进行实时定量 PCR 分析。(D)用 DMSO 和 200 μM 皮质酮处理后,对 STB 中HLA-G和MMP2以及CGB和PSG1的 mRNA 表达水平进行实时定量 PCR 分析。(E)用 DMSO 和 200 μM 皮质酮处理后,hTSC 中的 Ki67 和 HLA-G 以及 STB 中的 CGB 的免疫染色。(F)用 DMSO 和 200 μM 皮质酮处理后,用酶联免疫吸附测定 (ELISA) 测定每个细胞核产生和分泌的人绒毛膜促性腺激素 (hCG)糖蛋白的相对浓度。(G)用 DMSO、25 和 50 μM 棕榈酰肉碱 (PC) 处理后,对心肌细胞 (CM) 中NKX2-5、ISL1和TNNT2的 mRNA 表达水平进行定量实时 PCR 分析。(H)用DMSO、25和50μM棕榈酰肉碱(PC)处理后胰腺祖细胞(PPC)中PDX1、RFX6和PAX4的mRNA表达水平的实时定量PCR分析。(I)用 DMSO、25 和 50 μM 棕榈酰肉碱 (PC) 处理后,对肝祖细胞 (LPC) 中TBX3、AFP、HNF4A、HNF1B、FAH和ALB mRNA 表达水平。
06
猴和人母体血清代谢组数据的比较
为了验证怀孕猴代谢组学数据集对人类的可翻译性,他们将怀孕猴血清数据与公开的人类母体血液数据进行了比较。在本项研究的猴血清样本中检测到 20 种上调的人类血液代谢物,其中 17 种在至少一个妊娠阶段上调(图 7 A)。在项研究的猴血清样本中检测到 32 种下调的人类血液代谢物,其中 30 种(93.75%)在至少一个妊娠阶段下调(图 7 B)。
此外,他们在一项随机盲法研究中,通过 LC-MS 测量了正常孕妇和 PE 患者母体血清中的皮质酮和皮质醇。令人惊讶的是,他们观察到PE患者的血清皮质酮显著降低(图7C)。相比之下, PE 患者的血清皮质醇丰度变化很大,平均下降幅度较小(图 7D),这表明母体皮质酮缺乏可能有助于 PE 的临床诊断。
众所周知,促炎细胞因子肿瘤坏死因子α (TNF-α)和白细胞介素8 (IL-8)在PE患者中显著升高,例如,他们的血清和胎盘,导致一系列影响,最终导致PE发生,在本项研究的PE队列中也证实了这种促炎现象(图7E-F)。
LC-MS显示,经依托咪酯(Eto)和metyrapone (Met)治疗后,hTSC、evt和stb中的皮质酮显著降低,与预期一致。他们的研究结果进一步表明,Eto和Met均增加了hTSC、evt和stb中TNF-α和IL-8的表达(图7G-L),表明妊娠期间皮质酮缺乏促进滋养细胞炎症,导致pe样的促炎状态。
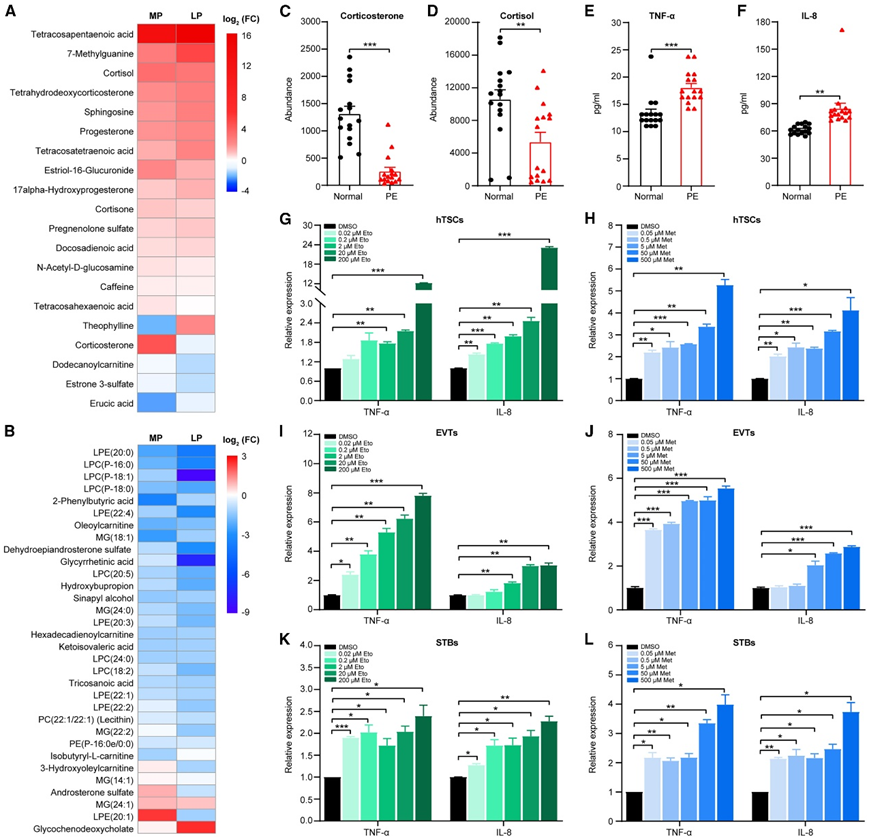
图7. 猴和人母体血清代谢组数据的比较,以及母体皮质酮、PE 和人滋养层细胞炎症之间的功能联系。
(A) 热图显示MP 和 LP 中猴血清中代谢物。(B) 热图显示MP 和 LP 中猴血清中代谢物。(C) 正常孕妇和先兆子痫 (PE) 患者的母体血清皮质酮丰度。(D) 正常孕妇和肺栓塞患者的母体血清皮质醇丰度。(E)正常孕妇和 PE 患者血清促炎细胞因子TNF-α的酶联免疫吸附测定 (ELISA) 分析。(F)正常孕妇和PE患者血清促炎细胞因子IL-8的ELISA分析。(H)用 DMSO 和甲吡酮(Met,0.05-500 Μm)处理后 hTSC 中TNF-α和IL-8 mRNA 表达水平的实时定量 PCR 分析。(I) DMSO 和依托咪酯 (Eto, 0.02–200 μM) 处理后 EVT 中TNF-α和IL-8 mRNA 表达水平的实时定量 PCR 分析。(J) 用 DMSO 和甲吡酮(Met,0.05-500 μM)处理后 EVT 中TNF-α和IL-8 mRNA 表达水平的实时定量 PCR 分析。(K)用 DMSO 和依托咪酯(Eto,0.02-200 μM)处理后,对 STB 中TNF-α和IL-8 mRNA 表达水平进行定量实时 PCR 分析。(L)用 DMSO 和甲吡酮(Met,0.05-500 μM)处理后,对 STB 中TNF-α和IL-8 mRNA 表达水平进行实时定量 PCR 分析。
+ + + + + + + + + + +
结 论
本项研究利用食蟹猴构建了一个全面的多组织代谢组图谱,分析了妊娠期间 23 个母体组织的 273 个样本。随着妊娠的进展,组织之间的代谢耦合下降。灵长类动物怀孕期间发生重塑的核心代谢途径包括类固醇生成、脂肪酸代谢和花生四烯酸代谢。本项研究揭示了 91 种妊娠适应性代谢物在 23 个组织中持续变化,在人类细胞模型和患者样本中验证了它们的作用。皮质酮和棕榈酰肉碱分别调节胎盘成熟和母体组织祖细胞,对母体先兆子痫、糖尿病、心脏肥大以及肌肉和肝脏再生具有影响。此外,本项研究发现皮质酮缺乏会诱发先兆子痫样炎症,表明该图谱具有潜在的临床价值。
+ + + + +



 English
English


