文献解读|Cell Host Microbe(20.6):母亲妊娠期糖尿病与男性后代肠道微生物组成改变和头围异常有关
✦ +
+
论文ID
原名:Maternal gestational diabetes mellitus associates with altered gut microbiome composition and head circumference abnormalities in male offspring
译名:母亲妊娠期糖尿病与男性后代肠道微生物组成改变和头围异常有关
期刊:Cell Host & Microbe
影响因子:20.6
发表时间:2024.07.01
DOI号:10.1016/j.chom.2024.06.005
背 景
肠道微生物群对母婴围产期健康至关重要,在怀孕期间,宿主因素(例如激素水平的变化)会重塑肠道微生物群。妊娠晚期粪便的炎症和能量含量更高,宿主代谢与代谢综合征相似。妊娠期糖尿病(GDM)是全世界妊娠期间的主要并发症,GDM对母亲或婴儿微生物组轨迹的影响仍不清楚。
实验设计
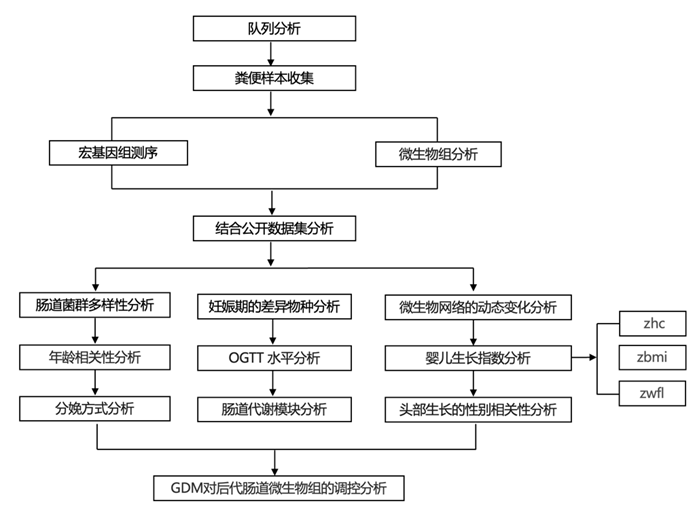
结 果
01
妊娠期糖尿病妇女及其后代的微生物多样性和组成发生改变
MOMmy(母婴微生物群传播及其与婴儿长期健康的联系)研究是一项来自中国香港的前瞻性纵向出生队列研究。在 MOMmy 队列中的 981 名女性中,有 90 名诊断患有 GDM。本研究共纳入 535 名参与者,包括 269 名孕妇(90 名患有 GDM,179 名正常)和 266 名婴儿(90 名由患有 GDM 的母亲所生,176 名由正常母亲所生)(图 1 A)。研究团队对来自 264 对母婴的 1566 个粪便样本进行了宏基因组测序,与正常女性相比,GDM 女性在妊娠期 (MG)1 和 2 的肠道菌群丰富度和系统发育多样性显著降低,但在MG3 时则没有发生降低(图 1B-C)。与妊娠期 MG2 或 MG1 相比,GDM 组的丰富度和系统发育多样性在MG 3 时增加,但在正常组中没有增加(图 S1A-B)。
此外,在调整所有 269 名受试者或仅 179 名正常女性的孕前超重后,年龄较大与细菌丰富度和系统发育多样性较低有关(图 S1 C)。MG1 的肠道微生物组丰富度与高龄育龄和 GDM 发展有关(图 S1 D)。较高的肠道细菌丰富度和系统发育多样性对 30 岁以上母亲的 GDM 发展具有保护作用(图 S1 E)。令人惊讶的是,GDM 母亲所生的婴儿肠道细菌表现出更高的丰富度和系统发育多样性,且在婴儿月龄(BM) 2 到 BM12 之间有差异(图1B-C)。
物种水平的主坐标分析 (PCoA) 显示,在调整年龄和孕前 BMI 并按 3 个妊娠期分层后,与正常母亲相比,GDM 患者的整体肠道菌群结构发生了改变(图 1 D),尤其是 MG2(图S1F-H)。与对照组相比,GDM 母亲所生婴儿在第一年肠道菌群的 β 多样性没有差异。剖腹产分娩在婴儿出生后的第一年显著影响了婴儿的肠道微生物组(图 1 E)。
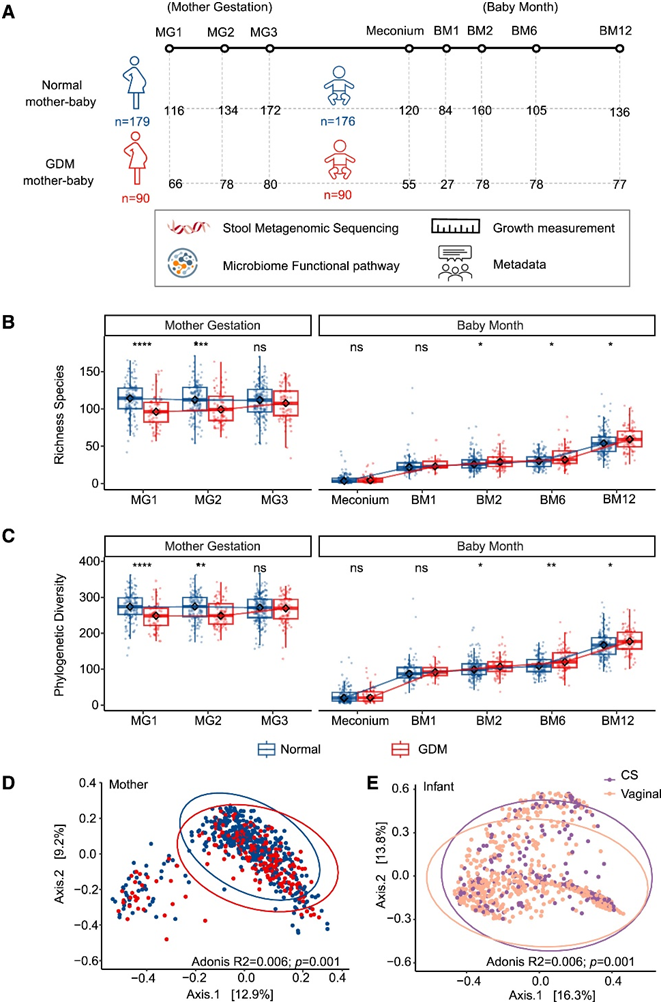
图1. MOMmy 队列中 264 对母婴对的纵向宏基因组图谱。
(a) 研究设计。(b-c) 微生物 α 多样性:在较晚诊断出 GDM 的母亲中,MG1 和 MG2 的丰富度和系统发育多样性较低。 (d) 母体微生物β多样性:物种水平的PCoA分析显示,GDM母亲与正常母亲之间存在显著差异。(e) 婴儿微生物组 β 多样性分析。
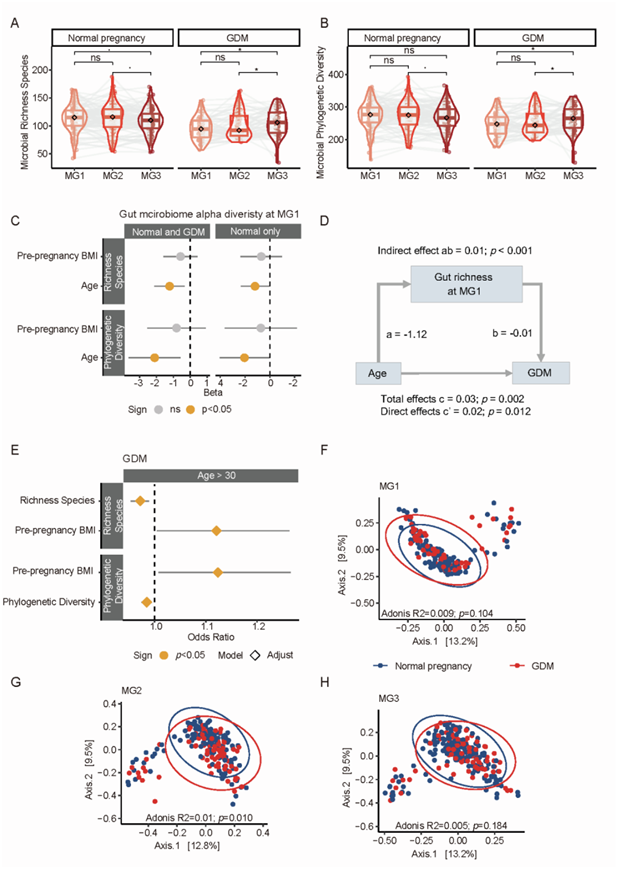
图S1. GDM妊娠期和正常妊娠期间肠道微生物组α和β多样性的变化。
(A-B)妊娠期微生物α多样性动态变化。(C)怀孕年龄越长,细菌丰富度和系统发育多样性越低。(D) MG1期肠道丰富度介导晚育对GDM发展的风险效应。(E)敏感性分析表明,较高的肠道细菌丰富度或系统发育多样性可能对30岁以上孕妇的GDM发育有保护作用。(F-H)微生物β多样性分析。
02
怀孕期间肠道微生物群的部分趋同与适应激素变化有关
在同一受试者中,MG3-MG2的肠道菌群相似性高于MG3-MG1,并且在正常妊娠组和GDM组中,MG2-MG2或MG3-MG3的相似性均高于MG1-MG1,这可能反映了激素的变化(图S2A-B),在正常组的三个妊娠期检测到差异物种(图2A)。与MG1相比,在MG2和MG3期间,两种产丁酸菌(Flavonifractor plautii 和 Lawsonibacter saccharolytic)、一种胆汁耐受菌 (Bilophila wadsworthia) 和Clostridium citroniae的相对丰度均增加(图S2C-E)。在微生物胎龄模型中,收集的样品的胎龄(周)与预测的微生物胎龄呈正相关(图2B)。Bilophila wadsworthia和Flavonifractor plautii均纳入该模型的前20个重要变量中(图S2F)。
孕妇体内的雌激素和孕激素会急剧增加,羟基类固醇脱氢酶 (HSD) 参与激素代谢。参与胆汁酸代谢的关键酶 7-alpha- HSD 在正常妊娠或 GDM 妊娠期间均有所增加(图 2C),这与胆汁耐受细菌(Bilophila wadsworthia)的增加一致。此外,与 MG1 相比,3-氧代-5-α-类固醇 4-脱氢酶(受体)(能够将孕酮转化为其相应的 5-α-3-氧代类固醇)在 MG2 中趋于增加(图 2 D)。这些结果表明,妊娠晚期肠道微生物群部分趋同,这可能与适应激素变化有关。
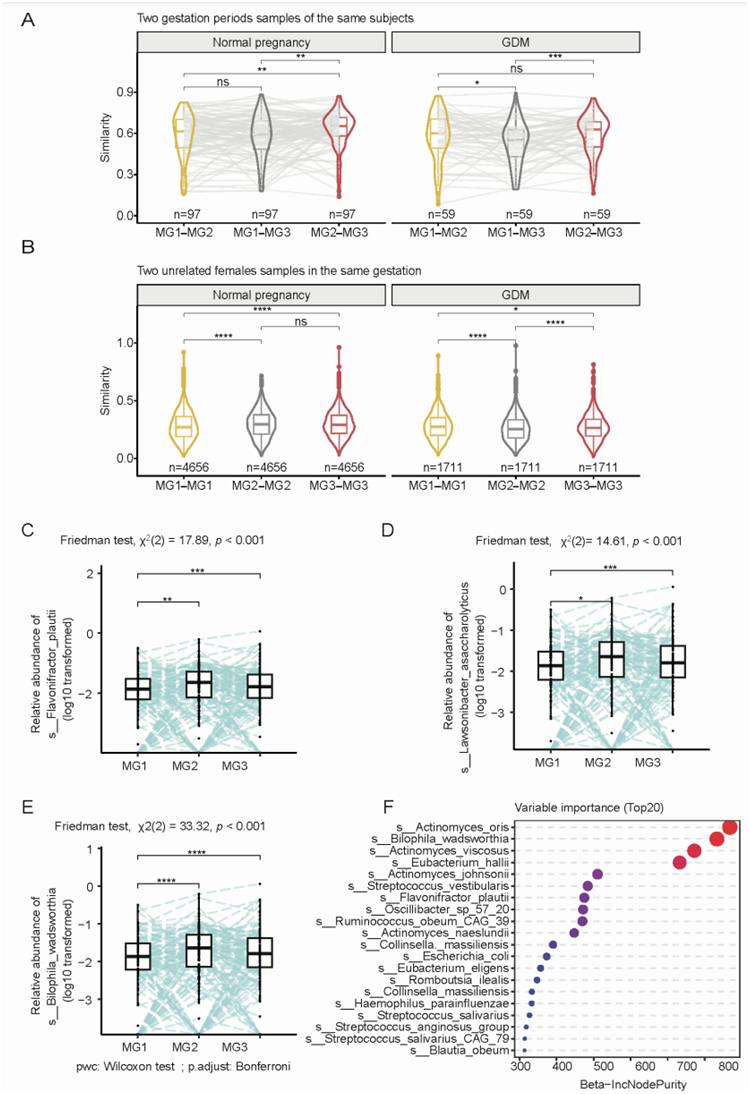
图S2. GDM受试者与正常人肠道菌群组成。
(a) 正常孕妇(左)和GDM孕妇(右)两组相同受试者妊娠期样本的肠道微生物组相似性。(b) 正常孕妇(左)和GDM孕妇(右)在相同妊娠期的两名无亲缘关系的女性的肠道微生物组相似性。(c-e) 3种细菌的相对丰度在3个妊娠期发生变化。(f) 正常妊娠期间微生物胎龄模型的前20个重要变量。
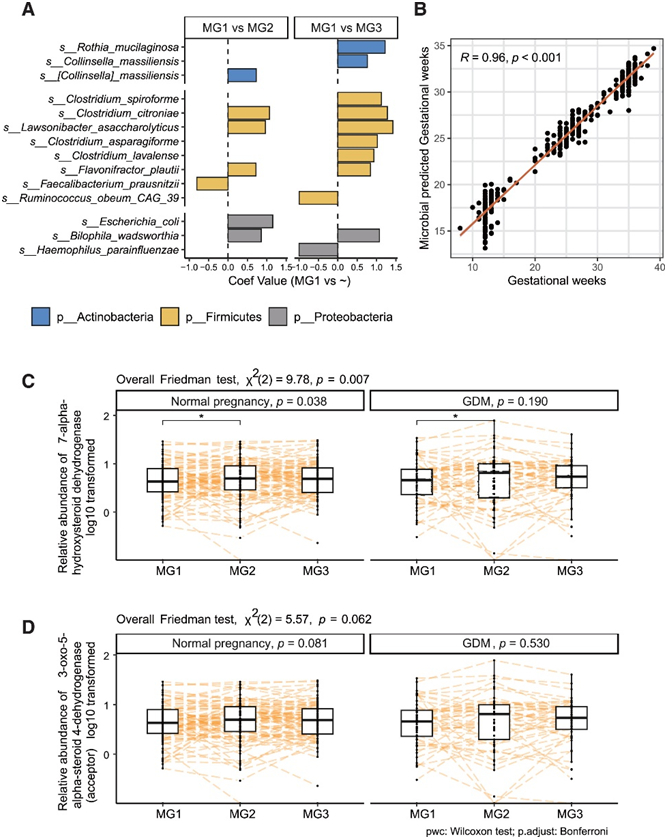
图2. 妊娠期间肠道微生物群的部分趋同与适应激素变化有关。
(a) 正常孕妇体内 MG2/MG3 与 MG1 之间的差异物种。(b) 正常妊娠中微生物预测的妊娠周数与妊娠周龄。(c-d) 两种肠道羟基类固醇脱氢酶的相对丰度在三个妊娠期发生变化。
03
GDM 抑制了母体肠道微生物群的发展轨迹
接下来,他们比较了 GDM 组和妊娠期间正常组之间的纵向差异物种,共鉴定出 21 个物种(图 3 A)。进一步使用偏差校正的微生物组组成分析 (ANCOM-BC) 进行敏感性分析。GDM 中消耗的物种相对丰度(包括MG1时的Akkermansia muciniphila、Coprococcus eutactus和Enterorhabdus caecimuris,以及MG3 时的Dialister sp CAG 357)与 2 小时口服葡萄糖耐量测试 (OGTT) 水平呈负相关(图 3 B)。
此外,GDM受试者肠道中7种肠道代谢模块(GMM)纵向增加,3种肠道代谢模块减少(图3C)。在MG1处的两个富集的能量代谢GMM,包括MF0071戊糖磷酸途径(非氧化支)和MF0065双歧杆菌旁路,与2小时口服葡萄糖耐量测试 (OGTT) 呈正相关,也许是由于肠道微生物吸收了过多的能量。总之,肠道菌群失调与葡萄糖耐受不良相关,并影响孕妇妊娠期间的代谢健康。
基于 MG1 时所有肠道细菌种类和宿主风险因素的组合预测模型可以区分妊娠后期的 GDM 发病,受试者工作特征曲线下面积 (AUC) 为 0.70。GDM 风险因素和肠道微生物因素的组合可以为 GDM 风险分层提供更高的早期鉴别能力。
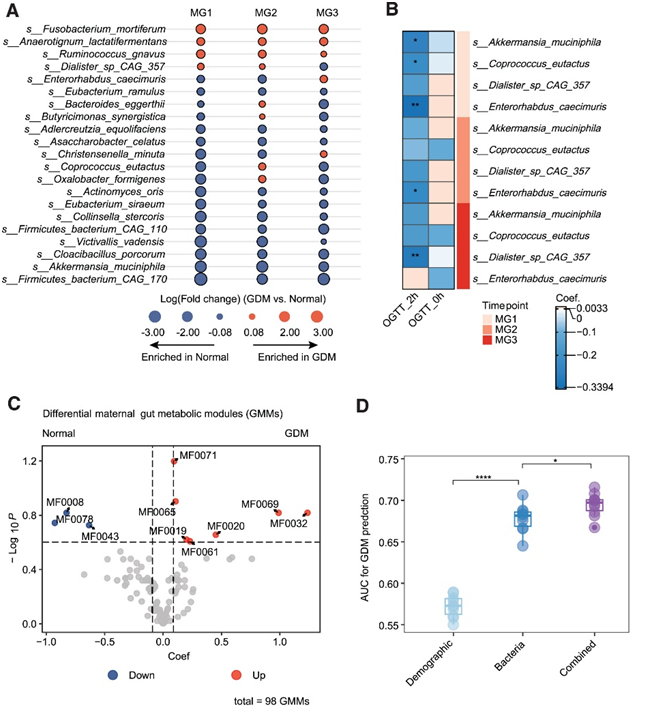
图3. GDM对女性肠道菌群的影响及其与妊娠期宿主血糖状态的关系。
(a) 妊娠期 GDM 与正常孕妇之间的纵向差异物种。(b) GDM 相关物种与各妊娠期 OGTT 之间的关联。(c) 妊娠期糖尿病 (GDM) 和正常孕妇妊娠期间肠道代谢模块 (GMM) 纵向差异火山图。(d) 箱线图显示基于训练集中三个向量的 GDM 预测的 AUC 分数。
04
GDM 影响婴儿肠道微生物组的分类和网络以及菌株传播
GDM 母亲所生婴儿的肠道微生物组比 BM2 至 12 的同类菌群表现出更高的丰富度和系统发育多样性,尤其是在厚壁菌门中(图 4 A)。在纵向分析中,15 种婴儿细菌特征与 GDM 相关,尤其是GDM母亲所生婴儿肠道中富含梭菌和乳杆菌(图 4 B)。为了揭示GDM婴儿和对照组婴儿的微生物共生网络,他们分析了细菌属生态相互作用(图4C)。首先,两组间的属的接近中心性明显不同(图4D)。GDM 婴儿肠道群落中的三个富集属(Clostridium、Gemella和Lactobacillus)在 GDM 婴儿肠道微生物网络中具有更高的紧密中心性,这表明了这些分类单元的重要性。GDM 耗竭的属(Rothia)在正常婴儿的微生物网络中具有更高的紧密中心性(图 4 E)。其次,数百个边是正常或GDM婴儿特有的,几乎没有重叠(图4F)。他们检测了四个差异属(GDM 和正常婴儿之间)与其他属之间的相互作用。与对照组相比,在GDM婴儿肠道中可以检测到更多的GDM婴儿差异属相关边,尤其是3个富集的属(图4 G)。值得注意的是, GDM婴儿网络中胎粪中的Gemella和Clostridium呈正相关。同样,正常母亲所生婴儿胎粪中的Clostridium与Klebsiella呈正相关。此外, Clostridium与3个属(包括BM1或BM2时的双歧杆菌、拟杆菌和柯林斯菌)呈负相关,并且在GDM组中,这3个潜在有益属的总丰度在BM6和BM12时显著降低(图4 H)。生态网络结果表明,GDM不仅影响婴儿肠道微生物组中的分类单元,还影响肠道微生物的相互作用。
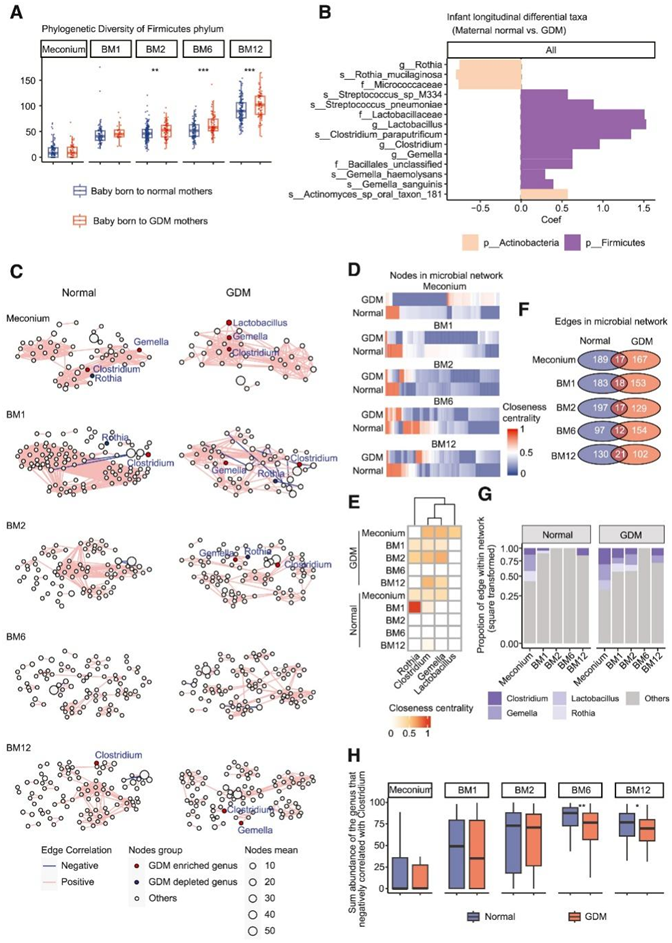
图4. GDM 影响婴儿肠道微生物组的分类和网络。
(a) 婴儿微生物群落厚壁菌门的系统发育多样性。(b) 出生后第一年,GDM 婴儿与正常母亲所生婴儿之间的纵向差异分类群。(c) GDM 影响生命早期属级微生物网络的动态变化。(d) GDM组和正常组婴儿微生物网络中节点的中心性。(e) 每个微生物网络内四个分化属的中心性。(f) GDM 组和正常组之间的婴儿微生物网络分析。(g) 每个微生物网络内四个差异属相关边的比例。 (h) BM6 和 BM12 时婴儿肠道中该属的总相对丰度与梭菌属呈负相关。
05
肠道微生物组与妊娠期糖尿病对婴儿出生后第一年生长指数的影响
早期肠道微生物群可能影响儿童的生长发育,因此,他们对导致 GDM 婴儿不同生长的差异细菌种类进行了分析。此处,GDM母亲所生婴儿的特点是,在 BM12 时,头围年龄 Z 分数(zhc)、身体质量指数(BMI) Z分数 (zbmi) 和体重身长Z分数 (zwfl) 大于对照组(图 5 A)。GDM 母亲所生婴儿的头围增长率(在 BM1 和 BM12 之间计算)显著更高,这表明 GDM 婴儿在出生后第一年内头部生长加速。在单变量分析中,只有 GDM 和孕前母亲 超重或肥胖(OWOB)与 BM12 生长结果相关;具体来说,患有 OWOB 和 GDM 的母亲所生的婴儿具有更高的 zwfl、zbmi 和 zhc。
根据婴儿的性别进行分组后,只有GDM组的男婴在 BM12 时的zhc 大于对照组(图 5 B),这意味着存在性别依赖性效应。同样,GDM 对男性后代的肠道微生物组和通路具有明显的纵向影响(图 5C-D)。GDM 母亲所生男婴的特征是Clostridium paraputrificum(厚壁菌门)增多,而 GDM 母亲所生女婴的特征是放线菌属的Actinomyces sp S6 Spd3增多(图 5 C)。Clostridium sp CAG 242的相对丰度与BM12时男婴的zhc呈正相关,但与女婴无关。此外,在所有婴儿和仅有男婴群体的数据集中,BM12时的Clostridium paraputrificum与BM12时的三个较高的婴儿生长指数呈显著正相关(图5E),但与女婴群体无关。
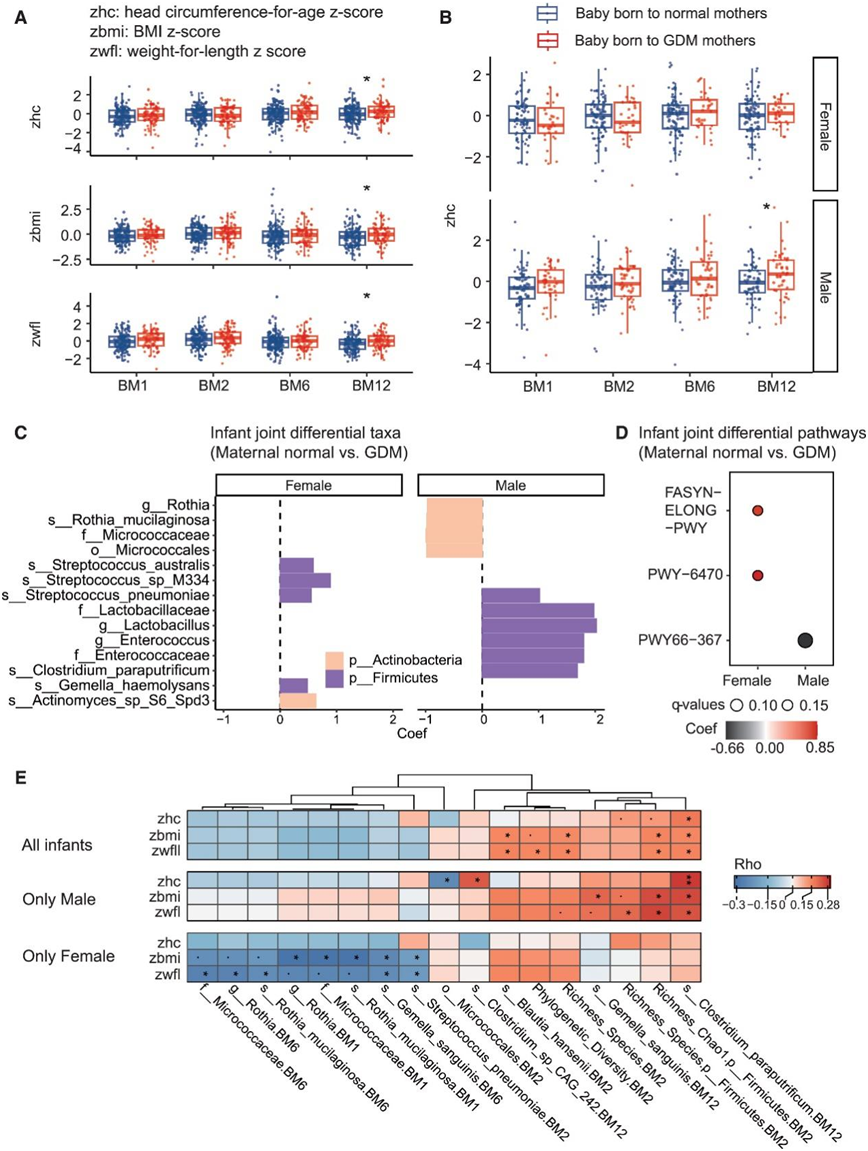
图5. 肠道微生物组与GDM对婴儿出生后第一年生长指数的影响相关。
(a) GDM 对出生后第一年婴儿生长指标的影响。(b) GDM 对婴儿性别分组后第一年婴儿 zhc 指数的影响。 (c-d) GDM 婴儿和正常母亲所生婴儿在出生后第一年内对性别进行分组后纵向差异分类群和功能途径。 (e) GDM 婴儿的差异性细菌特征与生长指数之间的相关性。
06
肠道微生物群神经活性潜力与 GDM 后代头部生长的性别相关性
他们利用肠-脑模块 (GBM) 来确定神经活性化合物的代谢是否与头部发育存在性别依赖关系。与正常母亲相比,在怀有男性胎儿的 GDM 母亲中检测到了几种差异KEGG Orthology (KO)(10 个耗竭和 2 个富集)和GBM(4个耗竭和 2 个富集)(图 6 A-B)。在怀有男婴的 GDM 母亲中,MGB043(乙酸合成 I)、MGB047(乙酸降解)和 MGB007(谷氨酸合成 II)发生耗竭(图 6 B)。在怀有男婴的 GDM 母亲中,促进MGB047(乙酸盐降解)的物种的总相对丰度较低,排名第二的是siraeum,也是GDM母亲中减少的物种(图 6C-D)。与正常孕妇相比,GDM孕妇的肠道微生物组中只有1个参与GABA合成II的KO (K00137)富集(图6A)。
在GDM组的男婴的肠道微生物组中,与色氨酸合成相关的K01658发生耗竭,其在胎粪样本中的丰度仅在男性后代中与BM12时的zhc呈负相关,而在女婴中则没有(图6E)。相反,与对照组的婴儿相比,参与异戊酸合成I(KADH途径)的K10806在GDM组的男婴中富集(图6A),其在胎粪样本中的丰度与12个月龄的zhc呈正相关,而在女婴中则没有(图6E)。在GDM组的女婴中,GBM的丰富度在BM6和BM12时高于对照组(图6F),这些结果表明 GDM 会影响其后代具有神经活性潜力的肠道微生物群。
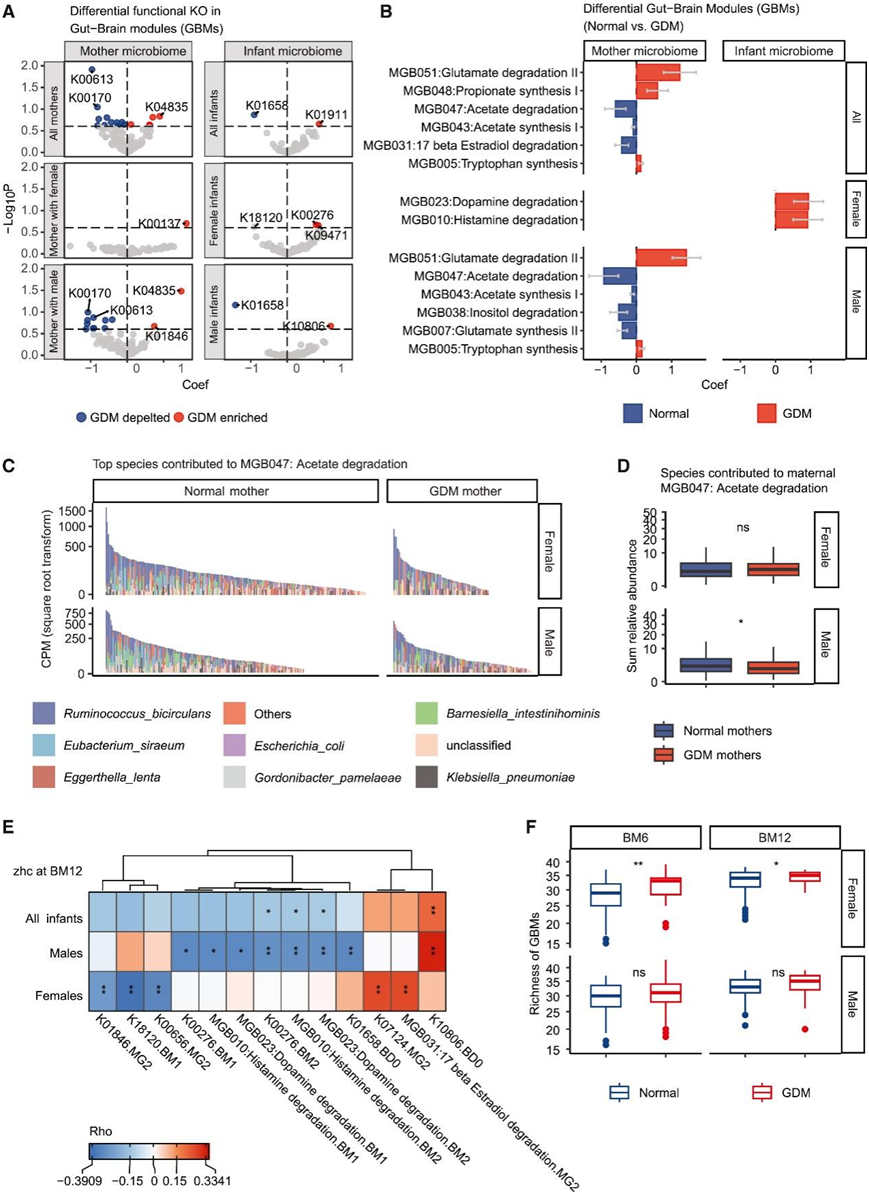
图6. 肠道菌群神经活性潜力与 GDM 后代头部生长的性别相关性。
(a) GDM 和正常母亲在怀孕期间或出生后第一年婴儿的肠脑模块 (GBM) 纵向差异 KO 火山图。 (b) 妊娠期糖尿病 (GDM) 和正常母亲在怀孕期间或出生后第一年婴儿的纵向差异性。 (c) 使用物种分层数据,显示母体肠道中对 MGB047 有贡献的细菌种类。(d) 母体肠道中对 MGB047 有贡献的物种总丰度。(e) GDM 组中差异性 GBM 特征与所有婴儿、仅男婴或仅女婴 BM12 时的婴儿 zhc 之间的相关性。(f) 肠道微生物群中 GBM 的丰富度。
+ + + + + + + + + + +
结 论
本项研究发私信GDM 母亲在妊娠期间具有独特的微生物组多样性和组成。GDM 会影响后代具有神经活性潜力的肠道微生物群。此外,梭菌与男性后代 12月龄时的头围较大呈正相关。怀有男性胎儿的 GDM 母亲的肠道微生物组显示出肠脑模块的耗竭,包括乙酸合成 I 和降解以及谷氨酸合成 II。GDM 组的女婴的肠道微生物组具有更高的组胺降解和多巴胺降解。总之,这些结果表明,GDM 会影响母亲和婴儿的肠道成分,这与婴儿头部的生长有关。
+ + + + +



 English
English


