文献解读|Nat Cell Biol(21.30):低输入脂质组学揭示早期哺乳动物胚胎发育过程中的脂质代谢重塑
✦ +
+
论文ID
原名:Low-input lipidomics reveals lipid metabolism remodelling during early mammalian embryo development
译名:低输入脂质组学揭示早期哺乳动物胚胎发育过程中的脂质代谢重塑
期刊:Nature Cell Biology
影响因子:21.30
发表时间:2024.02.01
DOI号:10.1038/s41556-023-01341-3
背 景
脂质对于能量储存、膜结构和细胞信号传导是不可或缺的。然而,哺乳动物早期胚胎发育中各类内源脂质的动态变化尚未得到系统的表征。
实验设计
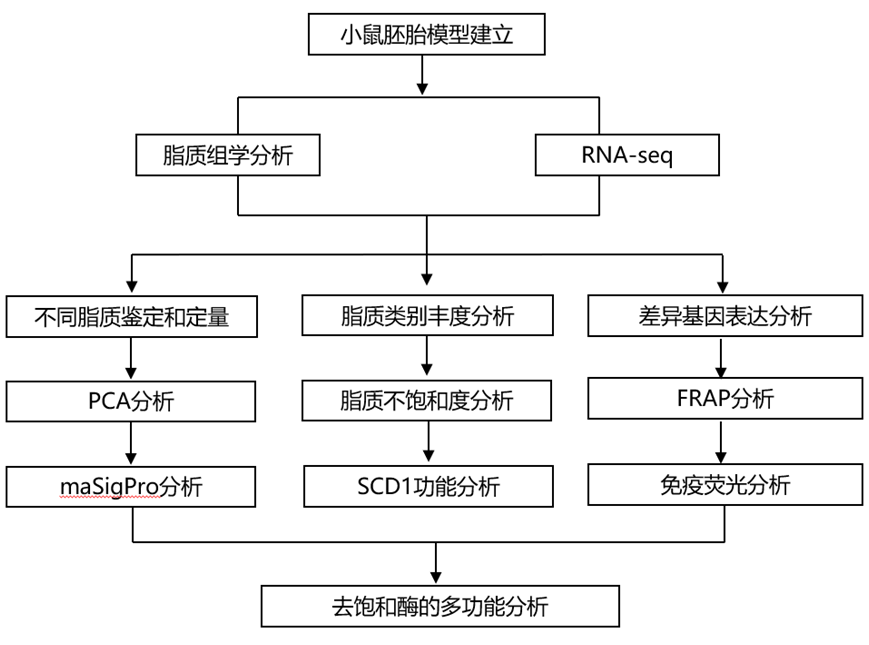
结 果
01
小鼠植入前胚胎发育过程中阶段特异性脂质组学特征
研究者团队首先建立了小鼠胚胎模型,并在指定时间收集了 120 个中期 II (MII) 卵母细胞、受精卵以及两细胞、四细胞、八细胞和囊胚期胚胎。采用基于异丙醇(IPA)的提取方法,然后进行高效液相色谱质谱联用(HPLC-MS)分析(图1a,图S1a)。主成分分析(PCA)显示,尽管存在组间方差,但每个阶段的样本都聚集在一起并与其他阶段分开(图1b),这表明不同的胚胎阶段表现出不同的脂质组学特征。特别是囊胚阶段与所有其他阶段的分离更加明显,这表明与其他发育时期相比,该时期的脂质组成发生了重大变化。共检测到23类332种脂质(图1c,图S1b-c),包括甘油磷脂(磷脂、缩醛磷脂和溶血磷脂)、甘油脂[二酰基甘油(DAG)和三酰基甘油(TAG)]、鞘脂[鞘磷脂(SM)和神经酰胺 (Cers)]和胆固醇。
然后,他们应用 maSigPro 方法来识别脂质聚类在六个发育阶段的不同趋势。总的来说,他们观察到五个不同的脂质聚类代表不同的调节趋势(图S1d-e)。其中,聚类1由发育过程中减少的脂质组成,主要包括磷脂酰乙醇胺(PE)和磷脂酰肌醇(PI),这表明这些脂质的富集可能对卵母细胞活化和受精很重要。聚类 2 代表卵母细胞中丰富的脂质,受精后耗尽,并在囊胚阶段逐渐补充。长链脂肪酸磷脂酰胆碱(PC)在该聚类中占主导地位,考虑到它们是质膜的主要成分,它们在囊胚阶段的富集意味着在此期间存在动态膜重塑。聚类3 代表囊胚阶段更具体需要的脂质。除了某些 PC 之外,该聚类还包括 SM,它们可能对于膜上微结构域的形成至关重要。聚类4和聚类5包括从四细胞阶段甚至两细胞阶段逐渐出现的脂质,这表明某些类型的新生脂质的生物合成在受精卵基因组激活后立即发生。
总体而言,Shannon多样性指数(衡量一个群体中物种的均匀性)从卵母细胞和受精卵阶段到囊胚阶段呈增加趋势。这一结果表明,在发育过程中,不同脂质种类变得更加多样化和均匀分布(图1d),可能是为了适应日益复杂的生物过程。
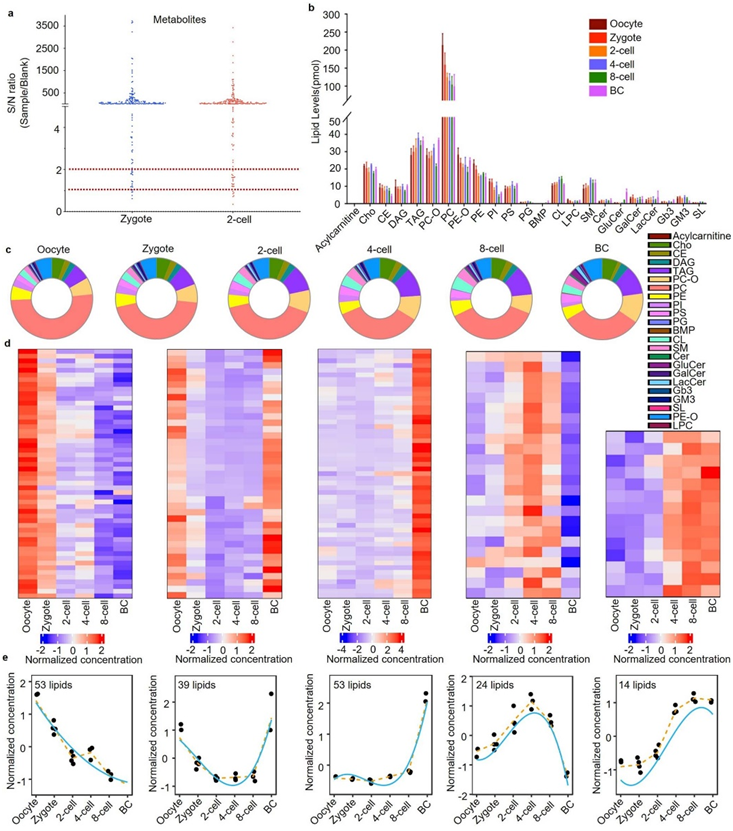
图1. 小鼠植入前胚胎发育阶段特异性脂质组学特征。
(a) 胚胎收集和脂质组学实验的示意性工作流程。 (b) 脂质组学分析数据的主成分分析(PCA)。 (c) 热图显示六个发育阶段脂质的相对丰度。 (d) 计算多样性分数以估计每个发育阶段脂质种类的多样性。

图S1. 小鼠植入前胚胎发育中脂质组的动态变化。
(a) 脂质组学实验中总共使用 120 个受精卵和 120 个双细胞胚胎进行胚胎数量分析。(b) 在六个发育阶段通过 LC-MS 量化所有脂质类别的水平。(c)饼图显示每个发育阶段中每种脂质类别的比例。(d) 热图显示了六个发育阶段脂质的不同时间模式。(e) 线性图显示脂质聚类在六个发育阶段的趋势。
02
小鼠植入前胚胎发育过程中个体脂质类别的动态变化支持各种脂质介导的功能
为了了解植入前发育过程中每种脂质类别的动态变化和功能,他们分别分析了各个脂质类别的丰度。甘油磷脂是细胞膜的主要成分,包括PC、PE、PI、磷脂酰丝氨酸(PS)和心磷脂(CL)。其中最主要的是 PC,值得注意的是,其丰度呈现双峰分布,在卵母细胞和囊胚阶段含量较高。此外,更长的不饱和脂肪酰链(PC38-PC42)在囊胚阶段富集(图2a)。pe在卵母细胞中表现出稳定的丰度减少,并且与 PC 不同,它们在囊胚阶段并未充满(图2b)。PC和PE主要存在于质膜的外叶和内叶中;因此,这些结果表明在发育过程中膜成分存在动态重塑。值得注意的是,包含多不饱和脂肪酸(PUFA)的缩醛磷脂(PC Os)在囊胚阶段的丰度显著增加(图2c),而大多数缩醛磷脂磷脂酰乙醇胺(PE Os)的丰度下降,但是少数高度不饱和的脂质未发生明显改变,这些脂质包括PE O-38:7(O-16:1_22:6)和PE O-38:6(O-16:1_22:5)(图2d)。
因此,PC Os和PE Os的动态模式表明它们在维持胆固醇稳态、膜流动性和氧化还原环境中发挥作用,以支持胚胎发育。
接下来,他们分析了 PI 的类别。卵母细胞和受精卵中的水平最高,并在发育过程中逐渐下降,直至八细胞和囊胚阶段(图2e)。鞘脂主要由Cers、SM和糖鞘脂组成,在细胞膜上形成专门的微结构域并促进信号转导。含有胆固醇的 SM 不仅是脂筏的重要细胞结构成分,也是细胞分裂和分化所必需的。大多数SM物种在囊胚阶段变得更加富集(图2f),并且(SM+胆固醇)/PC的比率在此过程中增加(图2g)。该结果与活胚胎的脂筏染色一致(图2h),这表明脂筏的形成增加以在发育过程中容纳胚胎细胞表面上的信号转导分子。
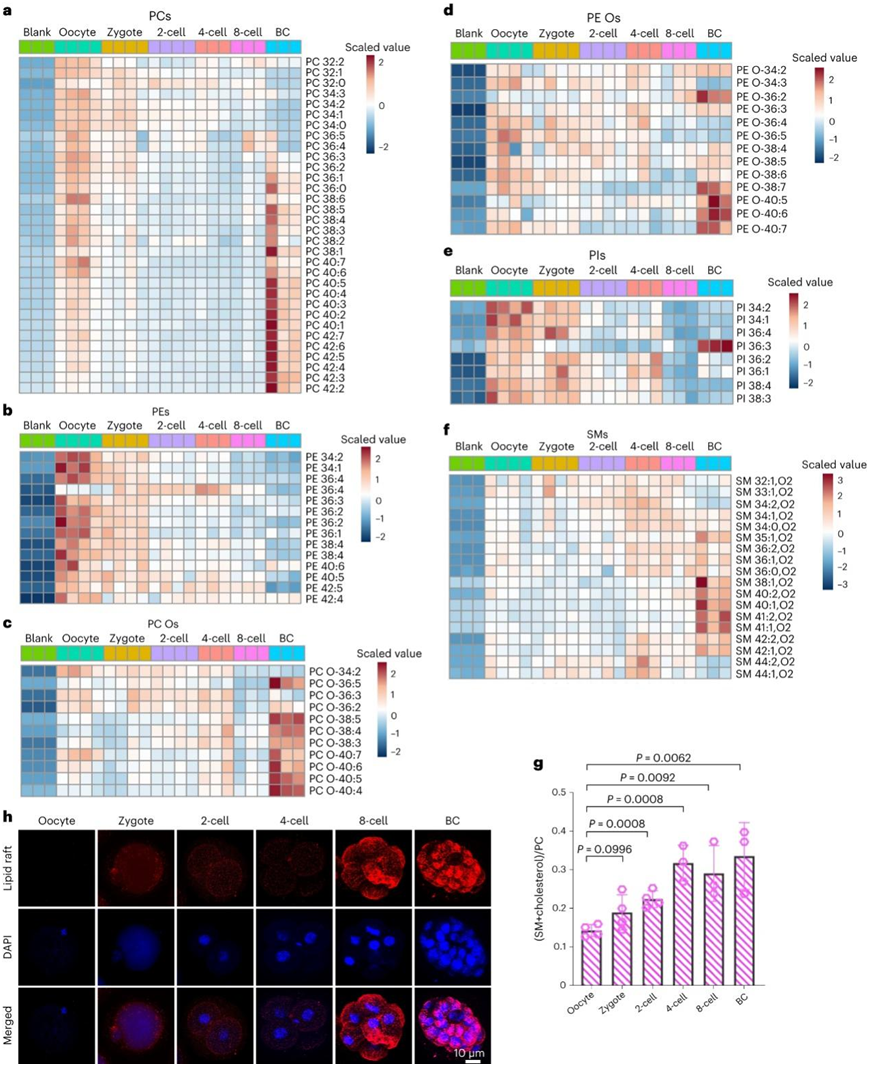
图2. 小鼠植入前胚胎发育过程中各个脂质类别含量的动态变化支持脂质介导的功能。
(a-f) 热图显示了PC、PE、PC Os、PE Os、PI和SM各类物种在六个发育阶段的丰度。(g) (SM+胆固醇)/PC的比值,表示六个发育阶段脂筏的水平。(h) 脂筏染色显示其在胚胎发育过程中的形成。
03
小鼠和人类植入前发育过程中脂质不饱和度增加
细胞膜由具有磷脂的脂质双层组成,并呈现流体状特征。这种灵活的特征促进了通过表面受体感知环境、细胞分裂和分化所必需的细胞形态转变。脂质组学分析结果表明,在植入前发育过程中,总体上碳双键的数量随着烃链长度的增加而增加(图3a)。因此,所有脂质根据其不饱和程度分为三类:将脂质种类的脂肪酸部分中的零碳双键指定为“饱和”;一个或两个双键作为“单饱和和双不饱和”(单+双不饱和);多于两个双键为“多不饱和”。
首先,根据这些类别中发现的多不饱和物种的数量,他们发现 PC、PE、CL 和双(单酰基甘油)磷酸酯 (BMP) 比其他类别更具多不饱和特性。其次,根据相对浓度,PC或PE的多不饱和物种在囊胚中比双细胞胚胎中更富集(图3b)。火山图分析还证实,不饱和脂质如PC 38:6、GluCers和神经酰胺三己糖苷(Gb3s)在囊胚阶段表现出显著增加的水平(图3c)。同样,计算每个发育阶段所有三类脂类的总和显示,单+双不饱和脂类与饱和脂类或多不饱和脂类与饱和脂类的平均比例呈现双峰趋势:在双细胞阶段低,在卵母细胞和囊胚阶段高(图3d)。
个别类别,包括PC(图3e)、lyso-PCs (LPCs)、PC Os、PS、GluCers、硫脂类(SLs),有助于增强两细胞到囊胚发育过程中的不饱和特征。通过绘制单个多不饱和或单+双不饱和脂质的分布也得到了类似的结果(图3f)。最后,脂质代谢基因的转录组学分析也发现,囊胚期的内细胞团 (ICM) 和外层滋养外胚层 (TE)细胞大多富含“不饱和脂肪酸的生物合成”(图3g)。
总而言之,这些数据表明,在胚胎发育过程中,从双细胞阶段到囊胚阶段,不饱和度,特别是磷脂的不饱和度增加。
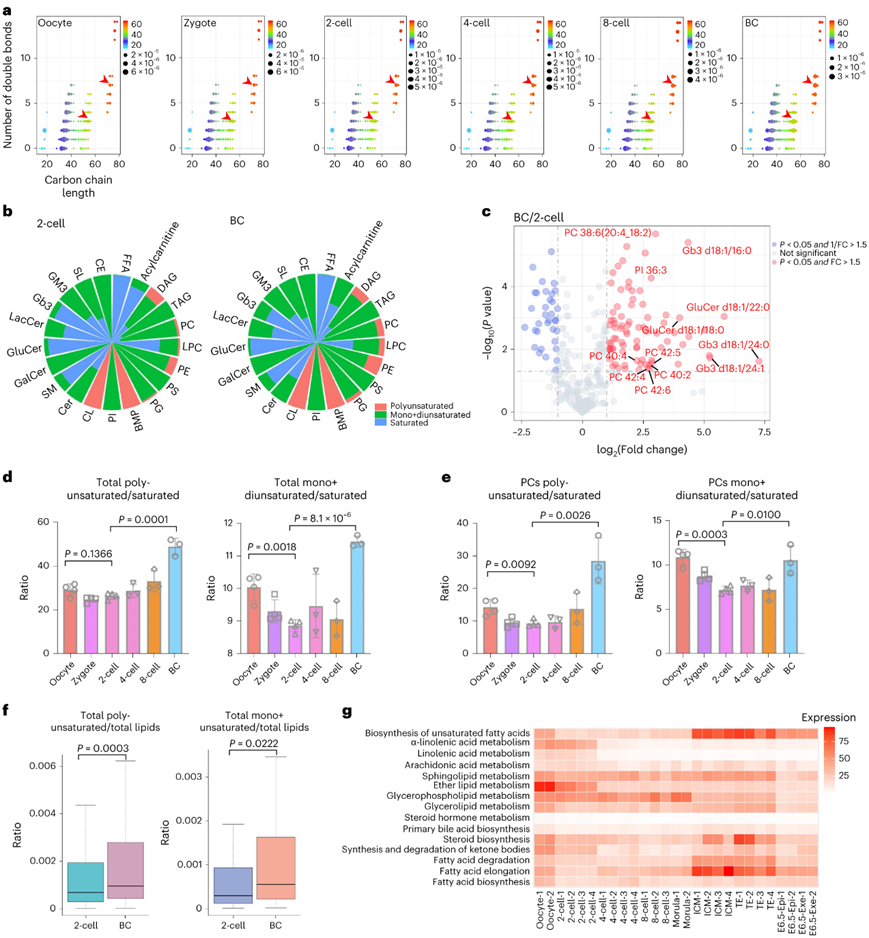
图3. 在小鼠植入前胚胎发育过程中,脂质不饱和度增加。
(a) 气泡图显示小鼠植入前胚胎发育过程中总脂质谱中碳链长度和碳双键数量的变化。 (b) 南丁格尔玫瑰图,说明双细胞和囊胚胚胎中多不饱和、单+双不饱和和饱和脂质种类的浓度总和的分布。(c) 火山图,比较时脂质种类的显著变化。(d) 条形图显示在六个发育阶段中总多不饱和脂质与总饱和脂质以及总单+双不饱和脂质与总饱和脂质的浓度比率。(e) 条形图显示了在六个发育阶段中多不饱和PC与饱和PC以及单+双不饱和PC与饱和PC的浓度比率。 (f) 箱线图显示归一化为饱和加不饱和脂质浓度总和的每种多不饱和脂质种类的水平分布。 (g) 对公开的bulk RNA-seq数据和平均基因表达进行KEGG通路分析,显示了胚胎发育阶段脂质代谢通路的动态变化。
为了探索脂质重塑在小鼠和人类之间的保守程度,他们分析了从人类八细胞胚胎阶段到人类囊胚阶段(在多能状态方面与小鼠囊胚相对应)的脂质组,表现出类似的变化趋势,如PI和PE水平降低,CL和TAG水平升高(图4a),囊胚期不饱和程度增加(图4b)。
为了检查胚泡阶段富集不饱和脂质的来源,他们分析了由 Δ5、Δ6 和 Δ9 酶介导的从头合成途径。其中,Δ9[硬脂酰辅酶A去饱和酶(SCD)]负责形成单不饱和脂肪酸(MUFA),例如棕榈油酸(C16:1)和油酸(C18:1),而Δ5和Δ6酶负责生成多不饱和脂肪酸。
他们检测了C16:0、C18:0、C16:1和C18:1的总水平,并观察到与双细胞胚胎期相比,小鼠囊胚期C18:1含量和C18:1/C18:0比值的增加(图4c-e),单个类别的pi显示出类似的模式(图4f-h)。值得注意的是,在人类胚胎中,C18:1/C18:0和C16:1/C16:0的比值均有所增加(图4i)。这些结果表明SCD1在早期胚胎发育中起作用,油酸可能是小鼠早期胚胎中更主要的产物。

图4. MUFA 水平在小鼠和人类植入前胚胎发育过程中增加。
(a) 热图显示人类八细胞和胚泡胚胎中的脂质水平。 (b) 箱线图显示人八细胞和胚泡胚胎中总脂质中多不饱和脂质的水平总和。 (c-e) 箱线图显示硬脂酸 (C18:0)、油酸 (C18:1)的水平以及油酸/硬脂酸 (C18:1/C18:0) 的比例小鼠双细胞和囊胚期胚胎的总脂质。 (f-h) 条形图显示小鼠双细胞和囊胚阶段 PI 中C18:0、C18:1和 C18:1/C18:0的水平。 (i) 显示人类八细胞胚胎和囊胚胚胎的 C18:1/18:0 比率的箱线图。
04
脂质不饱和度的进一步分析
接下来,他们使用SCD1抑制剂(CAY10566)来确定SCD1在小鼠胚胎发育中的功能(图5a)。当在KSOM完全培养基中培养时,处理过的胚胎表现出囊胚形成率轻度受损(图5b)和囊胚腔面积减小(图5c)。培养中的胚胎可以从培养基中获取脂质。因此,为了避免这个问题,他们使用含有无脂肪酸牛血清白蛋白(BSA)的KSOM培养基和不含BSA的培养基进行了相同的实验。这些培养基中的囊胚形成高度受损,具有明显的形态异常(图5d-f)并且空腔面积显著减少(图5e-g)。这些实验证实了使用SCD1抑制剂的实验中观察到的发育异常(图5h-i)。
他们还验证了Scd1敲低后,C18:1/C18:0 比率降低(图 5j),特别是对于PI(图5k)。在 CAY10566 处理或 siRNA 处理的胚胎中,通过补充油酸可以挽救大多数囊胚的形态异常和发育迟缓(图5l-o)。为了更好地了解Scd1如何影响囊胚形成,他们对经过si Scd1处理的达到囊胚阶段的胚胎进行转录组分析 (RNA-seq) ,显示与 ER 应激相关的基因上调,这一结果与 ER 应激可能由外源补充饱和脂肪酸引起的结果一致(图5p)。与顶端质膜和微管运动相关的基因表达发生下调(图5p),这表明细胞骨架组织(对于顶端结构域形成和极性建立至关重要的过程)可能在八细胞到囊胚发育过程中受损。
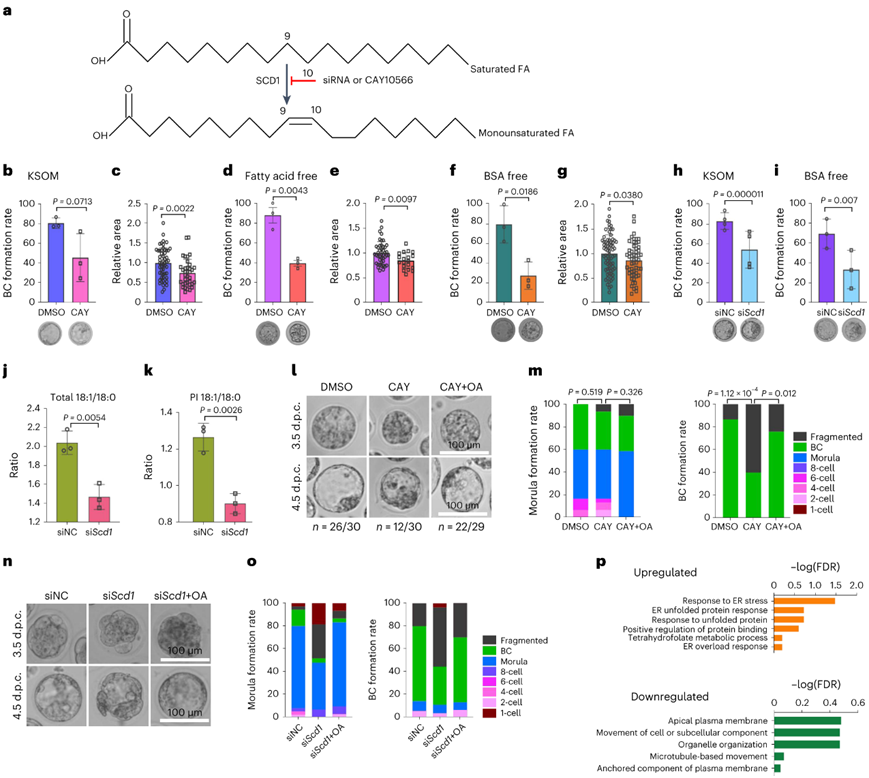
图5. 脂质不饱和度有助于囊胚胚胎的发育过程。
(a) 示意图显示 SCD1 介导 MUFA 合成,以及阻止该过程的方法。(b,d,f) 用二甲亚砜 (DMSO) 或 100 nM CAY10566 (CAY) 处理的胚胎在常规 KSOM 培养基、不含脂肪酸的 KSOM或不含 BSA 的 KSOM 中培养的胚泡形成率。(c,e,g) 用DMSO或CAY10566处理并在常规KSOM培养基、不含脂肪酸的KSOM培养基或不含BSA的KSOM培养基中培养后的囊胚腔面积。(h-i) 敲低Scd1并在常规 KSOM或不含 BSA 的 KSOM 培养基中培养后的囊胚形成率。 (j-k) 条形图显示敲除Scd1后总脂质和 PI的 C18:1/C18:0 比率。(l-n) 用抑制剂或 si Scd1处理的小鼠胚胎在 3.5 或 4.5 dpc 时的代表性图像。(m-o)堆积柱形图,显示用抑制或 si Scd 1处理后处于不同发育阶段的胚胎分数。(p)GO分析。
05
去饱和酶有助于八细胞至囊胚阶段胚胎发育中的膜流动性和细胞骨架组织
他们研究了脂质不饱和度的改变如何导致囊胚期胚胎的缺陷。使用光漂白后荧光恢复(FRAP)分析,发现质膜流动性在卵母细胞阶段后降低,并从两细胞阶段恢复到囊胚阶段(图6a)。值得注意的是, Scd1的抑制导致膜流动性降低,通过补充油酸可以挽救这种情况(图6b)。该结果表明去饱和酶 SCD1 通过介导 MUFA 的脂质不饱和度对膜流动性产生影响。
在早期胚胎发育过程中,角蛋白等细胞骨架成分可以感知内部和外部信号来调节其组织并促进顶端结构域的形成和维持。为了进一步评估脂质去饱和酶 SCD1 对细胞骨架组织的功能,他们对角蛋白 8 (K8) 和角蛋白 18 (K18)进行了免疫荧光分析。他们观察到K8和K18在交配后3.5或4.5天(dpc, 交配后的天数)囊胚中形成了一个密集的网络,并划分了顶端域(图6c-i)。相比之下, CAY10566对Scd1的抑制破坏了K8和K18的有组织定位,将它们的分布转移到胚胎表面上更均匀的模式,并导致细胞-细胞边界处的界面模糊(图6c-g),对细胞数量没有很大影响(图6e-h)。通过敲低Scd1,这些结果得到进一步巩固(图6i-l)。值得注意的是,这可以通过外源补充油酸来挽救(图6c-j),这表明这种脂肪酸去饱和酶在囊胚发育中有助于稳定细胞骨架。
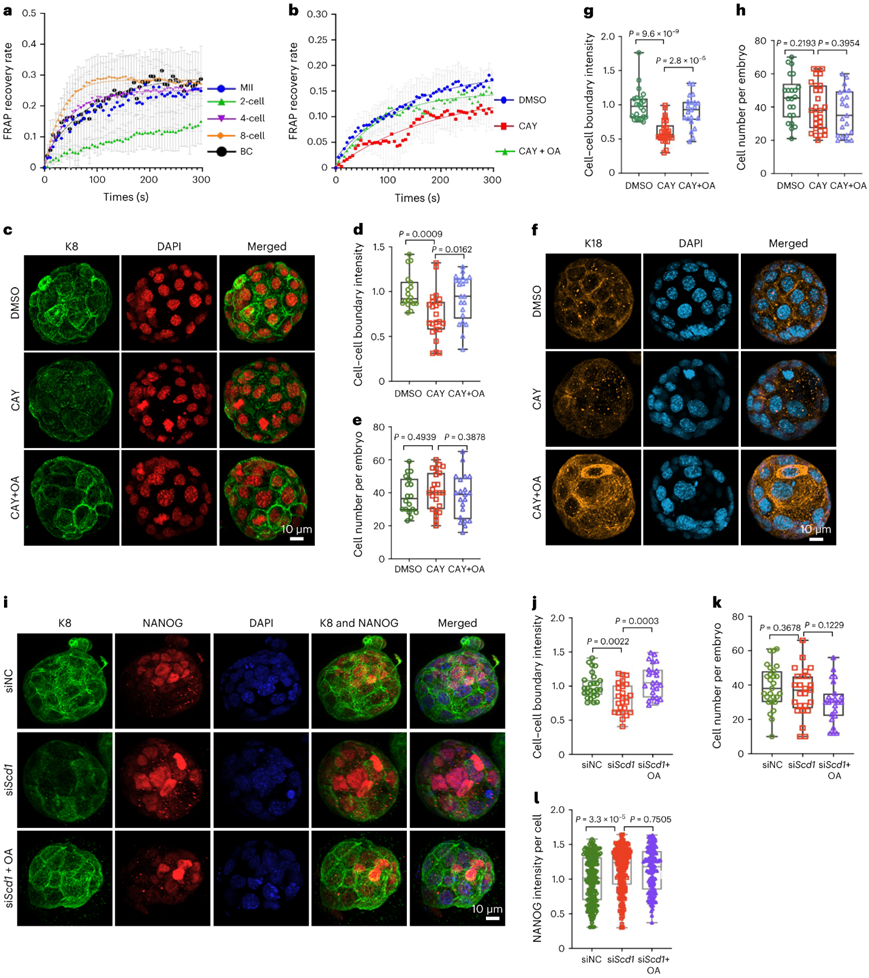
图6. 去饱和酶 SCD1 有助于八细胞至囊胚发育过程中的膜流动性和细胞骨架稳定。
(a) FRAP 分析显示卵母细胞、二细胞、四细胞、八细胞和囊胚胚胎的细胞膜流动性。(b) FRAP 分析显示用 DMSO、CAY10566 或 CAY10566 加油酸处理的 3.5 dpc 囊胚胚胎的细胞膜流动性。(c)免疫荧光分析。 (d,e,g,h) 用 DMSO、CAY10566 或 CAY10566 加油酸处理的 4.5 dpc 囊胚胚胎的细胞-细胞边界荧光强度和每个胚胎的细胞数的量化。 (i)免疫荧光分析。 (j-l) 用 siNC、si Scd1或 si Scd1加油酸处理的 4.5 dpc 囊胚胚胎中细胞-细胞边界的荧光强度、每个胚胎的细胞和 NANOG 强度的量化。
哺乳动物细胞可以通过去饱和酶例如Δ6和Δ5(由Fads1/2编码)合成PUFA。基于他们的发现,多不饱和度也在囊胚阶段增加(图3)。用 SC-26196 或芝麻素抑制 Δ6 或 Δ5 会显著损害囊胚形成并减少空腔面积(图7b-e)。同样,任何一种抑制剂的处理都会导致细胞骨架组织破坏和细胞-细胞边界模糊(图7f-i),这可以通过补充PUFA二十碳五烯酸(EPA)来挽救(图7f-i)。
综上所述,这些结果表明,MUFA 和 PUFA 合成的去饱和酶通过促进顶端域形成所需的细胞骨架组织,对于早期胚胎发育至关重要。
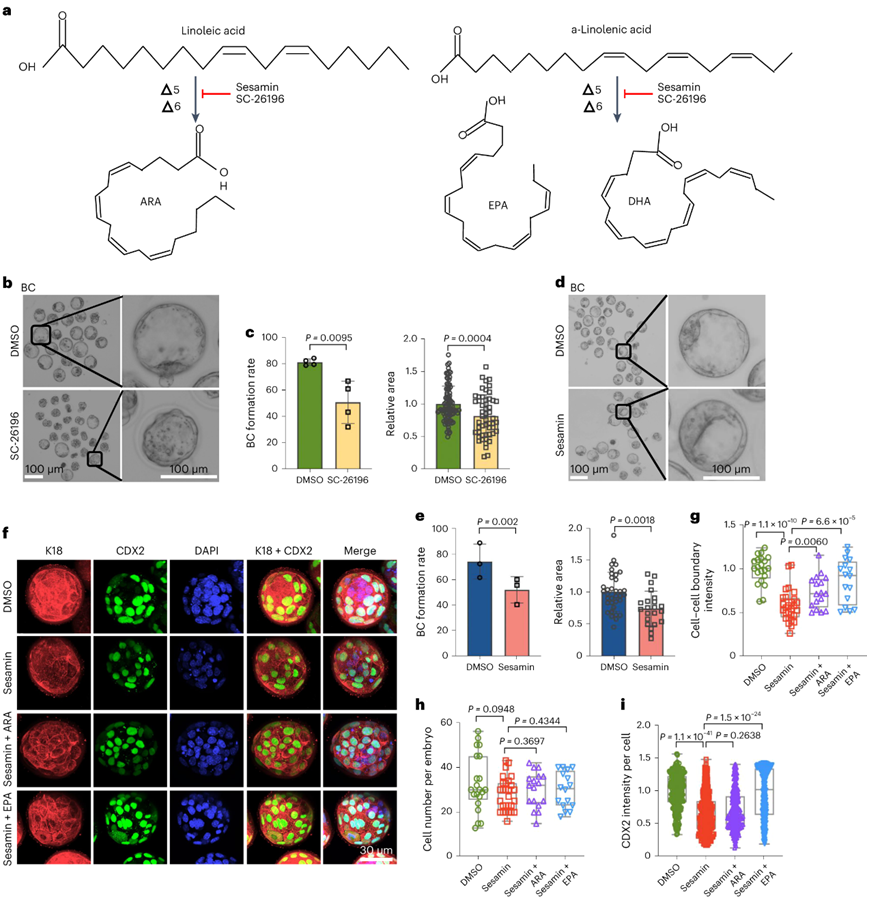
图7. PUFA 合成的去饱和酶通过介导细胞骨架组织和顶端结构域形成来促进囊胚形成。
(a) 包括花生四烯酸 (ARA)、二十碳五烯酸 (EPA) 和二十二碳六烯酸 (DHA) 在内的 PUFA 由去饱和酶 Δ6 和 Δ5 合成,可由所示抑制剂抑制。(b)用 DMSO 或 100 nM Δ6 酶抑制剂 SC-26196 处理的 4.5 dpc 小鼠胚胎的代表性图像。(c) 用DMSO或SC-26196处理的囊胚胚胎在不含BSA的KSOM培养基中生长的囊胚形成率和腔面积。(d) 在 4.5 dpc 时用 DMSO 或 100 nM Δ5 酶抑制剂芝麻素处理的小鼠胚胎的代表性图像。(e) 用DMSO或芝麻素处理的囊胚胚胎在不含BSA的KSOM培养基中生长的囊胚形成率和腔面积。 (f)免疫荧光分析。(g-i) 用 DMSO、芝麻素、芝麻素+ ARA 或芝麻素+ EPA 处理的 4.5 dpc 囊胚胚胎中细胞-细胞边界的荧光强、每个胚胎的细胞数和 CDX2 强度的定量。
06
去饱和酶有助于建立早期胚胎的顶端-基底极性,从而使囊胚成功植入子宫
小鼠早期胚胎从八细胞阶段发育到囊胚阶段需要形成顶端和基底外侧区域,以建立顶端-基底极性,促进囊胚形成并支持囊胚在子宫中的植入。用CAY10566处理导致八细胞胚胎顶端域的磷酸化埃兹蛋白富集减少(图8a-b)并破坏囊胚中磷酸化埃兹蛋白(ezrin)的模式(图8e-f)。另一种极性蛋白αPKC在八细胞胚胎中没有表现出水平变化,但在囊胚中略有下降(图8a-g)。此外,当八细胞和囊胚胚胎中的SCD1受到抑制时,基底外侧蛋白E-钙粘蛋白的表达降低(图8a-h)。
正如之前的分析表明,抑制SCD1导致膜流动性降低(图6b),当使用CAY10566处理时,埃兹蛋白和F-actin的流动性(极性建立所需的横向迁移率)减弱(图8j-k)。通过补充油酸,这种效果得以恢复(图8j-k)。这些数据表明SCD1是通过调节极性和细胞骨架蛋白的流动性来建立顶基极性以支持八细胞向囊胚发育所必需的。
由于顶基极性促进TE细胞分化,在scd1抑制的囊胚中,TE转录因子YAP的细胞核表达减少(图8e-i)。此外,当他们将囊胚移植到假怀孕受体小鼠的子宫中时(图81),与对照组相比,scd1抑制的囊胚形成的卵泡明显减少(图8m-n)。胚胎发育第7.5天 (E7.5)时,胚胎标记物K18的表达也减少(图8o)。综上所述,这些结果表明SCD1调节了八细胞到囊胚发育过程中顶基极性建立的分子事件,支持囊胚在子宫内植入的生理功能。
他们抑制了诱导培养基中去饱和酶的活性,使胚胎干细胞和滋养层干细胞产生囊胚,与对照细胞相比,效率降低(图8p-r),发现CAY10566、SC-26196或芝麻素处理后囊胚中E-cadherin和K18的表达降低(图8s)。综上所述,这些数据表明,脂质不饱和度的增加对胚胎细胞极化和囊胚的产生是重要的。
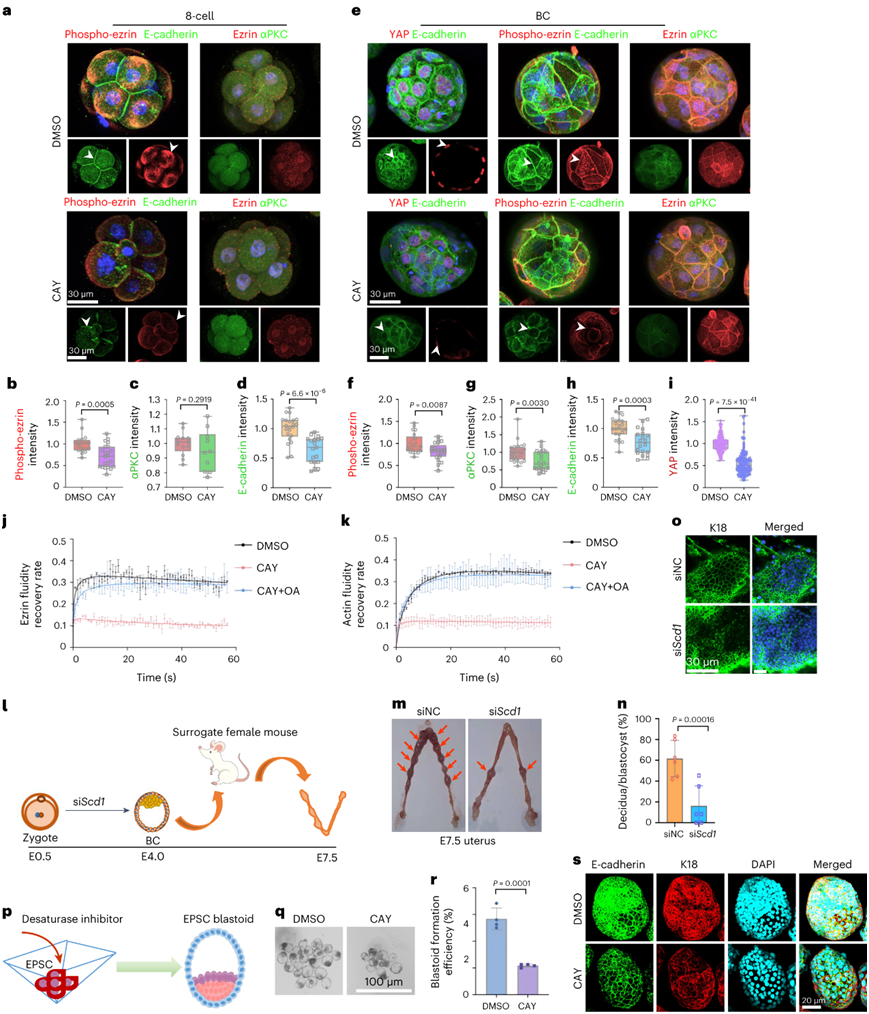
图8. 去饱和酶有助于早期胚胎顶端-基底极性的建立,从而使囊胚成功植入子宫。
(a)免疫荧光分析。 (b-d) 荧光强度定量。(e) E-钙粘蛋白、埃兹蛋白、αPKC、磷酸埃兹蛋白和 YAP 染色的免疫荧光显示它们在用 DMSO 或 CAY10566 处理的囊胚期胚胎中的定位。 (f-i) 荧光强度定量。(j-k) FRAP 分析显示用 DMSO 或 CAY10566 处理的八细胞胚胎中埃兹蛋白和 F-肌动蛋白的流动性。 (m) 由转移的囊胚诱导的E7.5蜕膜。(n) 蜕膜形成效率的量化。 (o)免疫荧光。(p) 该图显示了使用去饱和酶抑制剂对干细胞 (EPSC) 诱导的过程。(q) 用 DMSO 或 CAY10566 处理的 EPSC 胚泡的相差图像。 (r) 用 DMSO 或 CAY10566 处理的 EPSC 胚泡形成效率的量化。(s) 用 DMSO 或 CAY10566 处理的 EPSC 母细胞中 E-钙粘蛋白和 K18 定位的免疫荧光。
+ + + + + + + + + + +
结 论
本项研究全面研究了小鼠和人类早期胚胎发育过程中的动态脂质景观。不同发育阶段的脂质特征是不同的,特别是对于磷脂类别。高度的磷脂不饱和度是胚胎发育到囊胚阶段的一个保守特征。此外,脂质去饱和酶(如 SCD1)是体外囊胚发育和囊胚植入所必需的。其中一种机制是通过调节不饱和脂肪酸介导的质膜和顶端蛋白的流动性以及在八细胞胚胎发育至囊胚过程中建立顶端-基底极性。总的来说,本项研究为哺乳动物植入前胚胎发育中内源脂质组的重塑以及脂质不饱和调节胚胎发生和植入的机制见解提供了新的理论依据。
+ + + + +



 English
English


