文献解读|Cancer Cell(48.8):TREM2 在中枢神经系统癌症和外周癌症中的不同作用
✦ +
+
论文ID
原名:Distinct roles of TREM2 in central nervous system cancers and peripheral cancers
译名:TREM2 在中枢神经系统癌症和外周癌症中的不同作用
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.05.23
DOI号:10.1016/j.ccell.2024.05.001
背 景
胶质母细胞瘤 (GBM) 是一种无法治愈的中枢神经系统 (CNS) 癌症,其特征是大量髓细胞浸润。髓系细胞表面受体髓系细胞表达触发受体-2 (TREM2) 是多种疾病中的主要免疫信号中心。从生理上讲,TREM2 在有限数量的组织特异性髓系细胞中表达,包括CNS中的小胶质细胞 (MG),以维持细胞稳态。然而,TREM2在癌症中的作用更为复杂。越来越多的证据表明,TREM2的表达仅限于肿瘤相关巨噬细胞 (TAM) 和髓系抑制细胞 (MDSC)。不过目前TREM2 将 TAM 重定向到免疫抑制或防御状态的潜在机制尚未阐明。如何利用 TREM2 靶向 TAM 或诱导其在不同恶性肿瘤中的重编程需要进一步研究。
实验设计
结 果
01
TREM2 缺乏会促进小鼠的GBM进展
TREM2 优先在髓系细胞而非其他细胞类型中表达,癌症基因组图谱 (TCGA) GBM 数据集表明肿瘤中 TREM2 总体上调。因此,研究团队在 C57BL/6 小鼠中遗传性地敲除了 TREM2(Trem2−/−小鼠),以研究其在 GBM 中的作用。接下来,给小鼠颅内注射鼠同源 GBM 细胞系(GL261 和 CT-2A)(图 1 A)。Trem2−/−小鼠中植入的两种肿瘤生长速度明显快于野生型小鼠(图 1 B)。与野生型小鼠相比,具有肿瘤的Trem2−/−小鼠的总生存期 (OS) 也缩短(图 1 C)。
为了进一步验证TREM2在GBM中的作用,他们将TREM2缺陷小鼠与自发性遗传性GBM模型小鼠(Gfap-Cre;Trp53f/f;R26-MET404-flagLSL/+)杂交,并比较了这些小鼠的GBM生长(spTREM2-WT vs. spTREM2-KO)(图1D)。与上述结果一致,spTREM2-KO小鼠的脑肿瘤体积比spTREM2-WT小鼠大(图1E),spTREM2-KO组的OS显著缩短,中位生存时间(MST)缩短了约40天(图1F)。此外,他们采用了药理学 TREM2 阻断模型。GL261-GBM 小鼠接受了 TREM2 阻断肽 IA9(图1G)。注射的肽对外周免疫的影响极小,穿过血脑屏障并与 TME 中细胞膜的 TREM2 共定位(图1H),并有效阻断了分类的 TAM 中的 TREM2 下游信号传导。IA9 治疗持续加剧肿瘤进展并缩短 OS(图 1 I-J)。IA9 的作用是 TREM2 依赖性的,因为在对照组和 IA9 治疗的Trem2−/−小鼠之间没有观察到肿瘤生长和 OS 的差异。
这些数据揭示了 TREM2 在预防 GBM 进展方面具有保护作用,与其在外周非中枢神经系统癌症中已确定的肿瘤促进作用相反。
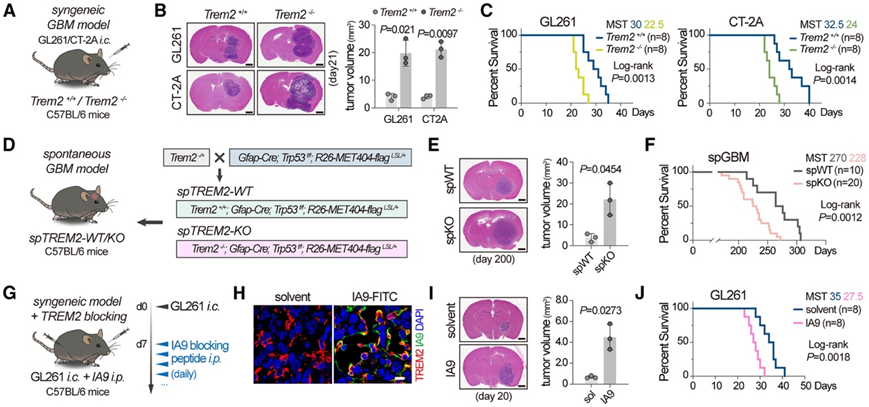
图1. TREM2 缺乏会促进小鼠的 GBM 进展。
(A) 在Trem2 +/+和Trem2 −/−小鼠中建立的 GL261/CT2A GBM 模型的图示。(B) 苏木精和伊红 (HE) 染色分析和定量。(C) Kaplan-Meier 分析。(D) 生成 spTREM2-WT/KO 小鼠的杂交策略说明。(E) HE 染色脑切片和肿瘤体积的定量。(F) Kaplan-Meier 分析。(G) 用 IA9 治疗的 GBM 模型小鼠的插图。(H) 免疫荧光染色。(I) HE 染色脑切片和肿瘤体积的定量。(J) Kaplan-Meier 分析。
02
TREM2 缺乏会诱发 GBM TME 中的免疫抑制 TAM 区室
为了了解 TREM2 对 GBM 进展过程中免疫景观的影响,他们从野生型和Trem2 −/−小鼠的正常大脑或颅内 GL261 同种异体移植物中分选出的免疫细胞进行了单细胞转录组分析(scRNA-seq)(图 2 A)(以下将无肿瘤野生型和Trem2 −/−小鼠分别称为 WT 和 KO;将带肿瘤的野生型和Trem2 −/−小鼠分别称为 GBM 和 GBM KO)。共获得 121701 个细胞。通过均匀流形近似和投影 (UMAP) 进行无监督聚类,根据典型基因标记的表达确定了 12 种细胞类型。他们集中研究了仅在肿瘤接种后可见的一组细胞 (TAMG,聚类 8)。尽管 GBM 和 GBM KO 组之间该子集在 TME 中的比例相似(图 2 B),但在转录水平上发生了显著变化,包括Arg1的增加(TME 中髓系抑制细胞的标志)水平在 TREM2 破坏后下降(图 2 C)。通路分析显示,白细胞活化和细胞因子产生显著负调节,表明 TREM2 缺失后抗肿瘤活性降低(图 2 D)。TREM2 缺失后,几种 TREM2 相关基因(Tyrobp、Apoe、Spp1和Lpl)下调,而在促炎基因(Cst7、Cd80和Il1b)中观察到类似的模式(图2E)。相反,除了Arg1之外,其他抗炎特征(Mrc1、Msr1、Ap1b1、Tgfbi和Igf1)在此 TAMG 聚类中显著上调(图 2 E)。
接下来,他们研究了 TREM2 缺失对血液单核细胞衍生的巨噬细胞 (MDM)的影响,将 MDM 重新聚类为 12 个亚聚类(图 2 F)。TREM2 缺失严重改变了转录水平上的基因表达,以Arg1水平显著增加为标志。上调的基因在细胞群体增殖的负向调控和内在凋亡信号通路中富集,而下调的基因在巨噬细胞活化和 T 细胞活化的正向调控中富集(图 2 G)。抗炎特征(Tgfbi和Chil3)的表达上调,同时促炎特征(Cd86和Tnfaip2)下调(图 2 E)。
TREM2 缺失后,该 TAMacro-Lipid 亚群中的单核细胞特征评分(Ly6c2、Plac8、Ccr2、Gsr 、 Plaur等)增加,同时巨噬细胞特征(Apoe、C1qa、C1qb、C1qc、Ms4a7、Cd81、Egr1等)下调(图 2 H),表明 TREM2 缺陷组的 TME 中巨噬细胞成熟停滞,这是导致抗肿瘤反应激活不足的原因。使用常规标记物通过流式细胞分析证实了 MG 和 MDM 的抗炎作用增强和促炎作用减弱(图 2 I-J)。
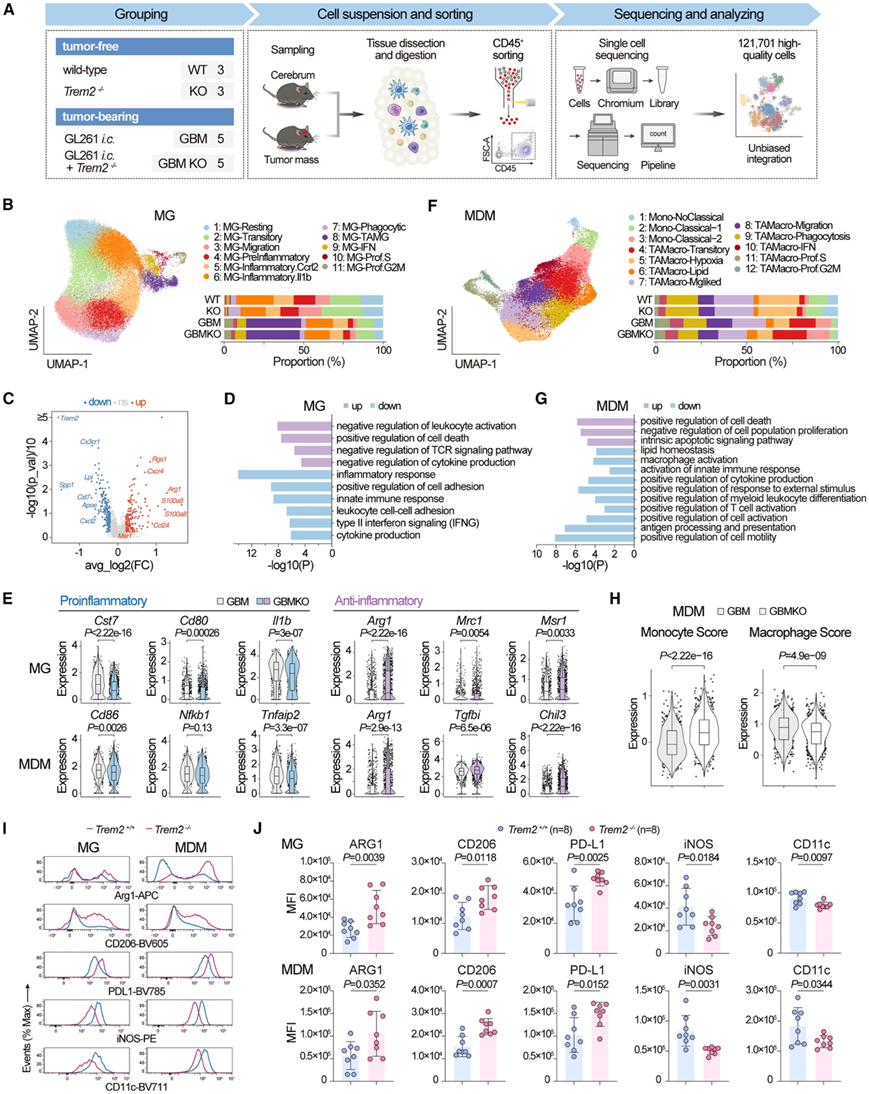
图2. TREM2 缺乏会在 GBM TME 中诱导免疫抑制性 TAM 区室。
(A) scRNA-seq 分析工作流程。(B) UMAP 图和条形图显示已识别的 MG 细胞聚类及其在所示组中的比例。(C) 火山图显示 MG-TAMG 聚类(GBM 与 GBM KO)中的差异表达基因。(D) 功能富集通路分析。(E) 促炎或抗炎特征的表达分析。(F) UMAP 图和条形图显示已识别的浸润 MDM 细胞聚类及其在所示组中的比例。(G) 功能富集通路分析。(H) 单核细胞和巨噬细胞评分。(I-J) GBM 模型小鼠的 MG 或浸润 MDM 中 M1 样或 M2 样标志物的表达。
03
髓系细胞中的 TREM2 缺乏会损害 GBM 中的 T 细胞抗肿瘤活性
TME 的另一个不可或缺的组成部分是淋巴亚群,其中 CD4+辅助 T 细胞 (Th) 和 CD8+ 细胞毒性T淋巴细胞(CTL) 是针对肿瘤的免疫反应中的关键参与者。他们将淋巴区重新聚类为 21 个亚群(图 3 A-B),在这些亚群中几乎没有检测到 TREM2 表达,TREM2 缺失后,这些亚群中没有观察到显著的比例变化。与稳态脑 (WT) 相比,GBM 的 TME 由数量减少的幼稚 T 细胞和CD4+ Th 细胞组成,但效应细胞和耗竭的 CD4+ /CD8+ T 细胞数量增加(图 3 A)。在 GBM 进展过程中,T 细胞亚群表现出以效应样特征和明显耗竭特征的表型(图 3 C)。
他们发现trem2缺陷组细胞的特点是下调效应因子评分(Gzmk、Gzmb、Cst7、Prf1等)和T辅助评分(Ifng、Tnf、Cd69、Il17a等),但进一步提高衰竭评分(Pdcd1、Tigit、Ctla4等)(图3D-E),这表明TREM2缺陷是抑制T细胞抗GBM活性的原因。
细胞间通讯分析表明,TREM2 缺乏导致 MG 亚群与 T 细胞之间的相互作用增强,这些 T 细胞表现出PDCD1 - CD274、CD48-CD244、ADORA2A-NAMPT 和LGASL3-MERTK相互作用对,这些相互作用对参与介导抗肿瘤 T 细胞耗竭(图3F)。流式细胞分析显示,Trem2 −/− TME中的效应 T 细胞(CD44hi CD62L lo)和 IFN-γ+ CD8 + T 细胞减少,同时耗竭的 CD8+ T 细胞(PD-1+和 LAG-3+)显著增加(图 3 G-H)。
在抗原特异性 T 细胞启动试验中,TREM2 缺陷型 TAM 在激活幼稚 OT-1 T 细胞方面不如野生型 TAM(均装载有 OVA 257-264肽),表现为增殖、效应子比例和效应标志物(穿孔素/TNF-α)表达减少(图3I-K)。这些结果表明 GBM TAM 中的 TREM2 缺乏会导致更强的免疫抑制状态并导致 CTL 活性降低,从而导致 GBM 进展增强。
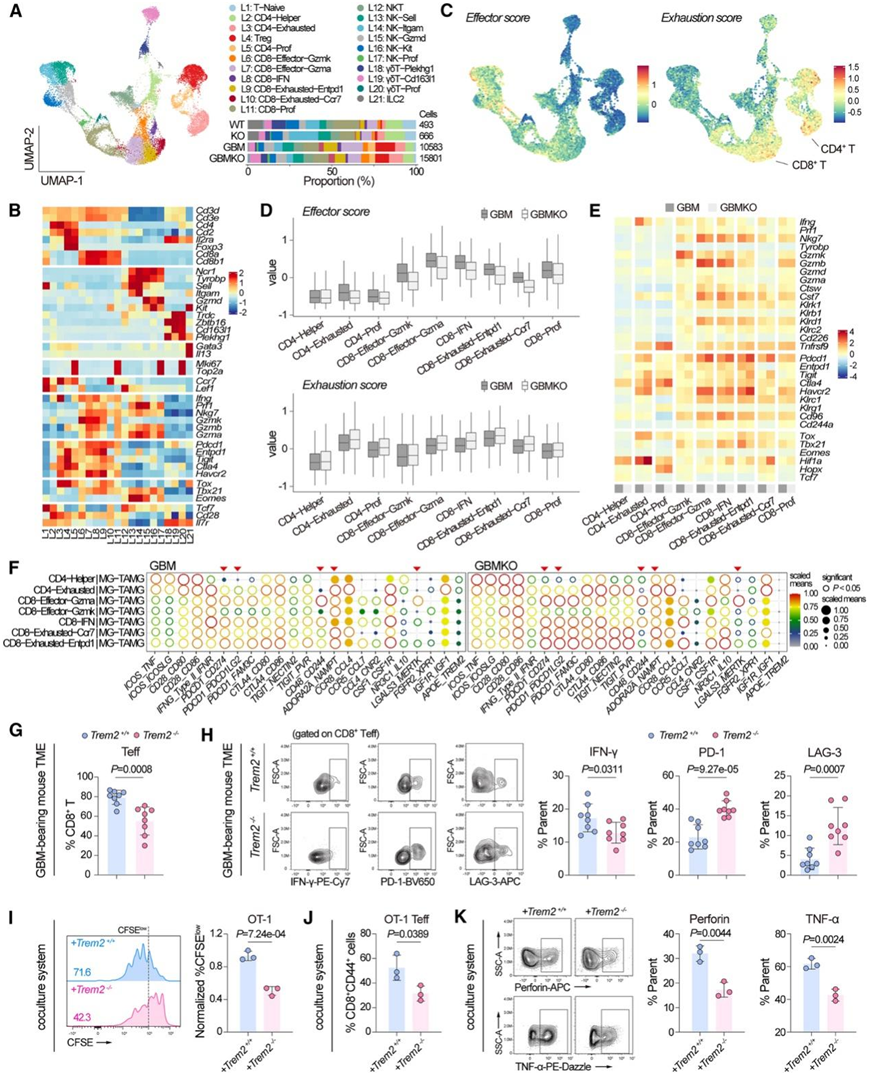
图3. 髓系细胞中的 TREM2 缺陷会损害 GBM 中的 T 细胞抗肿瘤活性。
(A) UMAP 图和条形图显示已识别的淋巴亚群聚类及其在所示组中的比例。(B) 热图显示已识别淋巴聚类中标记基因的表达水平。(C) 已识别淋巴聚类的效应器(左)或耗竭(右)评分水平由颜色梯度表示,从蓝色(低表达水平)到红色(高表达水平)。(D) 箱线图显示指定聚类(GBM vs. GBM KO)中的效应器或耗竭分数。(E) 功能基因集的热图分析。(F) 配体-受体对的相互作用。 (G)流式细胞分析。(H) IFN-γ 标记的效应 CD8 + T 细胞和PD-1 和 LAG-3 标记的耗竭 CD8 + T 细胞的比例。(I) OT-1 细胞与载有 OVA 257-264 的 Trem2+/+ 和 Trem2 −/− TAM 共培养后的增殖(CFSElow)的代表性直方图(左)和量化(右)。(J) 与载有 OVA 257-264的 TAM 共培养后效应OT-1 细胞 (CD62Llo CD25+) 比例的量化。 (K) 代表性轮廓图(左)和定量图(右)显示 T 细胞启动试验中穿孔素或 TNF-α 表达 OT-1 细胞的比例。
04
单细胞和空间转录组学揭示了 GBM 进展过程中髓系成分中的 TREM2 下调
他们首先从配对的 GBM 样本中分选出髓系细胞 (CD14+),然后对其进行 qPCR(图 4 A)和免疫印迹分析(图 4 B)。与肿瘤周围髓系细胞相比,肿瘤髓系细胞中的 TREM2 表达降低。IBA1 和 TREM2 的 免疫荧光(IF) 染色也显示出与小鼠样本中观察到的类似的模式。肿瘤区域中的髓系细胞 (IBA1+)明显增加,每个单细胞中的 TREM2 强度减弱(图 4 C)。
随后,他们对人类神经胶质瘤癌性和肿瘤周围组织(包含三个配对样本)进行了 scRNA-seq(图 4 D),检测到 94577 个高质量细胞并聚类为 16 个亚群(图 4 E),TREM2 表达集中在主要的髓系亚群上。在癌性组织中,在髓系亚群中发现 TREM2 表达水平明显下降(图4F-G),并且在每个配对样本中都观察到了这一发现(图 4 H)。在 MG 和 MDM 中也观察到了相同的模式(图 4 I)。与 MG 相比,在肿瘤组中 MDM 中观察到更明显的 TREM2 下调。
为了更深入地了解空间组织信息,他们通过空间转录组学(ST)检测了三张人类高级别胶质瘤载玻片(均包含横跨肿瘤周围和肿瘤组织的区域)(图 4 D)。对于每张载玻片,区域可分为四种不同的类型:正常、肿瘤周围、肿瘤和肿瘤核心区域(图 4 J)。与苏木精和伊红 (HE) 染色结果一致,在这些 ST 切片中,TREM2 表达分布与髓系细胞标志物AIF1 (IBA1) 共定位。值得注意的是,空间轨迹分析突出显示了肿瘤周围区域的 TREM2 表达较高,而肿瘤区域的 TREM2 表达相对较低,其中肿瘤核心表达水平最低(图 4 K-L)。
使用来自 TCGA、中国胶质瘤基因组图谱 (CGGA) 和 PrognoScan 的多转录组分析(RNA-seq) GBM 数据集进行生存分析,未发现TREM2high组和TREM2low组之间存在任何显著差异(图 4M)。相反,在分析来自 TCGA 临床数据资源 (TCGA-CDR) 数据集的 GBM 队列后,发现TREM2 负相关基因的高表达,与较差的 OS 和无进展间隔 (PFI) 相关(图 4 N),证明TREM2 在 GBM TME 中保持保护性作用。在IF 染色队列中,髓系细胞中较高的 TREM2 MFI 与这些 GBM 患者的更好 OS 相关(图 4 O)。
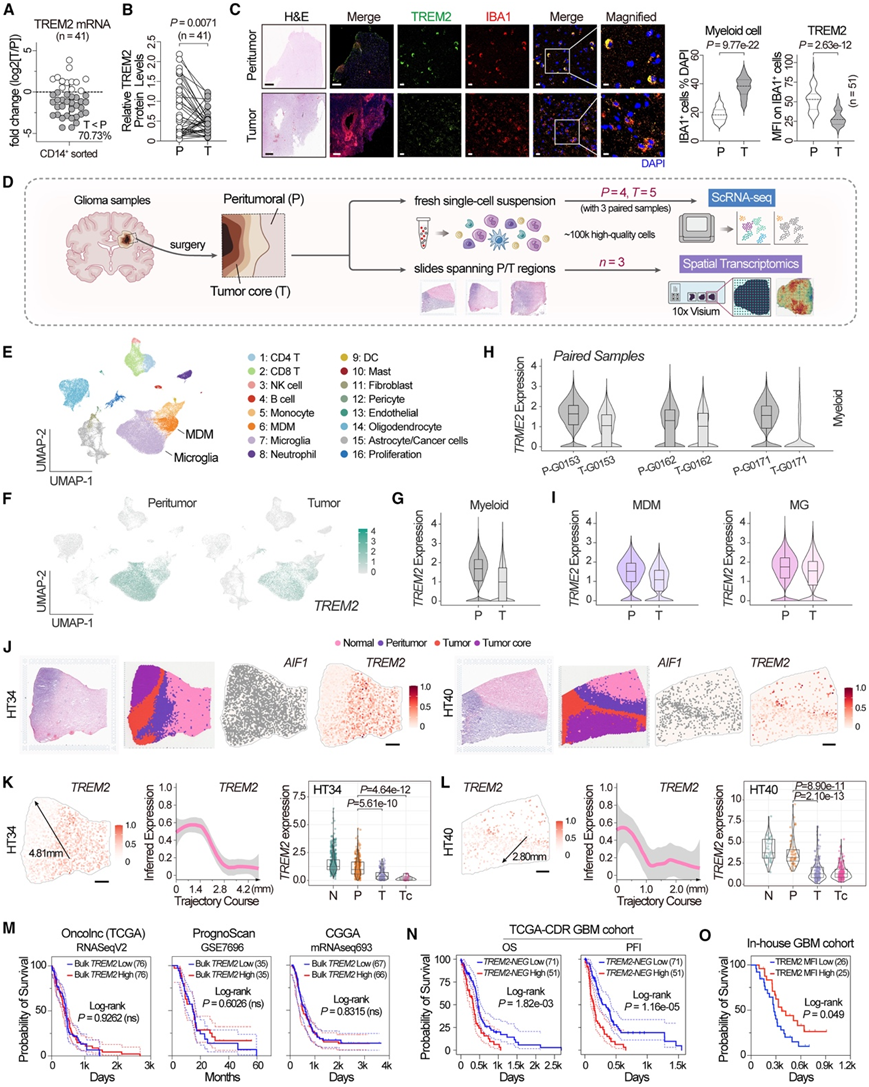
图4. 单细胞和空间转录组学揭示了 GBM 进展过程中髓系成分中的 TREM2 下调。
(A) 散点图显示肿瘤组织中分选的 CD14+ 髓系细胞与肿瘤周围组织中分选的细胞中 TREM2 mRNA 水平的差异倍数。(B) 免疫印迹分析。(C) H&E 染色和免疫荧光分析。(D) 人类神经胶质瘤样本的 scRNA-seq 和空间转录组学分析说明。(E) 人类胶质瘤样本中已识别细胞聚类的 UMAP 图。 (F) UMAP可视化。(G-I) TREM2水平分析。(J) 人类高级别胶质瘤样本 HT34(左)和 HT40(右)的 HE 染色切片。(K-L) TREM2 表达分析。(M-O)生存分析。
05
髓系细胞中 TREM2 的过表达可抑制 GBM 的生长并与ICB疗法产生协同作用
鉴于 GBM 进展下调了髓系细胞中的 TREM2 表达,他们接下来研究了提高 TAM 中的 TREM2 表达是否可以有效阻止 GBM 发展。为了有效地在 MG 和 MDM 中过表达 TREM2,他们使用了腺相关病毒载体 (AAV9-F4/80-TREM2-flag) 来递送 TREM2。AAV 在肿瘤接种后第 3 天和第 10 天颅内注射,分别靶向常驻 MG 和随后浸润的 MDM(图 5 A)。在 GL261 和 CT-2A GBM 模型中,提高 TREM2 表达可抑制 GBM 生长并延长 OS (图 5 B-C)。
为了研究 TREM2 过表达如何改变 GBM 的免疫状况,他们应用 scRNA-seq 来分析用载体或 AAV-TREM2 处理的 GL261 模型的 TME。获得了 66643 个细胞并进行 UMAP 聚类(图 5 D)。在 MG 和 MDM 亚群中观察到选择性 TREM2 过表达(图 5 E)。AAV 给药将髓系成分重定向到免疫活性表型,证据是 MG 和 MDM 中上调的促炎特征(Il1b、Il1a、Tnf、Cd86和Cd80)和下调的抗炎特征(Mrc1、Arg1、Chil3、Cd163和Tgfbi)。通路分析表明,施用 AAV-TREM2 上调了 MG 和 MDM 亚群中的炎症免疫反应,并且上调的标记与 T 细胞的抗肿瘤功能增强有关(图 5 F),这些结果与使用典型标记物进行的流式细胞分析一致(图5G-H)。
由于 AAV 专门针对髓系细胞区,并且在 GBM TME 中观察到明显的 CTL 耗竭(图 3C),他们试图探究这种治疗是否可以与 T 细胞靶向免疫检查点阻断 (ICB) 疗法相结合,于是用 AAV-TREM2 和腹膜内注射抗 PD-1 抗体(10 mg/kg,每 5 天一次)治疗小鼠(图 5I)。与 AAV-TREM2 单药治疗相比,联合治疗进一步抑制了肿瘤增殖并延长了 OS(图 5J-K),表现出强大的协同作用。
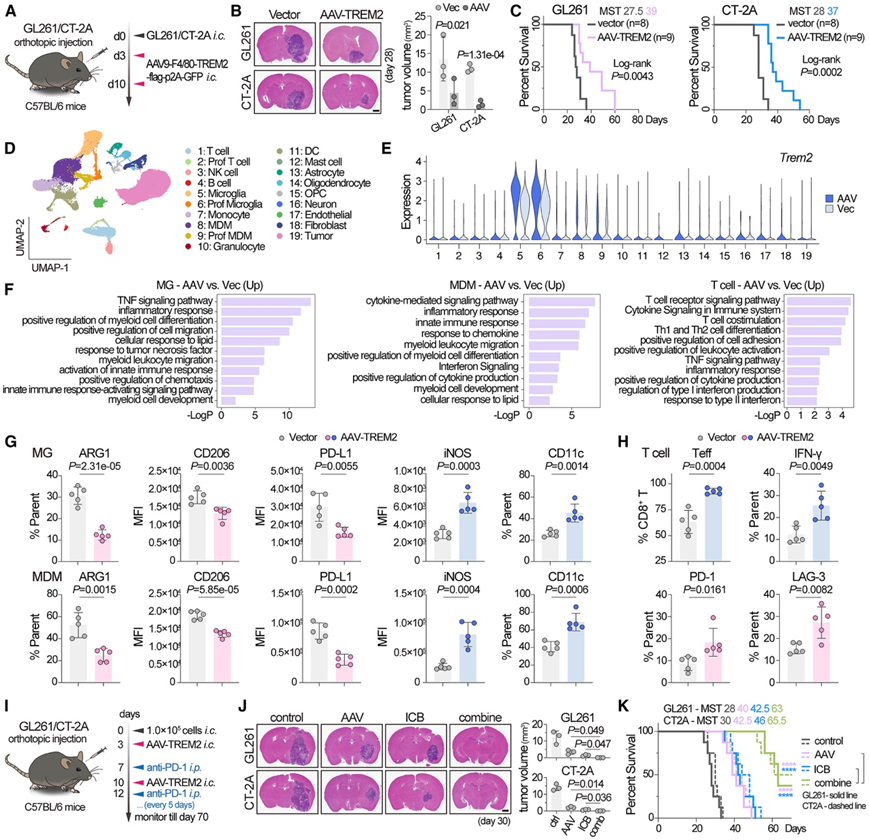
图5. 髓系细胞中TREM2过表达抑制GBM生长并与ICB疗法产生协同作用。
(A) GBM 模型小鼠中 AAV 治疗的图示。(B) 对照载体或 AAV-TREM2 治疗的具有GBM 的小鼠的 HE 染色脑切片的代表性和定量。(C) 生存分析。(D)已识别细胞聚类的 UMAP 图。(E) 小提琴图显示每个已识别细胞聚类中的 TREM2 表达情况。 (F)通路分析。(G-H)流式细胞分析。(I) 在指示时间点的 AAV 治疗、抗 PD-1 (ICB) 治疗或联合治疗的说明。(J) HE 染色脑切片的代表性和定量。(K) Kaplan-Meier 分析。
06
中枢神经系统微环境决定了 TREM2 在 GBM 中的独特作用
接下来,他们试图研究 TREM2 在 GBM 中的独特功能的机制。为了确定是否与 GBM 内在特征有关,在颅内注射了乳腺癌细胞系 EO771,进入野生型和Trem2 −/−小鼠。与 GBM 肿瘤类似,EO771 肿瘤在Trem2 −/−小鼠中表现出加速生长和引起更差的存活率(图6A-C)。流式细胞分析显示这些小鼠的 TME 更具免疫异常特征,其特点是 M2 样免疫抑制 TAM 群体扩大、CD8 + T 细胞耗竭以及效应 T 细胞数量减少(图 6 D)。这些结果表明,肿瘤内在特征不太可能决定 TREM2 在 CNS 致癌过程中的功能。
相反,当 GL261 细胞在皮下植入时,TREM2 缺陷导致接种的肿瘤细胞增殖停滞(图 6E-F)并且 TME 向促炎和有效抗肿瘤状态转变,以下调的 CD206 为标志,但 MDM 中的 M1 样标志物(iNOS 和 CD86)和 CD8+ T 细胞中的效应标志物(IFN-γ 和 GZMB)上调(图 6G)。这些发现表明,肿瘤外部或微环境因素(而不是肿瘤内部因素)介导 TREM2 在中枢神经系统和外周癌症中的相反作用。
为了探究潜在原因,他们分选了 CD11b+髓系细胞(代表 TREM2 表达细胞) 来自 GL261 颅内和皮下肿瘤(icTAM 和 scTAM),并进行RNA-seq以研究这些细胞中的 TREM2 相关反应。icTAM 的转录组与 scTAM 的转录组明显不同(图 6 H)。获得了 1532 个显著差异表达基因 (DEG) 的列表(图 6 I)。上调的 DEG 在与膜成分和信号转导相关的通路中富集,包括质膜外侧、细胞表面受体信号通路和细胞内信号转导(图 6 J)。这些结果表明,icTAM 和 scTAM 之间的主要差异表现在信号传感表面和随后的信号转导通路,表明来自微环境的配体的刺激不同。
进一步的基因集富集分析 (GSEA) 和基因集变异分析 (GSVA) 均证明 icTAM 与鞘脂相关通路更相关(图 6 K)。在 icTAM 中发现了与鞘脂信号通路相关的几种基因(Sgpp2、Adora1和Acer2 )的显著上调(图6I-L)。鞘脂是一种 TREM2 配体,在包括癌症在内的病理条件下在 CNS 微环境中高度富集。接下来,他们试图确定负责 TREM2 在中枢神经系统癌症中的特征功能的特定配体。
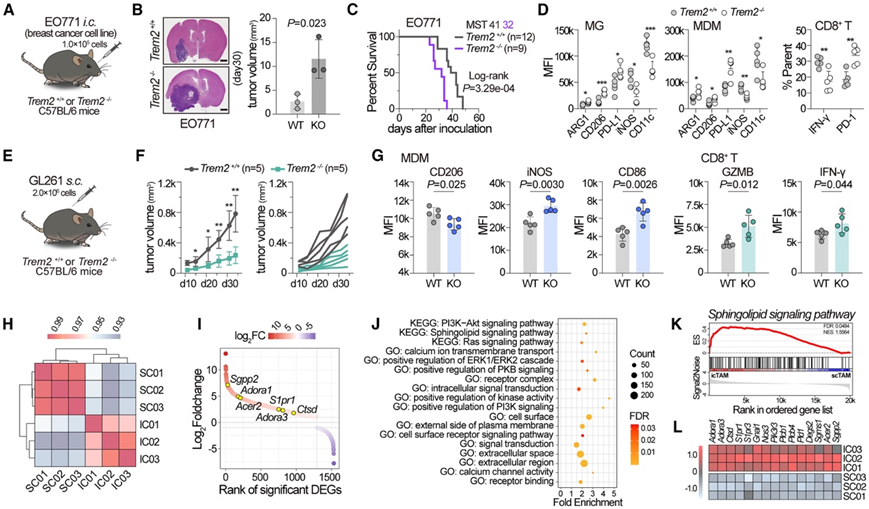
图6. CNS 微环境决定了 TREM2 在 GBM 中的独特作用。
(A)在Trem2 +/+和Trem2 −/−小鼠中建立的大脑 EO771 模型的说明。(B-C) HE 染色脑切片的代表性和定量以及生存分析。(D) 流式细胞分析。(E)在Trem2 +/+和Trem2 −/−小鼠中建立的皮下 GL261 模型的说明。 (F) 肿瘤的生长曲线。(G) 流式细胞分析。(H) 基因表达相关性的热图。(I) 瀑布图显示 icTAM 和 scTAM 之间的显著 DEG。(J) 气泡图显示 icTAM 中显著上调的 DEG 的 GO 和 KEGG 通路富集分析。(K) GSEA 显示鞘脂信号通路在 icTAM 中富集。(L) 热图比较 icTAM (IC) 和 scTAM (SC) 之间鞘脂信号通路相关基因的表达。
07
鞘脂-TREM2 信号将 TAM 重新编程为抗肿瘤状态
TREM2 作为环境变化的膜结合传感器,在与不同配体(多种代谢物,包括磷脂和阴离子碳水化合物)结合后介导多方面的下游信号传导。他们推测,在 CNS TME 中富集的 TREM2 未指明的脂质配体可能导致不同的 TREM2 相关抗肿瘤反应。为了确定潜在的脂质配体,他们分析了从 21 个 GBM 和 4 个对照患者中采集的脑脊液 (CSF) 的代谢组学数据(图7A),共鉴定出 656 种脂质代谢物(图7B),值得注意的是,鞘脂代谢在上调代谢物的通路富集分析中显得格外重要(图 7 C)。
鞘磷脂 (SM) 和鞘糖脂 (GSL) 均参与鞘脂代谢,在 GBM 的 CSF 中含量显著增加(图 7 B)。它们是肿瘤进展过程中 CNS TME 中的常见脂质,由肿瘤破坏的髓鞘和其他神经元结构释放,这些神经元结构在 CNS 中高度富集,但在外周病理条件下分布较少。他们选择了这些脂质的代表性形式,并对其进行对接分析,以模拟它们与 TREM2 的结合。SM 和 GSL(神经节苷脂 GM1)均与 TREM2 胞外域上的基本贴片很好地契合(图 7 D)。
他们从 GL261 GBM 中分选出 TAM,并将其与纯化的 SM 和 GM1 一起孵育。用梯度浓度的 SM 和 GM1 处理,最佳浓度分别为 0.2 μg/mL 和 0.5 μM(图 7 E)。SM/GM1 刺激显著下调了 M2 样标志物 CD206 和 ARG1,同时上调了 M1 样标志物 iNOS 和 MHC-II(图 7 F)。SM/GM1 处理后,M2 极化的关键调节因子磷酸化 STAT3 的水平降低,而 M1 相关的磷酸化 STAT1 的水平升高(图 7F)。SM/GM1 刺激后,磷酸化 SYK 和下游磷酸化 AKT2 上调(图 7 G),而抗炎相关异构体 AKT1 保持不变(图 S7 D)。上述影响在从Trem2 −/−小鼠中分选出的 TAM 中不存在(图 7 F-G),这表明 SM/GM1 的重编程依赖于 TREM2。
在从人类 GBM 中分离的 TAM 中,SM/GM1 刺激也导致从 M2 样表型转变为 M1 样表型(图 7 H-I)。经 qPCR 评估,在 SM/GM1 刺激后,更广泛的 M2 样标记基因(Cd163、Arg1、Mrc1、Stab1、Il10、F13a1和Chil3)显著下调,同时伴有 M1 样标记(Il12a、Il1a、Cd86和Nos2)上调(图 7 J)。SM/GM1 刺激的 TAM 对 T 细胞增殖的抑制作用减弱(图 7 K),SM/GM1 刺激的 TAM 的吞噬活性显著增加(图 7 L)。总体而言,这些结果共同表明,富含 CNS 的鞘脂能够通过 TREM2 引导 TAM 进入针对 GBM 的防御状态。
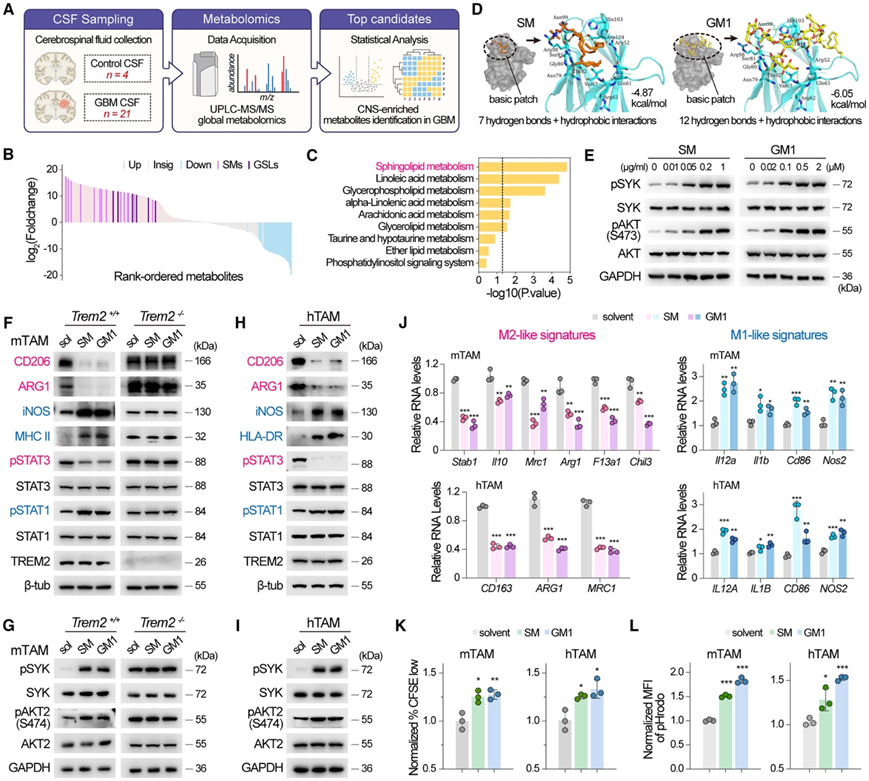
图7. 鞘脂-TREM2 信号将 TAM 重新编程为抗肿瘤状态。
(A) 脑脊液代谢组学分析的工作流程图。(B) 瀑布图显示脂质代谢物发生差异改变。(C) KEGG 通路富集分析显示脂质代谢通路的重要性。(D) 分子对接分析显示 TREM2 与 SM(橙色)或 TREM2 与 GM1(黄色)之间的关键相互作用。(E-I)免疫印迹分析。(J) SM/GM1 刺激的 mTAM 和 hTAM 中 M1 样和 M2 样基因特征的相对 mRNA 水平。(K) 与 SM/GM1 或溶剂刺激的 mTAM 和 hTAM 共培养的 CD3+ T 细胞的增殖测定。(L) SM/GM1 或溶剂刺激的 mTAM 和 hTAM 的吞噬试验。
+ + + + + + + + + + +
结 论
本项研究发现外周癌症中关键的免疫抑制靶点TREM2在 GBM 中具有免疫保护作用。遗传或药理学 TREM2 缺乏会促进体内GBM 进展。单细胞和空间转录组分析显示 GBM 浸润的髓细胞中 TREM2 下调。TREM2 与 GBM 中的免疫抑制髓系和 T 细胞耗竭特征呈负相关。在 GBM 进展过程中,富含 CNS 的鞘脂与髓细胞上的 TREM2 结合并引发抗肿瘤反应。临床上,髓细胞中高 TREM2 表达与 GBM 中的更好生存相关。腺相关病毒介导的 TREM2 过表达可阻碍 GBM 进展并与抗 PD-1 疗法产生协同作用。这项研究结果揭示了 TREM2 在中枢神经系统癌症中的不同功能,并支持癌症免疫治疗中的器官特异性髓系细胞重塑。
+ + + + +



 English
English


