文献解读|Cell Discov(13.0):单细胞测序描绘肿瘤结构并为转移性结膜黑色素瘤的临床决策提供支持
✦ +
+
论文ID
原名:Single-cell sequencing depicts tumor architecture and empowers clinical decision in metastatic conjunctival melanoma
译名:单细胞测序描绘肿瘤结构并为转移性结膜黑色素瘤的临床决策提供支持
期刊:Cell Discovery
影响因子:13.0
发表时间:2024.06.11
DOI号:10.1038/s41421-024-00683-y
背 景
结膜黑色素瘤 (CoM) 是一种起源于球结膜、睑结膜和泪阜的恶性肿瘤,可危及视力和生命。由于来源难以区分、对肿瘤微环境 (TME) 缺乏了解、即使接受标准治疗后转移死亡率仍很高,因此 CoM 的诊断较为困难。
实验设计
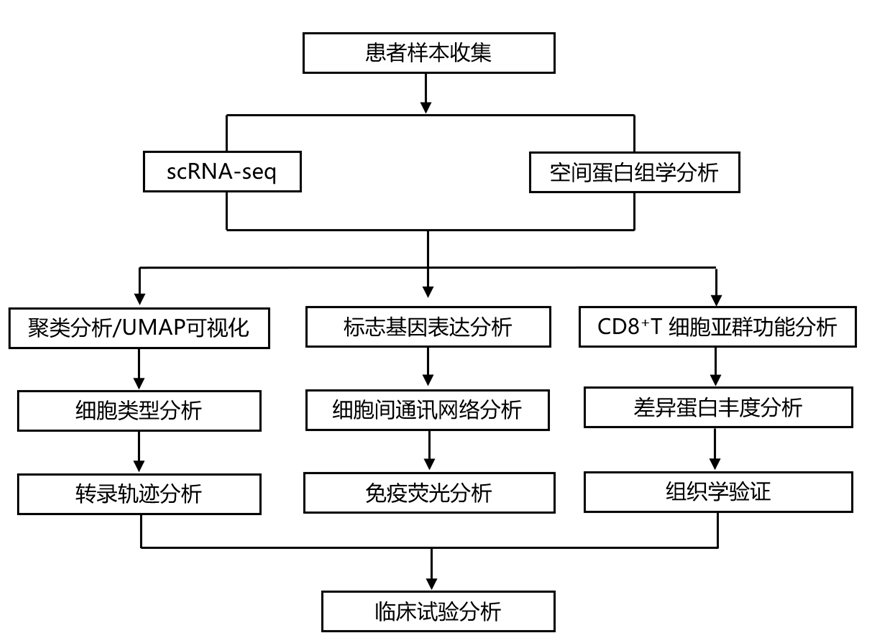
结 果
01
良性结膜和 CoM 微环境的单细胞分析
为了系统地探究 CoM 的起源和肿瘤状况,研究者团队收集了结膜样本和结膜黑色素瘤样本,随后对其进行了单细胞转录组分析(scRNA-seq)。在至少 12 个月的随访期内未出现已知转移的 CoM 患者的原发性肿瘤组织归类为稳定肿瘤组(ST 组),而发生远处转移的患者的原发性肿瘤组织归类为远处转移性肿瘤组(DMT 组)。他们还纳入了更多患者作为验证队列 2,以通过免疫荧光 (IF) 染色分析目标蛋白的表达水平。该 IF 队列包括 13 例良性结膜病变、18 例原发性 CoM 病变(包括 10 例稳定性 CoM 和 8 例远端转移性 CoM)和 2 例来自远处转移性 CoM 患者的远端转移性病变(1 例皮下转移性样本和 1 例肺转移性样本)。此外,他们还纳入了 10 个额外的 CoM 样本进行空间蛋白质组分析(验证队列 3),以验证所鉴定的分子畸变(图1a)。
降维分析用于显示黑素细胞/黑素瘤细胞,基质细胞和其他非恶性细胞类型的异质性,其中细胞根据已建立的基因标记进行聚类和定义(图1b)。具体而言,TME 和非恶性组织中注释的细胞类型包括黑素细胞/黑色素瘤细胞(以DCT和PAX3标记)、T 细胞(以PTPRC、CD3D和CD3E标记)、B 细胞(CD79A、MS4A1和CD19)、浆细胞(ICHAIN和TNFRSF17)、单核细胞(CSF1R、C1QA和VCAN)、中性粒细胞(CSF3R和FCGR3B )、肥大细胞(MS4A2和CPA3)、内皮细胞(PECAM1和VWF)、成纤维细胞(DCN和COL1A1)和上皮细胞(EPCAM和KRT5)(图1c)。
在定义了个体细胞亚群类型以及根据发生远处转移的可能性划分的临床亚群类型后,分析了每个样本中细胞类型的比例。良性病变、ST CoM 病变和 DMT CoM 病变中的细胞比例差异很大,但细胞亚群类型是相同的,包括黑色素细胞/黑色素瘤细胞、上皮细胞、内皮细胞、成纤维细胞、T 细胞、B 细胞、浆细胞、中性粒细胞、肥大细胞和单核细胞(图1d)。由于来源不同,Nevus 与 CoM 样本的细胞类型组成相似。均匀流形近似和投影 (UMAP) 分析可视化了良性病变和 CoM 病变的分布,根据样本采集自的患者的随访情况,进一步分为 ST 组和 DMT 组(图1e-g)。总的来说,在 ST 和 DMT 组中观察到个体肿瘤在组成上存在显著的异质性。
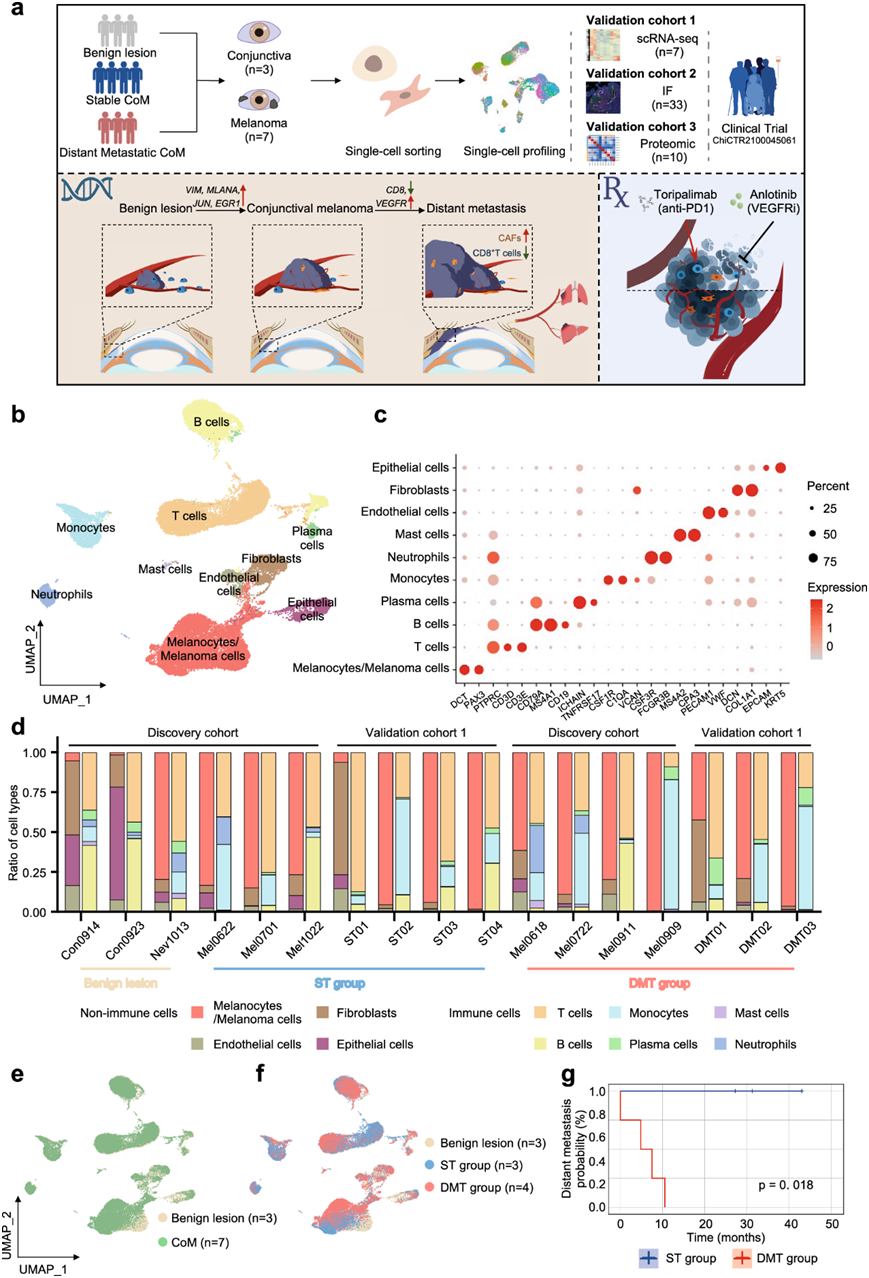
图1. scRNA-seq 注释的 CoM 和非恶性结膜样本中细胞类型的多样性。
(a) 实验策略示意图。(b) UMAP图显示了 CoM 和非恶性结膜组织中不同细胞类型的注释。(c) 点图显示不同细胞类型中特定细胞标记基因的表达水平。(d) 条形图表示注释细胞类型的比例。 (e-f) UMAP 图按颜色显示细胞起源。(g) scRNA -seq 队列中 ST(蓝色)和 DMT(红色)组的 CoM 患者基于远处转移的无进展生存期。
02
转录轨迹分析确定了 CoM 肿瘤发生和进展过程中多种致癌信号通路的激活
他们对 3041 个非恶性黑色素细胞和 11964 个黑色素瘤细胞进行了转录轨迹分析。推断的状态转变轨迹表现出两种不同的谱系,从初始状态到最终状态呈现出分叉状态。根据转录状态,这些谱系可进一步分为三个不同的聚类(图2a)。两种谱系均起源于共同的祖细胞状态,随后在中间状态之后出现分化,一种谱系发展为黑色素瘤细胞,另一种谱系分化为黑色素细胞(图2b-c)。黑色素细胞主要存在于一种终末状态(聚类2),而黑色素瘤细胞分布于未分化的祖细胞状态(聚类1),另一种则为已确定的终末分化状态(聚类3)(图S4a)。然后,他们使用 Monocle 2 分别分析了每个聚类的轨迹,采用分支表达分析模型 (BEAM) 和层次聚类来识别跨状态富集的基因。沿着这一轨迹,黑色素瘤细胞中聚类3 的基因特征是激活某些功能通路,包括细胞粘附通路 (VIM)、免疫反应信号通路 (JUN和EGR1)和黑素体组织信号通路 (MLANA)(图2d-e)。一致的是,对验证队列 2(包括 13 个良性结膜病变和 18 个原发性 CoM 病变)进行的 IF 分析显示,在恶性结膜黑色素瘤样本中,这些标志基因的表达水平升高(图2e-f)。
为了更深入地研究 CoM 的进展,他们利用 Monocle 算法对黑色素瘤细胞进行伪时间分析,目的是描绘出它们在 ST 和 DMT 组中的进化轨迹(图S4b)。利用转录状态的伪时间顺序将总共 3 个细胞聚类分为 3 个主要分支(图S4c-d)。在按临床结果分类的亚组水平上,观察到 ST 组的黑色素瘤细胞主要集中在聚类1 和聚类3 中,而聚类2 主要由 DMT 组贡献(图S4e-f)。为了更深入地了解驱动 CoM 进展的因素,他们利用并比较了 BEAM 中进展轨迹上的标记基因(图S4g)。值得注意的是,在聚类 2 中观察到一系列激活的信号通路,包括糖酵解和谷胱甘肽代谢。值得注意的是,这些信号通路还支持 SKCM 和其他粘膜黑色素瘤的远端转移。总之,这些观察结果阐明了 CoM 开始和进展期间的情况,可能表明 CoM 和其他黑色素瘤变体之间存在类似的转化模式。
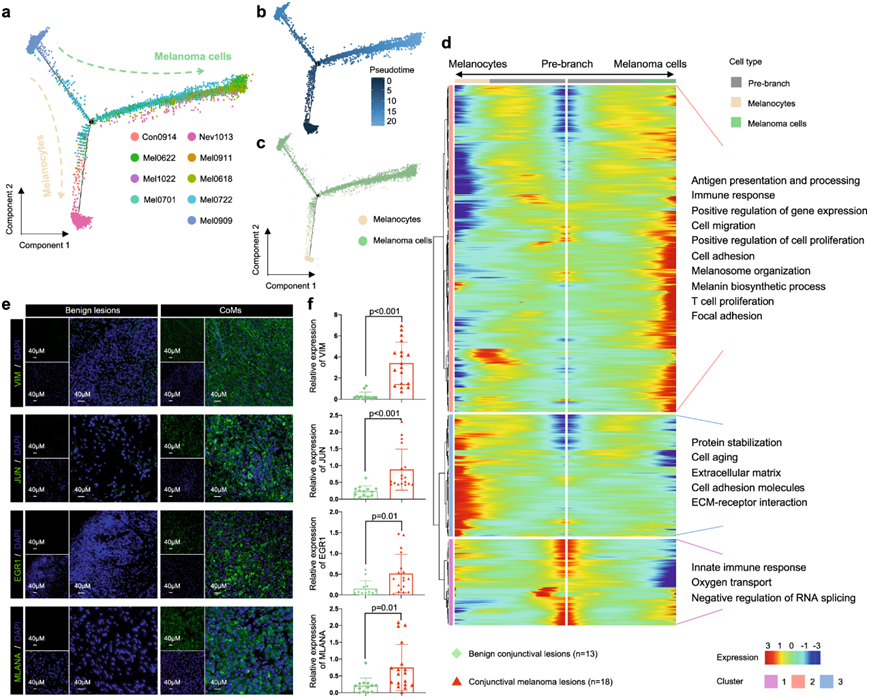
图2. 差异基因表达特征揭示了 CoM 肿瘤发生和转移的触发因素。
(a) 所有结膜样本中 3041 个黑色素细胞和 11964 个黑色素瘤细胞的转录轨迹分析。(b) 分化过程的转录轨迹。(c) 采用伪时间分析比较黑色素细胞和黑色素瘤细胞之间的分布。(d) 热图显示分化过程中上调或下调的基因。(e) 验证队列中 FFPE 组织中 IF 染色的代表性图像。(f) 基于IF 染色结果,验证队列中非恶性结膜病变(绿色)和 CoM 组织(红色)中 VIM、JUN、MLANA 和 EGR1 的平均表达。
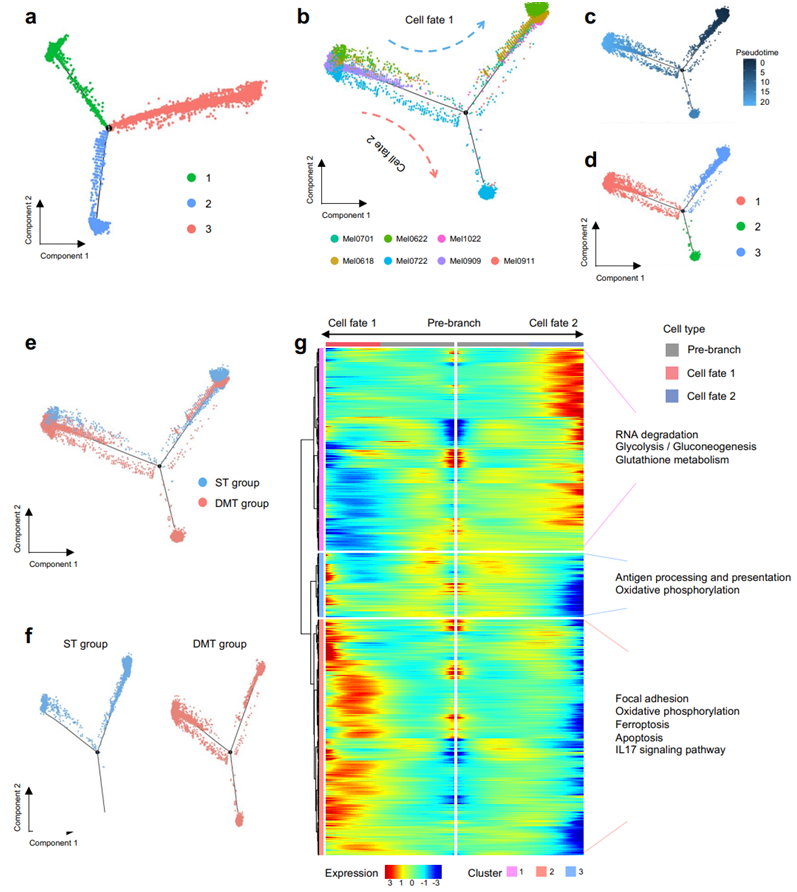
图S4. CoM的转录轨迹分析。
(a) 不同过程的转录轨迹用聚类表示。(b) ST组和DMT组所有黑色素瘤细胞的伪时间状态。(c-f) 转录轨迹分析显示黑色素瘤细胞的不同过程。(g) 热图显示分化过程中基因的上调或下调。
03
CAF通过增强血管生成来支持远处 CoM 转移
基质成纤维细胞是TME的重要组成部分,有助于肿瘤进展以及免疫治疗耐药性。然后,他们根据癌症相关成纤维细胞 (CAF)(FAP、IL1R1、MMP2和PDGFRA)和肌成纤维细胞(TAGLN、MYL9、TPM1和TPM2)标志基因的表达,检测并探索了基质成纤维细胞(包括CAFs和肌成纤维细胞)的特征(图3a-b)。DMT组比ST组观察到更多的CAF(图3c)。DMT组中大量的CAF表明,在CoM的DMT样本中,CAF具有致癌作用。
CAF与血管内皮系统表现出强烈的正相关性,包括 CAF-动脉、CAF-静脉和 CAF-毛细血管相互作用增强。此外,在 CAF中观察到一系列血管生成信号通路的 GSVA 评分升高,包括内皮细胞增殖和迁移(图3e)。这些结果表明 CAF与血管共有许多血管生成标志物。
通过 Matrigel 管形成试验评估,CAF 增强了人脐静脉内皮细胞 (HUVEC) 的管形成能力(图3f-g)。他们进一步推测,CAF促进血管生成并形成纤维血管微环境,这两者都对肿瘤进展起着积极作用。为了全面重现原发性和远处转移性 CoM 的分子特征,他们收集了验证队列 2 中的 ST 和 DMT 患者的原发性和远处转移性病灶,并评估了 FAP、CD31 和 VEGFR 的表达。与之前的观察结果一致,CAF通常缠绕内皮细胞以形成纤维血管微环境 (图3h)。具体而言,他们观察到FAP 与血管标志物(CD31和VEGFR)之间存在正相关的表达(图3i-j)。总之,这些结果表明血管生成过程中的 CAF 激活有助于 CoM 远处转移(图3k)。
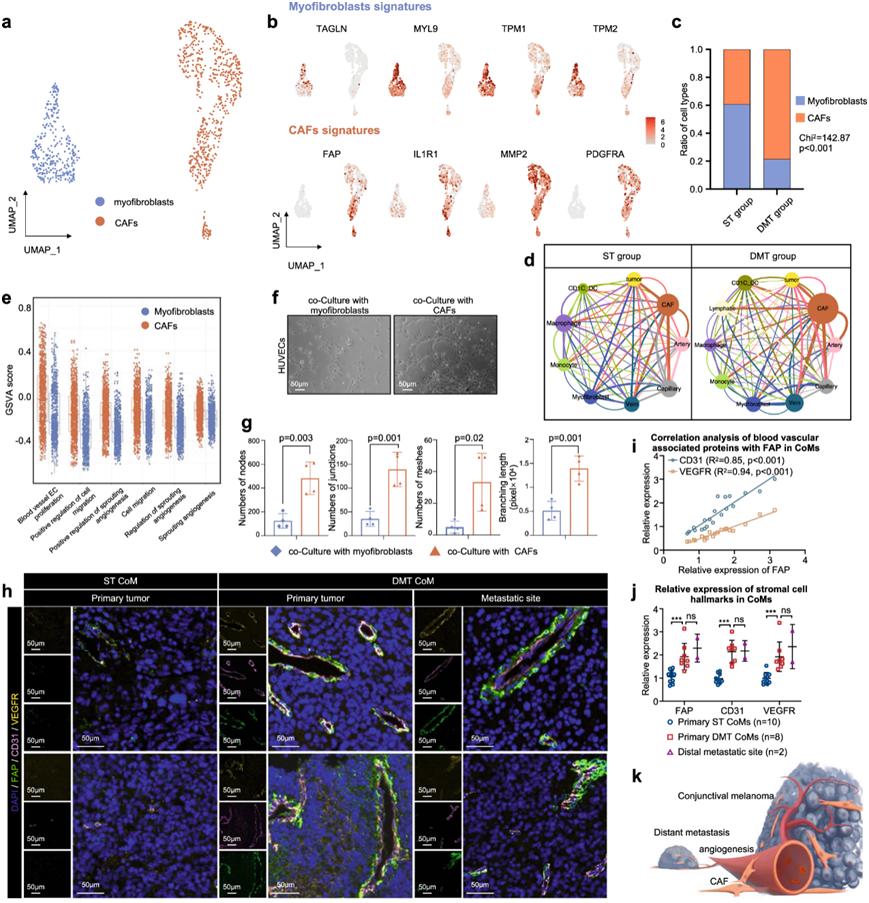
图3. CAF 的转录组特征表明它们通过增强血管生成在促进远处转移中发挥潜在作用。
(a) UMAP 图显示源自 ST 和 DMT 患者的 CAF 亚型。(b) UMAP图说明肌成纤维细胞(TAGLN、MYL9、TPM1和TPM2)和 CAF(FAP、IL1R1、MMP2和PDGFRA)的标志基因表达。(c) 条形图显示 ST 和 DMT 样本中 CAF 和肌成纤维细胞的比例。(d) ST 和 DMT组中 CAF、血管内皮细胞、肿瘤和免疫微环境的通讯网络。(e) 肌成纤维细胞和 CAF 中血管生成 GSVA 评分的箱线图。(f-g) HUVEC 管形成试验显示肌成纤维细胞和CAF对 HUVEC 小管形成的影响。(h) ST组和 DMT 组的 FAP(CAF 标志物)、VEGFR 和 CD31 的 IF 染色。(i) 血管相关蛋白与 CoM 中的 FAP 的相关性分析。(j) 根据IF 染色的结果,原发性 ST CoM、原发性 DMT CoM 和远端转移部位中基质细胞标志的相对表达。(k) 示意图显示了它们通过增强血管生成在促进远处转移中的可能作用。
04
相对静止的免疫生态系统与远处转移性 CoM 相关
来自免疫微环境的信号可培养肿瘤细胞的适应性可塑性,在决定临床结果方面发挥着至关重要的作用。为了分析肿瘤免疫微环境,他们生成了免疫细胞的 UMAP 图,并检测了肿瘤样本中的平均基因表达(图4a)。已识别的免疫细胞包括 T 细胞(PTPRC、CD3E和CD3D)、B 细胞(CD79A、MS4A1和CD19)、肥大细胞(MS4A2和CPA3)、单核细胞(CSF1R、C1QA和VCAN)、中性粒细胞(CSF3R和FCGR3B)和浆细胞(ICHAIN和TNFRSF17) (图4b)。值得注意的是,在发现队列和验证队列 1 中,ST 组和 DMT 组之间的比例存在很大的异质性(图4c)。他们在所有 CoM 中都观察到极少的肥大细胞和中性粒细胞浸润。相反,DMT 组和 ST 组之间的其他免疫细胞组成有所不同。在发现队列和验证队列 1 中,DMT 样本中的 B 细胞和 T 细胞浸润水平均低于 ST样本中的 B 细胞和 T 细胞,尤其是 CD8 + T 细胞(图4d)。总之,这些结果表明,虽然存在如此显著的异质性,但不同的免疫微环境与 CoM 患者的转移结果有关。
他们进一步应用降维分析来说明 T 细胞的异质性。如 UMAP 图所示,T 细胞根据标记基因的平均表达水平聚类为 9 个亚型(图4e)。与 scRNA-seq 结果一致,在远处转移性 CoM 组织中观察到较低比例的 CD8 + T 细胞,包括验证队列 2 中的原发性病变和转移性病变(图4f-g)。ST和 DMT 样本中的CD8 + T 细胞表现出不同的转录组谱,与 ST 样本相比,DMT 样本的CD8 + T 细胞中 216 个基因上调,173 个基因下调(图4h)。一致地,这些下调的基因在免疫相关通路中富集,包括抗原加工和呈递、T 细胞分化和自身免疫性疾病(图4i)。总的来说,这些数据表明远端转移性 CoM 中的免疫生态系统表现出 CD8+ T 细胞浸润水平降低,导致远端转移性 CoM 中的免疫环境相对不活跃。
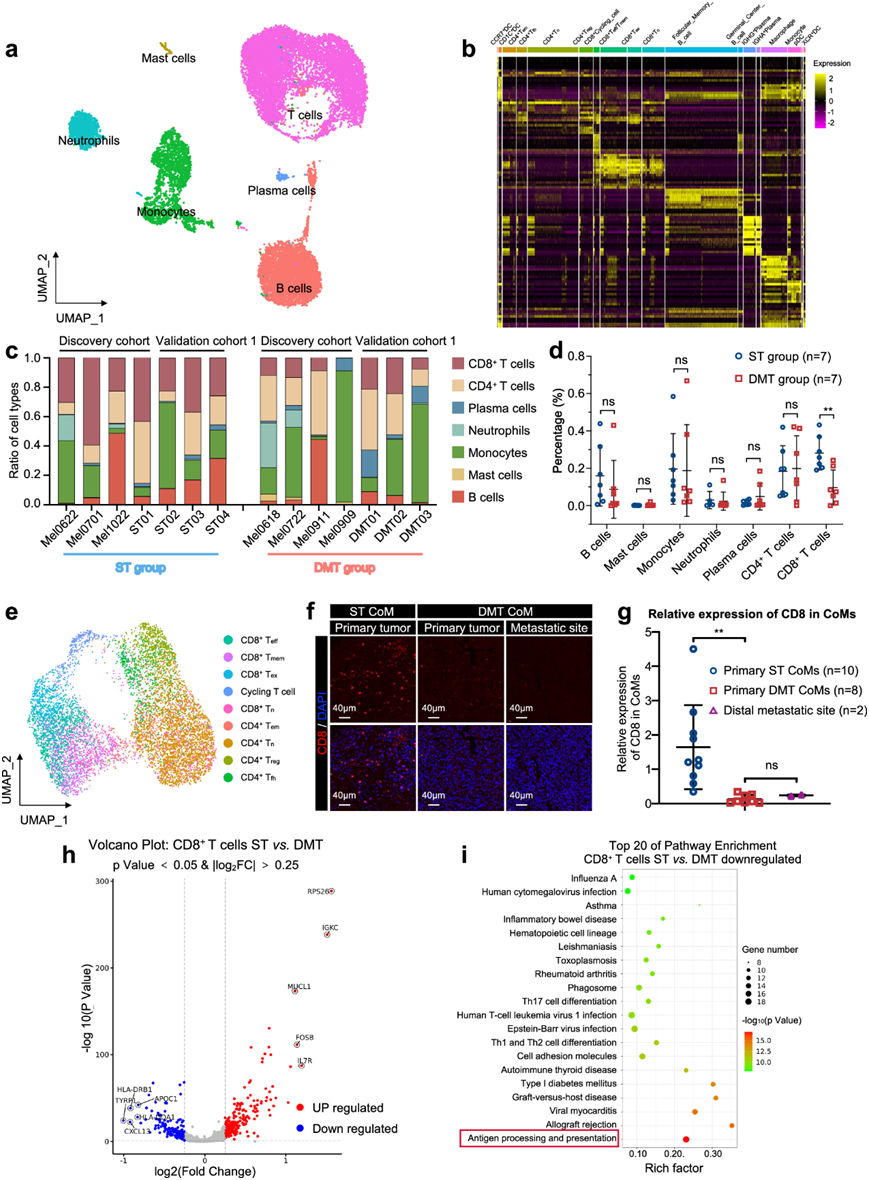
图4. CoM 中肿瘤免疫微环境特征。
(a) UMAP 图显示 CoM 样本中的免疫细胞类型。(b) 热图显示每种免疫细胞亚型中标记基因的表达水平。(c) 条形图显示 ST 组的 7 个样本和 DMT 组的 7 个样本中注释细胞类型的比例。(d) 来自发现队列和验证队列 1 的 ST 组和 DMT 组中每种免疫细胞亚群的比例。(e) UMAP图显示发现队列中所有 7 个 CoM 样本的 T 细胞亚群。(f) 分别来自 ST 和 DMT 组的 CoM 组织切片和远端转移部位的 CD8 抗体 IF 染色。(g) 根据IF 染色的结果,原发性 ST CoM、原发性 DMT CoM 和远端转移部位中 CD8 的平均表达。(h) ST组和 DMT 组之间CD8 + T 细胞中差异表达基因的火山图。(i) ST 组和 DMT 组之间 CD8 + T 细胞中下调基因的气泡图富集通路。
05
分析远处转移性 CoM 中功能性 CD8 + T 细胞
随后,他们应用降维分析进一步说明 CD8 + T 细胞的异质性。如 UMAP 图所示,根据以前的方法,CD8 + T 细胞根据标记基因的平均表达聚类为 5 个亚型(图5a)。为了展示 CD8 + T 细胞的详细功能亚群,他们比较了 ST 组和 DMT 组之间的细胞比例。具体而言,在 DMT 组中观察到CD8 +幼稚 T 细胞 (Tn) 的细胞比例显著升高(图5b)。DMT组CD8+ T细胞IL7R、LEF1、SELL和CCR7的表达增加,出现幼稚和功能失调的表型(图5c)。由于幼稚 T 细胞群的细胞毒性降低,这在转移性肿瘤中观察到,表现为常规功能性 CD8+T 细胞浸润减少,这表明 T 细胞重编程在远端转移性 CoM 中起着至关重要的作用。
为了进一步评估DMT样本中免疫生态系统的功能效应,他们分离了CD8 + T细胞,并比较了ST和DMT组分离样本中每个亚群的浸润情况。DMT组中大多数CD8 + T细胞亚群的浸润水平低于ST组,DMT组中CD8 +效应T (Teff )细胞和CD8 +记忆T (Tmem)细胞的比例明显较低(图5d)。此外,在ST和DMT(原发性和转移性病变)组中,IF染色证实了CD8+ T细胞的独特特征,包括功能失调亚群比例升高(通过初始T细胞标记物SELL检测)和功能亚群浸润减少(通过有效T细胞标记物GZMK检测)(图5e-f)。总的来说,功能失调的 Tn细胞比例升高和 CD8 + Teff /Tmem细胞浸润低造成了静止微环境,将远端转移性 CoM 称为排除功能性T细胞的“冷”肿瘤(图5g)。
为了研究 TME 的蛋白质组学模式,他们对 10 个采样良好的福尔马林固定石蜡包埋 (FFPE) 原代 CoM 进行了空间蛋白质组学分析。总的来说,他们分离了 10 个 CoM 样本通过 LC-MS/MS 分析,定量了总共 3514 种蛋白质,其中 66 种上调,48 种下调(图5h)。重要的是,DMT 样本表现出增强的血管生成能力,CAF 标记物(FAP和IGF2)表达增加,肌成纤维细胞标记物(MYL9)表达减少,功能性 T 细胞标记物(GZMK标记的CD8+ Teff细胞)表达减少,与发现队列的发现一致。这些发现与转移性 CoM 的 TME 内观察到的 CAF 介导的血管生成和功能失调的 T 细胞增加相一致(图5i)。
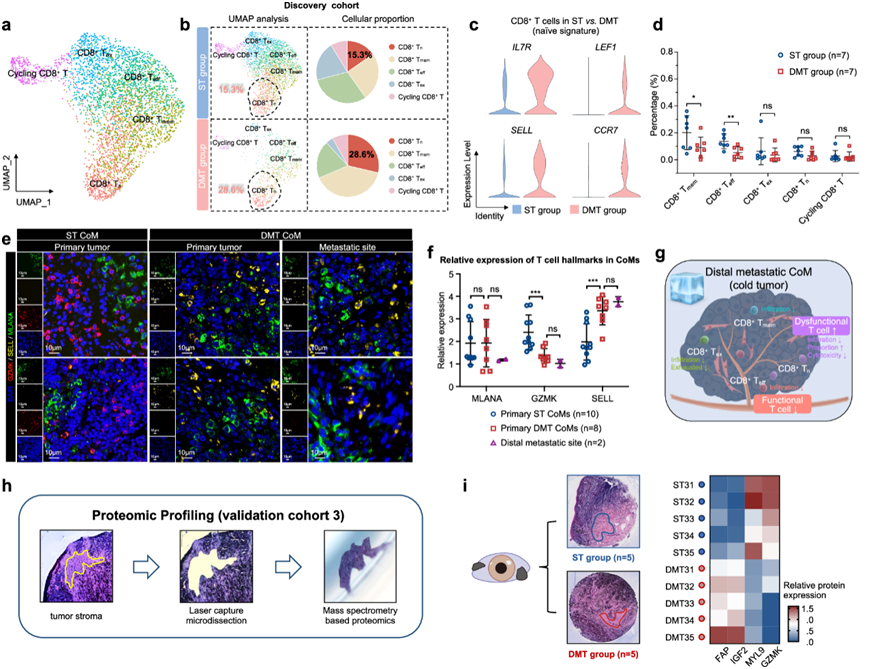
图5. CD8 + T 细胞在远处转移性 CoM 独特的免疫微环境中发挥着至关重要的作用。
(a) UMAP 图显示所有 7 个 CoM 样本的 CD8 + T 细胞亚群,以不同颜色标记。(b) 分析了 ST 组和 DMT 组之间特定 CD8 + T 细胞亚群的比例(左)。饼图显示 ST 和 DMT 组中 CD8 + Tn细胞的比例(右)。 (c) 小提琴图显示ST 和 DMT 组中 CD8 + T 细胞幼稚特征的表达。(d) 分析了发现队列和验证队列 1 中 ST 组和 DMT 组之间特定 CD8 + T细胞亚群 的浸润百分比。 (e) IF 染色验证 ST 和 DMT 样本中免疫微环境的特征。(f) 根据IF 染色的结果,原发性 ST CoM、原发性 DMT CoM 和远端转移部位中 MLANA、GZMK 和 SELL 的相对表达。(g) 显示远处转移性 CoM 中CD8 + T 细胞变化的示意图。(h) 组织形态学特征。(i) ST组和 DMT 组之间的差异表达蛋白质。
06
VEGFR 阻断联合抗 PD1 疗法可促进远处转移性 CoM 患者的临床疗效
为了研究 VEGFR 阻断剂 (Apatinib)与抗 PD1 (Camrelizumab) 疗法相结合的临床效果,招募并记录了一组患有远端转移的患者。患者 CoM-10 在通过 PET/CT 识别出多个肝转移后接受了 VEGFR 抑制剂 (VEGFRi) 和抗 PD1 治疗。按照为期 5 个月的标准治疗方案后,该患者的影像学评估显示病情稳定(图6a)。患者在病情稳定 14 个月后出现进展,从病情稳定到因脑转移死亡经历了 22.42 个月的随访。患者 CoM-11 于 2021 年通过 PET/CT 诊断为远处转移,显示癌细胞转移到左肺上叶和下小叶。经过 3 个疗程的抗 VEGFR 和抗 PD1 治疗后,没有病情进展的迹象(图6b)。截至2023年8月最新随访,患者存活,伴有肿瘤。计算并比较肿瘤负荷。根据RECIST 1.1标准,VEGFR阻断联合抗PD1治疗后,两例患者的肿瘤负荷均减轻(图6c)。总的来说,VEGFR 阻断联合抗 PD1 疗法可以作为针对远处转移的 CoM 患者的新治疗策略(图6d)。
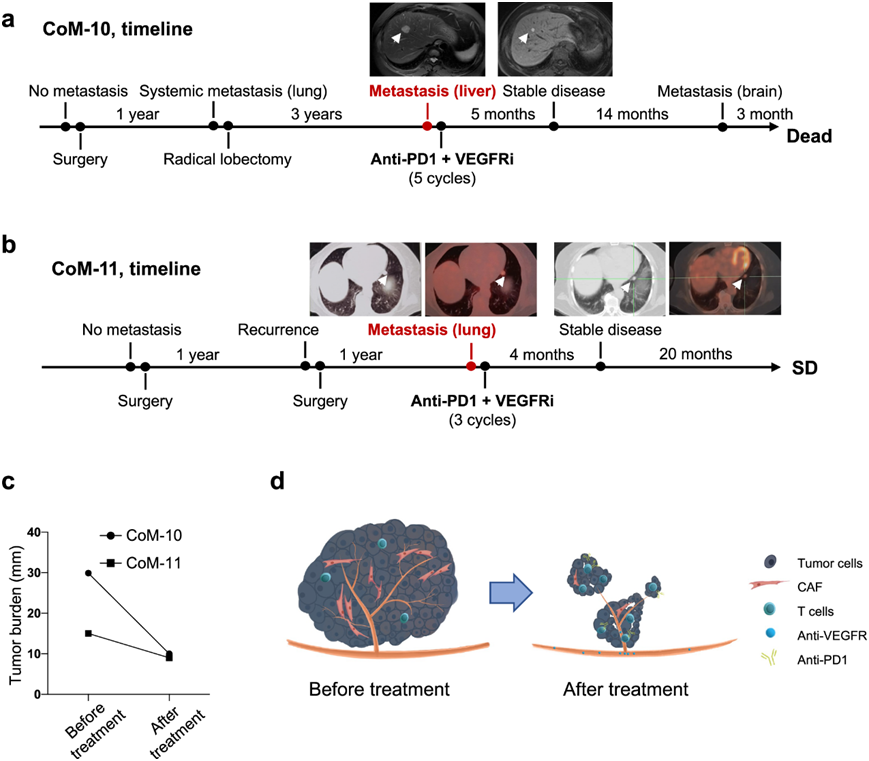
图6. VEGFR 阻断联合抗 PD1 治疗在全身转移性 CoM 患者中的临床试验。
(a) 接受 VEGFR 阻断联合抗 PD1 疗法治疗的 CoM-10 患者放射学随时间的变化。 (b) 患者 CoM-11 的CoM进展和治疗图。(c) 患者肿瘤负荷随时间的变化。(d) 临床试验可能的潜在机制示意图。
+ + + + + + + + + + +
结 论
本项研究对从正常结膜样本和结膜黑色素瘤中获得的 47017 个细胞进行了scRNA-seq。值得注意的是,肿瘤微环境 (TME) 中癌相关成纤维细胞 (CAF) 的丰度较高,这与远端转移性 CoM 中增强的血管生成能力和增加的 VEGFR 表达相关。此外,总 CD8 + T 细胞比例显著下降,幼稚 CD8 + T 细胞比例增加,导致远端转移性 CoM 中的免疫环境相对静止。通过分析 7 个 CoM 样本的 70303 个单细胞转录组数据以及另外 10 个 CoM 样本的空间分辨蛋白质组数据,证实了这些发现。由于远端转移性 CoM 中 VEGFR 介导的血管生成增加和 T 细胞环境活性降低,已启动一项临床试验 (ChiCTR2100045061),以评估 VEGFR 阻断联合抗 PD1 疗法对远端转移性 CoM 患者的疗效,显示出良好的肿瘤抑制效果。总之,该研究揭示了 CoM 肿瘤发生和进展过程中 TME 的景观和异质性,为远端转移性 CoM 管理的临床决策提供了帮助。
+ + + + +



 English
English


