文献解读|Cell Stem Cell(19.8):利用多层蛋白质组学解读小鼠原肠胚早期胚胎发生过程中的谱系特征
✦ +
+
论文ID
原名:Deciphering lineage specification during early embryogenesis in mouse gastruloids using multilayered proteomics
译名:利用多层蛋白质组学解读小鼠原肠胚早期胚胎发生过程中的谱系特征
期刊:Cell Stem Cell
影响因子:19.8
发表时间:2024.05.10
DOI号:10.1016/j.stem.2024.04.017
背 景
原肠胚形成是胚胎发育的关键阶段,在此期间胚层形成。测序技术的进步促成了控制胚层及其衍生物出现的基因调控程序的鉴定。然而,基于蛋白质组的早期哺乳动物发育研究很少。
实验设计

结 果
01
mESC 向原肠胚分化的时间分辨蛋白质组
为了评估原肠胚形成过程中的蛋白质组动态,研究者团队进行了两项生物学实验,在五个时间点从未分化的 小鼠胚胎干细胞 (mESC)到 120 小时的原肠胚中收集样本(图 1 A)。无标记定量 (LFQ) 质谱法在两个实验中鉴定了 5079 种蛋白质。在两个生物学重复中观察到 87% 和 95% 的蛋白质重叠(图 S1 A)。样品之间的相关性很高(图 S1 B)。主成分分析 (PCA) 按时间点分离样品,揭示分化过程中不同的蛋白质表达模式(图 1 B)。为了研究蛋白质随时间表达的动态,他们使用层次聚类进行了差异表达分析(图 1 C-D)。与所有定量蛋白质相比,差异表达蛋白质显示出相似的蛋白质丰度分布,并且高丰度蛋白质在翻译和 RNA 加工中富集(图 S1 C)。聚类3 中的蛋白质主要在分化时下调,包括 SOX2 和 PRC2 复合物的成员。聚类4 中的蛋白质(例如 OCT4 和 DNMT3A)在 48 和 72 小时的类原肠胚中表现出最高表达。聚类1 包含在类原肠胚分化过程中上调的蛋白质(例如 CTNNB1、NES 和 T),而聚类2 中的蛋白质在 48 小时下调,然后在稍后的时间点强烈诱导。正如预期的那样,GO富集分析显示 120 小时类原肠胚中“细胞对白血病抑制因子 (LIF) 的反应”受到抑制,而动物器官形态发生、Wnt 信号传导和与神经元发育相关的通路发生富集(图 1 E)。
为了探索整体 mRNA 和蛋白质表达动态之间的关系,他们生成了所有时间点的转录组分析(RNA-seq) 文库。将 RNA-seq 数据与公开发表的原肠胚 RNA-seq 数据进行比较,发现转录组谱高度一致(图 S1 D -F)。一组差异表达蛋白质在蛋白质和转录本水平上显示出相似的动态(图 S1 G),这与之前的研究一致。蛋白质和mRNA表达动态之间强相关性的基因富集于与代谢和表观遗传过程相关的通路(图 1 F-G)。相比之下,相关性较低的基因在与核糖核蛋白复合物和细胞周期相关的生物过程中富集(图 1 H-I)。
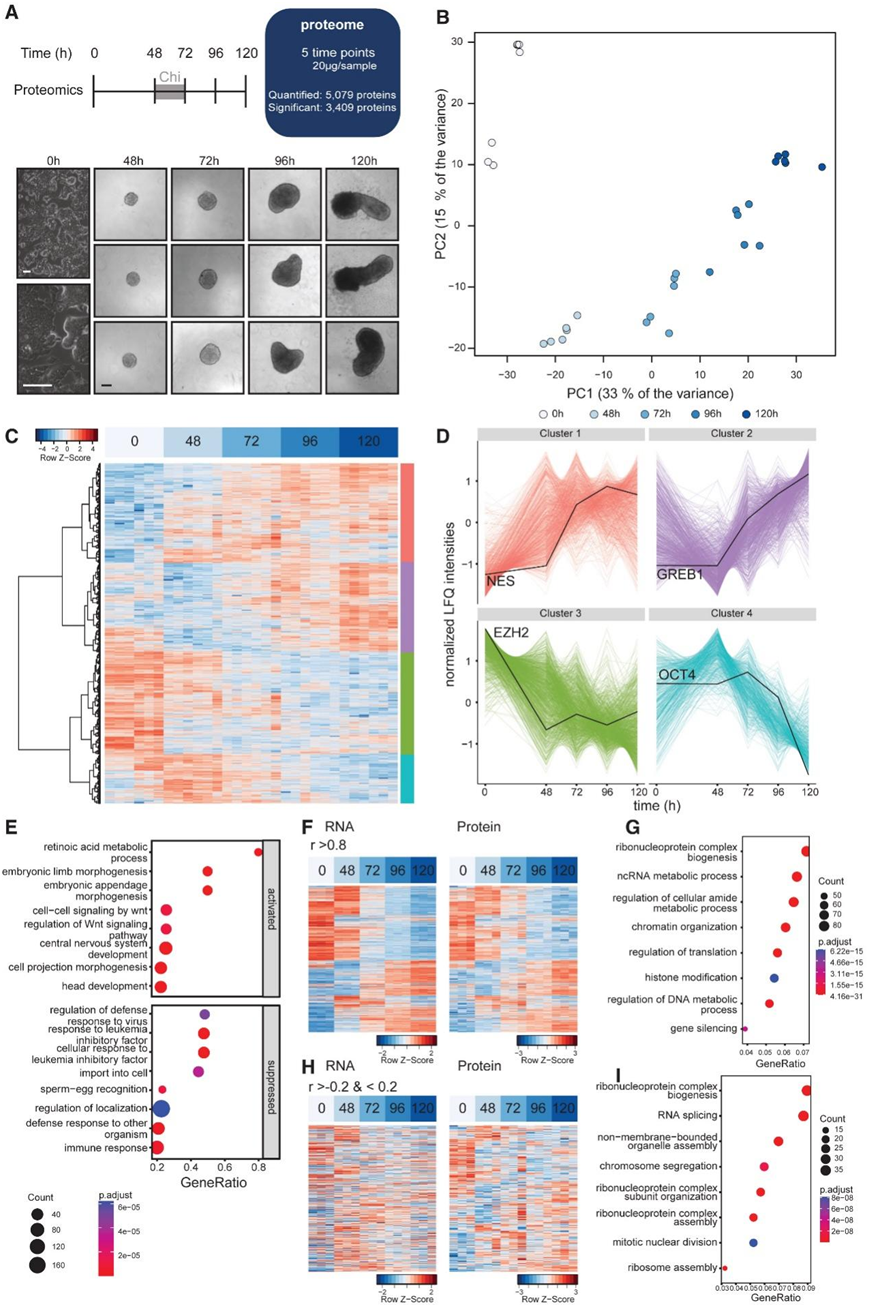
图1. mESC 向 120 小时原肠胚分化的时间分辨蛋白质组分析。
(a)示意图显示,在原肠胚分化过程中,对 0、48、72、96 和 120 小时的蛋白质组进行分析。(B) 使用重叠蛋白质 (5079) 的 LFQ 强度进行 PCA。(c)不同时间点显著表达的蛋白质的热图。(d) 每个聚类的差异表达蛋白质图。 (e) gseGO 结果显示 120 小时类原肠胚中抑制和激活的 8 个生物过程。 (f) 热图显示显著变化蛋白质的相对 mRNA(左)和蛋白质(右)表达。(g) GO分析。(h) 热图显示显著变化蛋白质的相对 mRNA(左)和蛋白质(右)表达。 (i) GO分析。

图S1. 胃原体分化过程中的蛋白质组学和转录组学分析。
(a) 两个生物实验中定量蛋白的重叠。(b) 样本间log2归一化LFQ强度的Pearson相关性。(c) log2归一化蛋白强度分布的直方图。 (d) 使用前1000个可变表达基因进行批量校正后的主成分分析(PCA)。(e) 热图显示了两个数据集中所有成对组合样本的基因表达的Pearson相关系数。(f) 与胚胎发育相关的选定基因按比例表达的热图。(g) 直方图显示按基因计算的mrna-蛋白相关性的分布。
02
小鼠原肠胚与自然胚胎间蛋白质时间表达谱比较
鉴于小鼠原肠胚模仿植入后发育的关键方面,基于比较蛋白质组学的原肠胚和植入后小鼠胚胎分析是必不可少的(图 2 A)。他们选择了胚胎第 7.5 天至第 9.5 天的胚胎,因为之前的转录组分析显示原肠胚分化大致对应于 E6.5(24 小时原肠胚)、E7.5–8.0(72 小时原肠胚)和 E8.5–9.5(120 小时原肠胚)胚胎的细胞群。鉴于原肠胚表现出与胚胎后部相当的发育特征和组织,小鼠 E8.5 和 9.5 胚胎分别解剖成前部和后部(缺少头部区域)或仅后部。他们总共在小鼠胚胎中鉴定了 5998 种蛋白质。他们观察到的胚胎珠蛋白和肌球蛋白重链蛋白的差异表达,特别是在 E9.5 时表达,分别表明与红细胞生成和心肌发育相关的过程(图 2 B-C)。从 E6.5 至 8.5 小鼠胚胎的公共 scRNA-seq 数据证实了胚胎珠蛋白基因表达增加,特别是在胚胎发育的后期时间点。在 E7.5 胚胎中,观察到了多能性相关蛋白的表达,例如 POU5F1、DNMT3B 和 UTF1。主成分 2 捕获了前部和后部样本之间的差异。差异表达的蛋白质包括已知的后部(CDX4 和 HOXB9)和前部蛋白质(DDX10)(图 2 D)。特别重要的是 RPL38 的前部表达,该蛋白质通过特异性控制 Hox mRNA 的翻译参与轴向骨骼模式形成(图 2 E)。
然后,他们比较了小鼠胚胎和类原肠胚的蛋白质组学图谱。总共在小鼠类原肠胚和小鼠胚胎数据集中检测到了 4736 种蛋白质。PCA显示了基于发育阶段的分离,E7.5 小鼠胚胎蛋白质组与 mESC 和 48 小时类原肠胚蛋白质组最相似,E8.0-8.5 小鼠胚胎与 72 小时类原肠胚相似,E9.5 小鼠胚胎与 96-120 小时类原肠胚最一致(图 2 F),观察到与多能性、神经元发育和体节分化相关的特定蛋白质表达的类似变化(图 2 G-H)。总之,蛋白质组学分析表明小鼠原肠胚和小鼠胚胎之间的蛋白质表达谱具有很好的重叠性。
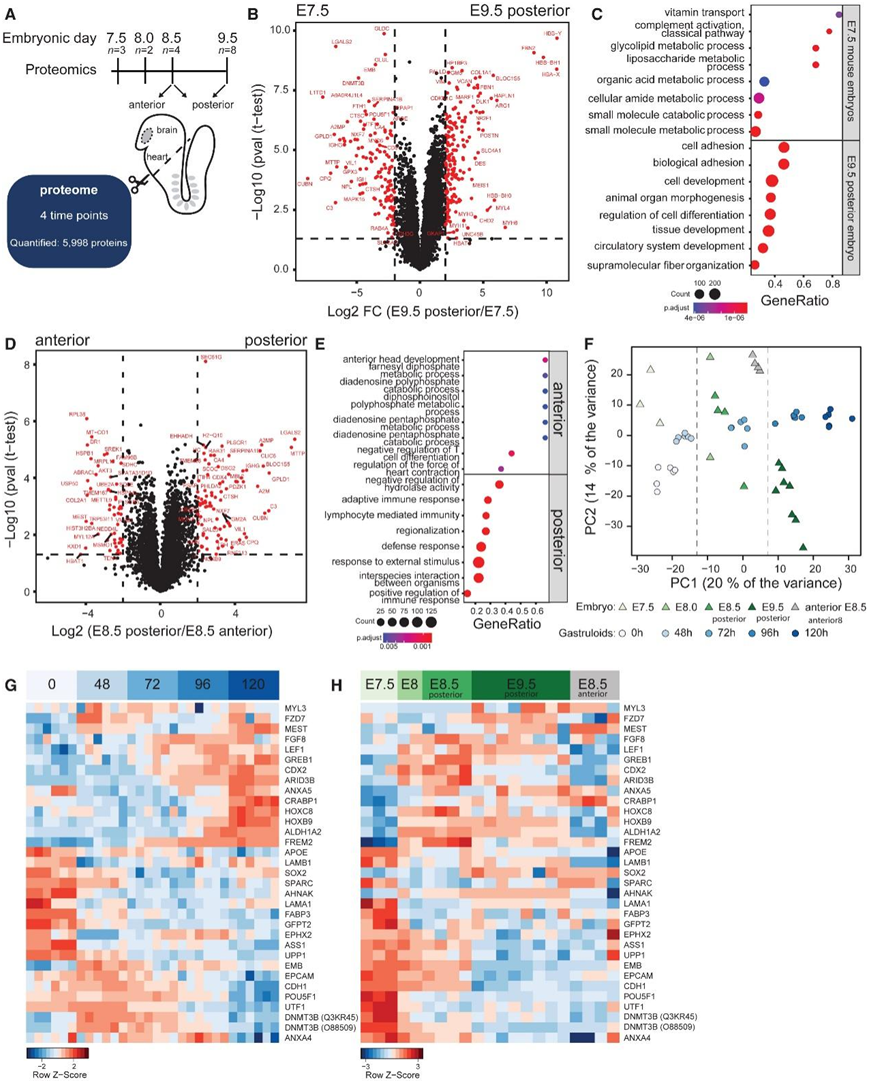
图2. 小鼠胚胎的蛋白质组分析以及与小鼠类原肠胚的比较。
(a) 对四个胚胎阶段的蛋白质组进行了分析。(b) 火山图显示小鼠胚胎在 E7.5 和 9.5 之间的蛋白质表达水平变化。(c) gseGO 结果显示 E7.5 或 9.5 小鼠胚胎中富集最多的 8 个生物过程。(d) 火山图显示 E8.5 小鼠胚胎前后样本之间的蛋白质表达水平变化。(e) gseGO 结果显示 E8.5 小鼠胚胎前半部分或后半部分中富集最多的 8 个生物过程。(f) 使用重叠蛋白质(4736 种蛋白质)的 LFQ 强度进行 PCA。(g) 与小鼠原肠胚发育相关的蛋白质的表达热图。 (h) 小鼠胚胎中与胚胎发育相关的蛋白质的表达热图。
03
mESC 向类原肠胚分化的时间分辨磷酸化蛋白质组
为了识别原肠胚形成过程中的动态信号通路,他们对未分化的 mESC、72 小时原肠胚和 120 小时原肠胚的磷酸化蛋白质组进行了分析(图 3 A),鉴定了 20380 个磷酸化位点,其中 11695 个位点在至少三次重复的条件下进行鉴定,定位概率得分 > 0.75(图 3 B-C)。在 2366 种独特蛋白质上鉴定了近 6000 个显著调节的磷酸化位点,其中大多数在未分化的 mESC 中发生磷酸化(图 3 D)。接下来,他们评估了蛋白质组和磷酸化蛋白质组之间的重叠,以探究由于总蛋白质丰度变化而导致的磷酸位点丰度变化。约 30% 的磷酸化蛋白质未在整个蛋白质组中量化。在重叠蛋白质中,1151 种蛋白质表现出差异表达和磷酸化,而 412 种蛋白质发生磷酸化变化,与蛋白质丰度的变化无关。分析类原肠胚中的信号通路表明,剪切应力信号在 120 小时类原肠胚中受到抑制,而与 RNA 剪接和胚胎发育相关的信号通路则处于活跃状态。有趣的是,差异剪接模式已知与胚胎干细胞分化有关。接下来,他们采用激酶富集分析(KEA2)技术来识别负责 mESC 和类原肠胚中蛋白质磷酸化的上游激酶。结果显示,与类原肠胚相比,未分化的 mESC 中 CDK2、CDK1、GSK3B、P38-MAPK14 和 DYRK2 的活性增加(图 3 E)。由于将原肠胚与 GSK3B 抑制剂 CHIR99021 一起培养 24 小时(时间点 48 和 72 小时之间),因此预计 GSK3B 活性会降低。
与 72 小时类原肠胚和未分化 mESC 相比,他们在 120 小时类原肠胚中发现了更多的磷酸化转录因子(图 3 F)。其中大多数属于 C2H2 型锌指转录因子家族,该家族是小鼠基因组中最大的转录因子家族(图 3 G-H)。例如,在未分化 mESC 中检测到了 Krüppel 样家族 (KLF) 成员的磷酸化残基,已知多能性调节因子。他们还观察到多个位点上的几种蛋白质发生磷酸化,包括 SALL1。SALL1 的磷酸化会抑制其与 NuRD 的相互作用并影响其转录能力。此外,他们还发现了 CTCF (S402) 上的差异磷酸化,已知这会降低 CTCF 对 DNA 的亲和力。与干细胞特异性转录因子磷酸化相反,发现同源域转录因子家族的几个成员在 120 小时的类原肠胚中发生特异性磷酸化(图 3G-I)。
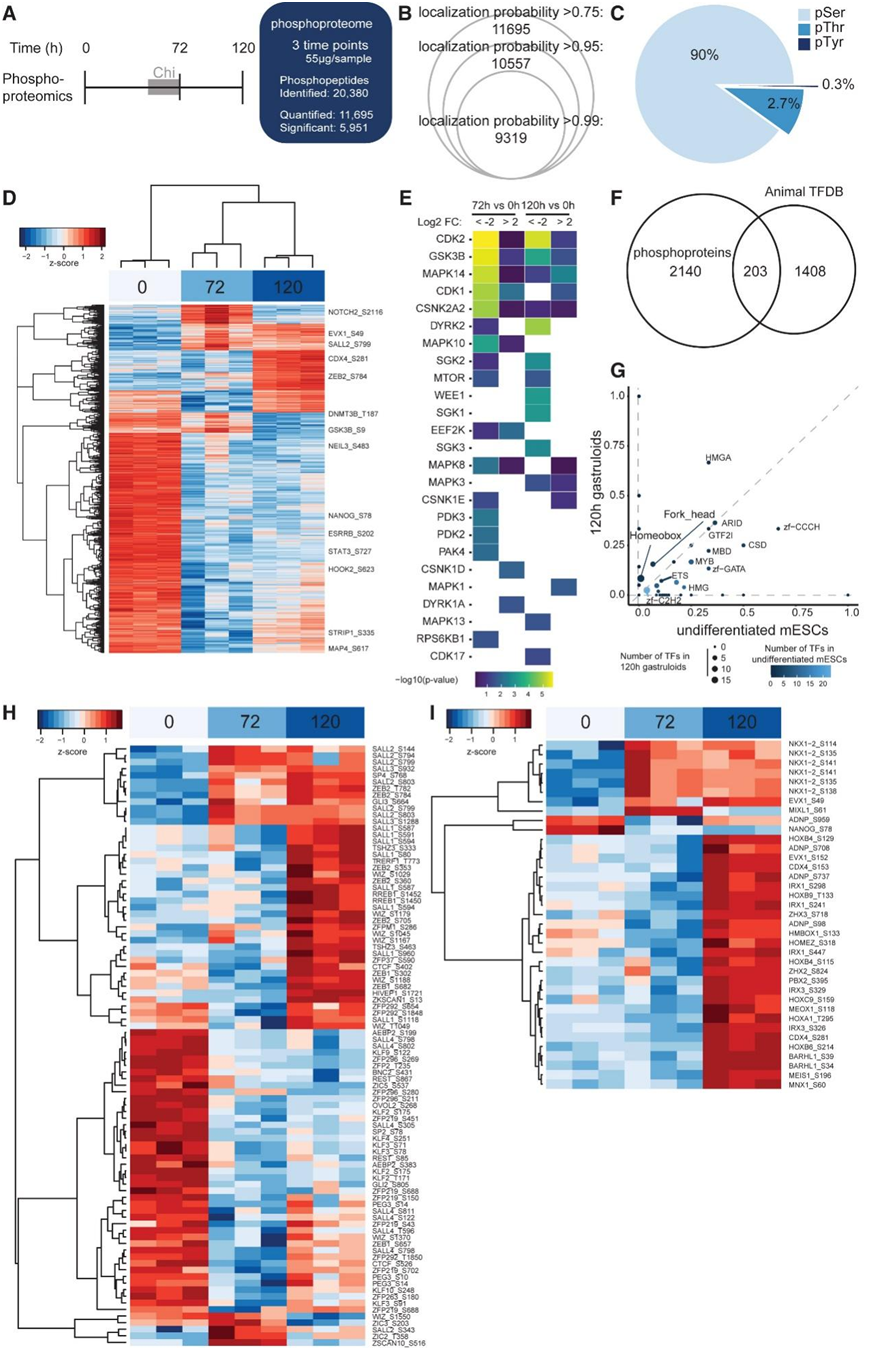
图3. mESC 向 120 小时原肠胚分化的时间分辨磷酸化蛋白质组分析。
(a) 在 mESC 向类原肠胚分化的过程中,在 0、72 和 120 小时对磷酸化蛋白质组进行分析。(b) 根据定位概率评分检测到的磷酸化位点的数量,定位概率评分指的是肽上特定磷酸化位点正确分配给特定氨基酸残基的可能性。(c) 丝氨酸、苏氨酸和酪氨酸残基中磷酸位点的分布。(d) 显著变化的磷酸位点的层次聚类。(e) 根据显著变化的磷酸位点预测上游激酶。(f) 维恩图显示了从 AnimalTFDB v4.0 数据库中显著检测到的磷蛋白和 1611 个转录因子之间的重叠。(g) 散点图显示 120 小时类原肠胚和 mESC 中鉴定为显著磷酸化的转录因子比例。(h) 属于 C2H2 锌指 (C2H2-ZF) 转录因子家族的转录因子上显著检测到的磷酸位点的热图。(i) 属于同源域转录因子家族的转录因子上显著检测到的磷酸位点的热图。
04
三个胚层表现出不同的蛋白质表达谱
为了鉴定胚层特异性蛋白质组,他们生成了一个报告基因系,其中胚层可通过不同的荧光团区分(图 4 A)。对 120 小时原肠胚的分析显示,RFP +细胞约为 4%,BFP +细胞约为 6% ,GFP +细胞 >20%(图 4 B),随后对荧光激活细胞分选 (FACS) 纯化的群体进行 RNA 表达分析,证实了胚层特异性标记基因的表达。使用蛋白质组学,他们鉴定了 4795 种蛋白质,其中 2708 种在四种细胞群之间存在差异表达(图 4 C)。对双报告细胞系的 FACS 分选细胞群进行蛋白质组学分析显示,引入第三个报告基因对 RFP +和 GFP +细胞群的蛋白质组没有明显影响。
正如预期的那样,中胚层和视黄酸信号在 BRA-GFP +细胞中富集。与细胞连接和细胞运动相关的基因集在 SOX17-RFP +细胞中富集,与三阴性人群中的神经发育过程相关的通路也发生富集。此外,他们观察到代谢过程、对 LIF 的反应和组蛋白甲基转移酶复合物在 MT1-BFP +细胞中的富集。接下来,他们进一步评估了其他蛋白质复合物的哪些成员是共同调节的。除了 PRC2 复合物成员的蛋白质丰度增加外,在 MT-BFP+ 细胞中还观察到了微型染色体维持复合物、预折叠蛋白复合物、T 复合物蛋白 1 和 eIF3 复合物的蛋白质丰度增加(图 4D)。在SOX17-RFP +细胞钟,他们观察到线粒体膜 ATP 合酶复合物、液泡 ATPase 复合物和肌动蛋白相关蛋白 2/3 复合物成员的丰度增加(图 4E)。
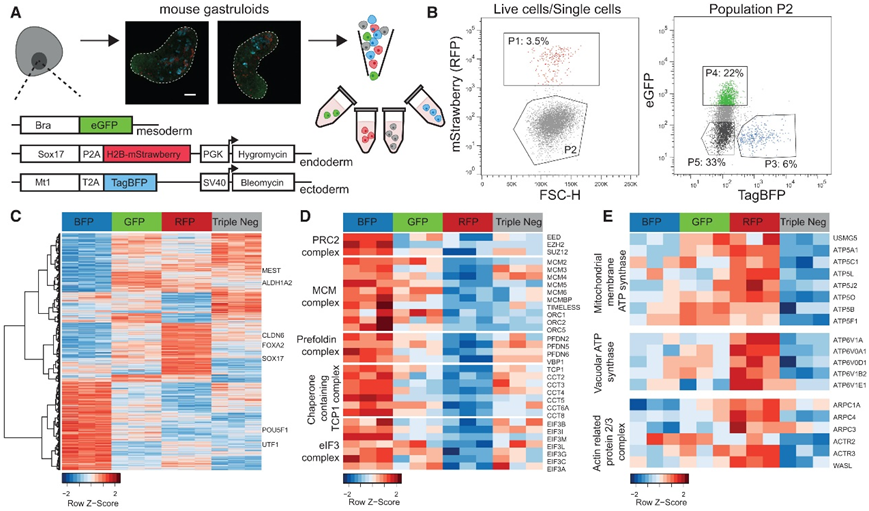
图4. 三个胚层表现出不同的蛋白质表达谱。
(a)荧光报告基因 mESC 系的示意图。 (b) 流式细胞分选策略分离荧光报告细胞和三阴性细胞群。 (c) 2708 种显著表达蛋白质的热图。(d) 热图选择属于同一蛋白质复合物的显著表达的亚基,其在 MT1-TagBFP +细胞中显示出更高的表达。(e) 热图选择属于同一蛋白质复合物的显著表达的亚基,其在 SOX17-RFP +细胞中显示出更高的表达。
05
SCP 捕获胚层特异性细胞异质性
他们接下来对 SOX17-RFP+、BRA-GFP+、MT1-BFP+ 细胞和未分化 mESC 进行了单细胞蛋白质组学 (SCP) 分析,鉴定出 2259 种至少含有两种独特肽的蛋白质,平均每个单细胞有 1541 种蛋白质。75 种差异表达蛋白质的 PCA 显示,在第一个组分上不同细胞群明显分离(图 5 A)。对主成分 1 贡献最大的 15 种蛋白质中,有参与 RNA 加工(例如 NSRP1、GTPBP1 和 UTP6)和转录调控的蛋白质,包括 CHD8 和 CARM1。所选蛋白质的表达显示在 PCA 投影上(图 5 B)。SOX17-RFP +细胞中 ANXA5 的主要表达与 scRNA-seq 数据一致,后者显示 SOX17 +内皮细胞中 ANXA5 表达较高。此外,在 144 个 SOX17-RFP+细胞中 89 个检测到 SOX17 蛋白表达。mESC 表达更高水平的 ESRRB、NDUFV1 和 NEDD8,而中胚层细胞表达更高水平的 TGM1。在成功鉴定出分选细胞群中独特的蛋白质表达谱后,他们利用未分类的解离原肠胚进行了无偏 SCP 分析。
两个实验的整合取决于使用相同的载体蛋白质组(mESC、RFP +、GFP +、BFP +和未分类细胞的等比例)。在均匀流形近似和投影 (UMAP) 投影中,可以观察到未分化的 mESC 和胚层细胞聚类的明显分离(图 5C)。只有少数类原肠胚衍生的单细胞与 mESC 聚类,而大多数类原肠胚衍生的细胞与 BRA-GFP +细胞聚类,这表明这些可能是中胚层来源的细胞(图 5 C),这对应于中胚层细胞亚型在原肠胚中占主导地位。为了提高细胞类型特异性蛋白质鉴定率,他们使用了仅含有 BRA-GFP +细胞的载体蛋白质组。总共有 363 个单细胞通过了质量控制,结果鉴定出 1822 种至少有两种独特肽的蛋白质,平均每个单细胞有 1605 种蛋白质。他们在 BRA-GFP +细胞群中鉴定了三个亚细胞群(图 5 D)。来自原肠胚 scRNA-seq 数据的注释细胞类型的基因标记的聚集蛋白质表达区分了 PSM、体节和 NMP 细胞亚型(图 5 D)。

图5. SCP 捕获胚层特异性细胞异质性。
(a) PCA 图显示基于 675 种蛋白质表达的细胞分布。(b) PCA 嵌入按 ANXA5、NEDD8、SOX17、ESRRB、NDUFV1 和 TGM1 的表达着色。 (c) 已排序和未分类的 SCP 实验的综合数据集的 UMAP 投影。(d) 基于 1822 种蛋白质表达的BRA-GFP +细胞的 UMAP 投影。
06
识别增强子相关蛋白揭示富含原肠胚的转录因子
接下来,为了便于识别可能对驱动类原肠胚细胞类型特征化很重要的转录因子,他们旨在识别 mESC 和类原肠胚中的全局增强子相互作用组。P300 乙酰化活性增强子处的 H3K27。因此,他们推断 P300 邻近生物素化将有助于识别 mESC 和类原肠胚中的增强子相互作用蛋白,包括阶段特异性转录因子。他们用 V5 标签和生物素连接酶 miniTurboID 对 P300 的 C 末端进行内源性标记(图 6 A),成功创建了纯合敲入细胞系。他们通过进行 V5 染色质免疫沉淀测序 (ChIP-seq) 实验,定位了未分化的 mESC 和类原肠胚中的活性增强子。在 mESC 和类原肠胚中,他们分别检测到 31100 个和 53474 个 P300 结合位点(图 6 B)。
接下来,将 P300 区域分为三组区域:(1)在 mESC 中富集,(2)共有,和(3)在类原肠胚中富集(图 6 C)。共有峰的平均 ChIP-seq 信号高于仅在类原肠胚或 mESC 中富集的峰(图 6 D)。正如预期的那样,基序分析揭示了 mESC 富集的 P300 位点的多能性转录因子基序(NANOG、SOX2 和 POU5F1)(图 6 E)。相比之下,原肠胚富集的 P300 位点显示出同源结构域基序的过度表达。在原肠胚的 P300 结合位点富集的其他基序包括 ZIC1/3/4、TCF7L2、SOX6 和 Forkhead box 蛋白。
转录因子基序的存在并不一定表明蛋白质结合。P300 邻近标记与定量质谱法相结合,提供了一种机会,可以无偏地绘制增强子在其天然环境中的蛋白质组成。总共有 250 种蛋白质鉴定为 mESC 中的 P300 近端蛋白质(图 6 F)。P300-miniTurboID 是生物素处理的 mESC 中富集程度最高的蛋白质(图 6 F)。他们还观察到 Mediator、SWI/SNF 复合物成员和许多转录因子的富集,包括 SALL4、NANOG、TCF7L1 和 KLF4。对于其中一种相互作用因子 PAXIP1,使用表达内源性 PAXIP1-miniTurboID 的 mESC 进行了相互邻近标记实验。在类原肠胚中进行邻近标记产生了 161 个 P300 近端蛋白(图 6 G)。
与 mESC 相比,P300 蛋白本身在类原肠胚中的富集程度并不高,这可能是由于用于培养类原肠胚的 Ndiff227 培养基中的内源性生物素引起的自身生物素化。在没有外源生物素刺激的情况下,在类原肠胚中检测到的 P300 肽(80 种肽)比未处理的 mESC(<10 种肽)更多。他们鉴定了 64 种类原肠胚特异性 P300 近端蛋白,其中 39 种仅在类原肠胚的 P300 近端检测到(mESC 中没有肽)(图 6 H-I)。

图6. 增强子蛋白质组分析识别 mESC 和类原肠胚中的转录调控因子。
(a) CRISPR-Cas9 介导的Ep300基因C 末端内源基因标记,使用 V5-miniTurboID,随后是切割肽 (T2A) 和嘌呤霉素编码序列。 (b) 未分化 mESC 和原肠胚中 P300 结合位点重叠的维恩图。(c) mESC(浅绿色)和 120 小时原肠胚(深绿色)中三个示例基因座的 P300 染色质结合快照。(d) 热图显示 mESC 和 120 小时原肠胚中的 P300 ChIP-seq 信号 (FPKM)。 (e) mESC 和原肠胚富集的 P300 结合位点的基序富集。 (f) 在未分化 mESC 中 P300 邻近标记实验中鉴定的蛋白质的火山图。(g) 在类原肠胚中的 P300 邻近标记实验中鉴定的蛋白质的火山图。 (h) mESC 和类原肠胚之间 P300 近端蛋白显著富集重叠。 (i) STRING 蛋白质-蛋白质相互作用网络由 39 种蛋白质组成。
07
ZEB2 的破坏会损害小鼠和人类的体节发生
接下来,他们研究了 ZEB2 在类原肠胚形成中的作用。在未分化的 mESC 中检测不到 ZEB2 蛋白表达,而在 96 小时后类原肠胚分化过程中,ZEB2 蛋白表达上调。对 120 小时类原肠胚中的 ZEB2 蛋白进行染色,结果显示与 SOX17-RFP +细胞无重叠(图 7 A),这与类原肠胚和小鼠胚胎中Sox17 + scRNA 聚类中均无Zeb2 mRNA 表达相一致。为了确定 ZEB2 耗竭对类原肠胚形成的影响,在(体细胞)类原肠胚分化期间,用 dTAG-13 在 72 小时至 120 小时处理表达 ZEB2-HA-FKBP12 F36V的 mESC(图 7 B-C)。与未处理的类原肠胚相比,在“常规”类原肠胚分化过程中 ZEB2 降解会导致更多的卵形类原肠胚而不是细长的类原肠胚(图 7 B)。嵌入基质胶中的类原肠胚(体节类原肠胚)中的 ZEB2 消耗未能伸长,而 dTAG-13 处理不会干扰野生型体节类原肠胚的细胞活力和分化(图 7 C-D)。
为了进一步研究这种表型,他们进行单细胞转录组分析(scRNA-seq),在质量控制后获得了 6529 个未处理的细胞和 6997 个来自 ZEB2 消耗的类原肠胚的细胞。数据整合和 UMAP 投影显示 13 个聚类,聚类中未处理和 ZEB2 消耗的细胞(dTAG-13 处理)的比例不同(图 7 E)。聚类1 和聚类3 富含 dTAG-13 处理的细胞,而四个聚类(聚类 5、6、8 和 9)富含未处理的细胞。他们使用小鼠胚胎的参考图谱来预测此数据集中的细胞类型,大多数细胞归类为 NMP(图 7 F-G)。他们观察到 ZEB2 耗尽的类原肠胚的细胞组成从更多的 NMP 和富含体节中胚层的类原肠胚转变为富含表面外胚层细胞和脊神经外胚层细胞(图 7 G)。
更多的 ZEB2 耗竭细胞分配到胚胎阶段 E7.75(22.48% ZEB2 耗尽细胞 vs 7.6% 未处理细胞),而较少的 ZEB2 耗尽细胞分配到 E8.5(16.78% ZEB2 耗尽细胞 vs 36.87% 未处理细胞)(图 7 H)。接下来,他们对未处理和 dTAG-13 处理的细胞进行了差异表达基因分析。ZEB2 耗竭的类原肠胚中上调的基因参与细胞间连接和肌动蛋白细胞骨架组织(图 7 I)。
他们生成了纯合和杂合的ZEB2敲除人类诱导多能干细胞 (iPSC) 系。在基质胶中培养 24 小时后,野生型人类 iPSC 形成包含多个体节样结构的结构(图 7 J)。相反,ZEB2敲除 iPSC 无法伸长(图 7 J)。具有杂合ZEB2缺失的体节表现出中间表型,以伸长但没有分段结构为特征。接下来,他们评估了在 ZEB2 耗尽的小鼠体节类原肠胚中鉴定的差异表达基因是否在人类体节中表现出差异表达。通过定量逆转录 PCR(RT-qPCR)进行的实验初步验证了在小鼠体节类原肠胚中因 ZEB2耗竭而上调的四个基因 CLDN7、SCUBE2、KRT8和DLX5)在ZEB2敲除的人类体节类原肠胚中也上调,而下调的基因DMRT2显示出一致的下调。具有杂合 ZEB2 缺失的体节类原肠胚对相同基因的基因表达表现出中等影响。 转录组分析(RNA-seq)进一步证实了小鼠体节类原肠胚和人类体节类原肠胚之间的一致性,特别是在小鼠体节类原肠胚中鉴定的那些差异表达基因(图 7 K)。
人类ZEB2敲除体节中上调的基因显示出表面外胚层标记基因的显著富集,而下调的基因则富集了近轴中胚层标记物,这与在小鼠体节原肠胚中的发现一致(图 7G)。总之,ZEB2 对于小鼠和人类体节发生过程中分段结构的形成至关重要。
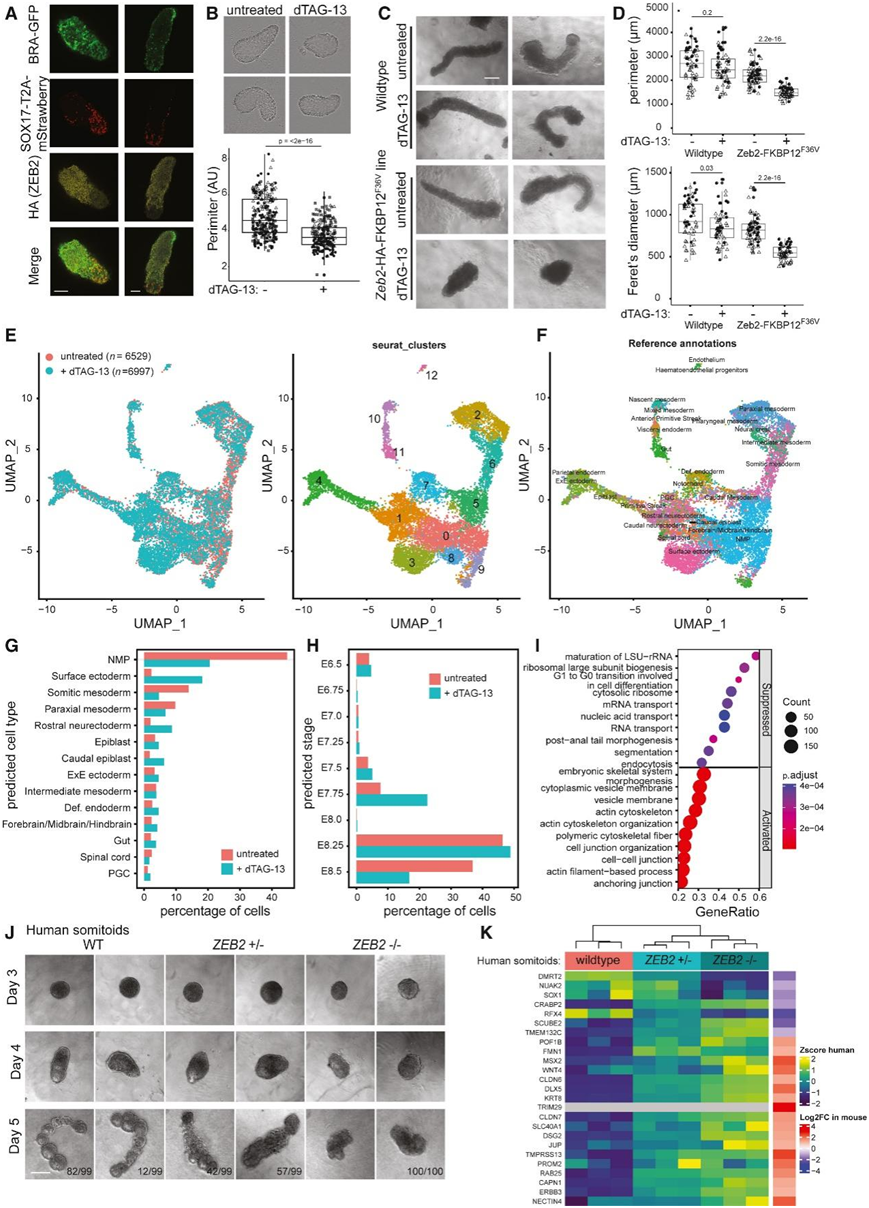
图7. 类原肠胚中 Zeb2 表达的扰动。
(a)免疫荧光染色。 (b)表达Zeb2 -HA-FKBP12 F36V的 mESC产生的常规 120 小时原肠胚的相差图像和周长定量。(c) 野生型 mESC 和表达Zeb2 -HA-FKBP12 F36V的 mESC 产生的体节原肠胚的相位对比图像。(d) 体节原肠胚的周长和 Feret 直径。(e-f)UMAP可视化。(g) 通过从公开可用的小鼠原肠胚形成 scRNA-seq 图谱转移特征来注释细胞类型。(h) 通过从公开可用的小鼠原肠胚形成 scRNA-seq 图谱转移特征来注释细胞类型。(i) fGSEA 结果显示 ZEB2 耗尽的体节类原肠胚中前 10 个抑制和激活的生物过程。(J) 使用野生型人类 iPSC (WT)、纯合 (ZEB2−/−) 和杂合 (ZEB2+/−) ZEB2 KO iPSC 进行的人类体节样发育的相位对比图像。(K) 人类体节类原肠胚中基因表达的热图。
+ + + + + + + + + + +
结 论
本项研究利用类原肠胚和基于多层质谱的蛋白质组学方法来研究类原肠胚分化过程中(磷酸化)蛋白质表达的整体动态,本项研究结果揭示了许多具有时间表达和每个胚层独特表达谱的蛋白质,还使用单细胞蛋白质组学技术对其进行了验证。此外,本项研究使用 P300 邻近标记分析了增强子相互作用景观,揭示了许多类原肠胚特异性转录因子和染色质重塑因子。随后基于降解的扰动结合scRNA-seq确定了 ZEB2 在小鼠和人类体节发生中的关键作用。
+ + + + +



 English
English


