文献解读|Nat Commun(16.6):纵向分子分析阐明乳腺癌的免疫代谢动态
✦ +
+
论文ID
原名:Longitudinal molecular profiling elucidates immunometabolism dynamics in breast cancer
译名:纵向分子分析阐明乳腺癌的免疫代谢动态
期刊:Nature Communications
影响因子:16.6
发表时间:2024.05.07
DOI号:10.1038/s41467-024-47932-y
背 景
乳腺癌是一种高度异质性的疾病,新辅助治疗中的临床试验正在加速对新型乳腺癌药物的评估过程,以病理完全缓解 (pCR) 作为主要终点,这与长期结果密切相关。
代谢重编程使肿瘤获得支持细胞存活、逃避免疫监视和增生性生长的代谢特性,这不仅满足了增加能量、生物量、氧化还原维持和细胞通讯的特定需求,而且还与复杂的肿瘤微环境 (TME)相互作用。通过测量接受新辅助化疗 (NAC) 的乳腺癌患者的连续样本(尤其是治疗期间的样本)的免疫状态谱,可以更好地预测治疗反应和长期生存期,但这个复杂生态系统内的动态功能相互作用尚不清楚。
实验设计
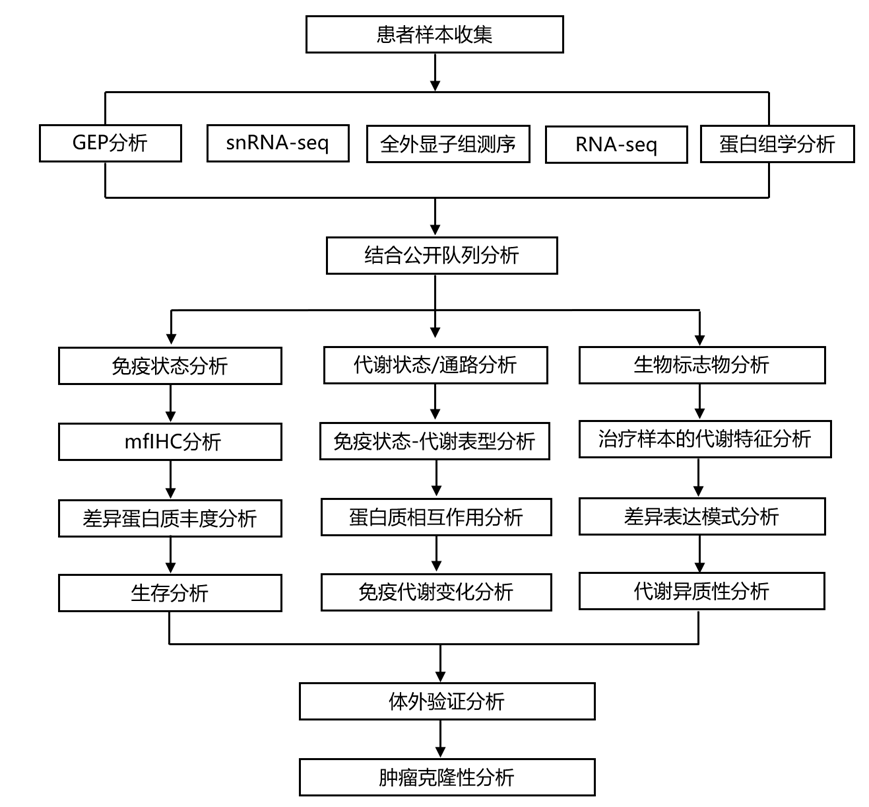
结 果
01
纵向蛋白质组乳腺癌队列以及免疫状况及其预后意义
PROMIX 试验在方法中详细描述。接受 NAC 治疗后,13.4% 的患者达到 pCR,包括 10 例(26.3%)三阴性肿瘤和 10 例(9%)管腔肿瘤。PROMIX 试验收集了纵向组织活检(治疗前和两个周期后)和手术标本(图 1a),从而建立了 150 例 HER2 阴性乳腺癌患者的多组学队列(图 1b-c):微阵列基因表达谱(GEP)(122 例患者,275 个样本)、单细胞核转录组分析(snRNA-seq)数据(8 例患者,20 个样本)、全外显子组测序(WES)(20 例患者,50 个肿瘤样本)、多重荧光(mf)免疫组织化学(IHC)(6 例患者,16 个肿瘤样本)和基于 MS 的蛋白质组学(29 例患者,53 个样本)。多组学数据可以全面分析免疫代谢表型与治疗反应/长期生存(GEP)的相关性、免疫状态与肿瘤代谢的相互作用(GEP)、调节TME 的潜在代谢靶点(配对 GEP 和蛋白质组学)、乳腺上皮、免疫和基质细胞在每个免疫状态下的代谢特征(snRNA-seq)、NAC后的肿瘤和免疫状态共同进化(WES 和 GEP)。
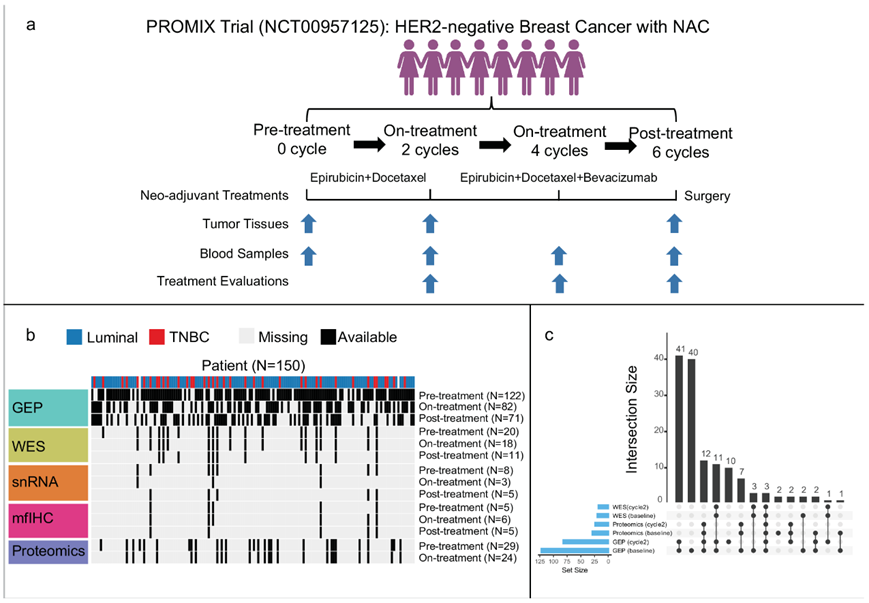
图1. 研究设计和多组学数据收集概述。
(a) 研究设计和多组学数据收集概述。 (b) 热图显示来自 PROMIX 试验的纵向深入蛋白质组学、转录组学、遗传学和 mfIHC分析。(c) UpSet图显示多组学数据交叉。
为了更好地描述 NAC 期间 TME 的演变,他们分析了三个时间点(NAC 前/中/后)的 GEP 数据,并使用 mf IHC 和基于 MS 的蛋白质组学在蛋白质水平以及外部队列进行验证。使用 GEP,通过将代表七种免疫成分的综合免疫特征与基于 quanTIseq分析的免疫细胞部分相结合来建模无监督的免疫状态聚类,将所有样本分为三种不同的免疫状态:冷(n = 100)、温(n = 118)和热(n = 57)(图 2a)。总体而言,免疫评分最高的热肿瘤也具有上调的整体免疫相关特征评分,冷肿瘤则反之亦然(图 2a),而 KI67 mRNA 在三组之间是可比的。总体而言,三阴性乳腺癌 (TNBC)(基于 IHC)/基底样(PAM50 内在亚型)肿瘤标记为热(均为 38.6%),而管腔 A/B 肿瘤在免疫学上为冷(71%)。有趣的是,当用 Thorsson 的 PanCancer 免疫亚型31注释样本时,>80% 的热肿瘤归类为 IFN-γ 显性,而发挥全身免疫抑制并抑制宿主免疫监视的 TGF-β 显性亚型仅出现在冷肿瘤中(图 2a)。热肿瘤中的中等(10-50%)和高密度(>50%)TIL 浸润(65.6%)比温肿瘤(49.4%)或冷肿瘤(31.3%)更高。 三种免疫状态下的时间点和肿瘤细胞数分布均无差异(图2b)。
此外,基于 quanTIseq 的免疫细胞组成表明热肿瘤中活化细胞(如 CD8+ T 细胞、B 细胞和 M1 巨噬细胞)的比例最高。相反,冷肿瘤中 M2 巨噬细胞等抑制细胞增多。此外,他们采用了全切片的多重荧光免疫组织化学(mfIHC)来支持上述免疫细胞反卷积结果,并使用二值化标记(共)表达模式分配细胞类别。mfIHC 表明热肿瘤的 B 细胞密度、CD8 + T 细胞密度高于冷肿瘤,但巨噬细胞 M2 细胞密度低于冷肿瘤(图 2c)。为了研究免疫状态亚型之间的蛋白质水平差异,他们使用基于质谱(MS)的蛋白质组学数据进行了差异蛋白质丰度分析(图 2d)。 与冷肿瘤(n = 23)相比,热/温肿瘤(n = 30)中免疫激活生物标志物(如 GZMK、CD8A、HLA-A、CD48)的蛋白质水平上调 (图 2d)。
接下来,他们旨在确定肿瘤免疫状态与临床结果之间的关联(图 2e)。在调整乳腺癌亚型、肿瘤大小和淋巴结状态后,热肿瘤比冷肿瘤更有可能达到 pCR,无论是治疗前还是治疗中。在管腔肿瘤组中观察到了类似的关联(热肿瘤与冷肿瘤)。关于免疫状态与长期 DFS 之间的关联,他们观察到治疗前温肿瘤的 DFS 往往低于冷肿瘤。

图2. 免疫状态与临床结果的关系。
(a) 使用基于免疫基因特征和免疫细胞组成的联合潜变量模型进行无监督聚类,揭示了乳腺癌的不同免疫状态。(b) 免疫状态中的 TIL、采样时间点和细胞性的分布。(c) 三种免疫状态的代表性 mfIHC 图像。(d) 火山图显示热/温肿瘤和冷肿瘤之间差异富集的蛋白质。(e) 多变量 Cox 和 Logistic 回归分析的森林图。
02
肿瘤代谢表型与免疫状态相互作用
鉴于大量肿瘤组织中代谢物的复杂性以及实际代谢物丰度与相应代谢通路基因表达之间的正相关,他们使用GEP探索了衍生的免疫状态和代谢表型之间的相互作用,并在MS蛋白质组学中得到证实。首先,仅使用肿瘤细胞的GEP将肿瘤分为七种预定义代谢通路中的三种代谢状态(即下调、中性、上调)(图 3a)。他们将ISOpureR应用于270个含有肿瘤细胞的样本,在基线、第2周期和手术时估计平均肿瘤纯度分别为0.58、0.50、0.31,并提取仅肿瘤细胞和肿瘤邻域细胞的mRNA表达。如预期的那样,t统计量随机邻域嵌入 (t-SNE)揭示了肿瘤邻近细胞和肿瘤细胞之间不同的七种基于 GEP 的代谢通路。然后,他们使用本体和肿瘤细胞的基因表达将这 270 个样本分为三种代谢状态(下调、中性、上调),所有患者和每个乳腺癌亚型(管腔内和三阴性)的免疫状态中本体/肿瘤细胞衍生的代谢状态的比例(图3b)。
接下来,他们研究了代谢和免疫状态之间的相互作用以及基因表达水平上不同代谢亚型的预后意义。总体而言,针对肿瘤亚型调整的线性混合效应模型 (LMEM) 显示,代谢基因集状态与免疫状态相关。上调的脂质、氨基酸、TCA 循环和维生素/辅因子代谢通路与免疫热肿瘤呈负相关(图 3b-c)。他们进一步评估了七种不同代谢通路(基于肿瘤细胞/本体 GEP)与免疫状态的成对相关性(图 3d)。TCA 循环亚型 与碳水化合物亚型以外的其他代谢亚型呈强正相关,而基于本体和肿瘤细胞 GEP 的代谢状态与免疫状态呈负相关。当结合治疗前和治疗期间的样本时,发现来自肿瘤细胞 GEP 的预后代谢表型比来自本体 GEP 的预后代谢表型更多(图 3d)。具体而言,与下调组相比,上调肿瘤细胞 GEP 代谢亚型的碳水化合物和 TCA 循环通路与更差的 DFS 相关。同样,基于氨基酸上调、TCA 循环和核苷酸通路亚型的患者与通路下调的患者相比,获得 pCR 的可能性较小。
韩国队列的表达谱从外部验证了基于代谢通路的亚型与免疫状态之间相互作用的可重复性(图S7a-c)。基于代谢通路的表型如 TCA 循环和核苷酸水平与免疫状态呈负相关,但上调的维生素/辅助因子与热免疫状态相关(图S7b)。此外,与下调组相比,治疗前氨基酸表型上调的患者达到 pCR 的可能性较小(图S7c)。总的来说,这些结果揭示了肿瘤细胞基于 GEP 的代谢表型(即 TCA 循环)与免疫状态亚型之间的关键相互作用,并强调了细胞代谢的预后作用。
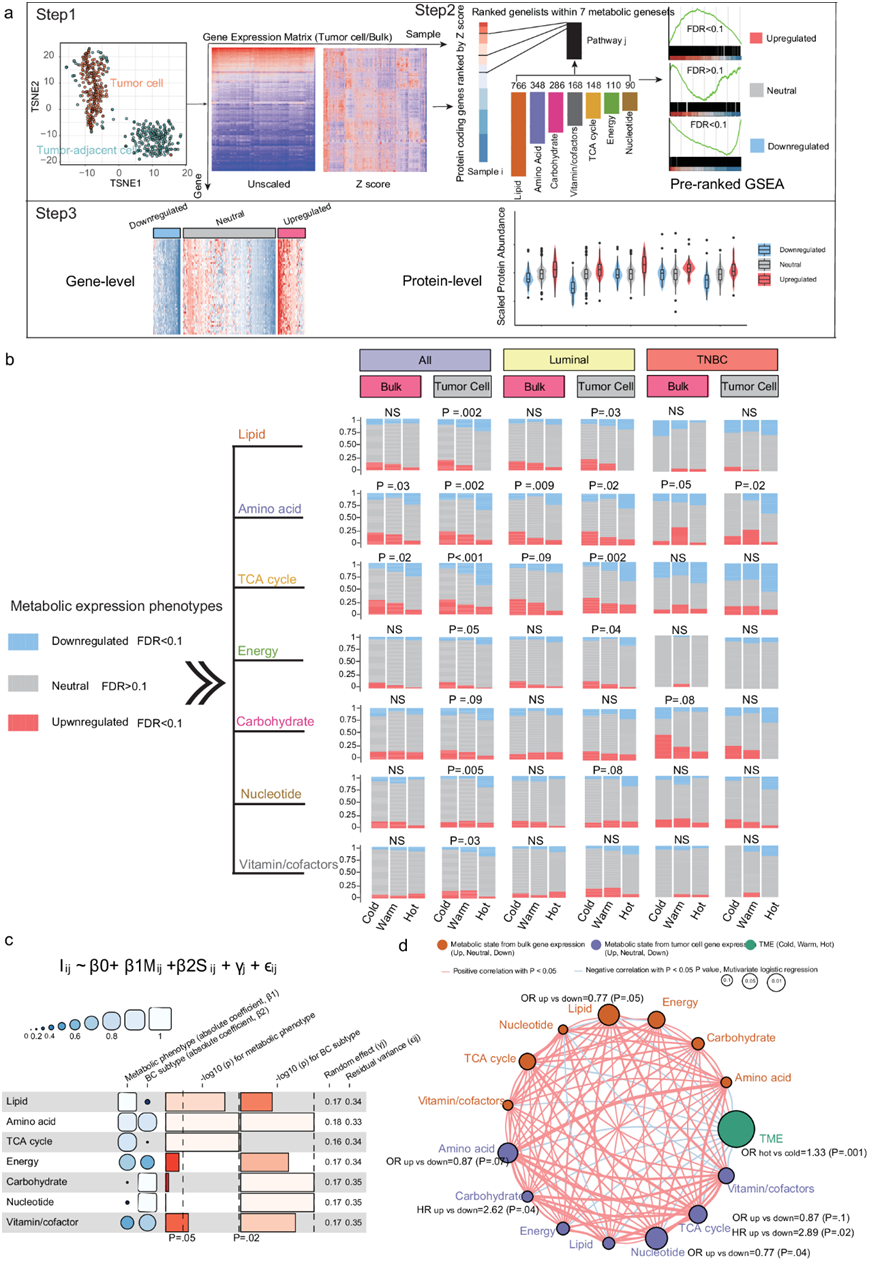
图3. 肿瘤细胞基于GEP的代谢状态与免疫状态的相互作用。
(a) 将每个样本分为七种代谢通路中的三种基于 GEP 的代谢状态(上调、中性和下调)之一。(b) 三种免疫亚型/状态的七种代谢通路中代谢状态的百分比。(c) 热图描绘了 LMEM 的系数、随机项、残差方差和p值。(d)代谢表型与免疫状态的相互作用。
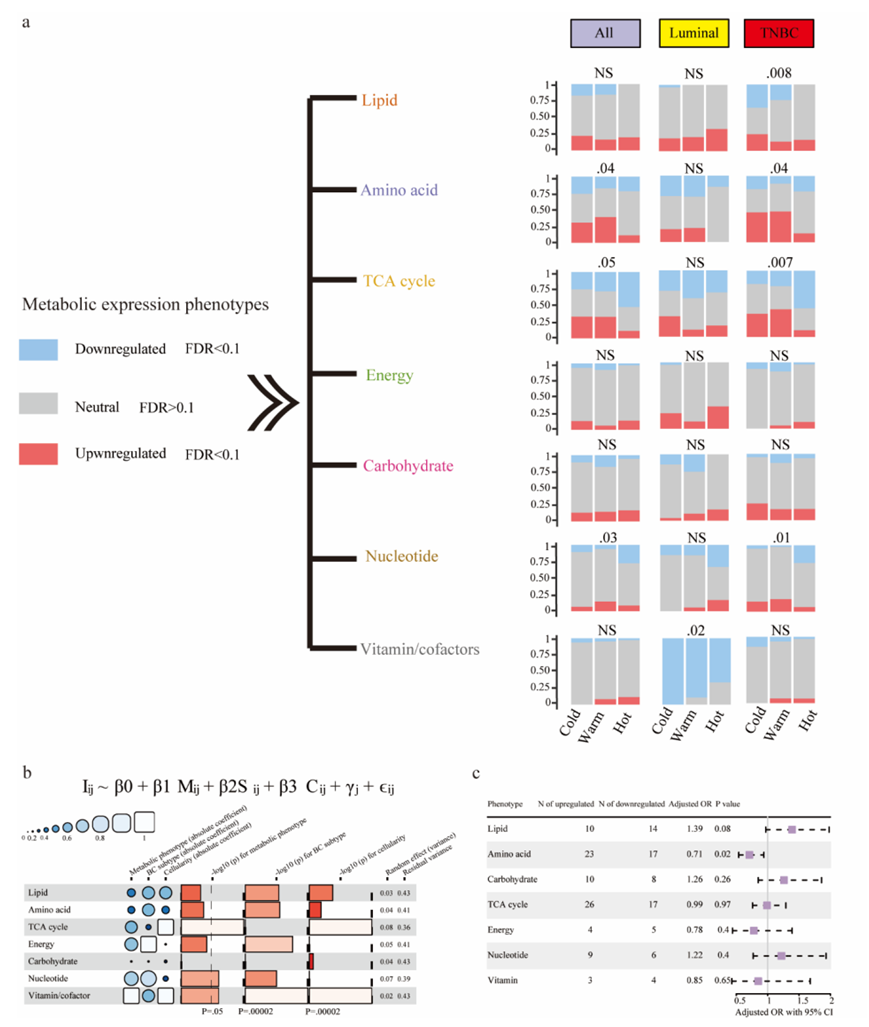
图S7. 韩国NAC队列中基于代谢表型的大量基因表达谱与免疫亚型相互作用。
(a) 百分比堆叠柱状图显示了不同免疫状态下7种通路中基于代谢表型的基因表达分布。(b) Funkyheatmap描绘系数,随机项,残差方差和p值。(c) 森林图描绘了大量代谢表型和pCR之间的关联。
03
免疫代谢表型和通路相关的蛋白质组学图谱
42种肿瘤的mRNA和蛋白数据基于基因的相关性显示4585/ 8290(55%)蛋白呈正相关(图4a),这与之前的蛋白质基因组学研究相当。此外,Biogrid 或 CORUM 中已知复合物成员的蛋白质相互作用相关性在 mRNA-mRNA 和蛋白质-蛋白质相关性之间有所不同(图 4b)。与 mRNA 水平相比,蛋白质水平的相关性更高,这表明这些生物过程在蛋白质水平上受到严格调控。与代谢和免疫功能相关的蛋白质与各自的转录本丰度显示出不同的相关性(图 4c),其中免疫蛋白与相应 mRNA 的相关性明显高于代谢蛋白。
排除相关性较弱的蛋白质对后,他们使用免疫代谢和乳腺癌特异性(PAM50)蛋白绘制了蛋白质相关网络。网络快照表明具有相似生物学功能的蛋白质高度相关(图 4d)。有趣的是,脂质蛋白在免疫相关模块中富集(图 4d),表明脂质代谢在抗原呈递和 T 细胞活化等免疫功能中的重要性。免疫代谢蛋白的平均丰度在三种免疫状态下有所不同(图 4e),这突出了 TME 在塑造肿瘤代谢景观中的作用。与冷肿瘤相比,热/温肿瘤在氨基酸和核苷酸代谢中的平均蛋白质丰度可能更高,这可能是因为功能性免疫细胞需要额外的营养(图 4e)。
代谢重编程可能提供新的治疗机会,一些代谢酶已发现是癌症治疗和调节支持性免疫细胞的有价值的药物靶点。他们绘制了热肿瘤和冷肿瘤在主要代谢通路上差异表达的mRNA和蛋白图谱(图4f),以寻找fda批准的药物的潜在靶标,这些药物似乎与TME改善协同作用,阻止肿瘤生长。
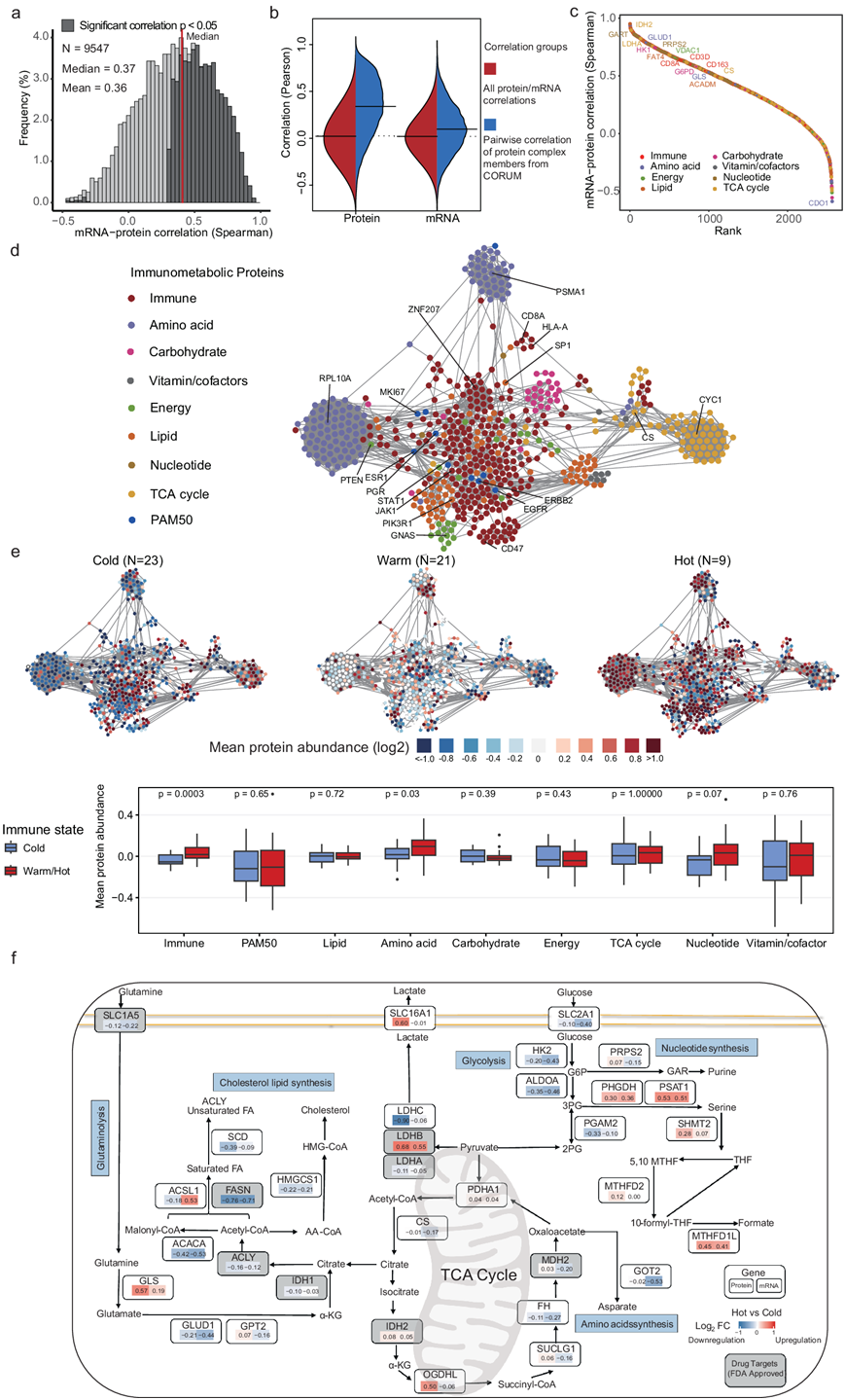
图4. 基于 MS 的免疫代谢表型和通路的蛋白质组学景观。
(a) 单个基因的蛋白质和 mRNA之间的相关性。(b) 使用53 个肿瘤的定量蛋白质和 RNA 水平,将所有成对相关性与来自 CORUM 数据库的已知相互作用对的相关性进行比较。(c) mRNA-蛋白质相关性。(d) 基于免疫代谢和 PAM50 蛋白的乳腺癌蛋白质相关网络。(e) 相关网络中三种免疫亚型/状态的平均蛋白质组定量的可视化。箱线图显示冷和温/热肿瘤之间每个模块平均蛋白质丰度的差异。(f) 通路图总结了参与 TCA 循环、糖酵解、核苷酸、氨基酸和胆固醇脂质合成与代谢的代谢基因。
04
免疫代谢的纵向成对分析
免疫状态的成对比较表明,40% 的冷肿瘤在两个 NAC 周期后转变为温热状态或热状态(图 5a-b)。同样,28% 的温热肿瘤变为热状态,但在 NAC 下从热免疫状态转变为冷免疫状态(1/10)的肿瘤较少。有趣的是,这种对免疫状态的影响在最后四个 NAC 周期中持续存在。此外,如果肿瘤在 NAC 后保持冷免疫状态或转变为更冷的免疫状态,他们将其定义为负免疫状态变化,反之亦然,为正免疫状态变化(图 5c)。调整肿瘤大小、淋巴结状态和乳腺癌亚型后,免疫状态改变为阳性的患者更有可能达到 pCR(图5d)。同样的策略也用于定义基于肿瘤细胞-GEP 的代谢表型谱(即阳性变化:患者在 NAC 下维持下调的代谢表型,或代谢表型发生变化(即从上调/中性到下调);其他所有变化均定义为阴性变化。因此,他们发现 TCA 循环和核苷酸代谢的阳性变化与 pCR 增加独立相关。同样,能量代谢变化为正的患者也显示出更好的治疗反应趋势。此外,他们评估了两个治疗周期后综合免疫代谢谱与放射学反应之间的相关性(图 5e)。与其他组相比,免疫状态和代谢表型谱均呈阳性的患者更有可能对 NAC 产生反应(图 5e)。
为了确定 NAC 期间免疫代谢中的潜在肿瘤驱动因素和生物标志物,他们根据客观反应状态(部分反应与稳定疾病或疾病进展)分别进行了纵向差异 mRNA 和蛋白质表达分析(图 5f-g)。几种免疫相关蛋白质,包括 IL32、CCL18、CD247 和 CD8A,与 NAC 反应呈现出强烈的正相关性。相反,TCA 循环和核苷酸代谢中的蛋白质下调(图 5f)。有趣的是,在“无反应”组中,他们仅在蛋白质水平上鉴定了上调的碳水化合物(SLC6A8、HS6ST2、SLC5A1)和耗竭的 CD8 + T 细胞 (CD244) 生物标志物(图 5g)。
总之,他们证明 HER2 阴性乳腺癌的免疫状态和代谢表型都不稳定,而是由 NAC 动态塑造的,这些早期变化对于治疗的放射学和病理学反应具有重要的预后意义。
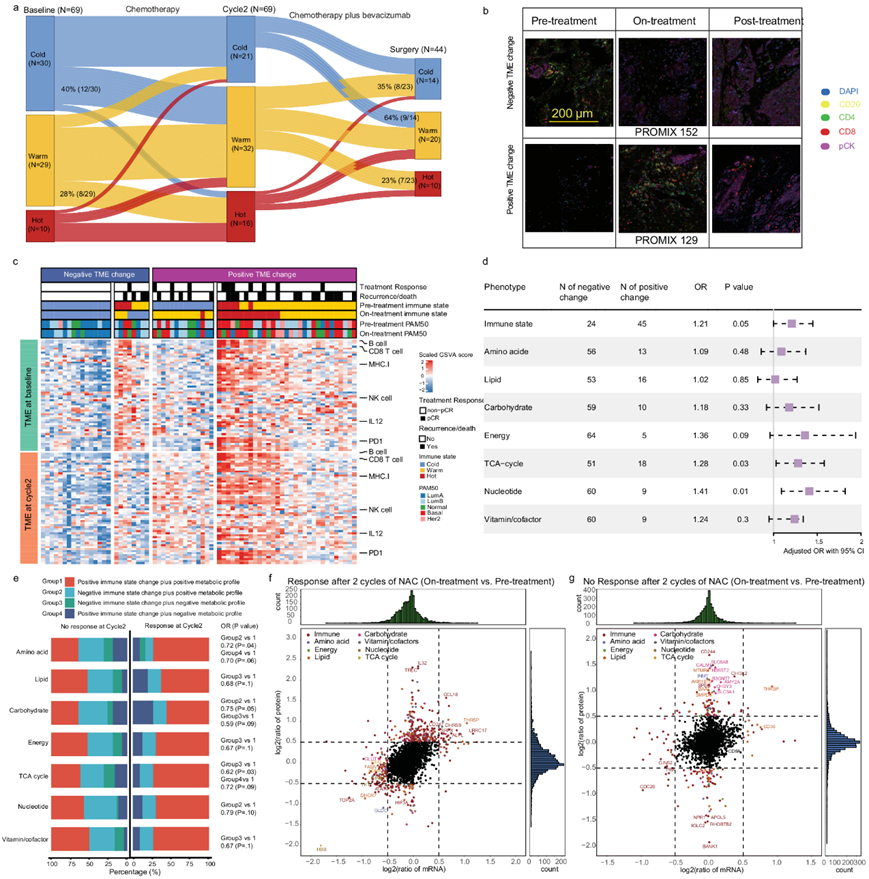
图5. 配对的治疗前/治疗中样本的蛋白质组学分析揭示了免疫代谢变化与对 NAC 的反应之间的关联。
(a) 从治疗前(基线)到治疗中(周期 2)以及从治疗中到治疗后(手术)的免疫状态变化的桑基图。(b) 别来自 16 个独立实验的代表性mfIHC图像。(c) 69 对治疗前/治疗中样本的免疫特征。(d) 森林图描绘了多变量逻辑回归模型。(e) 条形图显示在两轮 NAC 治疗后,反应组和无反应组(部分反应与疾病稳定或疾病进展)中综合免疫状态与基于肿瘤细胞 GEP 的代谢状态变化的分布。(f-g) 散点图分别显示反应组和无反应组(部分反应与疾病稳定或疾病进展)中治疗中和治疗前样本之间的成对差异蛋白质(y 轴)和 mRNA(x轴)表达。
05
TME 中代谢状态和重编程的单细胞核转录分析
接下来,他们分析了乳腺上皮细胞在 NAC 治疗压力下的代谢特征。在纵向收集的 TNBC 活检和手术标本中发现了五个处于代谢中的上皮聚类 (MC1-MC5)(图 6a-b)。代谢特异性上皮聚类的组成在治疗前和治疗中/治疗后样本之间发生变化,这与免疫状态变化(阴性或阳性)显著相关(图 6c)。上皮 MC1(PDK4、DCN、ACTA2、FABP4)的特征是正常上皮细胞、抗原呈递(趋化因子)和甘油脂代谢(图 6d-e),在免疫状态变化阳性的组中,NAC 后 MC1 比例增加。在 MC2(FABP5、MTHFD2、TPI1、GAPDH)中,他们鉴定出一个高度增殖(嘌呤、叶酸一碳代谢)的上皮细胞亚群,具有活跃的生物能量代谢特征(即 OXPHOS、糖酵解)(图6d-e)。在免疫负向变化组中,治疗后 MC2 比例增加,而在免疫正向变化组中,MC2 比例消失,表明该细胞亚型的收缩与对 NAC 的良好反应有关(图 6c)。MC2 显示糖酵解和缺氧的富集,而 MC3(COL1A1、MMADHC、PGK1、RAN、GLS、OAT)主要与 OXPHOS 和谷胱甘肽代谢有关,而不是糖酵解(图6d-e)。此外,轨迹分析强烈表明MC2 通过其他代谢聚类的转变(图 6f)。伪时间排序显示从正常乳腺上皮细胞 (MC1) 到恶性缺氧糖酵解表型 (MC2) 的有序、渐进、逐步转变(图 6f)。在免疫状态负面变化组中,MC3可能转化为MC2(图 6c)。无论是在免疫状态正向变化组还是负向变化组中,MC4(FAU、ATP5G2、COX8A、COX5B)的组成都依赖于氨基酸和胆固醇(视黄醇代谢、类固醇激素代谢)(图 6d-e),在NAC过程中相对稳定(图 6c)。免疫状态正向变化组治疗期间/治疗后 MC5 的消失可能是由于趋化因子高表达所致,趋化因子引导免疫细胞迁移至肿瘤组织。他们对免疫状态变化组治疗前和治疗中/治疗后进行了差异表达分析,以确定免疫代谢中的差异表达模式(图 6g-h)。在负向变化组中,NAC 后下调的基因与抗原呈递/主要组织相容性复合体 (MHC) 相关(HLA-DRA、HLA-DPAI、HLA-B、HLA- C、HLA-DQB1、CXCL9/10/11),代谢基因上调(RPL5、GAPDH、TPI1、DCXR、ATP5G2),而在正向变化组的患者则相反(图6g-h)。此外,他们计算了癌抗原呈递和上皮细胞代谢的GSVA评分,表明治疗过程中乳腺上皮细胞的动态代谢变化与免疫状态转换相关(图6i)。
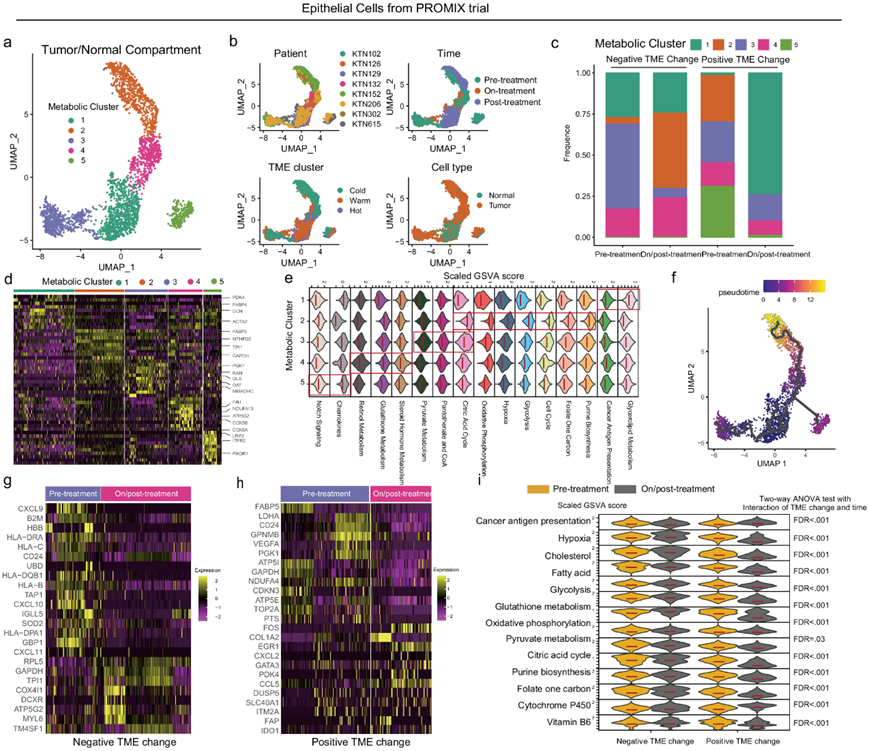
图6. 通过纵向snRNA-seq识别免疫状态演变过程中的代谢重编程。
(a) 在 PROMIX 试验中识别出乳腺癌治疗前/治疗中/治疗后乳腺上皮细胞的五个代谢聚类(MC1-5)。(b) 特征图显示样本 ID、采样时间点、TME 亚型和每个代谢乳腺上皮细胞亚聚类中的细胞类型。 (c) 每个采样时间点代谢上皮细胞聚类按免疫状态变化的百分比。(d) 与( a )中所有其他聚类相比,前 10 个差异表达基因的热图。(e) 根据代谢特征评分分析和量化每个乳腺上皮细胞聚类 (MC) 的代谢特征。(f) 乳腺上皮细胞代谢聚类的 UMAP可视化。(g-h) 治疗前后乳腺上皮细胞差异表达基因表达水平的热图。(i) 治疗前后乳腺上皮细胞的代谢基因特征分数的堆叠小提琴图。
他们使用 HER2 阴性乳腺癌单细胞图谱数据集(GSE176078)(图7a)对免疫细胞和基质细胞内的代谢概况进行了额外分析。有趣的是,尽管乳腺上皮细胞、免疫细胞(图7b)或基质细胞(图7c)主要依赖于OXPHOS,但已鉴定出 TME 内的代谢灵活性和变化。具体来说,在上皮细胞中,糖酵解是除OXPHOS之外最关键的代谢通路,并且在高度增殖的基底样和循环癌细胞中富集。同样,糖酵解通路也在免疫效应细胞中富集,包括记忆B细胞、CD8 + T细胞、循环T细胞、单核细胞和循环髓系(图7b)。癌相关成纤维细胞(CAF)(肌成纤维细胞样CAF和炎症样CAF)和内皮细胞是肿瘤基质和ECM的主要成分,它们表现出代谢可塑性,并具有相似的代谢活性(OXPHOS、糖酵解、谷胱甘肽、细胞色素P450)(图7c)。 以平均CD8+T细胞比例为截断值,将 21例肿瘤进一步分为免疫冷性和免疫热性。然后,他们使用每个样本的免疫和基质细胞的伪批量基因谱计算代表性代谢通路GSVA评分,并在热肿瘤和冷肿瘤之间进行比较(图7d)。热肿瘤的免疫效应细胞比冷肿瘤的对应细胞具有更高的代谢活性,包括丙酮酸(CD4 + T 细胞和 NK 细胞)、糖酵解(NK 细胞)、柠檬酸循环(CD8 + T 细胞和 NK 细胞)和脂肪酸代谢(CD4 + /CD8 + T 细胞)(图7d)。相反,冷性肿瘤中来自 CD4 + T 细胞的氨基酸(谷胱甘肽)代谢特征评分高于热性肿瘤(图 7d),并且他们观察到循环 T 细胞和记忆 B 细胞的相似趋势(图 7d)。
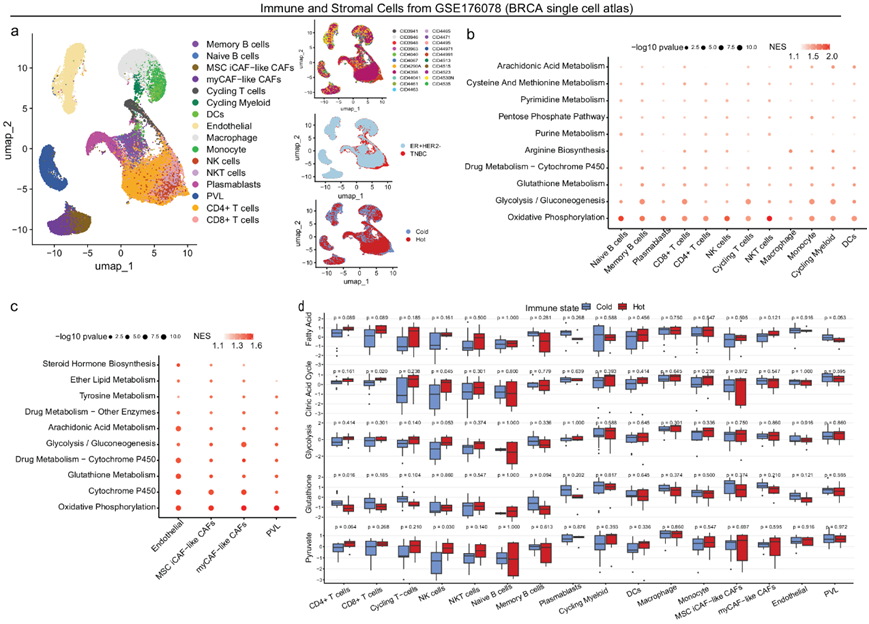
图7. 免疫细胞和基质细胞的代谢异质性。
(a) UMAP图显示乳腺癌单细胞图谱 (GSE176078) 中 HER2 阴性子集的免疫和基质细胞。(b-c) 代谢通路富集对免疫细胞和基质细胞之间代谢异质性贡献最大的基因。(d) 比较了冷和热肿瘤中免疫和基质细胞的代表性代谢通路得分 。
06
免疫代谢靶标的体外验证
在对大量 GEP、蛋白质组学数据和 snRNA-seq 进行广泛分析后,他们发现各种代谢相关基因在冷性肿瘤中上调(即FASN、ALDOA、HMGCS1、ACACA)(图 4f)或在治疗中/治疗后免疫状态发生负向变化的肿瘤中出现(即RLP5、GAPDH、TPI1、DCXR)(图 6g)。因此,为了进一步证实这些发现并深入了解免疫代谢相互作用的功能,他们针对这些基因进行了体外研究,并使用了公开的细胞系转录组数据,观察到这些代谢相关基因中的三个(即RLP5、TPI1、ALDOA)的基线表达在以下乳腺癌细胞系中最常见上调:MDA-MB-231 和 BT549(基底样亚型)、MCF7 和 T47D(管腔亚型)。通过使用 siRNA技术,他们成功地在所有 4 种细胞系中敲低了这三个基因。敲低代谢相关基因后,与对照细胞相比,敲低基因的肿瘤细胞的细胞活力下降(通过XTT 细胞毒性试验评估)(图8a-b),凋亡增加(通过 caspase 3/7 试验评估)(图8c-d)。
鉴于TME中T细胞的抗肿瘤活性对于消除肿瘤细胞的重要性,他们接下来将T细胞与前面提到的癌细胞系(对照和基因沉默)共培养,并在24小时活细胞成像过程中评估其杀肿瘤作用。敲低代谢相关基因后,与T细胞一起培养时,大多数细胞系和靶基因均能直接杀死肿瘤细胞,尤其是管腔细胞和基底样细胞中的ALDOA以及管腔细胞中的TPI1(图8e)。此外,与T细胞一起培养和基因沉默后,肿瘤细胞生长受到抑制。总之,这些体外数据支持以下假设:靶向代谢基因可能导致免疫细胞介导的肿瘤细胞杀死和肿瘤生长抑制,从而为该领域的未来研究提供见解。
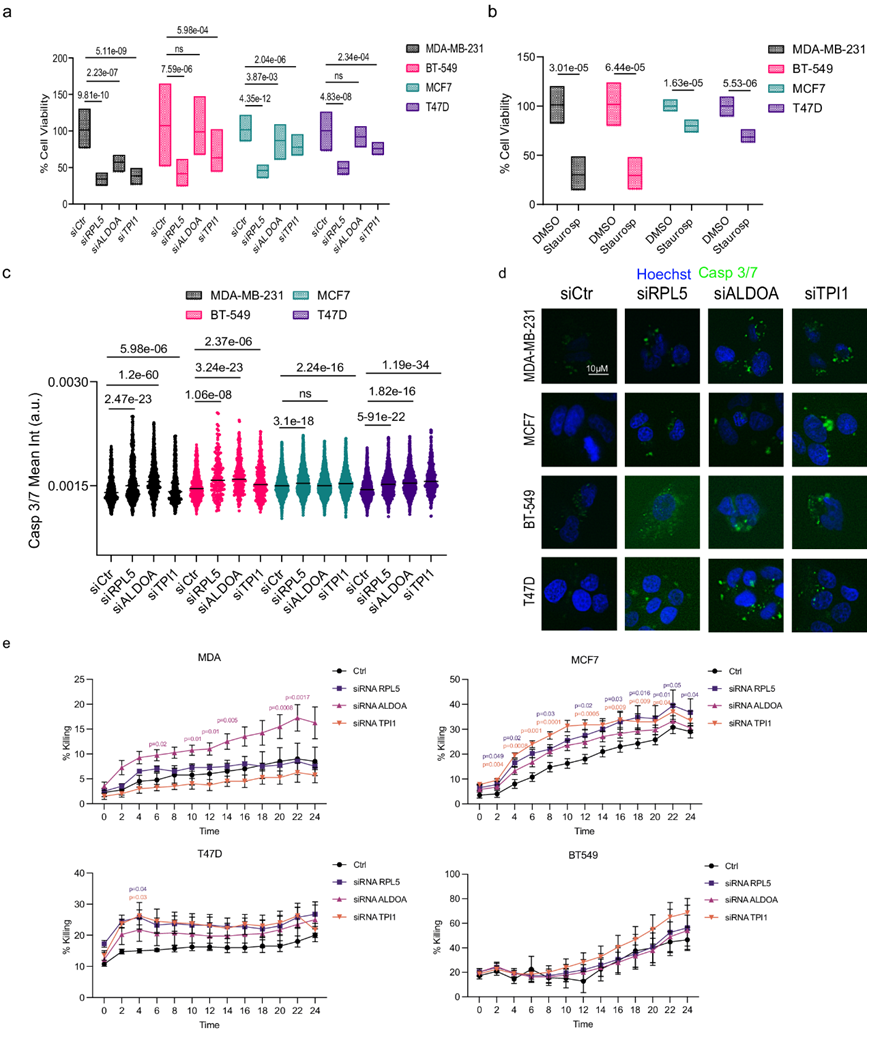
图8. TME相关代谢靶点的体外验证。
(a-b) 对两种腔内(MCF7、T47D)和两种基底样(MDA-MB-231、BT-549)乳腺癌细胞系进行 XTT检测。 (c)细胞凋亡分析。(d) 用于(c)中所示分析的代表性免疫荧光图像。 (e) 肿瘤细胞杀伤百分比。
07
NAC 期间肿瘤与免疫状态的共同进化
为了深入了解肿瘤细胞和免疫状态在 TME 下如何共同进化,他们对 PROMIX 试验中 20 名 TNBC 患者的纵向肿瘤样本的 WES 数据进行了克隆性分析。他们观察到基线热/温肿瘤比具有冷免疫表型的肿瘤更具异质性(图 9a)。肿瘤块包含不同适应度的克隆,并且异质克隆在没有选择压力的情况下共存。他们在治疗中/治疗后的热/温肿瘤中鉴定出的亚克隆数量低于冷肿瘤(图 9a)。治疗后冷肿瘤还获得了更多的癌症特异性突变(即BRCA2、TPR、OMD、RANBP2、EP300)。如果基线时存在的90%以上的突变在NAC后消失或治疗后样本中存在10个以下突变,则将该状态定义为克隆消亡,所有其他情况定义为克隆持续存在。他们发现免疫状态变化与治疗期间的克隆进化相关(图 9b)。具有正向免疫状态变化的肿瘤更多地与克隆消亡相关(7/9),而负向免疫状态变化与克隆持续相关(11/11)。
他们采用了 PhylogenicNDT 来计算子克隆和亲本克隆之间的生长率差异(ΔGR),其中使用癌症共识基因定义推定的驱动因素,关注了在接受 NAC 的 20 名 TNBC 患者中检测到的亚克隆(图 9c-d)。事实上,来自 2 名患者(患者 152和310)的两个亚克隆均具有负向免疫表型变化和克隆持久性,它们含有已知的代谢驱动因素,并且它们的生长显著高于其亲本克隆/亚克隆(图 9c)。他们进一步发现,患者206的免疫状态改变呈阳性,克隆消失,与化疗耐药相关的介质复合物亚基12 (MED12)突变,生长加速。相反,那些已知乳腺癌驱动因素的亚克隆(患者155、115和612)与其亲本克隆相比,没有表现出生长速度优势(图9d)。总体而言,这些分析提供了 TME 和肿瘤共同进化的证据,强调治疗可能导致免疫抑制 TME 的出现和耐药亚克隆的选择。
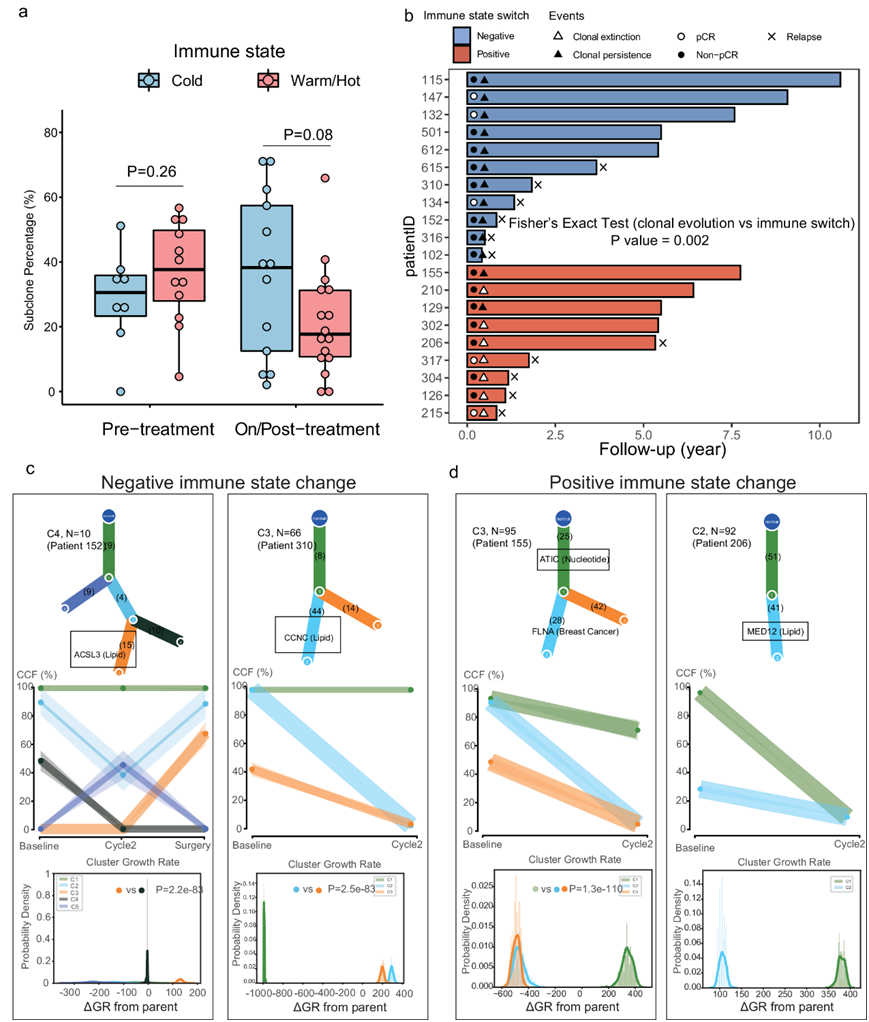
图9. 新辅助化疗下肿瘤克隆性和免疫状态亚型的共同进化。
(a) 按采样时间点划分的免疫状态之间的亚克隆百分比差异。(b) Swimming图显示治疗结果,每条柱的长度代表 PROMIX 试验中每位患者的 DFS 持续时间。(c-d) 在免疫状态变化为阴性和阳性的患者中,含有已知代谢驱动因素的亚克隆相对于其亲本具有显着生长优势的示例。
+ + + + + + + + + + +
结 论
本项研究使用蛋白质组学、基因组学和组织病理学描述了在新辅助化疗 (NAC) 之前、期间和之后从乳腺癌患者纵向采集的肿瘤组织样本的免疫代谢谱。免疫状态、肿瘤代谢蛋白和基于肿瘤细胞基因表达谱的代谢表型的治疗前、治疗中和动态变化与治疗反应有关。冷肿瘤和热肿瘤之间的免疫细胞状态存在不同。基于上述分析的 NAC 的潜在驱动因素在体外得到了验证。总之,该研究表明肿瘤内在代谢状态与 TME 的相互作用与治疗结果有关,支持以肿瘤代谢为靶点进行免疫调节的概念。
+ + + + +



 English
English


