文献解读|Cancer Cell(50.3):乳腺癌转移过程中肺免疫重塑的时间进展
✦ +
+
论文ID
原名:The temporal progression of lung immune remodeling during breast cancer metastasis
译名:乳腺癌转移过程中肺免疫重塑的时间进展
期刊:Cancer Cell
影响因子:50.3
发表时间:2024.05.30
DOI号:10.1016/j.ccell.2024.05.004
背 景
肿瘤转移需要系统性重塑远处器官微环境,从而影响免疫细胞表型、群体结构和细胞间通讯。然而,目前对转移性微环境免疫表型动态的理解仍然不完整。
实验设计
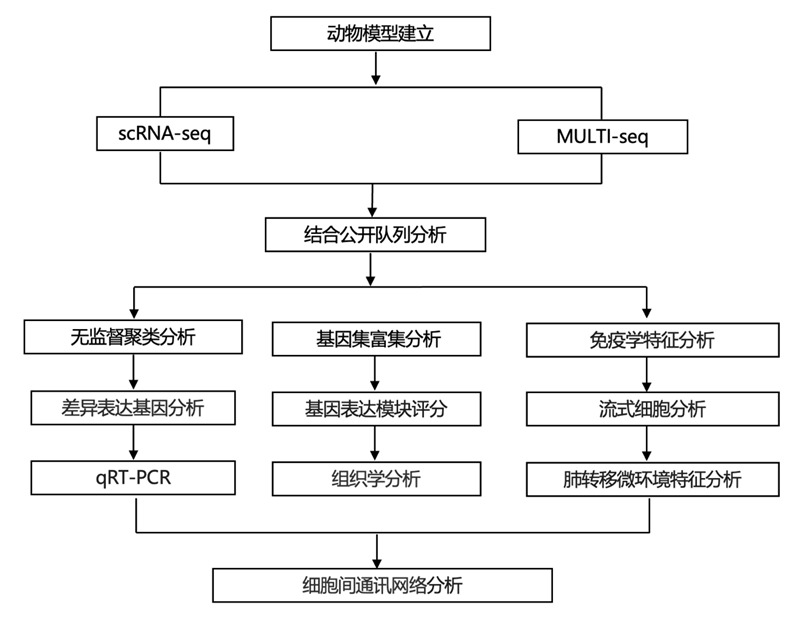
结 果
01
PyMT 小鼠肺的纵向 scRNA-seq 分析揭示了转移性微环境中免疫群体结构动态
多瘤病毒中T抗原(PyMT)小鼠是转移性乳腺癌的完善模型,该癌症是由鼠乳腺肿瘤病毒长末端重复启动子驱动的 PyMT 转基因的乳腺特异性表达引起的。PyMT阳性雌性小鼠在6 ~ 8周龄时形成乳腺肿瘤,肿瘤外显率为100%,80% ~ 90%的荷瘤小鼠在14 ~ 16周龄时自发发生肺转移。
为了纵向分析转移龛内的免疫细胞组成和转录变化,研究团队使用单细胞转录组分析(scRNA-seq)和样本多路技术(MULTI-seq)分析了从6 ~ 14周龄PyMT+雌性小鼠和9周龄野生型(WT)对照中分离出的CD45+免疫细胞(图1A)。所有第 6-14 周的时间点和对照都由至少 2 个生物学重复表示,每个样本平均包含 2915 个细胞(图 S1 A)。使用无监督聚类和差异表达基因分析的细胞类型注释确定了许多免疫细胞类型,包括四种 T 细胞谱系:CD4+和 CD8 + T 细胞、调节性 T 细胞 (Treg) 和 γδT 细胞;三种单核细胞亚群:经典 (cM)、非经典 (ncM) 和中间 (intM);两种组织驻留巨噬细胞:间质 (IM) 和肺泡 (AM);四种类型的树突状细胞 (DC):Ccr7 +迁移性 DC、1 型常规 DC (cDC1)、2 型常规 DC 和浆细胞样 DC (pDC);以及中性粒细胞、NK、B、增殖和先天淋巴细胞(图 1 B)。
接下来,他们试图根据转移性进展期间免疫人群结构的已知变化对这些数据进行基准测试。由于疾病进展时间的自然变异性,他们不选择对实验时间点进行连续建模。相反,他们使用差异度量Jensen-Shannon散度(JSD),以无偏倚的方式将样本计算分为三个转移阶段:(1)来自WT和6 ~ 9周龄小鼠的“早期”肺,(2)主要来自9 ~ 12周龄小鼠的“中期”肺,(3)主要来自12 ~ 14周龄小鼠的“晚期”肺(图1C)。
为了进一步对计算推断出的转移阶段进行基准测试,他们使用组织学和定量逆转录 PCR (qRT-PCR) 跟踪每个疾病阶段的转移负担。组织学分析显示,晚期肺脏有大量转移性病变(每肺 7-15 个),而早期和中期肺脏没有(图 S1 B-C)。晚期肺脏中的 PyMT mRNA 丰度也升高,而早期和中期肺脏的 PyMT mRNA 水平同样低,平均比晚期样本低 137.8 倍(图 S1 D)。qRT-PCR 滴定实验确定该检测方法可以在低至 0.01% 的 PyMT 肿瘤细胞样本中检测到 PyMT mRNA(图 S1 E),早期和中期肺脏中的 PyMT mRNA 水平接近此检测限(图 S1 D)。因此,这些分析表明,早期和中期肺中 PyMT 肿瘤细胞不超过 0.01%–0.05%。他们将这些样本归类为转移前微环境,定义为没有显著转移负担的肺,可能存在微量循环肿瘤细胞或非常早期的微转移。
接下来,他们使用 MULTI-seq 对代表每个转移阶段的 PyMT +小鼠验证队列中新鲜分离的 CD45 +免疫细胞进行分析(图 S1 A),以确定冷冻保存对 PyMT 肺样本中免疫细胞组成的影响。从 18 个独特样本的 76670 个高质量免疫细胞的最终数据集开始(图 S1 F),再次使用 JSD 来识别早期、中期和晚期组(图 S1 G),并验证了转移进展过程中免疫群体结构的许多观察到的变化,例如中性粒细胞和 cM 比例增加以及 B 细胞比例下降(图 S1 H)。值得注意的是,使用新鲜肺样本导致淋巴细胞检测总体增加,而 AM 等髓系谱系检测降低(图 S1 I)。

图1. PyMT肺免疫细胞的纵向 scRNA-seq 细胞分析捕捉了转移性微环境的动态。
(a) 实验方法示意图。(b) 免疫基因表达空间的均匀流形近似和投影 (UMAP) 可视化。(c) Jensen-Shannon 散度 (JSD) 热图展示了 PyMT 肺样本之间的相似性。(d) 描述转移过程中细胞类型比例变化的条形图。

图S1. 对原始纵向PyMT和PyMT验证队列scRNA-seq数据集进行基准分析。
(a) 柱状图描述原始PyMT scRNA-seq数据集(左)和PyMT验证队列scRNA-seq数据集(右)的MULTI-seq解复用后分配给每个样本的细胞数量。(b) 从中期和晚期PyMT验证队列样本中分离的肺组织的代表性H&E图像。(c) 箱线图描述检测到的转移瘤数量。(d) 柱状图描述PyMT验证队列肺部中使用qRT-PCR测量的PyMT mRNA丰度。(e) 条形图描述肿瘤滴定qRT-PCR实验中PyMT mRNA的丰度。(f) 新鲜PyMT验证队列肺样本免疫基因表达空间的UMAP可视化。(g) Jensen-Shannon散度(JSD)热图显示新鲜PyMT验证队列肺样本之间的(非)相似性。(h) 原始冷冻保存PyMT和新鲜PyMT验证队列scRNA-seq数据集中每个转移阶段免疫细胞类型比例的散点图。(i) 散点图描述了冷冻保存和新鲜PyMT肺样本在每个转移期和WT对照组之间免疫细胞类型比例的变化差异。
02
组织驻留巨噬细胞在转移前微环境内引发伤口愈合和 TLR-NFκB 炎症反应
他们接下来重点分析了肺髓系细胞,因为已知转移需要肿瘤介导的髓系细胞谱系的深刻重塑。此外,对不同髓系细胞的实验操作可以通过不同的机制影响转移进展,这使这些细胞成为抗转移免疫治疗的潜在靶点。他们在这些数据中确定了两组髓系细胞:(1)BM来源的单核细胞、中性粒细胞和迁移到肺内的DC,以及(2)常驻组织的巨噬细胞,如IM和AM。虽然大多数BM来源的髓系细胞在转移中的作用已广泛研究,但对于IM和AM如何促进转移进展的研究相对较少。
在IM中,无监督聚类和差异表达基因分析可区分出4种主要亚型(图2A),包括Mrc1+ IM和Cd74+抗原提呈型IM(之前在未患肿瘤的小鼠中观察到),以及表达已知转移相关基因(如S100a10和Vim)的增殖型IM和Crip1+ IM。值得注意的是,Crip1+ IM比例在中期肺中增加(图2A),并且与在小鼠膝关节损伤模型中观察到的Crip1high Cav1+巨噬细胞有许多共同的转录特征(图2B)。
虽然在不同的微环境中存在Crip1+巨噬细胞和关节液Crip1high Cav1+巨噬细胞,但这些结果表明,Crip1+巨噬细胞可能参与了PyMT小鼠肺组织的损伤反应。
无监督聚类和差异表达基因分析共发现8个AM亚型,其中5个亚型反映了AM的已知功能,如抗原提呈、对过敏原的反应、表面活性物质稳态、干扰素反应和增殖(图2C)。他们还确定了两种疾病相关的AM亚型:类似于其他小鼠肺转移模型中描述的“巨噬细胞调节性细胞”或“脂质相关”AM的Gpnmb+ Cd63+ AM,以及在慢性阻塞性肺疾病中观察到的表达金属硫蛋白的AM。最后,他们检测了表达细胞因子Tnf和Cxcl2、炎性小体成分Nlrp3和TLR共受体Cd14的炎性AM(图2C)。值得注意的是,Cd14+炎症AM在中期肺中富集,而表面活性物质稳态的AM频率降低(图2D),提示PyMT小鼠转移前生态位形成涉及诱导这些细胞的炎症反应。

图2. AM炎症和 IM 伤口愈合转录特征与转移前微环境形成相关。
(a) UMAP 对 IM 基因表达空间进行可视化,以亚型或注释标记基因为颜色,条形图描述了转移进展过程中亚型比例的变化。(b) IM 亚型中Crip1highCav1 +特征基因平均表达的Z分数热图。 (c) UMAP 对 AM 基因表达空间进行可视化。(d) UMAP 可视化 AM 基因表达空间中的转移阶段密度。
与转移前微环境形成相关的肺免疫亚型代表了抗转移免疫疗法发展的有吸引力的靶点。因此,他们使用非负性基质因子分解(NMF)来确定Cd14+炎性AM的详细转录特征。NMF发现一个单一成分(NMF8)在Cd14+炎性AM中富集(图3A)。值得注意的是,NMF8 还标记了抗原呈递、过敏反应和“脂质相关”AM 的亚群(图 3 A,中间和右),这些亚群也表达Cd14、Cxcl2和Nlrp3(图 3 B),并在中期肺中按比例富集(图 3 C),表明炎症程序在多种 AM 亚型中发生。基因集富集分析 (GSEA) 将 NMF8 特征基因与 Hallmark 基因进行比较,揭示了与许多炎症通路的关联,包括通过 NF-κB 进行的肿瘤坏死因子 (TNF) 信号传导(图 3D)。许多由炎症 AM 上调的基因包括 NF-κB 信号传导成分和产物,例如Nfkbia、 Tnfaip2、Tnf、Il1a和Tlr2,它们与 CD14 介导的 TLR-NFκB 信号传导一致。
TLR-NFκB炎症信号在肺上皮细胞和免疫抑制性BM来源的髓系细胞中促进肺转移。最近对脾脏和原发肿瘤中性粒细胞的单细胞分析表明,原发肿瘤中的髓源性抑制细胞(MDSC)“活化”与Cd14表达增加和TLR-NFκB炎症相关。比较“激活的”MDSC特征和NMF8之间的基因表达模块评分发现了显著的一致性(图3E-F)。这一结果表明,在中期肺组织驻留AM中观察到的TLR-NFκB炎症程序可能是由原发肿瘤局部“激活”MDSC的相同原发肿瘤来源的线索诱导的。

图3. NMF 和 GSEA 将Cd14 +炎症 AM 特征与 TLR-NFκB 炎症和 CD14 + “激活” MDSC联系起来。
(a) UMAP 对主要 AM 亚型(例如抗原、过敏和脂质 AM)进行子聚类之前和之后的 AM 基因表达空间进行可视化。(b) UMAP 可视化亚聚类 AM 基因表达空间。(c) 条形图描述了转移进展过程中Cd14 +炎性 AM 比例的变化。(d) Lollipop图描绘了在 NMF8 转录特征基因中富集的 Hallmark 基因集。(e) UMAP 对 AM 基因表达空间进行可视化。(f) 散点图显示 AM 中 CD14 + “激活”MDSC 与 NMF8 模块评分之间的相关性。
03
髓系 TLR-NFκB 炎症与 PyMT 小鼠转移前微环境形成有关
接下来,他们重点研究了 BM 衍生的髓系:单核细胞、树突状细胞和中性粒细胞。在单核细胞中,发现 ncM 和 cM 比例相互变化,在转移进展过程中,ncM 和 cM 频率分别降低和增加(图 4 A)。此外,他们观察到中性粒细胞分化状态连续(例如成熟、过渡和未成熟;图 4 B),转移进展与未成熟和过渡中性粒细胞比例增加相关(图 4 B)。中晚期成熟中性粒细胞特异性表达与脱颗粒相关的基因(例如Igfbp6和Lrg1)和与疾病相关的激活基因(例如Ifitm1和Tspo)(图 4 C)。除了这些已建立的免疫学特征之外,他们还发现了可能反映炎症反应的干扰素刺激和增殖的树突状细胞(DC),以及 cDC1 比例随时间的减少(反映转移性 PyMT 淋巴结的结果)和中期 pDC 比例的富集(图 4 D)。DC 亚型频率的这些变化与已知的 cDC1 促进抗肿瘤免疫生物学和 pDC 募集促转移细胞类型(如 MDSC 和 Treg)相一致。他们还检测到共表达 Cd14、Cxcl2 和 Nlrp3 的炎性成熟中性粒细胞;与CD14 + “激活”的 MDSC 模块相关;并且在中期肺中按比例富集,与炎性 AM 惊人地一致(图 4 B)。
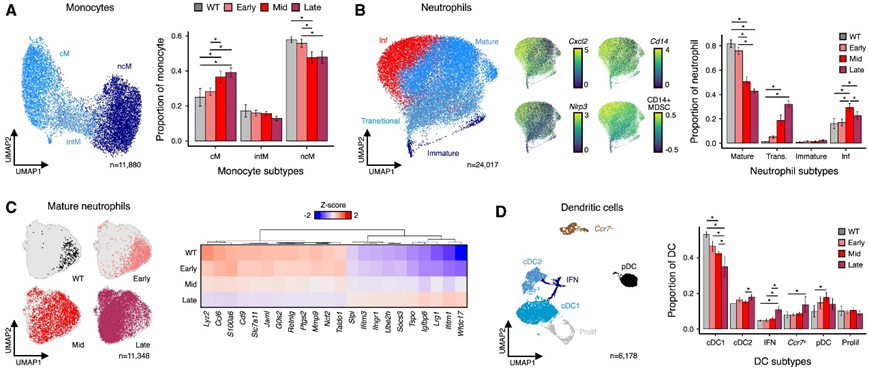
图4. BM 衍生的髓系亚型表征。
(a) UMAP 对单核细胞基因表达空间进行可视化,条形图描述转移进展过程中亚型比例的变化。(b) UMAP 可视化中性粒细胞基因表达空间,条形图描述转移进展过程中亚型比例的变化。(c) UMAP 可视化成熟中性粒细胞基因表达空间,按转移阶段着色,并显示特定阶段差异表达基因的Z分数热图。(d) UMAP 对 DC 基因表达空间进行可视化,条形图描述转移进展过程中亚型比例的变化。
对剩余髓系区室的检测发现,单核细胞和 IM(但不是 DC)聚类也与 NMF19 和 CD14+ “激活”MDSC 模块相关(图 5 A)。同样,Cd14+炎性单核细胞和 IM 在中期肺中按比例富集(图 5 B),NMF19 和 CD14 + “激活” MDSC 模块评分在这些细胞类型中呈高度相关性(图 5 C),NMF19 特征基因的 GSEA将此炎症转录谱与通过 NF-κB 的 TNF 信号传导联系起来(图 5 D)。为了验证这一发现,他们使用流式细胞分析了转移进展过程中肺髓系细胞中的 CD14 蛋白丰度,结果显示肺中性粒细胞、AM 和单核细胞中的膜 CD14 蛋白丰度随时间持续增加(图 5 E)。接下来,他们评估了Cd14 + TLR-NFκB 炎性髓系细胞是否与 PyMT 验证队列数据集中的转移前生态位形成有关。这些分析表明,在单核细胞、中性粒细胞、AM 和 IM 中检测到了 TLR-NFκB 炎症亚群(图 5 F)。在这些数据中,炎症单核细胞和 AM 的比例在中期肺中富集(图 5 F),但是炎症中性粒细胞和 IM 的比例并没有随着时间的推移而发生显著变化。
他们使用 MULTI-seq 纵向分析了 4T1 原位移植模型中的肺免疫细胞,该模型形成来自原发性乳腺肿瘤的肺转移,就像 PyMT 小鼠一样。4T1 转移进展期间肺免疫动力学分析验证了 PyMT 小鼠的许多关键发现。例如,4T1 转移进展与中性粒细胞和 cM 比例随时间推移而增加,AM、B 细胞、T 细胞和 cDC1 比例下降有关。检测到与 TLR-NFκB 炎症相关的单核细胞、嗜碱性粒细胞、中性粒细胞、AM 和 IM 亚群(例如NMF19 模块评分增加以及Cd14和Cxcl2表达增加)(图 5 G)。值得注意的是,4T1 和 PyMT 模型之间也存在差异,即检测到表现出明显转移相关转录变化的嗜碱性粒细胞,而在 PyMT 数据中完全不存在。此外,4T1 数据中 TLR-NFκB 炎性髓系细胞的比例主要在晚期肺中增加(图 5 G),这可能是由于疾病进展动力学、乳腺肿瘤分子亚型和/或小鼠背景的差异。
接下来,他们通过重新分析公开可用的 scRNA-seq 数据来分析是否在人类疾病中观察到髓系 TLR-NFκB 炎症,这些数据描述了 15 名人类供体的脑转移性微环境。他们专注于代表四名乳腺癌和黑色素瘤患者的数据中的主要髓系细胞群——类似于肿瘤相关巨噬细胞的APOE+转移相关巨噬细胞 (MAM) 和类似于 MDSC 的S100A8 + MAM——分析了在 PyMT 和 4T1 荷瘤小鼠中观察到的 TLR-NFκB 炎症特征 (NMF19) 是否在这种背景下检测到。该分析显示,NMF19 在S100A8 + MAM 中富集,但在APOE + MAM 中不富集(图 5 F-H)。值得注意的是,这些数据并不能提供脑转移性微环境的纵向视图。然而,在患有乳腺癌和黑色素瘤的人类患者中检测到肺转移性微环境之外的髓系 TLR-NFκB 炎症支持该通路参与转移进展。
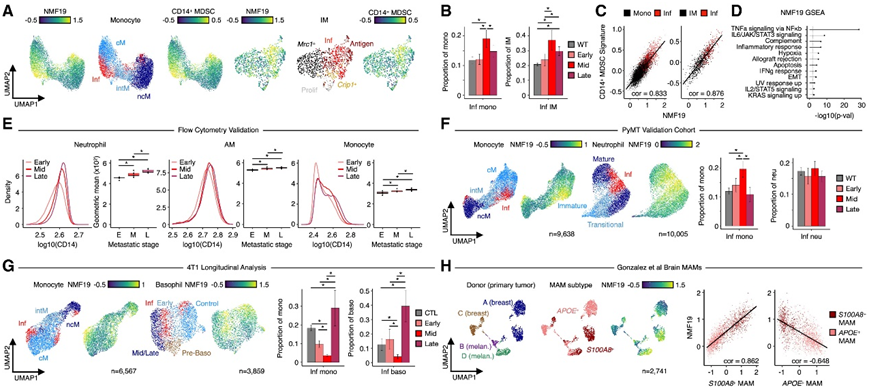
图5. 在PyMT 转移前微环境髓系细胞、人类转移相关巨噬细胞和另一种转移性乳腺癌小鼠模型中检测到髓系 TLR-NFκB 炎症特征。
(a) UMAP 可视化单核细胞和 IM 基因表达空间,以 NMF19 模块评分、亚型或 CD14 + “激活”MDSC 模块评分着色。 (b) 条形图描述了转移过程中炎症单核细胞和 IM 比例的变化。(c) 散点图显示单核细胞和 IM 中 CD14 + “激活”MDSC 与 NMF19 模块评分之间的相关性。(d) 棒棒糖图描绘了在构成 NMF19 转录特征的基因中富集的 Hallmark 基因集。(e) 密度图和箱线图描述了使用流式细胞术测量的转移进展过程中中性粒细胞、AM 和单核细胞中 CD14 膜蛋白丰度的变化。 (f) UMAP 可视化 PyMT 验证队列单核细胞和中性粒细胞基因表达空间,按亚型或 NMF19 模块评分着色,并使用条形图描述炎症亚群比例的变化。 (g) UMAP 可视化 4T1 单核细胞和嗜碱性粒细胞基因表达空间,按亚型或 NMF19 模块评分着色,并以条形图描述炎症亚群比例的变化。 (h) UMAP 可视化大脑 MAM 基因表达空间,按供体(和原发性肿瘤类型)、MAM 亚型或 NMF19 模块得分着色,散点图说明 NMF19、S100A8 + MAM 和APOE + MAM 模块得分之间的关系。
04
淋巴细胞对炎症和免疫抑制 PyMT 肺转移微环境作出反应并产生促进作用
淋巴细胞对转移进展具有多种多样且与环境相关的影响。例如,NK 和 CD8 + T 细胞的细胞毒性反应通常具有抗转移作用,而免疫抑制性 Treg、调节性 B 细胞 (Breg) 和“暴露于肿瘤”的免疫调节性 NK 细胞可发挥促转移作用。
在 NK 细胞中,他们鉴定了免疫调节和细胞毒性亚型,它们随着时间的推移按比例偏向细胞毒性 NK 细胞(图 6 A)。他们使用流式细胞分析,发现相对于CD27high免疫调节NK细胞(类似于人CD56dim NK细胞),CD11bhigh细胞毒性NK细胞(类似于人CD56bright NK细胞)的比例确实随着时间推移而增加(图6B)。他们重新分析了肺腺癌患者的正常肺、原发性肺肿瘤、正常淋巴结和转移性淋巴结样本的公开 scRNA-seq 数据中存在的 NK 细胞。该分析表明,与正常淋巴结相比,转移性淋巴结中的FCGR3A +细胞毒性 NK 细胞比例增加,而与正常肺组织相比,原发性肺肿瘤中的 FCGR3A + 细胞毒性 NK 细胞比例降低(图 6 C)。这些观察结果表明对细胞毒性 NK 细胞的偏向特定于人类和小鼠的转移性微环境,他们还观察到 CD8+ T 细胞分化随着时间的推移而增加(图 6 D)。
除了这些炎症反应外,他们观察到与转移相关的淋巴细胞免疫抑制特征。例如,免疫抑制性 Treg 在增殖性 T 细胞区室中富集,并且与 WT 小鼠相比,所有转移阶段的 Breg 频率均增加(图 6 E)。

图6. 淋巴细胞亚型表征揭示了炎症和免疫抑制性肺转移微环境的细节。
(a) UMAP 对 NK 细胞基因表达空间进行可视化,按亚型着色,条形图描述转移进展过程中亚型比例的变化。(b) 箱线图描述了使用流式细胞测量的转移进展过程中肺 NK 亚型比例的变化。 (c) UMAP 对人类淋巴结和肺 NK 细胞基因表达空间进行可视化,按亚型、组织或 NK 亚型标记着色,条形图描述样本类型之间亚型比例的差异。(d) UMAP 对 T 细胞基因表达空间进行可视化,按亚型着色,条形图描述转移进展过程中亚型比例的变化。(e) UMAP 对 B 细胞基因表达空间进行可视化,按亚型着色,条形图描述转移进展过程中亚型比例的变化。
05
细胞间通讯网络建模预测转移相关免疫信号模式
为了评估PyMT小鼠转移进展过程中免疫细胞间信号网络如何变化,他们使用 CellChat来预测每个转移阶段的活跃细胞间通讯轴。首先评估了与髓系 TLR-NFκB 炎症相关的细胞因子(例如Cxcl2、Tnf和Il1b)的预测信号网络在转移前利基肺中是否不同。该分析支持了 CellChat 预测的准确性,因为预测中期肺中AM、IM 和中性粒细胞之间的 CXCL2-CXCR2 信号传导和单核细胞和 AM 之间的 TNF-TNFRSF1A/B 信号传导会升高(图 7 A)。
在对这些信号预测进行基准测试后,他们使用 CellChat 探索转移进展过程中发生变化的信号通路。在这些预测的相互作用中,确定了Igf1+ IM和Igf1r +中性粒细胞之间的 IGF1-IGF1R 信号通路,该通路仅存在于 WT 和早期肺中(图 7B)。具体而言,Igf1由Mrc1+ IM表达并随时间推移而减少(图 7C),这表明Mrc1+ IM 表型的变化有助于预测的 IGF1-IGF1R 信号抑制。值得注意的是,肿瘤尾静脉注射后,Igf1r基因敲除小鼠的肺转移减少,表明 IM-中性粒细胞 IGF1-IGF1R 信号可能在早期转移性微环境形成中发挥作用。
最后,他们观察到一个预测的 CCL6-CCR1/2 信号网络,该网络由Ccl6 + AM、IM、中性粒细胞和单核细胞以及Ccr1+中性粒细胞或Ccr2 +单核细胞、DC、IM 和 NK 细胞组成(图 7 D)。有趣的是,随着时间的推移, Ccl6表达在中性粒细胞中降低而在 AM 中增加(图 7 E)。Ccl6由大多数中性粒细胞和 AM 亚型表达,但在转移进展过程中,其在所有中性粒细胞亚型中降低,在大多数 AM 亚型中升高(图 7 F)。
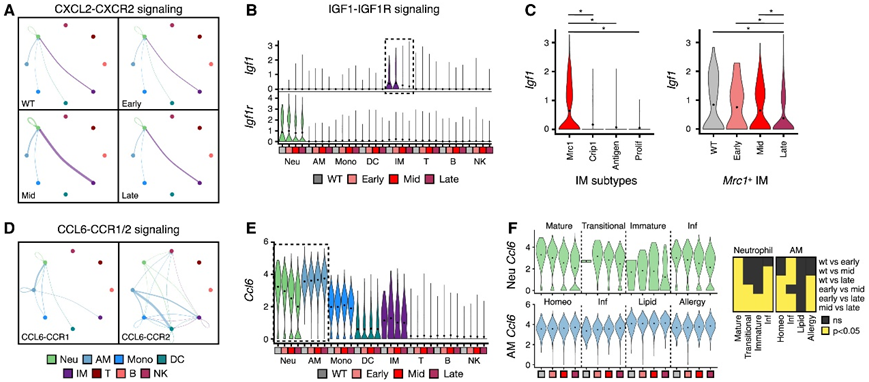
图7. 细胞间通讯建模揭示肺免疫细胞信号网络的转移相关变化。
(a) CXLC2-CXCR2 信号传导的加权网络图。(b) 小提琴图显示所有细胞类型中Igf1和Igf1r 的表达情况。(c) 小提琴图显示每个 IM 亚群和按转移阶段分组的Mrc1+IM中的Igf1表达。(d) CCL6-CCR1/2 信号传导的加权网络图。(e) 小提琴图显示按转移阶段划分的所有细胞类型中Ccl6 的表达情况。(f) 小提琴图显示中性粒细胞和 AM 亚型中Ccl6 的表达情况。
+ + + + + + + + + + +
结 论
本项研究纵向分析了PyMT和 4T1 转移性乳腺癌模型中的肺免疫转录谱,从原发性肿瘤发生到转移前微环境形成,再到单细胞分辨率下的转移性生长的最后阶段。对这些数据的计算分析揭示了外周来源和组织驻留髓细胞共同启动的 TLR-NFκB 炎症程序,该程序与转移前微环境形成相关,并反映了原发性肿瘤中的 CD14 + “激活”髓细胞。此外,观察到原发性肿瘤和转移性微环境NK 细胞在小鼠和人类患者样本中受到不同的调节,转移性微环境具有升高的细胞毒性 NK 细胞比例。最后,确定了转移进展过程中 IGF1 和 CCL6 信号细胞类型特异性动态调节,代表抗转移免疫治疗候选通路。
+ + + + +



 English
English


