文献解读|J Hepatol(25.7):肝细胞癌的多模态图谱揭示了趋同进化路径和“坏苹果”对临床轨迹的影响
✦ +
+
论文ID
原名:A multimodal atlas of hepatocellular carcinoma reveals convergent evolutionary paths and ‘bad apple’ effect on clinical trajectory
译名:肝细胞癌的多模态图谱揭示了趋同进化路径和“坏苹果”对临床轨迹的影响
期刊:Journal of Hepatology
影响因子:25.7
发表时间:2024.05.20
DOI号:10.1016/j.jhep.2024.05.017
背 景
肝细胞癌 (HCC) 是一种致死率极高的癌症,其特征是肿瘤内异质性 (ITH) 较高。全面了解其肿瘤演变及其临床轨迹,可能提供新的预后和治疗策略。
实验设计
结 果
01
绘制肝细胞癌基因组肿瘤内异质性 (ITH) 图谱
通过亚太网络肝癌精准医疗前瞻性队列研究(PLANet 1.0,NCT03267641),研究者团队招募了来自亚太四个国家的 155 名患者。其中,123 名患者符合纳入和排除标准,并纳入最终分析(图 1 A)。本项研究队列包括早期至中期疾病阶段(I 期,n=64,52.0%;II 期,n=40,32.5%;III 期,n=19,15.4%)。病毒性肝炎感染是亚洲 HCC 的主要风险因素,PLANet 队列包括 76 名 HBV 阳性(61.8%)、3 名 HBV+HCV 阳性(2.4%)、7 名 HCV 阳性(5.7%)和 37 名非病毒病因患者(30.1%)。
为了系统地分析患者的 ITH,他们收集沿原发肿瘤中心轴的多个代表性区域(图 1 A),避开明显坏死的区域。对 123 名患者中的 490 个肿瘤区域和 123 个相邻正常组织进行了 全基因组测序 (WGS)。同时,对 112 名患者的肿瘤和相邻正常组织进行了转录组分析(RNA -seq)。为了创建HCC的全面进化图谱,他们首先研究了已知癌症驱动突变的ITH程度。TP53、TERT和CTNNB1的突变最为常见,并且在大多数患者中至少可以发现一个突变(图1B)。他们推断了这些突变的克隆性,并发现所有三个主要驱动因素倾向于在同一肿瘤中发现的截短事件(TP53为78.8%,TERT为71.4%,CTNNB1为72.5%),证实了先前的报道,即它们代表了多步骤肿瘤发生过程中的早期事件。
接下来,他们进一步分析了拷贝数变异(CNV)和病毒整合(VI)的潜在驱动事件。GISTIC213用于识别复发性广泛和局部CNV事件。对于广泛水平的CNV,两个臂扩增(1q和8q)以及四个臂缺失(8p、13q、16q和21p)确定为潜在的驱动CNV(图1B)。对于局灶级CNV,鉴定出1个扩增的细胞带(11q13.3)和6个缺失的细胞(17p13.3、1p36.33、8p23.1、21p12、10q25.2和13q14.13)(图1B)。在这些细胞带中,包括TERT的反复扩增和AXIN1的缺失。这些结果与之前的报告一致,显示出16q缺失、8q扩增以及TERT和AXIN1基因扩增在亚洲HCC队列中普遍存在,突显了TERT、细胞周期和Wnt通路在HCC中的重要作用。在这些CNV(拷贝数变异)事件中,大部分超过一半是非截短事件。特别是对于21p缺失和17p13.3缺失,发现的仅为非截短事件。这些发现表明了CNV在肿瘤早期进化之外的作用。从HBV阳性患者中使用VIRUSBreakend工具识别了HBV VI,并且在小部分患者中发现了VI至TERT启动子区域或KMT2B基因,这些主要是截短事件(图1B)。
为了进一步了解ITH在HCC疾病进展中的作用,他们计算了系统发育ITH的程度(图1C-D)。PLANet 研究的一个关键方面在于能够追踪这些癌症患者的精确临床轨迹,他们将患者肿瘤的系统发育 ITH 程度与其临床变量相关联。出乎意料的是,系统发育 ITH 与 TNM 分期和微血管侵犯 (MVI) 等主要临床特征之间没有统计学上的显著关联。此外,在控制潜在临床混杂因素时,具有高系统发育 ITH 的患者与基于中位复发时间 (TTR) 的较差预后没有显著相关性(图1E)。当将相同的分析扩展到 CNV ITH 时,他们在分层患者时始终观察到无显著性(图 1 F)。这与其他类型的癌症,如ccRCC、肺癌、胃癌和头颈癌形成对比,在这些癌症中,较高的ITH与较差的临床结果显著相关。因此,系统发育和CNV ITH似乎不是HCC疾病复发的重要决定因素。
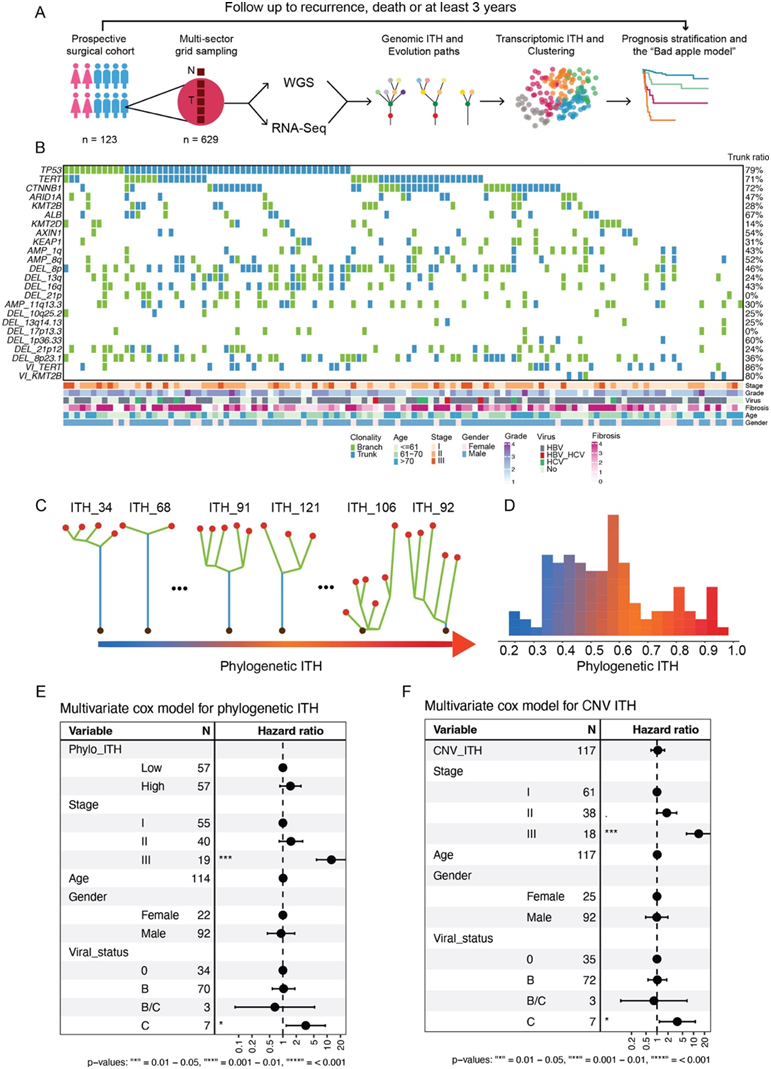
图1. PLANET 队列的基因组 ITH 景观。
(A)PLANET 研究概述。(B)显示基因组变异的克隆性和临床特征的热图。(C) PLANET 队列中低、中、高水平系统发育 ITH 的示例系统发育树。(D) 显示 PLANET 队列系统发育 ITH 分布的直方图。(E-F) 森林图显示在控制潜在混杂因素的多变量 Cox 模型中系统发育 ITH和 CNV ITH的 TTR 分层效应。
02
融合的遗传进化路径推动临床结果
在整个 PLANet 队列中,他们能够识别出七条遗传进化路径 P1-P7,这些路径主要由从种系 (GL) 到四个最常见的 HCC 驱动事件(即TP53 突变、TERT 突变、CTNNB1 突变和 TERT VI)的轨迹控制(图 2 A)。具体来说,这些路径中的三个路径,即P2、P3和P4,每个路径均由三个驱动突变中的单一事件定义,然后是其他CNV(拷贝数变异)事件。例如,P2中的轨迹富集为TP53->8p23.1缺失,P3中的轨迹为TERT->21p12缺失,P4中的轨迹为CTNNB1->8p23.1缺失。此外,路径P6和P7均以GL->TP53轨迹为特征,加上GL->TERT(P6)或GL->CTNNB1轨迹(P7),而路径P5的特征是TERT病毒整合。全基因组加倍(GD)事件在含有TP53突变的路径中更为频繁:P2、P6和P7(图2A),这与TP53突变是基因组不稳定性的强大遗传原因一致。将其余具有不同路径的患者分类为P1。值得注意的是,这些轨迹是通过驱动事件的顺序定义的,而不是它们在肿瘤内的(共)存在。例如,具有截短TP53和非截短TERT突变的肿瘤聚类到P2路径,而不是同时显示截短TP53和TERT的P5路径。有趣的是,除了臂和局部水平的CNV事件外,在这些HCC的进化路径中没有发现显著富集的非截短驱动突变。这表明早期的截短驱动突变和晚期的CNV事件塑造了HCC的遗传进化轨迹。
接下来,他们试图揭示临床特征与所识别的不同基因进化路径之间的关联。首先开始定义临床特征与七条路径之间的关联,然而,只有P7路径在非病毒性肿瘤中表现出富集。随后,他们检测了七条基因进化路径中患者TTR(无复发生存期)的差异。虽然将七个组分开时预后分层并不显著,但P6和P7显示出相对较差的预后(图2B-C)。事实上,当将P6和P7组合成一组时,即使在控制了其他临床变量(如肿瘤分期和病毒状态)之后,它们的预后也明显比其他路径差(图2D)。
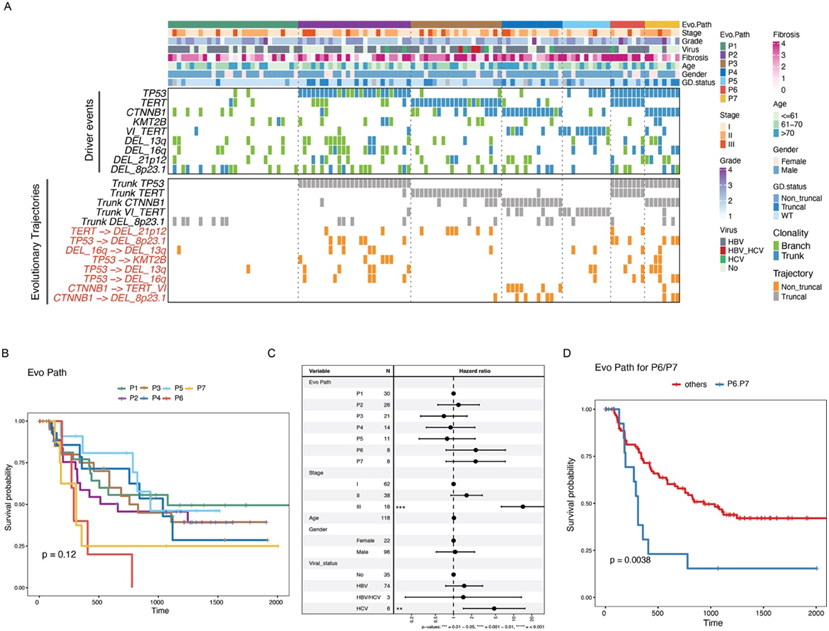
图2. PLANET 队列的进化路径。
(A) 热图显示了不同进化路径的代表性进化轨迹。(B) Kaplan-Meier 图显示七种进化路径的 TTR 分层效应。(C) 森林图显示控制潜在混杂因素的多元 Cox 模型中进化路径的 TTR 分层效应。(D) Kaplan-Meier 图显示将 P6 和 P7 路径合并为一组时的 TTR 效应。
03
不同的转录组亚型在 HCC 肿瘤内共存
对于具有 WGS 的相同肿瘤区段,他们进行了RNA-seq。对其转录组的无监督聚类确定了六种分子亚型,即 C1 至 C6。为了收集与不同亚型相关的功能差异,他们根据标志通路进行了基因集富集分析,揭示了代谢组学、免疫、增殖和细胞周期相关特征的统计学显著差异(图 3 A)。具体而言,C1 亚型与 G2/M 检查点基因和 Myc 靶基因的减弱标记相关,并且与相邻的正常样本最为相似,表明转录组标记与侵袭性较低的肿瘤相关。C2 亚型富集 CTNNB1 突变并显示 Wnt Beta-catenin 通路的强烈激活。C5 和 C6 亚型具有一系列表型特征,从 Myc 靶基因激活到代谢途径的显著下调标记,描绘出与正常样本最远的转录组谱(图 3 B)。综合起来,这些分析指向了一系列转录组亚型,从更正常的 C1 到假定更具增殖性的 C5 和 C6 亚型。
接下来,他们研究了六种转录组亚型的临床预后。令人惊讶的是,患有 C5 或 C6 亚型肿瘤的患者表现最差(图 3C)。与先前定义的HCC亚型相比,C5和C6亚型类似于“生存差”亚型以及“增殖”亚型(图3A)。此外,C5或C6亚型肿瘤区患者也与较差预后相关的临床特征相关,包括较高的血AFP水平、较高的MVI比例和较高的Edmonson - steiner分级。综合证据强烈提示C5和C6亚型具有高增殖和侵袭性,患者预后较差。
与之前的研究一致,这个扩大的PLANet队列证实了混合亚型肿瘤的患病率,即在单个肿瘤中共存一种以上不同的转录组亚型。根据PLANet队列中的6个转录组亚型,超过40%的肿瘤含有一个以上的亚型,其中大多数是两个亚型的混合(图3D)。
由于系统发育异质性(ITH)与临床预后之间的关联出乎意料地较弱,这促使他们探索转录组异质性的影响。虽然在具有混合亚型肿瘤的患者(p=0.02,图3E)或通过整体表达相似性测量的高定量转录组异质性患者(图3F)中,初步观察到预后分层效应较弱(即TTR较差),但在控制潜在混杂的临床变量(如肿瘤阶段和肿瘤中的节段数)后,这一效应变得不显著。尽管离散转录组亚型(如C5和C6在较差生存结果中具有分层作用)显示出强大的预后能力,但总体而言,转录组异质性似乎并未提供显著的预后价值。这表明需要更仔细地重新评估转录组亚型,通过其表型适应性来解释HCC患者的临床轨迹。
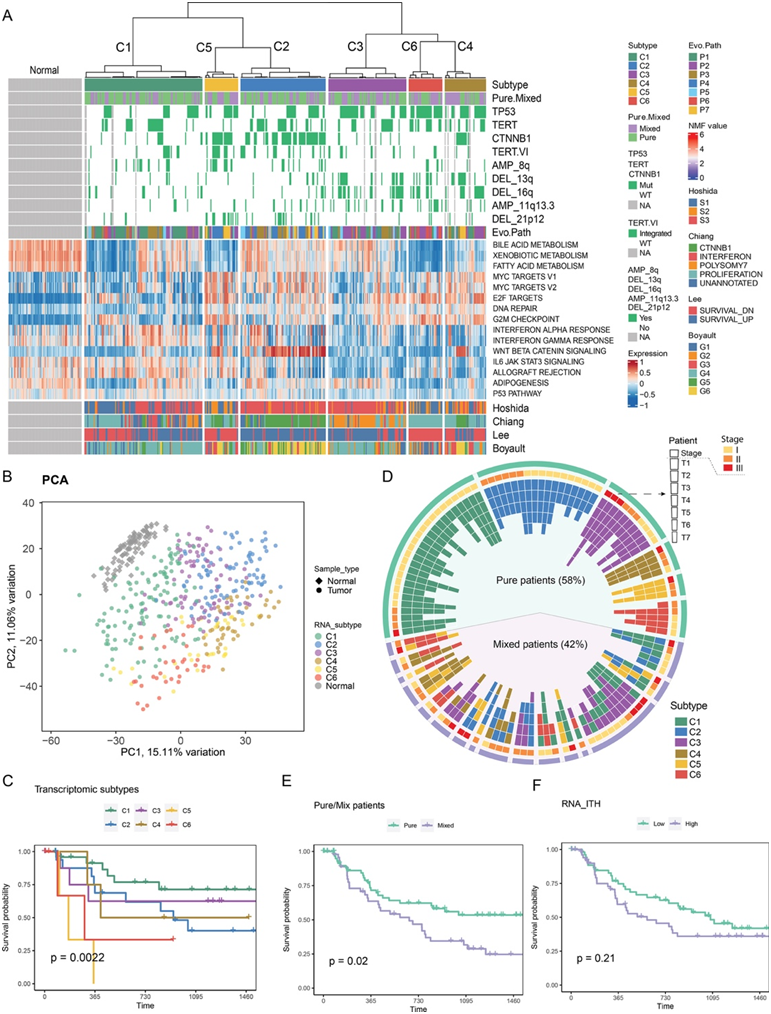
图3. PLANET 队列的转录组亚型和 ITH。
(A) PLANET 队列的转录组亚型和 ITH。(B) 肿瘤和正常样本中转录组亚型表达谱的主成分分析(PCA)。(C) Kaplan-Meier 图显示纯患者(即仅具有一种亚型的患者)转录组亚型的 TTR 分层效应。 (D) 热图显示按肿瘤中每个部分的位置排列的亚型组成。(E-F) Kaplan-Meier 图显示纯/混合转录组亚型状态和高/低转录组 ITH的 TTR 分层效应。
04
“坏苹果”效应决定了临床轨迹
为了分析对临床轨迹有更直接贡献的关键分子或遗传特征,他们首先分析了转录组亚型与 ITH 之间的关联。事实上,具有更高转录组 ITH 的肿瘤富含 C5 或 C6 亚型。这使他们推断,对于具有高转录组 ITH 的肿瘤,导致更不利临床轨迹的主要因素可能不是 ITH本身的程度,而是 C5 或 C6 亚型的存在。事实上,无论纯亚型还是混合亚型,没有 C5 或 C6 亚型的肿瘤对 TTR 的贡献都相似,而具有 C5 或 C6 亚型的肿瘤导致预后明显更差(图 4 A)。
他们随即提出这样的观点:HCC 患者的临床发展轨迹很大程度上可能由最具侵袭性的肿瘤细胞部分决定,这可以理解为“坏苹果”效应,即一颗坏苹果(即 C5 或 C6)会毁掉整桶苹果。“坏苹果”效应并不依赖于转录组分类。例如,当根据先前发表的分类系统将转录组亚型分配给患者时,观察到类似的效果,即具有更具侵袭性亚型的纯或混合肿瘤显示出更差的预后。为了更普遍地解释“坏苹果”效应而不使用分类系统,可以根据定量预后标志物来分配“坏苹果”,即将具有这些标志物最高表达水平的肿瘤节段分配为“坏苹果”。随后,患者的预后应由这些“坏苹果”节段的表达水平决定,而不是所有节段的平均或最小值。实际上,采用这种“坏苹果”方法(使用各节段的最大值)提供了最高的预后预测敏感性(图4B)。
他们进一步通过TCGA的外部队列验证了“坏苹果”效应。使用一种称为WISP的转录组反卷积方法,将每个单节段的TCGA HCC肿瘤解卷积到基于每个转录组亚型质心的转录组分类中,并根据反卷积权重将其分类为纯样本或混合样本。与在PLANet队列中发现的“坏苹果”效应一致,在TCGA队列中,包含C5或C6亚型的患者——无论是纯形式还是混合形式——都表现出比更差的无复发生存期(图4C)。
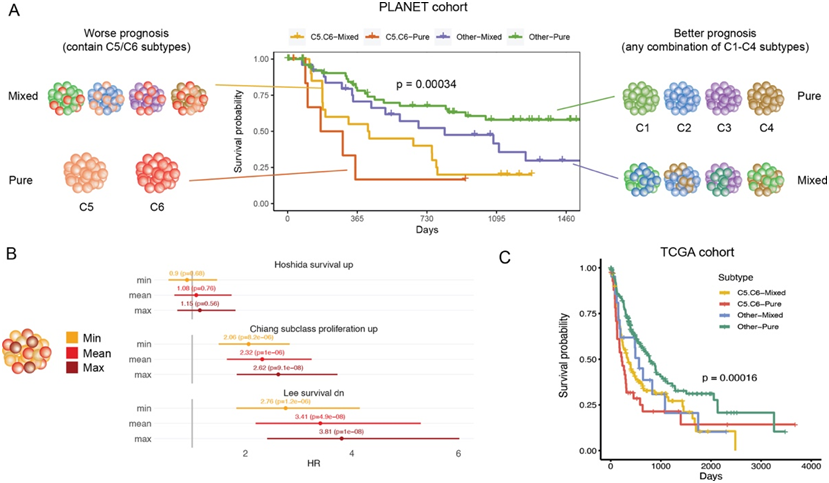
图4. 转录组的“坏苹果”效应。
(A) Kaplan-Meier 生存图显示 TTR 分层效应,即肿瘤的纯/混合状态与 C5/C6 亚型的存在/不存在之间的相互作用。(B) PLANet 队列中转录组预后特征的 Cox 模型系数和显著性水平。(C) Kaplan-Meier 图显示基于 TCGA 队列中的转录组反卷积方法分配肿瘤时的生存分层效应。
05
肿瘤的遗传进化史决定了分子表型
通过在基因型和表型空间的多模态分析,他们发现了几项与肿瘤不同进化方式相关的重要指标:代表整体遗传异质性的系统发育ITH、描述早期肿瘤进化的进化路径以及促进适应性表型行为的转录组亚型。虽然每个指标独立预测临床预后,但他们想知道综合模型是否能优于仅依赖临床特征的基线模型。有趣的是,这三种与进化相关的指标与临床特征的任何组合都能显著提高预后准确性,而单独的基线模型则不能(图5A)。例如,临床特征加上进化路径显示出比单独的临床特征显著更高的预后准确性。同样,将临床特征与转录组亚型结合也提高了预后价值。这与临床轨迹受到早期(进化路径)和晚期(转录组亚型)进化事件影响一致。有趣的是,将所有三种指标与基线模型结合提供了最佳性能(图5A)。此外,在综合模型中,除了临床分期和病毒状态外,这三种指标显示出比临床特征更高的预后重要性分数(图5B)。总的来说,这些分析表明肿瘤的遗传和转录组进化可能是相互关联的,并强调了需要阐明这种相互作用。
他们探讨了肿瘤的早期基因进化历史(由进化路径表示)如何影响最终的肿瘤表型。利用配对的WGS和转录组数据,将基因进化路径与转录组亚型进行了关联分析。令人惊讶的是,在三个具有GL->TP53路径的基因进化路径中发现了C5或C6亚型的明显富集(图5C)。具体而言,P6路径(包含GL->TP53和GL->TERT)和P7路径(包含GL->TP53和GL->CTNNB1)分别与C5和C6亚型相关(图5D)。包含C5或C6亚型的混合亚型肿瘤往往与P2路径(包含GL->TP53)相关(图5D-E)。虽然TP53、CTNNB1和TERT的主要突变已知会驱动HCC的初始肿瘤发生,表明这些截短突变可能以主导方式塑造分子表型,包括肿瘤细胞群体的侵袭性。事实上,锚定TP53基因突变可能改变关键下游分子通路,使癌细胞具有更具侵袭性的特性。此外,通过TIDE进行的肿瘤微环境分析表明,在C5和C6亚型以及三条具有TP53突变的路径中发现了较高水平的免疫治疗无应答者和髓源性抑制细胞。因此,HCC的基因进化过程遵循一个模型,其中早期驱动事件汇聚成由进化路径代表的一组有限的组合;这些路径随后塑造了肿瘤的转录组表型和临床轨迹。
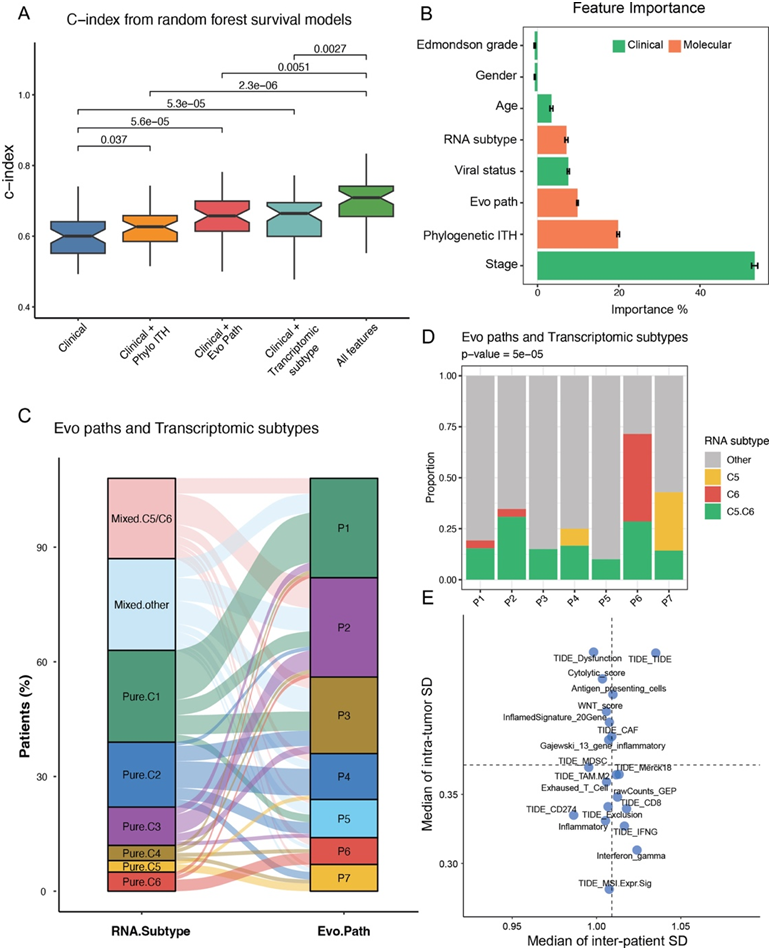
图5. PLANET 队列的多模态整合分析。
(A) 不同特征组合的一致性指数 (c 指数) 分布。(B) 特征重要性得分的排序。(C) 冲积图显示属于不同转录组亚型的进化亚型的比例。(D) 每种进化亚型中 C5 和 C6 纯或混合患者的比例。(E) 不同免疫检查点阻断 (ICB) 生物标志物的患者间和肿瘤内标准差 (SD)。
+ + + + + + + + + + +
结 论
使用多区域采样方法,本项研究揭示了由早期驱动突变、晚期拷贝数变异和病毒整合控制的七条趋同遗传进化路径,这些路径将手术切除后患者的临床轨迹分层。此外,这些进化路径塑造了分子谱,导致不同的转录组亚型。最重要的是,尽管发现某些肿瘤中多种转录组亚型共存,但患者预后最好由肿瘤中最具侵袭性的细胞部分来预测,而不是由转录组 ITH 水平的整体程度来预测——将这种现象称为“坏苹果”效应。最后,本项研究发现早期和晚期肿瘤进化的特征在预测患者生存方面具有重要且互补的预后能力。
+ + + + +



 English
English


