文献解读|Nat Commun(16.6):响应高原缺氧的全身组织转录调控的时间分辨多组学图谱
✦ +
+
论文ID
原名:A time-resolved multi-omics atlas of transcriptional regulation in response to high-altitude hypoxia across whole-body tissues
译名:响应高原缺氧的全身组织转录调控的时间分辨多组学图谱
期刊:Nature Communications
影响因子:16.6
发表时间:2024.05.10
DOI号:10.1038/s41467-024-48261-w
背 景
缺氧对生物体的稳态平衡是一个严峻的挑战,影响高海拔生物体的生理和病理过程。住在低地的人类和动物中,在迁移到高海拔后的短期适应过程中,会发生明显的生理调整以应对缺氧(例如通气量急剧增加),但其机制尚未阐明。
实验设计
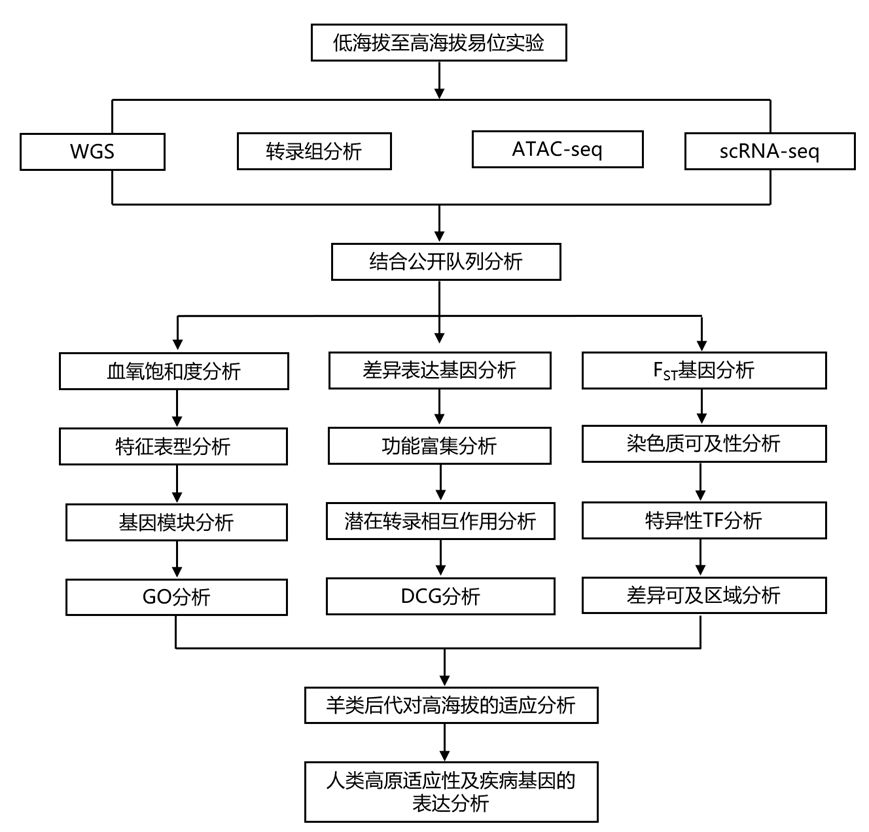
结 果
01
低海拔至高海拔易位实验以及表型和转录特征
在本研究中,研究者团队在绵羊中进行了低海拔至高海拔易位实验(图 1a),并产生了多层数据(图 1b),包括全基因组测序(WGS)、转录组分析(RNA-seq)、染色质可及性分析(ATAC-seq)和单细胞转录组分析(scRNA-seq)数据,以及血液生理生化表型。本项研究的目的是(1)确定组织中短期缺氧反应的时间序列表达变化和调控元件;(2)揭示与人类高海拔适应和疾病有关的基因的多组织表达模式;(3)测试后代对缺氧的适应。
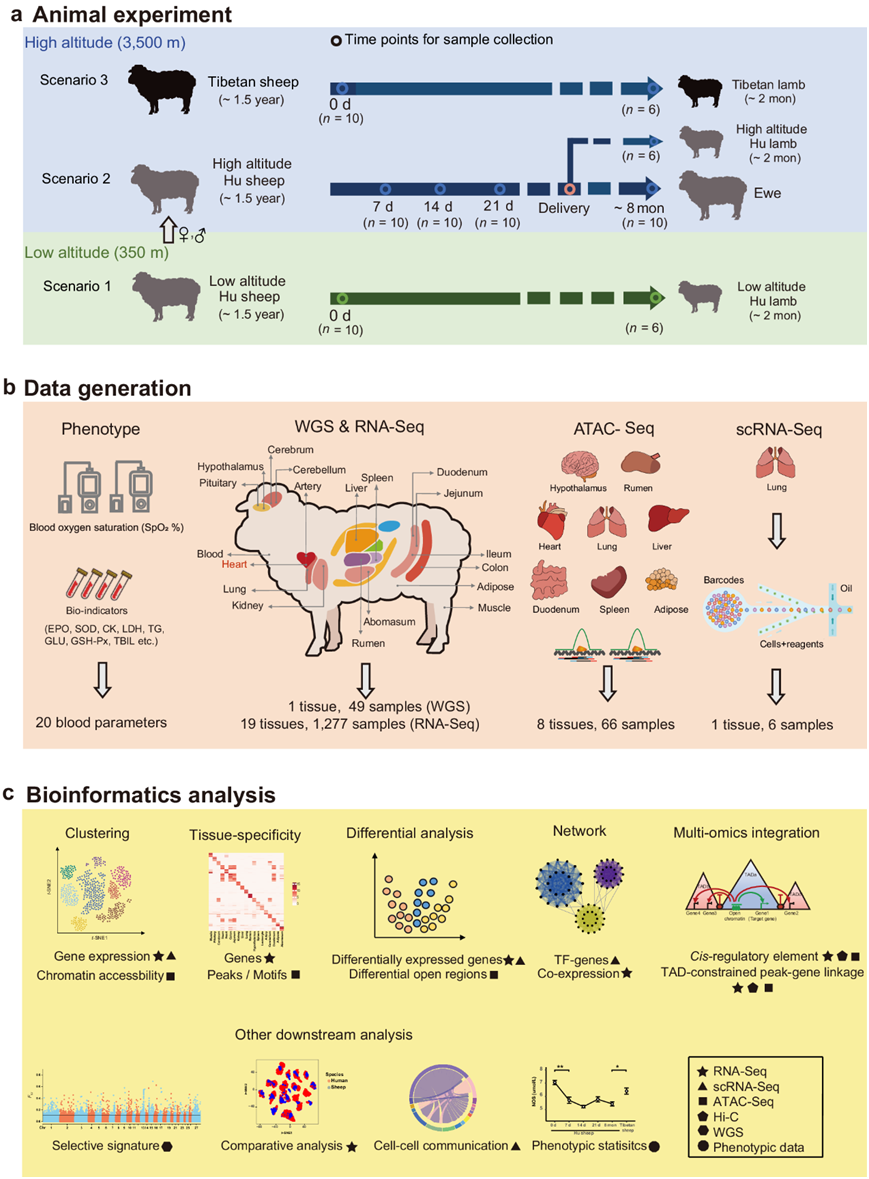
图1. 研究示意图。
(a) 动物易位实验设计。(b) 样本收集和数据生成。(c) 研究中涉及的主要生物信息学和统计分析。
他们在迁徙到青藏高原之前(即 0 天)和之后的四个时间点(即 7 天、14 天、21 天和 ~8 个月)对 10 只湖羊母羊进行了检测,以追踪血氧饱和度 (SpO2)和其他血液指标的变化。SpO 2的平均值在第 7天急剧下降,但随着适应,在第 14 天及之后持续增加(图 2a)。然而,与藏羊相比,即使在 8 个月后,湖羊的 SpO 2水平仍然明显较低(图 2a),这可能反映了哺乳动物对高原缺氧的表型可塑性和遗传适应的潜在不同机制。
除了 SpO2之外,他们还在迁徙的湖羊身上观察到了其他生物指标的不同模式。例如,限制血管舒张因子 NO 合成的一氧化氮合成酶 (NOS) 在易位后降低,且平均值明显低于藏羊(图2b),证实 NO 合成下调导致缺氧性肺血管收缩。与能量代谢相关的甘油三酯 (TG) 和葡萄糖 (GLU) 水平随时间推移而升高,表明缺氧时能量产生增强。总胆红素(T-BIL)的变化是与肝脏损伤呈正相关的指标,呈钟形曲线,表明在适应性过程中肝脏损伤逐渐减轻。心肌酶(CK)在适应性过程中的 4 个时间点均无显著变化,但平均值明显低于藏羊,表明在短期缺氧过程中不发生激活(图2c)。
为了表征全身组织的整体表达模式,他们首先应用了基于样本基因表达谱的 t分布随机邻域嵌入(t-SNE)分析。由此产生的样本聚类准确地重现了不同的组织(图2d)。他们使用加权相关网络分析(WGCNA)研究了血液基因表达与生物学指标之间的关联。在过滤后剩余的13707个基因中,他们确定了14个用不同颜色标记的基因模块(M1-M14)(图S5a-b),并且10个基因模块与一个或多个生物指标显著相关(图2e,图S5c)。特别是,他们观察到M3与促红细胞生成素(EPO),一氧化氮合成酶(NOS),谷胱甘肽过氧化物酶(GSH-Px)和碱性磷酸酶(ALP)显著正相关。M3中基因的GO富集结果与其相关的生物指标一致(图2f)。例如,EPO参与调控造血(如EGR3、HOX5和FOS),NOS与血管发育有关(如NR4A1、JUN和RHOB),GSH-Px与对活性氧的反应有关(如NR4A3、PLK3和TNFAIP3)。蛋白质-蛋白质相互作用分析也表明,与上述通路相关的基因(如JUN、FOS和NR4A1)在M3中的基因内处于调控网络的中心(图S5d)。
此外,他们还研究了基因表达和生物指标随时间的变化。NR4A1和EGR3(来自基因模块 M3)的整体表达水平分别与 NOS和 EPO呈显著正相关(图2e-g)。NR4A1在 0 天 (即常氧)显示出更高的表达和更高的 NOS 值 (图S5e)。在EGR3 也观察到了类似的表达趋势(图S5f)。
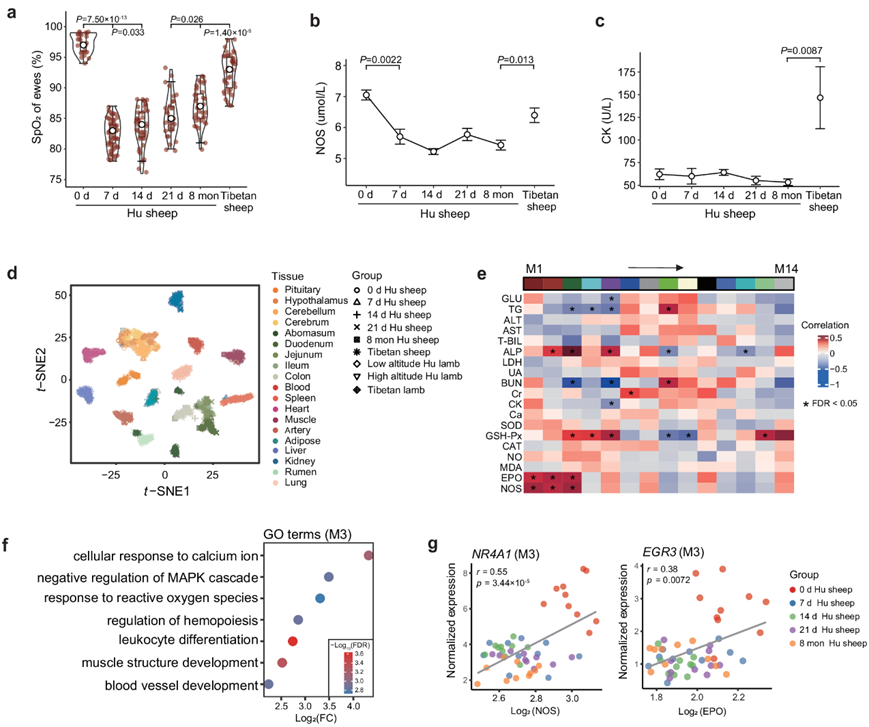
图2. 表型和基因表达的特征。
(a) 血氧饱和度(SpO2)随适应时间的变化。(b-c) 一氧化氮合成酶(NOS)和心脏酶(CK)值随时间的变化。 (d) RNA-Seq 样本的t分布随机邻域嵌入 (t-SNE) 聚类。(e) 血液中基因模块和生物指标之间的关联。(f)GO分析 (g) M3中的基因示例。
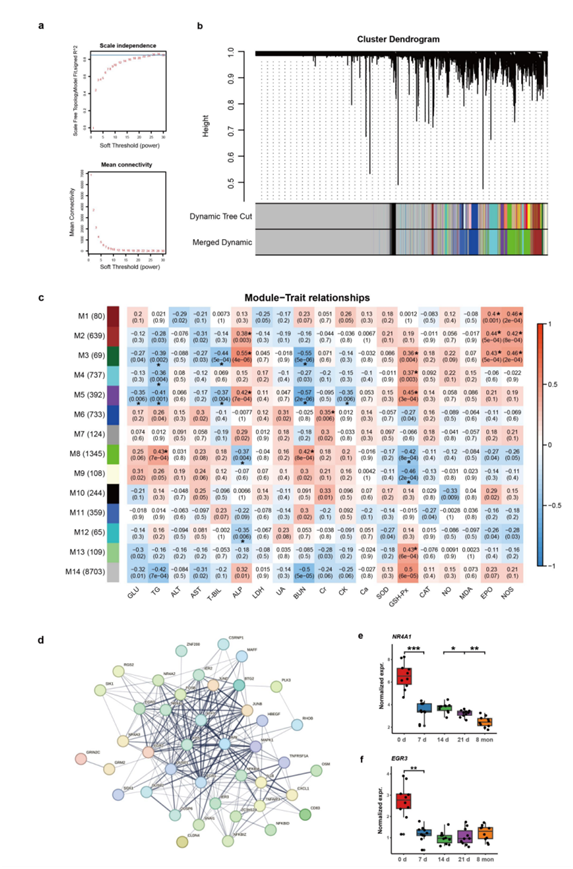
图S5. 加权相关网络分析(WGCNA)。
(a) 最佳β值的确定。(b)在血液中构建加权基因共表达网络。(c)与19种血液生物指标相关的基因模块(M1-M14)。(d)蛋白质-蛋白质相互作用网络。(e-f)基因模块3(M3)的基因样例。
02
时间转录组动态和多组织相互作用
为了探索缺氧适应过程中的转录变化,他们确定了跨组织五个相邻时间点之间的差异表达基因 (DEG)。总体而言,他们观察到组织间和组织内 DEG 数量的巨大差异,尤其是在 0 天到 7 天之间(图3a)。某些组织(例如肾脏、结肠、脂肪和小脑)在多个或特别是相邻时间点的比较中显示出激活(图3a)。
接下来,他们检测了相邻时间点之间每次比较中 DEG 在组织中的分布情况。大多数 DEG 分配到特定组织,而少数 DEG 则显示出普遍分布(图 3b)。然后,他们确定了每次比较中组织共有的(即至少在五种组织中)和组织特异性的(即仅在一种组织中)DEG(图3c-d)。组织共有DEG 的功能富集表明基因参与多种生物过程,例如骨骼肌细胞分化(例如BTG2、ATF3和NR4A1)、对缺氧的反应(例如NR4A2、EGR1和CPEB2)和对皮质类固醇的反应(例如NR4A3、IGF1R和FOS)(图 3e)。小脑特异性deg与突触信号传导(如NTNG1、TNF和GABBR2)和细胞对应激反应的调节(如HIF1A、ATF4和PARG)有关,而结肠特异性deg与细胞金属离子稳态(如HMOX1、TRPM8和CXCR5)和血管生成的调节(如ISL1、THBS4和ADGRB2)有关(图3f)。综上所述,研究结果表明,缺氧适应可能激活了多个组织的缺氧反应过程和特定组织的功能,这些过程由多基因(即组织特异性deg)和多效性(即组织共有deg)基因共同调节。
总的来说,在 0 天到 7 天之间的比较中,基因聚类5(如NOTCH1)在小脑中的表达增加最多,而在肾脏和脂肪中的表达减少(图3g)。值得注意的是,他们在在 0 天到 7 天之间观察到了最活跃的组织之间可能存在的相互作用,例如小脑、肾脏和脂肪组织(图 3a),这些发现暗示了在适应过程中不同时间点特定组织之间潜在转录网络的作用。
为了探索组织内跨时间点的表达模式,他们进行了时间序列差异表达分析,以识别动态变化基因(DCG)(即在整个适应过程中表达发生显著变化的基因)。不同组织中 DCG 的数量从 68(大脑)到 10459(小脑)不等(图 3h),并分为 2-6 个跨组织聚类。在大多数组织中,DCG 表达随时间的变化反映了上述时间转录变化的类似模式(图 3a)。例如,小脑中的DCG可分为四个聚类(图 3i),这些聚类的整体表达模式在第7天时变化很大。此外,小脑每个聚类中的DCG表现出不同的生物学功能(图 3j)。具体来说,聚类1中的DCG功能与能量代谢有关(如有氧呼吸和ATP代谢过程),而在聚类3中,基因功能与脑生物学有关(例如神经元投射形态发生和脑发育)(图 3j)。这些结果揭示了小脑在经历低氧后能量代谢和生物学功能的调整。
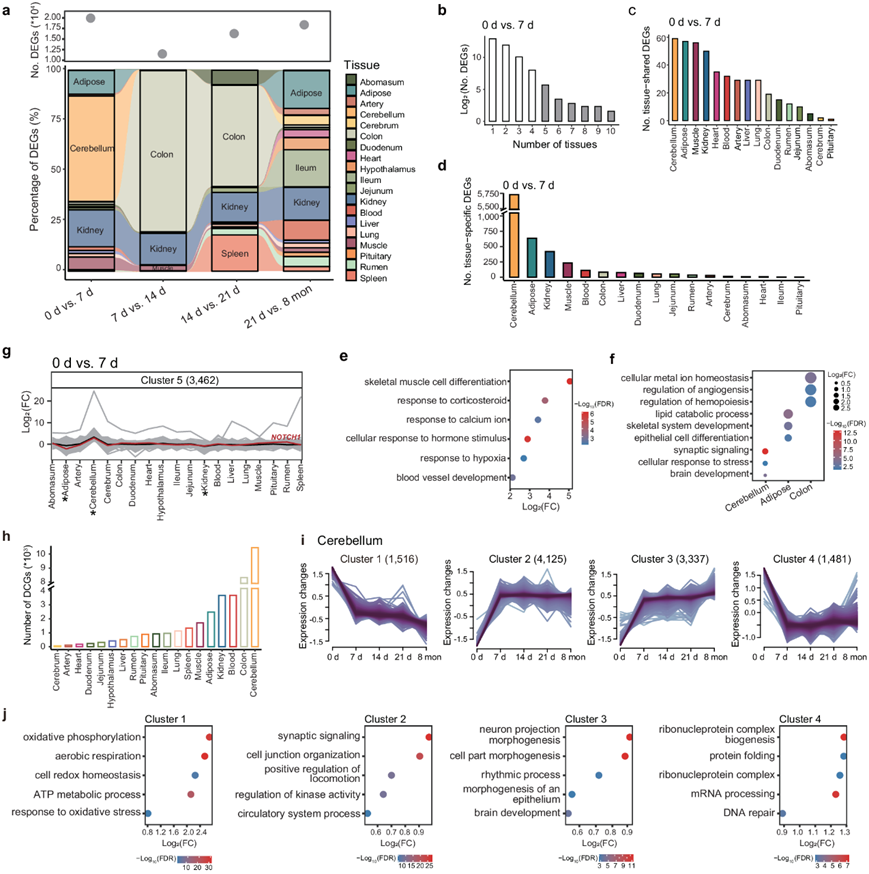
图3. 缺氧适应过程中的转录组动态。
(a) 组织间相邻时间点比较的差异表达基因 (DEG) 数量和 DEG 百分比。(b) “ 0 天与7 天” 中 DEG 在不同组织中的分布。(c-d) “ 0天与7天” 比较中组织间组织共有和组织特异性DEG 的数量。(e-f) GO分析。(g)多组织相互作用。(h) 组织间动态变化基因 (DCG) 的数量。(i) 模糊c均值聚类确定了小脑 DCG 的基因表达模式。(j) 四个聚类中的GO分析。
03
缺氧适应基因在短期适应和长期进化中的作用
为了探索低氧适应基因在长期适应和短期适应中的作用,他们将基因表达数据与基因组测序数据整合在一起进行联合分析。首先计算了来自低海拔和高海拔地区的7个绵羊品种的37个基因组之间的成对FST 值,并选择FST分布的 前5%作为候选选定区域(图S14a)。从候选区域中推定的选定基因(即F ST基因)的功能注释揭示了它们与高海拔适应高度相关(图14b)。他们在每种组织中都检测到了低海拔湖羊和藏羊之间的DEG。对于每种组织,他们分别将FST基因与品种间 DEG 和 DCG 进行交叉分析。他们检测了两类重叠基因(即DEG 中的FST基因和 DCG 中的FST基因)在组织中的分布(图 4a)。他们在DEG中鉴定了52个多组织FST基因(即至少在5种组织中存在的FST基因),在DCG中鉴定了179个多组织FST基因,其中包括13个常见基因(即APOLD1、NDUFB9、ERBB4、NFKBIZ、NR4A3、RPS8、CIAO2A、AHCYL2、ESRRG、KIAA0930、RASGEF1B、MRPS25和TNFRSF21)(图 4c)。13个常见基因的数量显著高于偶然预期的数量(图 4c)。结果表明,这13个FST基因可能通过调节多种组织的表达在缺氧适应和习得中发挥重要作用。此外,他们研究了这些基因在绵羊组织中表达水平的变化(图 4d),并在人类 GWAS 图谱数据库中研究了它们功能。他们发现这些基因的人类性状/疾病关联(例如缺氧相关性状)与类似绵羊组织中的动态表达变化大致一致。例如,APOLD1与心血管(例如高血压)、呼吸系统(例如哮喘)和血液学(例如血红蛋白)性状显著相关(图 4e),在心脏、肺和肾脏中显示出显著的表达变化(图 4d)。同样,NR4A3 与代谢(例如无脂肪质量)、神经/神经系统(例如神经质和失眠)和心血管(例如静息心率)特征显著相关(图4e),并在脂肪、小脑、心脏和动脉中动态表达(图 4d)。这些结果表明,已鉴定的13个组织共有的缺氧适应基因可以通过控制遗传适应和短期适应中不同组织中的表达来调节缺氧相关性状。
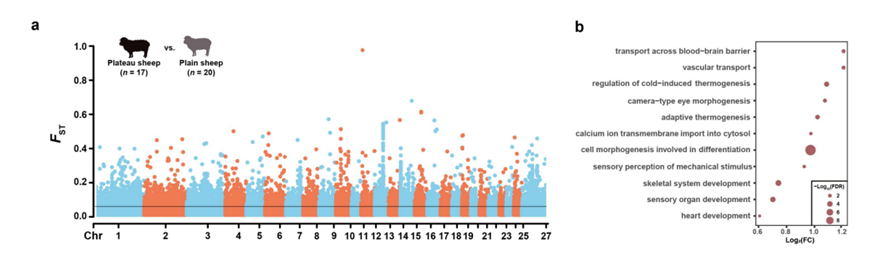
图S14. 选择性分析。
(a)低海拔和高海拔绵羊FST值的全基因组分布。(b)GO分析。
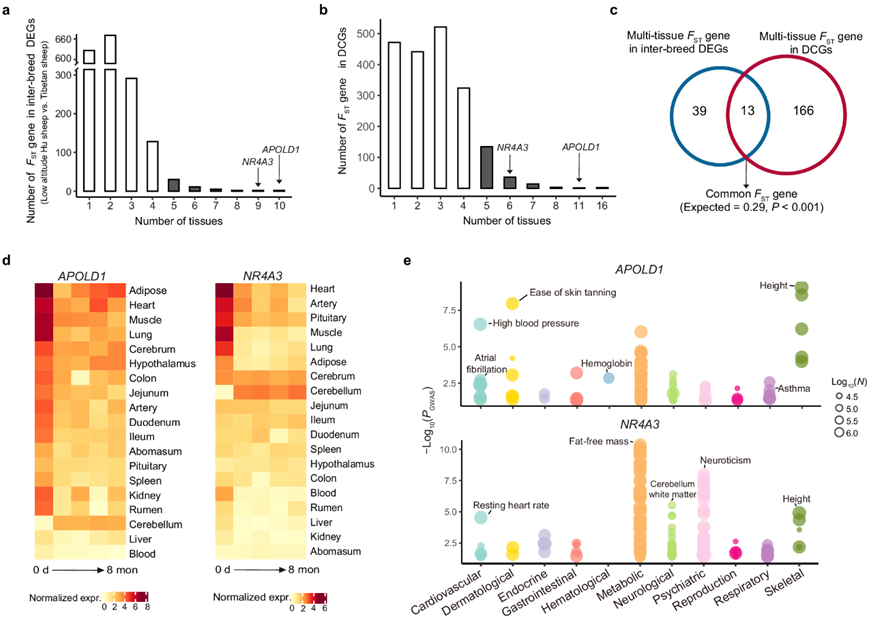
图4. 适应过程中的缺氧适应基因。
(a) FST基因在不同品种(即低海拔湖羊与藏羊)间组织差异表达基因(deg)中的分布 (b) FST基因在DCG组织中的分布。(c) 维恩图显示了杂交deg和dcg中多组织FST基因的交集。(d) APOLD1(左)和NR4A3(右)随时间在各组织中的表达变化。(e) APOLD1(上)和NR4A3(下)的全表型关联分析(Phe-WAS)。
04
缺氧条件下染色质跨组织可及性
为了识别与动态表达相关的调控元件,他们应用 ATAC-Seq 检测了上述三种情景下八种重要组织(即下丘脑、瘤胃、心脏、肺、肝脏、十二指肠、脾脏和脂肪组织)的基因组染色质可及性,他们总共获得了1662152 个具有统计学意义的峰(图S17a),八种组织中的开放染色质区域在转录起始位点(TSS)处高度富集(图 5a)。峰的分布在不同组织之间有所不同(图S17b),但总体而言,峰所占比例最高位于基因间区域,其次是内含子区域,而比例最低的位于 5′UTR(图S17c)。脂肪组织是一个例外,其在距离启动子 ≤ 1 kb 的区域中显示出最多的峰。ATAC-seq 信号在全基因组水平上显示出生物学重复之间的强相关性(图S17d),并且按不同组织而不是品种和时间点聚类(图 5b)。此外,他们观察到跨组织的蛋白质编码基因 (PCG) 数量与 ATAC-seq 峰之间存在很强的正相关性(图 5c),这表明开放的染色质区域正向调节转录活性。
他们表征了组织中组织特异性和保守的峰。结果表明,位于远端基因间和内含子区域的峰更具组织特异性,而位于启动子、外显子、3′ UTR、5′ UTR 和下游区域的峰更为保守(图S18a-b)。他们进一步鉴定了相应的组织特异性转录因子 (TF),并且 TF 结合基序 (TFBM) 显著富集在不同组织的特定峰中,例如心脏中的 MEF2D、肝脏中的 HNF4A 和脾脏中的 ETS1的TFBM(图S18c-d)。他们还对低海拔湖羊、迁徙到青藏高原 8 个月后的高海拔湖羊和藏羊进行了各组织的成对比较差异表达分析,并确定了差异可及区域 (DAR) 。他们发现一些组织特异性 TFBM 显著富集在相应组织的 DAR 中(图5d)。例如,MEF2D的心脏特异性 TFBM 存在于心脏组织的 DAR 中。MEF2D 的表达随时间推移逐渐增加(图 5d),表明 MEF2D 靶基因在心脏中持续发生激活,这与MEF2D在心肌调控中的作用相一致。
随后,他们检测了组织特异性和保守峰的靶基因功能。靶基因很好地反映了组织特异性和组织生物学功能。例如,肺靶基因与肺发育(例如FOXF1、NKX2-1和LIF)和上皮细胞分化(例如HOXA7、TMOD1和SOX17)显著相关(图S18e)。这一观察结果表明 CRE 经常在 TAD 内相互作用以调节基因表达。他们进一步探讨了 CRE 在低氧适应过程中调控基因表达的作用。首先基于 RNA-Seq 数据对低海拔湖羊、移居青藏高原 8 个月后的高海拔湖羊和藏羊进行成对比较的差异表达分析。对于每次比较,他们注释了与 DAR 链接的靶基因,并检测了表现出上调或下调表达和染色质可及性变化的常见基因(图 5e)。他们在组织间鉴定了总共 19151 对组间共同的峰基因对(即低海拔湖羊 vs. 高海拔湖羊、低海拔湖羊 vs. 藏羊和高海拔湖羊 vs. 藏羊),包括 364 个上调基因和 18787 个下调基因(图 5f)。从低海拔湖羊与高海拔湖羊的比较中鉴定出的常见基因与低氧适应相关。例如,高海拔湖羊中下调的常见基因显著富集在响应低氧和调节肝脏造血方面(图 5g)。特别是PPARG,由于染色质可及性较低而表达下调(图 5h),而该基因与心血管昼夜节律的调节有关。此外,LIMD1的功能与hippo信号的调节和对缺氧的反应有关,在高原湖羊的下丘脑中,LIMD1由于开放的可及性而上调(图5h)。因此,上述常见基因的表达受到染色质可及性的调控(即上调或下调),进而影响缺氧适应。
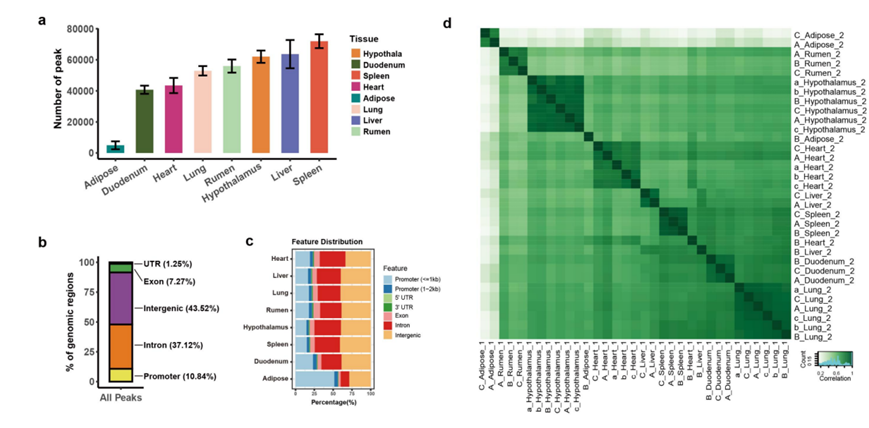
图S17. ATAC-Seq数据汇总。
(a) 组织中峰的数量。(b) 峰在基因组区域的总体分布。(c)峰基因组区在组织中的分布。(d)基于平均峰密度的所有ATAC-seq数据之间的Pearson相关性。
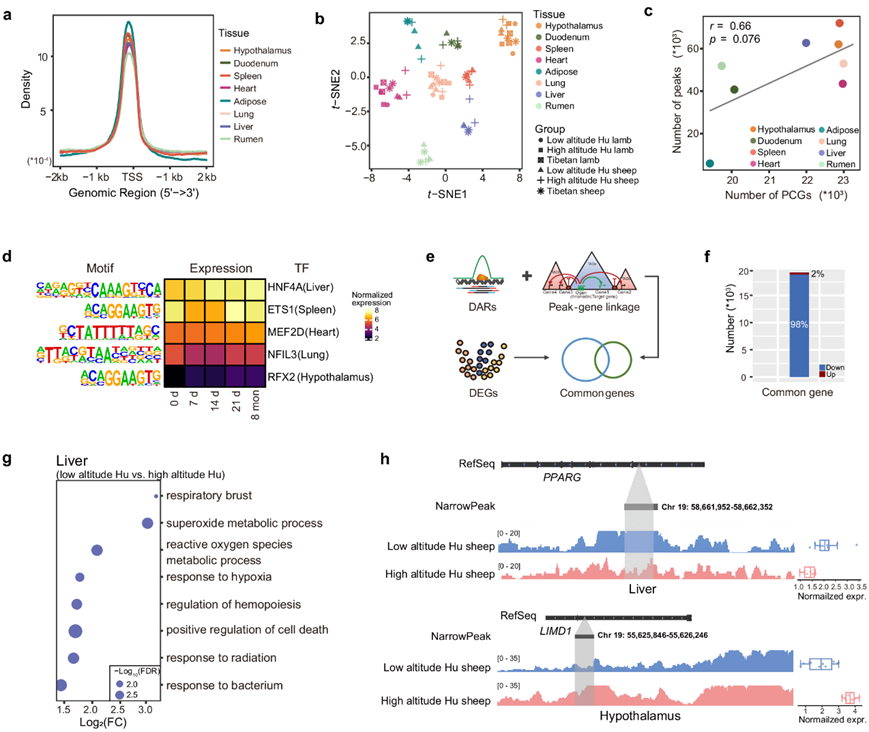
图5. 染色质可及性揭示了缺氧适应的调控格局。
(a)各组织在相对于转录起始位点(TSS)的位置处的平均峰密度。(b) 基于峰信号密度的66个样本的t -SNE聚类。(c) 各组织中表达基因数量与检测到的峰之间的Pearson相关性。(d) 各个组织的差异可及区域(DAR)中的组织特异性转录因子(TF)及其随时间的基因表达。(e) 常见基因的鉴定。(f) 上调和下调的峰基因对的数量。(g) 低海拔羊和高海拔羊肝脏的常见基因比较,在与缺氧反应相关的生物学过程中富集。(h) 常见上调和下调基因的示例。
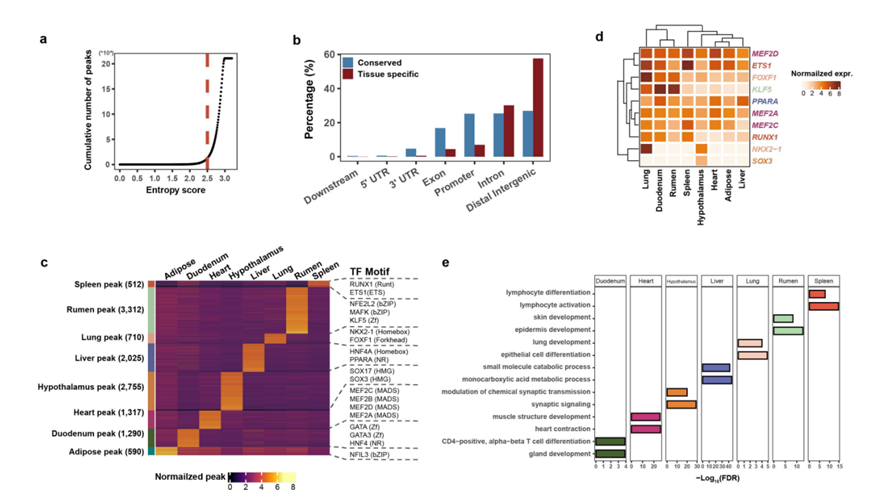
图S18. 组织特异性峰值和基序。
(a)基于Shannon熵评分的组织特异性峰的识别。(b)基因组区域中保守峰和组织特异性峰的分布。(c)热图显示了组织特异性峰的信号密度,以及每个组织的代表性转录因子(TF)基序。(d)热图显示TF靶基因在组织中的表达。(e)在整个组织中富集组织特异性峰连锁基因。
05
后代对高海拔的适应
为了探讨后代对高海拔环境的适应性,他们检测了三种绵羊类群(即低海拔湖羊、高海拔湖羊和藏羊)羔羊和母羊的SpO2、基因表达和染色质可及性。值得注意的是,高原湖羊的SpO2平均值与藏羊没有显著差异(图6a)。他们对三组羔羊的成对比较进行了差异表达分析,并重点关注高海拔湖羊与低海拔湖羊和藏羊与低海拔湖羊的比较中的DEG(图 6b)。与低海拔湖羊进行比较,他们发现在高海拔湖羊和藏羊中检测到的DEG在许多常见的通路中显著富集,例如肾脏中的细胞外基质组织、大脑中的膜内定位和动脉中细胞对血管紧张素的反应(图 6c)。其中一些通路(例如细胞外基质组织和膜内定位)由缺氧直接激活,这表明高海拔湖羊和藏羊可能具有相似的缺氧反应性生物过程。此外,他们注意到,仅在高海拔的湖羊羊羔与低海拔的湖羊羊羔的比较中发现了几种缺氧反应过程,包括对肺部缺氧的反应以及对动脉和肺部氧含量降低的反应(图 6d)。
他们进一步研究了重要功能基因CAT和UCP3在肺中响应缺氧的表达谱、NPPC在响应氧水平降低的表达谱以及动脉血液循环中的HBB表达谱。这些基因的表达模式与 SpO2改变的模式相似(图 6e)。总体而言,高海拔湖羊羊羔在出生时就表现出了成熟的适应性特征,上述三项指标与藏羊羊羔相似,但与低海拔湖羊羊羔存在明显差异。父系和母系的缺氧暴露可能是其子代在缺氧应激下氧调节能力提高的原因。
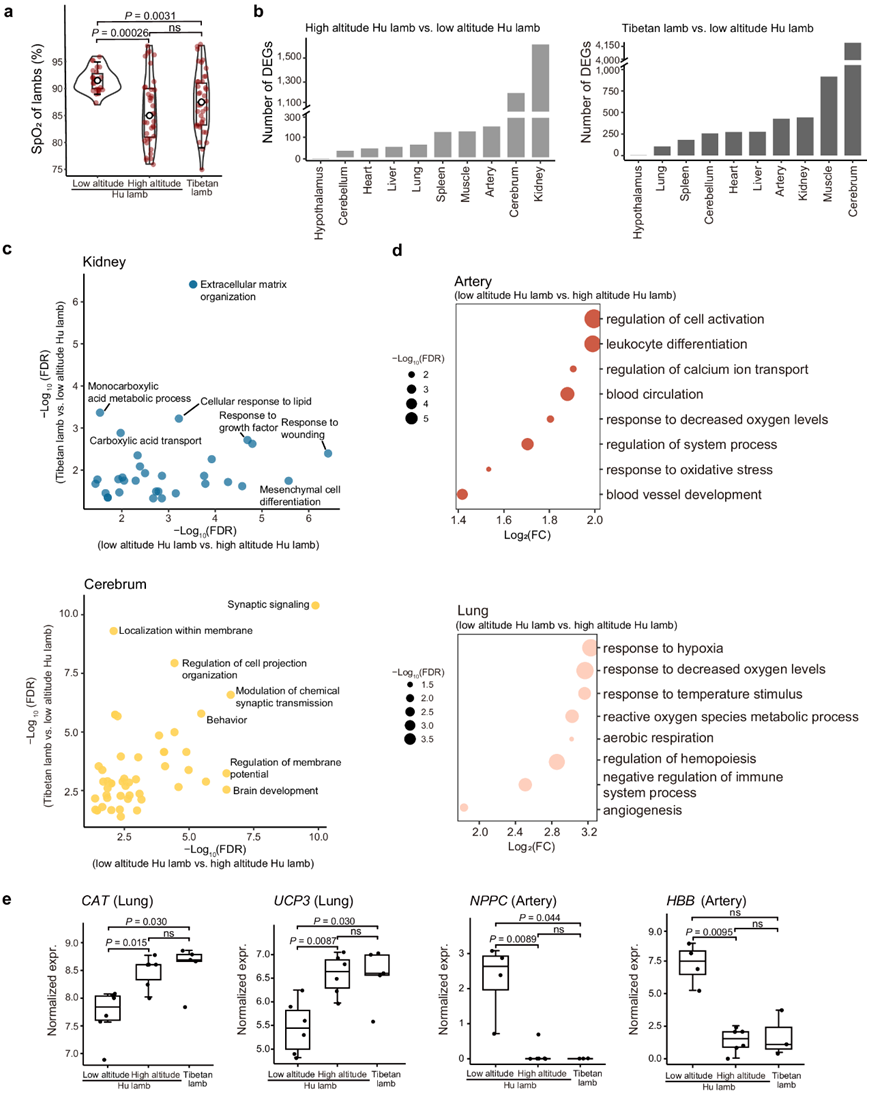
图6. 后代对高海拔的适应。
(a) 三组羔羊的SpO2变化。(b) DEG 数量分析。(c-d)GO分析。(e) 关键基因的表达水平分析。
06
人类高原适应性及疾病基因的表达
接下来,他们检测了羊和人类之间整体表达模式的相似性。从人类基因型-组织表达 (GTEx) 联盟 (v8) 检索了公开可用的 RNA-Seq 数据,并使用 14 种常见组织(即下丘脑、垂体、小脑、回肠、结肠、白细胞、脾脏、心脏、肌肉、动脉、脂肪、肺、肝脏和肾脏)中的 17279 个配对直系同源基因进行了比较分析。样本间基于t- SNE 的表达聚类清楚地概括了组织(图 7a)。在基于中位基因表达的组织层次聚类中也观察到了类似的结果(图 7b)。
他们分析了羊和人类之间适应性和疾病相关基因的表达相关性,发现大多数适应性基因和疾病相关基因显著相关。因此,他们利用绵羊时间序列转录组数据来研究这些基因在组织中随时间表达的变化。例如,BMPR2是一个众所周知的与肺动脉高压相关的基因,其表达水平在人和绵羊不同组织中 具有高度相关性(图7c)。BMPR2 在肺、动脉和心脏等重要组织中的表达变化随时间呈现出不同的模式。具体来说,肺中表达水平在第7 天时发生很大变化,动脉中在第21 天时发生很大变化,而在心脏中随时间逐渐升高(图7c)。此外,高海拔适应基因HIF1A的表达水平在人和羊之间表现出高度相关性(图7d)。该基因的表达在肺中随时间波动,但在心脏和小脑中随时间逐渐升高(图7d)。
他们检测了肺组织中所有细胞类型中HIF1A和BMPR2的表达,发现HIF1A在经典单核细胞(CM)和棒状细胞(CLU)中表达水平很高,而BMPR2在静脉内皮细胞(VEC)中表达水平很高(图 7e)。此外,他们发现HIF1A和BMPR2的时间序列表达模式与从肺中RNA分析获得的模式相似(图 7f)。细胞间通讯分析表明,细胞通讯事件随时间不断增加,其中增殖 T 细胞(PTC)、CM 和 CLU 保持高水平的通讯。此外,他们预测核心TF,例如 NFKB1、RELB 和 CEBPB,会调节HIF1A和BMPR2(图 7h)。值得注意的是, HIF1A的转录调控因子 NFKB1可由氧化自由基和紫外线照射激活,其功能与高海拔适应有关。BMPR2 相关的转录调控因子 RELB 的功能与NF-κB 通路相关,后者参与炎症、免疫和肿瘤发生等疾病相关过程。

图7. 与人类适应和疾病有关的基因的时间序列转录组。
(a) 人类和羊 14 种常见组织的转录本的保守性。(b) 基于 TPM 中值 Pearson 相关性对人类和羊常见组织进行层次聚类。(c-d) 人类肺动脉高压(即BMPR2)和高海拔适应(即HIF1A)的基因示例。(e) BMPR2和HIF1A在肺中不同细胞类型的表达。(f) 肺中棒状细胞(上)和经典单核细胞(下)中 HIF1A 的表达随时间的变化。(g)相邻时间点比较中BMPR2和HIF1A差异表达细胞类型的细胞间通讯结果。(h) 调节HIF1A和BMPR2 的TF。
+ + + + + + + + + + +
结 论
本项研究使用绵羊作为低海拔向高海拔易位的动物模型,表征了每种组织中所有基因的转录变化,并检查了多组织时间动态和基因之间的转录相互作用。特别是,确定了调节每种组织对缺氧的短暂反应的关键功能基因(例如小脑中的PARG和结肠中的HMOX1),还进一步确定了 TAD 约束的顺式调控元件,它们抑制了缺氧下大多数基因的转录活性。表型和转录证据表明,产前缺氧可以提高后代的缺氧耐受性。此外,本项研究还提供了与人类高山病(例如BMPR2)和高海拔适应(例如HIF1A)相关的候选基因的时间序列表达数据。
+ + + + +



 English
English


