文献解读|Cell Discov(33.5):scATAC-seq 和 scRNA-seq 综合分析绘制胸腺 iNKT 细胞发育图谱并确定 Cbfβ 的作用
✦ +
+
论文ID
原名:Integrative scATAC-seq and scRNA-seq analyses map thymic iNKT cell development and identify Cbfβ for its commitment
译名:scATAC-seq 和 scRNA-seq 综合分析绘制胸腺 iNKT 细胞发育图谱并确定 Cbfβ 的作用
期刊:Cell Discovery
影响因子:33.5
发表时间:2023.06.20
DOI号:10.1038/s41421-023-00547-x
背 景
恒定自然杀伤 T (iNKT) 细胞是先天性 T 细胞,具有 T 细胞和 NK 细胞的特征,可调节广泛的免疫反应和疾病。在小鼠胸腺皮质中,罕见的表达Vα14-Jα18 T细胞受体(TCR)链的CD4+CD8+双阳性(DP)胸腺细胞优先与多种TCR Vβ链(Vβ8链,Vβ7链或Vβ2链)配对,由DP胸腺细胞上的CD1d阳性选择b并高度表达CD24[CD24+,定义为阶段0 (ST0)]。这些新选择的iNKT细胞通过Ccr7的表达进入髓质。这些新选择的iNKT细胞通过Ccr7的表达进入髓质。在胸腺髓质中,它们急剧下调CD24 [CD24−CD44−NK1.1−,定义为阶段1 (ST1)],然后上调粘附分子CD44并获得记忆或激活表型[CD44hiNK1.1−,定义为阶段2 (ST2)]。ST2 iNKT细胞要么迁移到外周器官,要么保留成为长寿命驻留细胞,并在胸腺中获得NK1.1和其他NK谱系标记物 [CD44hiNK1.1+,定义为阶段3(ST3)]后成熟。
与传统的 αβT 细胞不同,恒定自然杀伤 T (iNKT) 细胞在胸腺中完成向功能性iNKT1/2/17 细胞的终末分化。然而,指导NKT 亚群分化的潜在分子程序仍不清楚。
实验设计
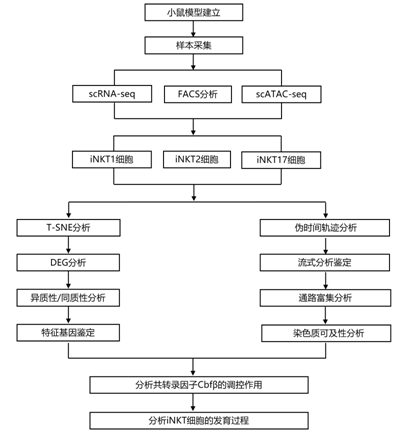
结 果
01
通过 scRNA-seq 和 scATAC-seq 对连续发育阶段的胸腺iNKT 细胞进行聚类
为了揭示iNKT 细胞的发育状况,研究者团队通过荧光激活细胞分选 (FACS) 收获连续发育阶段的胸腺iNKT 细胞,用于单细胞转录组分析(scRNA-seq) 和单细胞ATAC测序(scATAC-seq)(图1a-b)。他们使用rec-Vα14Tg小鼠对ST0 iNKT细胞以及使用C57BL/6小鼠对ST1 (CD24−CD44loNK1.1−)、ST2 (CD24−CD44hiNK1.1−)和ST3 (CD24−CD44hiNK1.1+) iNKT细胞进行scRNA-seq分析(图1a-c)。
在聚集的iNKT 细胞 (ST0-ST3) 中总共鉴定了 16 个聚类(C1–C16),每个聚类包含了 255-2817 个细胞(图1d-e),每个聚类中差异最大的表达基因(DEG) 显示在热图(图1f)和小提琴图(图1g)中。这些聚类中,四个聚类(C2、C4、C9 和 C14)来自 ST0,八个聚类来自 ST1(C3、C5、C6、C7、C10、C11、C15 和 C16),九个聚类来自 ST2(C1、C3、C5、C6、C7、C10、C11、C13 和 C15)和四个聚类来自 ST3(C1、C5、C8 和 C12)(图1d)。ST0 iNKT 细胞与其余iNKT 阶段明显分开,来自 ST1 和 ST2 iNKT 细胞的聚类适度重叠,而来自 ST3 的iNKT 聚类与来自 ST2 iNKT 细胞的聚类紧密相邻(图1d)。
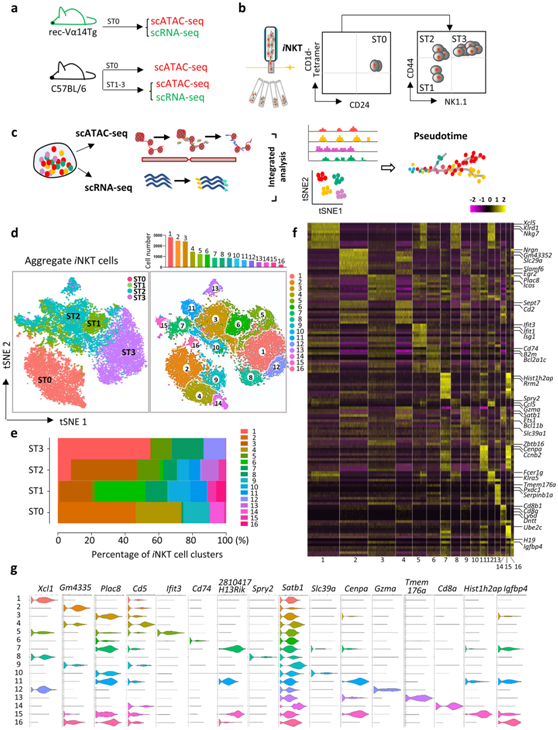
图1. 小鼠胸腺iNKT细胞的多样性。
(a) 收集iNKT细胞用于scATAC-seq和scRNA-seq分析。 (b) 分选策略。(c)实验设计概述。(d) scRNA-seq数据集的t-SNE图。(e) 在ST0-ST3中聚集的iNKT细胞中定义的16个聚类的分数。(f)排名前10的DEG热图。(g) 小提琴图分析聚类相关基因。
细胞分化伴随着受顺式调控元件控制的基因的表达,这些元件必须处于开放状态才能正常发挥作用。因此,他们对来自不同发育阶段的胸腺iNKT 细胞(如 scRNA-seq 分析中的细胞)进行了 scATAC-seq 分析,并使用 RSeurat 和 Signac 软件绘制了单个iNKT 细胞的染色质可及性图谱(图2a)。他们发现来自 ST1 和 ST2 的 C3、C6、C7、C10、C11、C15 和 C16 聚类分类为iNKT2 子集;主要来自 ST3 的 C1、C5、C8 和 C12 聚类分类为iNKT1(图2b),而 ST2 中唯一的iNKT C13 分类为iNKT17(图2b)。
总体而言,通过整合转录组和表观遗传图谱,他们绘制了具有 16 个聚类的胸腺iNKT 细胞的动态转录组和染色质图谱,并揭示了iNKT1 和iNKT2 细胞的异质性以及iNKT17 细胞的相对同质性。
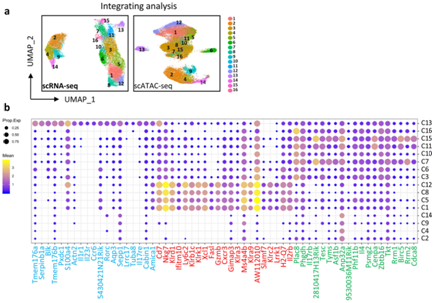
图2. 不同的聚类分配到功能子集中。
(a) UMAP图显示了对分选的 ST0–3 iNKT 细胞的 scRNA-seq 和 scATAC-seq 的综合分析。(b) 气泡图显示聚集的iNKT 细胞的各个聚类(C1–C16) 中的基因表达。
02
ST0的两条发展轨迹
胸腺中的iNKT 细胞发育依赖于位于胸腺皮质的约 1000 个 ST0 iNKT 前体 (iNKTp) 库。他们在 ST0 中鉴定了四个聚类(C2、C4、C9 和 C14)(图 1d和图3a),并突出显示了每个聚类的特定特征(图3b)。
根据CD4和CD8的表达,这些ST0聚类可分为三组:C14是CD4+CD8+ (DP) iNKTp;C9是CD4+CD8−(CD4SP) iNKTp,富含T淋巴细胞存活调节因子,包括Id2和Il7r;C2和C4是CD4−CD8−(DN) iNKTp,其中C4高表达Cd5和Cd6,而C2 iNKTp则高表达Egr2和Slamf6,它们分别通过调节PLZF表达和TCR信号强度影响iNKT细胞发育(图3b-d)。还在ST0中发现了一个小的DP iNKTpj聚类 (C14)(图3c-e)。
为了探索选择后的发育程序,他们进行了伪时间轨迹分析,鉴定了两个潜在的发育分支:C14-C2-C4分支(称为DP-DN)和C14-C9分支(DP-CD4SP)(图3f)。两个分支最终在发育末端相遇,趋化因子受体Ccr7的表达增加(图3g),这是ST0 iNKTp从胸腺皮质迁移到髓质所必需的。DP iNKTp下调CD4和CD8的表达,启动胸腺皮质的DP- cd4sp或DP- dn发育过程,最终迁移到胸腺髓质。
接下来,他们评估了ST0 iNKTp中Zbtb16 (编码 PLZF)的表达模式和染色质可及性,发现Zbtb16的+40kb和TSS在DP iNKTp (C14)中不可及,但在CD4SP (C9)和DN (C2和C4) iNKTp中可及,C2比C4开放程度高得多,与Zbtb16的表达模式非常相似(图3i-j)。伪时间轨迹和流式细胞术进一步表明Zbtb16在DN和CD4SP iNKTp中均富集(图3j-k)。
RORγt 是调节iNKT17 分化的关键转录因子,但也在 DP 胸腺细胞中高表达并促进iNKT 细胞选择。与Zbtb16不同的是,+ 4kb区域的Rorc(编码RORγt)在DP (C14)和DN (C2和C4) iNKTp中均可及,但在CD4SP (C9)中不可及,而+ 13kb区域的Rorc仅在DP iNKTp (C14)中可及。在每个聚类中,Rorc的表达模式与其染色质可及性状态一致(图3l)。Rorc在DP iNKTp中显著高表达,在DN分支(C4和C2)中逐渐下调,而在CD4SP (C4)中几乎没有检测到(图3m-n)。
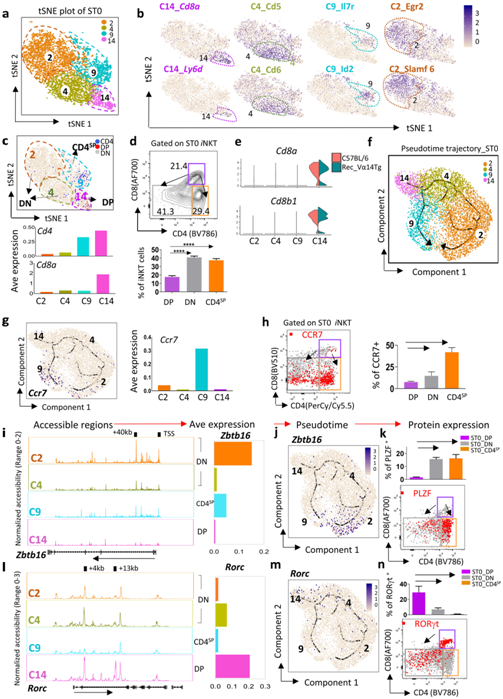
图3. ST0时iNKT细胞的细胞多样性。
(a)来自排序的 ST0 iNKT前体 (iNKTp)的 scRNA-seq 数据集的 t-SNE图。(b) 描述 ST0 iNKTp中每个聚类中特定基因表达的特征图。(c) 描绘Cd4、Cd8a的单细胞基因表达及其共表达的特征图(上)。条形图代表聚类中Cd4和Cd8a的平均 (Ave) 表达(底部)。(d) CD4 与 CD8 表达的代表性流程图。(e) 来自C57BL/6 小鼠(红色)和rec-Vα14Tg 小鼠(绿色)的每个聚类衍生的ST0 iNKT 细胞中Cd8表达的小提琴图。 (f) ST0 iNKTp 在 Monocle 3 定义的状态空间中沿着伪时间的排序。(g) 特征图描绘了ST0 iNKTp 发育中Ccr7的单细胞基因表达轨迹(左)。条形图代表Ccr7的 Ave 表达(右)。(h) ST0 iNKTp中 Ccr7 表达的代表性流程图(左)。条形图显示平均 CCR7+ iNKT ± SD(右)。(i) 在ST0 iNKTp聚类中聚合Zbtb16 和Rorc的scATAC-seq轨迹。(j-m) ST0 iNKTp发育过程中Zbtb16和Rorc单细胞基因表达的特征图。(k-n) ST0 iNKTp中PLZF和RORγt表达模式的代表性流程图。
03
iNKT细胞发育轨迹
为了了解ST0 后iNKT 聚类的发育,他们将胸腺iNKT 细胞(ST0-ST3)映射到伪时间轨迹上(图4a)。iNKT2细胞显示出广泛的多样性,包括C3、C6、C7、C10、C11、C15和C16聚类(图2b和图4a-b)。他们评估了整合的iNKT 细胞聚类 (C1–C16)中的Zbtb16染色质可及性。在Zbtb16基因座的 181 kb 中,从iNKT2、iNKT1 和iNKT17 中发现了高度可及的区域,但在 ST0 聚类(C2、C4、C9 和 C14)中发现了可及性较弱的区域。Zbtb16表达与其染色质可及性密切匹配(图4c)。iNKT2 聚类以及 ST0 中的 C2 和 C9 显示出GATA3的高活性基序结合活性,这对于iNKT2 分化至关重要(图4d)。正如预期的那样,iNKT2 细胞的大多数特征基因逐渐增加,直至在中间阶段达到峰值,然后在终末分化期间下调。然而,一些基因,包括Btg1、Cebpb和Osgin1,仅出现在iNKT 发育末端附近,这可能与iNKT2 细胞终末事件有关(图4e)。细胞周期通路富集分析表明iNKT2聚类(C7、C11和C15)表现出高度增殖特征,处于S期(C7)或G2/M期(C11和C15)(图4f)。
创新路径分析(IPA) 表明 C3、C6、C10 和 C16 在功能上不同。C16 是iNKT 细胞从 ST0 到 ST1的过渡阶段,这些细胞与糖酵解和氧化磷酸化相关的基因表达急剧升高(图4g),表明它们的能量需求增加。C6终止于ST1,这些细胞富含TCR信号、共刺激信号、细胞骨架、TNFR以及细胞死亡和耗竭通路中的基因(图4g)。
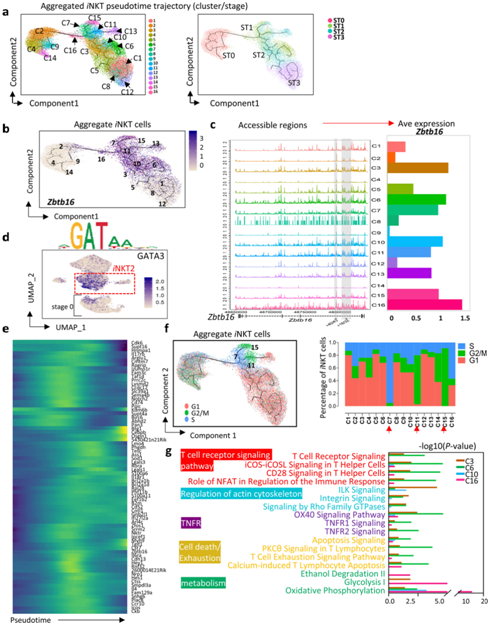
图4. iNKT2细胞的细胞多样性。
(a) 在 Monocle 3 定义的状态空间中,iNKT 细胞沿伪时间排序。 (b) 特征图描绘了Zbtb16在iNKT细胞发育中的单细胞基因表达轨迹。(c) 聚合 scATAC-seq 浏览器跟踪iNKT细胞聚类的Zbtb16(左)。条形图代表iNKT 细胞聚类中的Zbtb16平均 (Ave) 表达(右)。(d) 由GATA-3结合基序的活性着色的UMAP投影。 (e) 热图显示了从 scRNA-seq 数据的iNKT2 聚类C3、C6、C10 和 C16中选择的大多数 DEG 的伪时间排序。(f) 特征图描绘了聚集iNKT细胞发育过程中G1、G2/M和S期的单细胞基因表达轨迹(左)。柱状图表示G1、G2/M和S细胞在iNKT细胞聚类中的比例(右)。 (g) 聚类 C3、C6、C10 和 C16 中的 DEG。
04
iNKT1 细胞的异质性
iNKT1细胞分化由转录因子Tbx21控制并分配至四个聚类(C1、C5、C8和C12)(图2b和图5a)。在Tbx21位点的 17.2 kb 内,启动子区域 –3 kb 和 –4 kb 在 C1、C5 和 C12 中可及,但在 C8 中不可及(图 5b)。重要的是,tbx21结合基序活性也出现在这些聚类中,但不在ST0聚类中(图5c)。流式细胞仪分析进一步证实了一小部分 PLZF hi iNKT2细胞在ST1和ST2中表达T-bet(由Tbx21编码),通过Ki-67检测其具有相当大的增殖能力(图5d)。因此,iNKT1 祖细胞可能隐藏在这些所谓的增殖性 PLZF hi T-bet hi iNKT2 细胞中。
他们发现一个新的特征,即信号淋巴细胞激活分子家族成员7(Slamf7)在iNKT1细胞聚类中富集(图5e)。基于PLZFloT-bethi iNKT1细胞中SLAM7与NK1.1表达的强相关性,流式细胞分析进一步证实了这一点(图5f)。NK细胞相关特征Slamf4进一步将末端C12与其他iNKT1细胞聚类区分开来。SLAMF4+ iNKT细胞(C12)以DN为主,并逐渐从PLZFloT-bethi iNKT1细胞中发育(图5g-i)。SLAMF4 + iNKT1 细胞主要分泌 IFN-γ 和较少的 IL-4,如“经典iNKT1 细胞”,而大多数 SLAMF4- iNKT1 细胞在刺激后既分泌 IL-4 又分泌 IFN-γ(图5j)。C5细胞富含Ifit1和Ifit3,它们参与干扰素信号通路(图5k)。总体而言,iNKT1细胞从目前定义的“ iNKT2细胞”的ST1开始发育,并逐渐完成分化并转变为SLAMF4+ i NKT1 细胞位于末端,与经典的 IFN-γ 分泌iNKT1 细胞一样。

图5. iNKT1细胞具有广泛的细胞异质性。
(a) 特征图描绘了iNKT 细胞发育中Tbx21的单细胞基因表达轨迹。 (b) 对于iNKT细胞聚类,Tbx21的scATAC-seq聚合(左)。条形图表示iNKT细胞聚类中Tbx21平均值(Ave)的表达(右)。 (c) 对于iNKT细胞聚类,Tbx21的scATAC-seq聚合(左)。条形图表示iNKT细胞聚类中Tbx21平均值(Ave)的表达(右)。(d) iNKT的门控代表性流程图。(e) iNKT细胞发育过程中Slamf7单细胞基因表达轨迹。(f) iNKT细胞中SLAMF7与NK1.1表达的代表性流图。(g) 条形图表示Slamf4 Ave在iNKT细胞聚类中的表达。(h) SLAMF4在iNKT2 (PLZFhiT-bet−)和不同iNKT1 (T-bethi)细胞中的代表性表达流图。(i) 点图表示平均SLAMF4±SD。(j) SLAMF4−(左)和 SLAMF4+(右)iNKT1 细胞在 PMA/Ionomycin刺激 4 小时后IL-4 与 IFN-γ 产生的代表性流程图。(k) 聚类C1, C5, C8和C12中的DEG。
05
iNKT17 细胞表现出有限的异质性
他们将C13分类为iNKT17细胞,并与其他聚类明显分离(图2b和图6a)。他们观察到Rorc的+4 kb和+14 kb区域在ST0聚类(C2、C4和C14)和成熟的iNKT17聚类(C13)中可及(图6b),并且RORC的结合基序在iNKT17和ST0 iNKTp中发生激活(图6c)。在 mRNA 水平上,RorcST0 中的 C14 中高表达,这与Rorc处的染色质可及性一致,但在 C4 和 C2 中逐渐下调,并在 C13 中重新上调,表明其他转录因子可能靶向开放Rocr位点并操纵iNKT17 分化过程中Rorc 的表达。
为了追踪iNKT17细胞的发育轨迹,他们进一步检测了有序iNKT细胞轨迹中的iNKT17特征基因,发现包括Rorc在内的少数iNKT17特征最初在早期iNKTp中表达,然后才转化成成熟的iNKT17。然而,大多数iNKT17 相关特征在iNKTp中几乎没有表达(图6d)。他们进一步发现,一种新的标志性水通道蛋白3 (Aqp3) 在胸腺i NKT17 (PLZF int RORγt +) 细胞中特异性表达(图 6e-f)。总体而言,iNKT 细胞可能在 ST0启动iNKT17 定型,并且这些iNKT17 细胞表现出有限的异质性。

图6. iNKT17细胞表现出有限的异质性。
(a) iNKT 细胞发育中Rorc的单细胞基因表达轨迹的特征图。(b) iNKT细胞聚类的scATAC-seq(左)。柱状图表示iNKT细胞聚类中Rorc平均值(Ave)的表达(右)。(c) 由RORC-结合基序的活性着色的UMAP投影。(d) 显示scRNA-seq数据聚类13中前30个基因的伪时间排序的热图。(e) 表征iNKT细胞发育过程中Aqp3单细胞基因表达轨迹的特征图。(f) Aqp3表达的代表性流程图。
06
Cbfβ调节NKT细胞早期定型
Egr2和Slamf6通过调节ST0 中的Zbtb16表达和 TCR 来控制早期iNKT 细胞发育。他们鉴定了一种新的共转录因子Cbfβ ,它与Egr2和Slamf6表现出相似的表达模式,并且在iNKT 细胞的 ST0 表现出较高程度的富集,特别是在 DP-DN 分支 C2 中(图7a-b)。
Cbfβ的缺失导致胸腺iNKT细胞的频率和绝对数量严重减少(图7c)。Cbfβ 敲除(KO)小鼠中ST0和ST1 iNKT细胞的频率显著增加,但Cbfβ KO和WT对照之间的绝对数量相当(图7d)。有趣的是,DP iNKTp 在 ST0 中增加Cbfβ KO小鼠中的iNKT细胞(图7e),表明Cbfβ的敲除部分阻断了DP iNKTp向CD4 SP或DN谱系的转化。
ST1 iNKT 细胞经历快速增殖,并包含具有高Zbtb16编码 PLZF 表达的iNKT 子集的祖细胞。他们观察到在Cbfβ KO iNKT细胞中ST1处的PLZF表达显著下调(图7f)。在增殖标记物Ki-67上也观察到类似的现象(图7g)。这些数据表明,Cbfβ缺陷的iNKT 细胞进入相对静止状态,并且无法在 ST1 正常上调 PLZF 表达。
此外,ST1 中其余的 PLZF+ iNKT 细胞无法共表达 T-bet 来启动iNKT1 分化,也无法共表达 RORγt 以启动NKT17分化(图7h-i)。这些结果表明Cbfβ是控制早期iNKT细胞在ST0发育,ST1/2 iNKT细胞分化和ST3最终成熟的关键调节因子(图7j)。
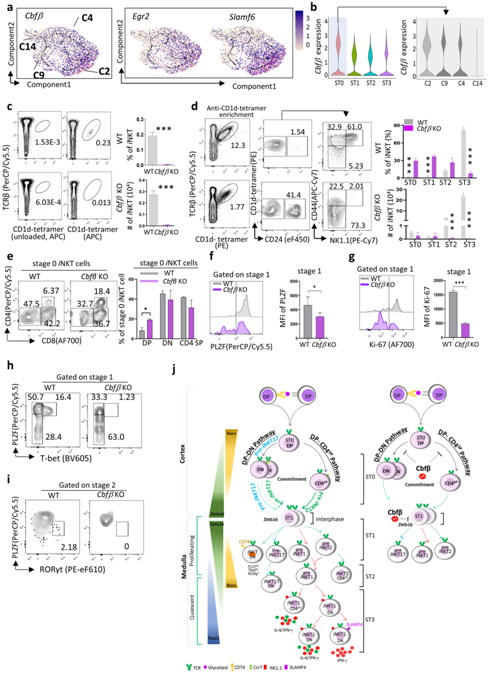
图7. Cbfβ调控iNKT细胞早期定型。
(a) 特征图描绘了ST0 i NKT 细胞发育过程中Cbfβ、Egr2和Slamf6的单细胞基因表达轨迹。 (b) iNKT 细胞不同阶段的Cbfβ表达以及ST0 i NKT 细胞不同聚类(C2、C9、C4 和 C14)中Cbfβ表达的小提琴图。(c) 来自Cbfβ KO 和 WT 小鼠的iNKT 细胞的代表性流动图(左)。(d) Cbfβ KO 和 WT 小鼠i NKT(富集抗 CD1d 四聚体后)不同阶段的代表性流程图(左)。条形图代表Cbfβ KO 和 WT 对照中iNKT 细胞频率和iNKT 细胞数量的平均值±SD(右)。 (e) 来自Cbfβ KO 和 WT 对照的 ST0 iNKT 细胞中 CD8 和 CD4 表达的代表性流程图(左)。条形图代表 DP、DN 和 CD4 SP ± SD 的平均值 ± SD(右)。 (f-g) 直方图显示Cbfβ KO和WT小鼠ST1 iNKT细胞中PLZF表达和Ki-67表达。 (h) Cbfβ KO和WT小鼠ST1 iNKT细胞PLZF与T-bet表达的代表性流动图。 (i) Cbfβ KO和WT小鼠ST2 iNKT细胞PLZF与RORγt表达的代表性流动图。(j) 小鼠iNKT细胞发育轨迹示意图模型(左)和Cbfβ在iNKT细胞发育中的作用(右)。
+ + + + + + + + + + +
结 论
本项研究使用scRNA-seq和scATAC-seq,来定义iNKT的发育轨迹。本项研究发现了iNKT前体和不同iNKT聚类的新特征,并表明iNKT2和iNKT17谱系定型可能早在ST0就通过两个不同的程序发生,而iNKT1定型可能在ST0之后发生。iNKT1 和iNKT2 细胞均表现出广泛的表型和功能异质性,而iNKT17 细胞相对同质。此外,本研究发现一种新的转录因子Cbfβ在iNKT 祖细胞定型检查点中高表达,其与iNKT 细胞发育的其他已知转录因子表现出相似的表达轨迹,Zbtb16和Egr2可以指导NKT细胞的命运并驱动其效应表型分化。敲除Cbfβ会阻碍早期iNKT 细胞发育,并导致iNKT1/2/17 细胞分化严重受损。总体而言,本项研究结果揭示了不同的iNKT 发育程序及其细胞异质性,并确定了一种新型转录因子Cbfβ作为早期iNKT 细胞定型的关键调节因子。
+ + + + +



 English
English


