文献解读|Cell Rep Med(14.3):罕见肾肿瘤的综合蛋白质基因组学特征
✦ +
+
论文ID
原名:Comprehensive proteogenomic characterization of rare kidney tumors
译名:罕见肾肿瘤的综合蛋白质基因组学特征
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.04.26
DOI号:10.1016/j.xcrm.2024.101547
背 景
世界卫生组织 (WHO) 2022 列出了 20 种不同的肾细胞癌 (RCC) 亚型,其中 7 种是由特定分子畸变定义的。非透明细胞肾细胞癌 (ccRCC) 约占 RCC 的 20%,涵盖多种罕见亚型,这些亚型主要由组织病理学特征定义。非 ccRCC 肿瘤的免疫浸润和肿瘤血管分布差异很大,因此需要进一步评估反应性标志物。
实验设计
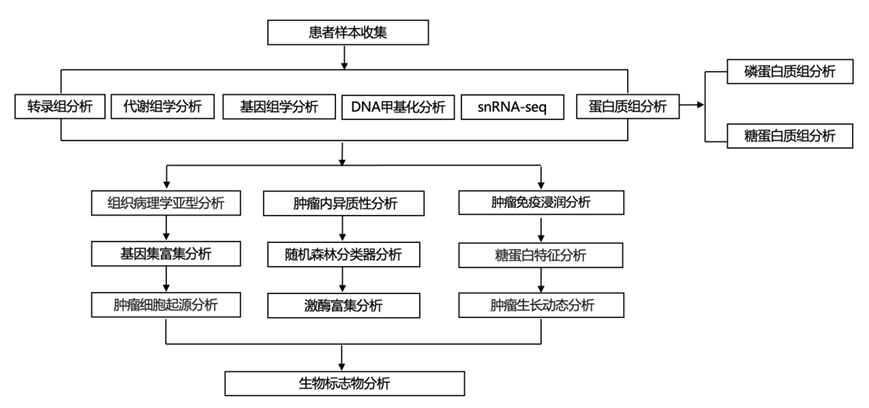
结 果
01
样本和多组学数据类型
研究者团队对 48 个非 ccRCC 肿瘤和 103 个 ccRCC 肿瘤以及 101 个正常邻近组织 (NAT)进行了多组学数据分析。组织病理学亚型信息和特征分子畸变(例如拷贝数变异模式、体细胞/种系突变、标记基因表达和基因融合)可共同评估以得出肿瘤分子注释(图1A)。根据WHO 2018肾肿瘤组织学分类,该分析队列包括103例ccRCC, 15例肾癌细胞瘤(RO)、13例乳头状 RCC (pRCC)、3例嫌色性 RCC (chRCC)、2例血管平滑肌脂肪瘤(AML)、2例嗜酸性实体和囊性RCC (ESCRCC)、1例Birt-Hogg-Dube综合征相关肾细胞癌、1例肾脏混合上皮和间质瘤、1例MTOR突变RCC、1例易位性RCC (TRCC)、8例基因组学畸变模式与组织学分类不一致的肿瘤注释为分子分化(MDTH)(图1A)。
不同亚型的非ccRCC肿瘤表现出与ccRCC不同的复发性基因组畸变(图1A)。值得注意的非ccrcc亚型特异性事件包括:chRCC的标志性染色体缺失和TP53突变,pRCC的chr7/17增益和MET突变,ESCRCC和AML肿瘤的TSC基因突变,TRCC病例的TFE3基因融合。与之前的RO分子亚型分类一致,18例RO 1型富集了CCND1基因重排,具有二倍体基因组,2型以1号染色体1拷贝丢失(chr1)为标志,没有表现出这些分子特征的RO病例归类为“RO变体”亚群。基因集富集分析(GSEA)揭示了RCC亚型之间一些通路相似性和差异性(图1B)。在 pRCC 和 ccRCC 中,同种异体移植排斥、炎症反应、干扰素 α/γ 通路显著上调,尤其是在蛋白质水平上。相反,糖酵解、缺氧和上皮间质转化(EMT)在 ccRCC 蛋白质组中显著富集,但在 pRCC 和 RO 中呈现负富集趋势。有趣的是,氧化磷酸化在 RO 中表现出显著的正富集,但在 pRCC 和 ccRCC 中如预期下降(图1A-B)。
接下来,通过免疫反卷积和聚类分析评估肿瘤免疫浸润的状态。他们鉴定出三个非 ccRCC 聚类:一个髓样淋巴-high非 ccRCC 聚类,一个包含大多数 pRCC 样本的髓样-high聚类,以及一个包含所有嗜酸细胞肿瘤的免疫缺失聚类(图 1 A)。总体而言,非ccRCC的免疫浸润程度低于ccRCC(图1C)。在CPTAC中的非ccRCC(~ 37%)、ccRCC(~ 23%)以及TCGA队列中的非ccRCC和ccRCC中观察到含有高加权基因组不稳定性(wGII)的病例(图1D-F)。
使用自动相关性测定非负矩阵分解(ARD-NMF)对RNA、蛋白质和磷酸化位点水平表达数据进行综合分析,定义了6个多组学聚类。其中,pRCC肿瘤多聚集在ARD-NMF-0,嗜瘤性肿瘤(RO、chRCC)在ARD-NMF-3、ccRCC样本中分布在ARD-NMF-1和-5,而NATs则集中在ARD-NMF-2和ARD-NMF-4(图1A)。较小的ARD-NMF-1与DNA超甲基化、高级别ccRCC、较差预后相关,而较小的ARD-NMF-5 ccRCC聚类在低级别ccRCC肿瘤中富集。接下来,由于DNA超甲基化亚群与较差的生存率相关,他们对DNA甲基化数据进行了共识聚类,并确定了五种不同的甲基化聚类。甲基3和甲基5主要是亚型特异性的,分别存在于ccRCC和所有嗜癌细胞肿瘤中。有趣的是,甲基1在具有高wGII、BAP1突变体的ccRCC样本和具有高wGII和高倍性的非ccRCC样本(主要来自MDTH类别)中富集(图1E)。接下来,他们比较了高wgii和低wgii非ccrcc样本(包括prcc、TRCC、ESCRCC、MTOR突变和MDTH)之间的mRNA和蛋白质差异表达(DE)(图1G)。RNA结合蛋白和n6 -甲基腺苷读取器IGF2BP3在非ccrcc高wgii样本中mRNA表达显著升高(图1G),免疫组化(IHC)证实了蛋白表达的上调趋势。重要的是,在 CPTAC 和 TCGA 数据集中的高 wGII 样本中发现了高 IGF2BP3 RNA 表达(图 1 H),IGF2BP3 与多种癌症类型的较差生存率相关。
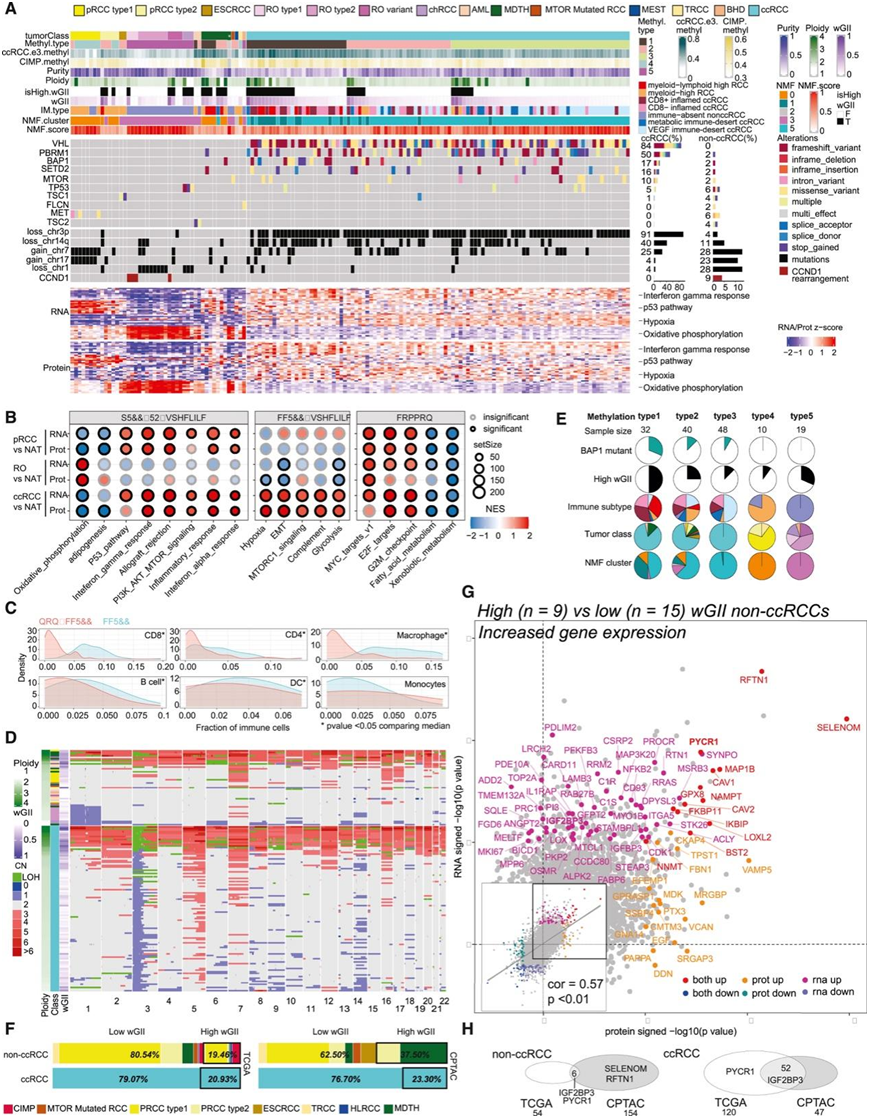
图1. 肾细胞癌中基于拷贝数的基因组不稳定性的蛋白质组生物标志物。
(A) ccRCC 和非 ccRCC 的蛋白质组畸变景观。(B) 不同 RCC 亚型之间差异富集的途径(RNA 和蛋白质)。(C) ccRCC 和非 ccRCC 的预测免疫成分。(D) 根据非 ccRCC(上)和 ccRCC(下)的 CNVEX 输出推导出的绝对拷贝数变异 (CNV) 热图。(E) BAP1 突变、wGII、免疫亚型、肿瘤类别和 NMF 聚类在五个甲基化亚组中的分布。(G) 在非 ccRCC 样本子集中高至低 wGII 比较下蛋白质(x 轴)和 mRNA(y 轴)之间的显著性水平的比较。(H) 非 ccRCC(左)和 ccRCC(右)中 TCGA 和 CPTAC 高 wGII mRNA 表达基因标记物之间的重叠。
02
非 ccRCC snRNA-seq 揭示肿瘤内转录组异质性和低免疫浸润
为了研究非 ccRCC 中的细胞水平关联,他们进行了单细胞核转录组分析(snRNA-seq)。UMAP可视化显示显示出不同的免疫细胞、内皮细胞和基质细胞团聚类,而与患者来源无关(图2A),而肿瘤上皮细胞形成了患者特异性的团聚类。他们使用来自各种RCC亚型和公开可用的良性人类肾脏样本的snRNA-seq数据集进行了分析(图2C)。TRCC、ESCRCC和pRCC显示出近端小管2(PT2)群体的最高起源概率,这是一种罕见的细胞类型,与之前证明含有干细胞样标记基因表达的PT-B群体相当,而之前证明PT-B群体包含干细胞样标记基因表达(图2D)。相反,RO和chRCC始终显示出最高的概率为插入型- a (IC-A)群体,提示远端肾单位起源(图2D)。在AML肿瘤区室中,他们注意到肿瘤亚群与间质vSMC细胞和内皮细胞之间的相似性,这与预期一致(图2C)。
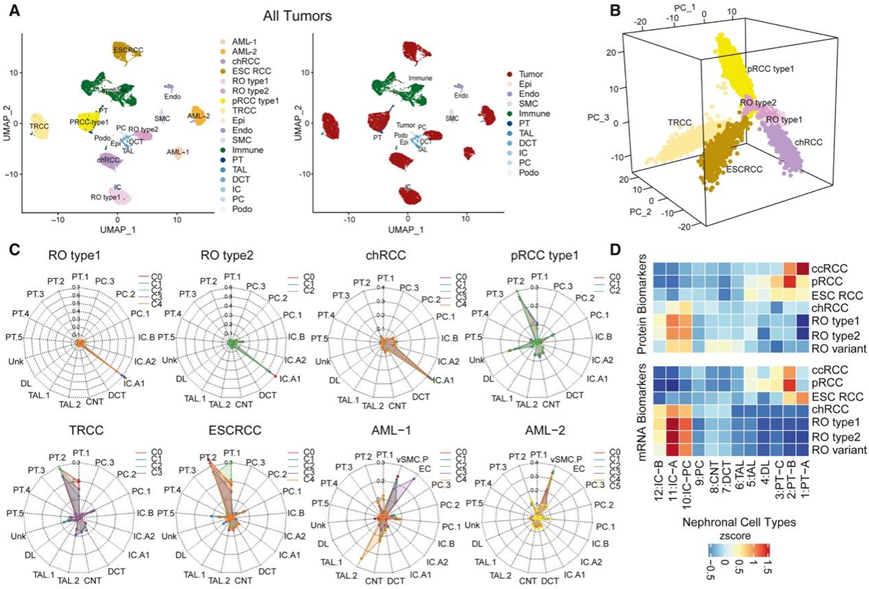
图2. snRNA-seq的肿瘤转录组异质性、免疫浸润状态和肿瘤细胞起源。
(A) 来自八个非 ccRCC 肿瘤的 snRNA-seq 数据的 UMAP。(B) 六个肿瘤(不包括 AML)的前三个主要成分按肿瘤类型着色。(C) 通过随机森林分类器预测 RCC 亚型的不同肿瘤亚聚类的细胞起源概率。(D) 每个 RCC 亚型的 DE 蛋白(上)和 mRNA(下)标记物的平均丰度与从正常肾脏 scRNA-seq 数据识别的上皮细胞类型中的 NAT 相比。
03
RCC 亚型和胃肠道肿瘤的磷酸化蛋白质组学特征
磷酸化蛋白质组学可以揭示肿瘤中潜在的可靶向激酶信号通路。首先,正如预期的那样,他们观察到 ccRCC 中血管内皮生长因子受体 FLT1 的富集,受体酪氨酸激酶 MET 和 KIT (CD117) 分别存在于 pRCC 和 chRCC/RO 中,丝氨酸苏氨酸激酶 MYLK 存在于 AML 中(图3A)。此外,他们发现CDK18、NEK6和PNCK在ccRCC中表达较高,BAZ1B和TNIK在pRCC 1型中表达较高。LATS1、PRKCD、PRKAG2和STK39是RO和chRCC的共同基因,DAPK2、MAPK13、MAP3K1、SYK、DDR1、EIF2AK4、PAK4和PTK2B是chRCC的特异性基因。
为了评估亚型富集激酶的磷酸化变化,他们比较了磷酸化数据,并强调了RCC亚型中选定的磷酸化变化。例如,δ型蛋白激酶C (PRKCD)的S645和T507的磷酸化在RO和chRCC中显著高于pRCC和ccRCC。PRKCD磷酸化是启动蛋白激酶成熟所必需的,与瘦素刺激的PLC-PKC信号通路相关,在RO肿瘤中显著富集(图3C)。瘦素通过JAK-STAT轴调控PI3K-AKT通路。
他们还探索了与GI相关的磷酸化变化,比较了高wGII和低wGII非ccRCC样本中的激酶-底物共调节。值得注意的是,周期蛋白依赖性激酶(CDK1、CDK2)在wGII高的样本中富集程度最高(图3D)。CDK1和CD2是细胞周期和DNA合成多个步骤的关键调节因子,因此与基因组稳定性密切相关。显著上调的CDK1底物包括E2F靶点,如RRM2、MCM4、DUT、RFC1、PAICS、NASP和HMGA1,它们调节DNA复制和染色体稳定性(图3E)。在应对复制应激和DNA损伤时,CDK2和CDK4/6促进E2F活性以及细胞凋亡的RB1 T356磷酸化,CDK2也可以在Y15位点由LYN激酶磷酸化。用CLUMPS-PTM分析来识别蛋白质三维结构中的磷酸化聚类,发现CDK2中的三个磷酸化位点(T14、Y15和T160)形成了一个磷酸化热点(图3F)。Y15和T160的磷酸化对CDK2功能有相反的影响,Y15是抑制性的,而T160是激活性的,这两种事件先前在卵巢高级别浆液性癌中同时存在。
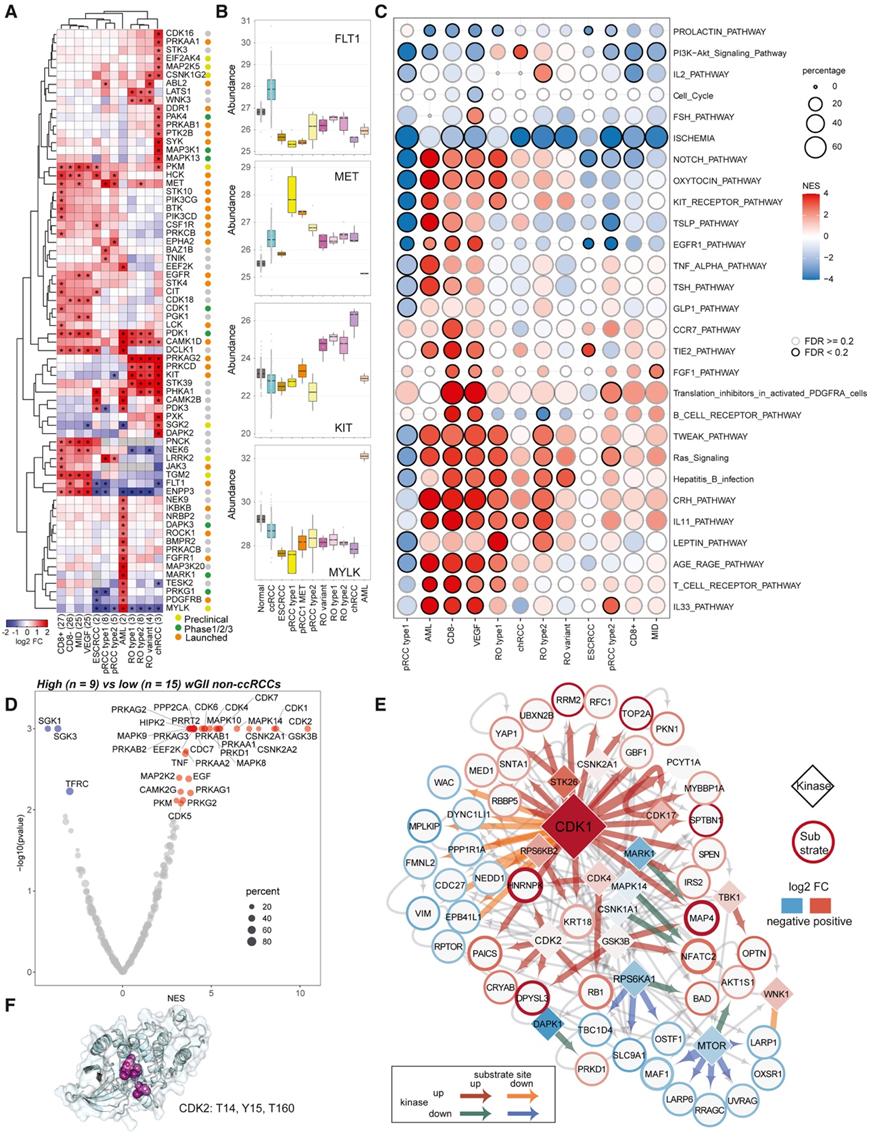
图3. 非ccRCC和基因组不稳定肿瘤中的磷酸化蛋白质组变化。
(A) 主要亚型的 DE 激酶。(B) 亚型特异性上调激酶。(C) 不同亚型的差异调节磷酸化位点之间富集的途径。(C) 不同亚型的差异调节磷酸化位点之间富集的途径。(E) 高 wGII 肿瘤中显著共同调节的激酶-底物对。(F) CDK2 的蛋白质 3D 结构。
04
RCC糖蛋白组反映肿瘤免疫浸润和血管生成
蛋白质糖基化与癌症的发生、发展以及肿瘤微环境(TME)相关。为了探索肾癌的糖生物学及其对TME的影响,他们分析了该队列中独立生成的两个不同的糖蛋白组学数据集。他们的N-连糖蛋白质组学分析分别鉴定了12503个完整的糖肽(IGP)和来自富含糖的样品中1035个糖蛋白的聚糖(糖型),以及来自富含磷的样品中1591个糖蛋白的29850个糖型,其中521个糖蛋白重叠(图4A)。根据糖单糖的组成,IGP可分为5类:寡甘露糖、唾液酸、岩藻糖、岩藻-唾液酸和中性部分。在糖富集的样品中,IGP主要附着在寡甘露糖聚糖上,其次是唾液酸化聚糖,而在磷富集的样品中,IGP大部分发生唾液酸化(图4B)。在糖富集数据集中,在RO和pRCC中,与正常DE事件相比,与寡甘露糖聚糖结合的糖肽占了大量的肿瘤DE事件(图4C)。RO样本只显示了间质细胞上调标记的较高比例,他们认为这种细胞是RO的起源细胞,这些观察结果也与基因集富集分析(GSEA)一致(图4E)。由于关键靶点的差异糖基化与免疫和内皮细胞功能改变相关,因此他们研究了TME细胞类型中的特定糖蛋白标志物(图4F)。具体来说,RO显示了已知标记物PLCG2的IGP,以及来自上皮/肿瘤的ADGRF5,来自内皮的VWF、POSTN和STAT5,以及来自免疫区室的CTSD的上调。另一方面,在pRCC中,TFPI2、FSTL1、FAS和PIGR在上皮/肿瘤中表达上调,C1QTNF3和GRN在内皮中表达上调,ITGAX、HLA-DQA1、IL4I1和CTSC在免疫区室中表达上调。他们还观察到不针对任何细胞类型的差异糖基化,例如在ccRCC和pRCC中涉及癌症干细胞标志物CD44(图4F)。所选标记物在不同细胞类型中的蛋白表达由人类蛋白图谱的免疫组化数据所证实(图4G)。
他们注意到与NATs和其他RCC亚型相比,ccRCC在RNA和蛋白质水平上具有高水平的糖转移酶(例如MGAT1、FUT11)和低水平的糖水解酶(例如GLB1、FUCA1、FUCA2、 HEXA、HEXB)。同时,RO细胞中MAN2A1和ST3GAL1表达上调,而pRCC细胞中糖转移酶FUT8表达上调(图4H-I)。与FUT8过表达一致,N-糖蛋白组学数据显示其预期靶点包括CTSC, FSTL1和LGALS3BP的糖基化上调。
最后,比较高wGII肿瘤和低wGII肿瘤的糖基化模式,免疫标记糖蛋白[如GZMA(细胞毒性T细胞)、FCGR1A、PTPRC(淋巴细胞)和CD163(巨噬细胞)],内皮糖蛋白(如POSTN、ITRIP、ANO6、CD74、CD14和STAB),基质标志物(如FBN、FBLN2、ITGA5和COL1A1),以及其他标志物MERTK和FH在高wGII肿瘤中富集(图4K)。
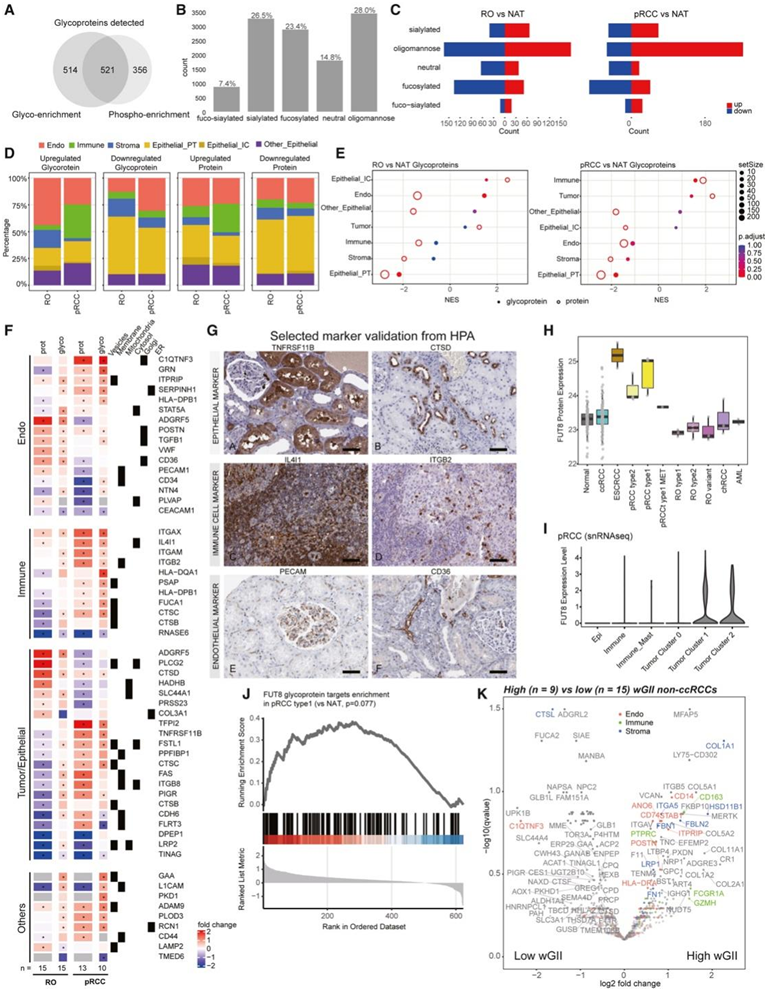
图4. RCC糖蛋白组反映肿瘤免疫浸润和血管生成。
(A) 糖富集样品(糖富集)和磷酸富集样品(磷酸富集)上之间的糖蛋白重叠。(B) 富含糖的样品中发现的各种糖型的分布。(C) 差异表达糖型的分布。(D) 富含糖的样品中的 DE 糖蛋白(左)和蛋白质(右)及其细胞类型注释。(E) 对富含糖的样品中嗜酸细胞瘤(左)和 pRCC(右)中糖蛋白标记物的细胞类型富集分析。(F) 富含糖的样品中的 DE 细胞类型特异性糖蛋白标记。(G) 使用人类蛋白质图谱的数据验证选定的糖蛋白标记表达。(H) 不同 RCC 亚型和 NAT 中的 FUT8 蛋白表达。(I) 1 型 pRCC (C3N-00439) snRNA-seq 数据中鉴定的不同细胞类型中的 FUT8 RNA 表达。(J) 通过 GSEA 在 pRCC 中表达假定的 FUT8 糖蛋白靶标。(K) 高 wGII 与低 wGII 非 ccRCC 之间的 DE 糖蛋白。
05
RCC亚型的肿瘤的生长动力学
已知 RCC 表现出多种突变驱动的代谢缺陷。ccRCC 表现出糖酵解增加和氧化磷酸化减少(Warburg 效应),与高级别、高阶段和低存活率相关。探索致瘤代谢重编程86在非 ccRCC 中,他们分析了 28 个非 ccRCC 肿瘤和 7 个 NAT 的 253 种代谢物。量化的代谢物包括有机酸和衍生物、核苷、核苷酸和类似物、有机氧化合物以及主要代谢途径的其他中间体,例如有机杂环化合物、脂质和苯类化合物(图5A)。通过主成分分析(PCA)发现了不同RCC亚型和AML样本的差异代谢组学特征(图5B),与NAT相比,分别包括65、136和97种显著富集于pRCC 1型、AML和RO的差异化合物。分析差异表达的代谢酶确定了不同RCC亚型的代谢途径。例如,与ccRCC和RO相比,ccRCC和pRCC 1型肿瘤具有一些共同的途径富集(图5C)。具体而言,嘌呤核苷酸从头生物合成和三羧酸循环在ccRCC和pRCC 1型中均缺失,但在RO中富集。磷酸戊糖途径和硫酸皮肤素降解在pRCC 1型中可能上调,但在其他类型的肿瘤中没有。嘧啶脱氧核糖核苷补救途径和糖酵解在AML和RO中均有活性。AML患者的高水平ACACA、ACACB酶和磷酸表明脂肪酸生物合成增加。
在pRCC 1型中,磷酸戊糖途径的氧化期(如G6PD)和非氧化期(如TALDO1、TKT)的几种酶高表达,这些酶与快速增殖的癌细胞对核糖核苷酸的需求增加相关(图5D)。在肾脏RO中,这些酶无差异表达,可能代表疾病进展的代谢障碍。事实上,RO显示了糖酵解的产物丙酮酸的积累(图5D)。
最后,他们比较了4个高wGII和10个低wGII非肾透明细胞癌样本的代谢组学特征,发现6个化合物在高wGII组中显著上调,5个显著下调(图5E-F)。高水平的脯氨酸和NADH,加上高水平的PYCR1表达,表明较高的脯氨酸生物合成,这可能支持癌细胞在限氧条件下的增殖和生存。
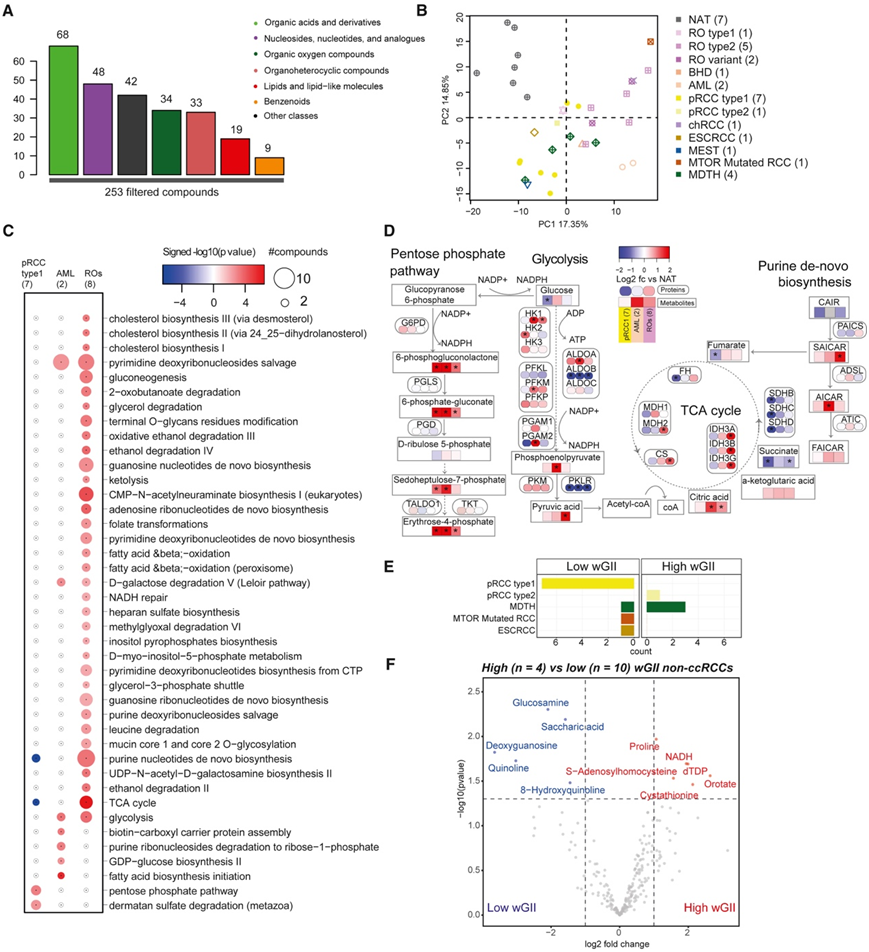
图5. RCC 亚型的代谢组学畸变。
(A) 分析的过滤代谢物及其在功能类别中的分布。(B) 来自不同非 ccRCC 和 NAT 的代谢组学数据的聚类。(C) 肿瘤亚型之间的 DE 途径。(D) 关键途径、蛋白质和代谢物丰度。(E) 按高和低 wGII 组分层的肿瘤亚型分布。(F) 高和低 wGII 肿瘤之间丰度显著差异的代谢物。
06
乳头状RCC生物标志物和激活MET突变的蛋白质基因组学
恶性pRCC占所有肾细胞癌的15%,是一种组织学和遗传异质性的肿瘤,目前缺乏特异性的诊断生物标志物。重要的是,pRCC的一个子集与粘液管状和梭形细胞癌(MTSCC)表现出重叠的形态,这是一种罕见的良性肿瘤。他们确定了一些pRCC 1型特异性的候选基因显著上调和下调(图6A)。排名靠前的pRCC特异性候选基因包括含骨硬化蛋白结构域的蛋白1 (SOSTDC1)和聚合免疫球蛋白受体(PIGR),这些基因在来自TCGA + MCTP联合队列的泛RCC RNA-seq数据中进一步验证(图6B)。比较公开的MTSCC和pRCC蛋白质组学数据,与MTSCC相比,pRCC中PIGR和SOSTDC1蛋白均高度上调(图6C),通过IHC和RNA-ISH验证了这些发现(图6D-E)。
接下来,他们探索了在1型pRCC中经常观察到的MET激酶域的激活突变对蛋白质基因组学的影响。与携带野生型MET的1型pRCC病例相比,在MET激酶结构域(Asp1246Asn和Met1268Thr)具有热点突变的两个1型pRCC样本(图6F)显示磷酸丝氨酸/苏氨酸和磷酸酪氨酸事件上调,包括几个已知的MET底物,如GAB1 Y689。除了已知的MET底物,PTM-SEA富集分析发现了磷酸化位点富集的信号通路,如EGFR、PI3K-AKT和MAPK(图6G)。MET激活的细胞内信号级联包括PI3K-AKT、rac1 -细胞分裂控制蛋白CDC42、RAP1和RAS-MAPK通路。chr7增益在1型pRCC中很常见,也发生在一些ccrcc中。在RNA水平上,chr7基因的丰度显著增加。由于这两种chr7/17基因的增加往往在pRCC中同时发生,他们也看到了chr17基因在非ccRCC肿瘤中的表达增加,而在ccRCC中没有观察到(图6H)。
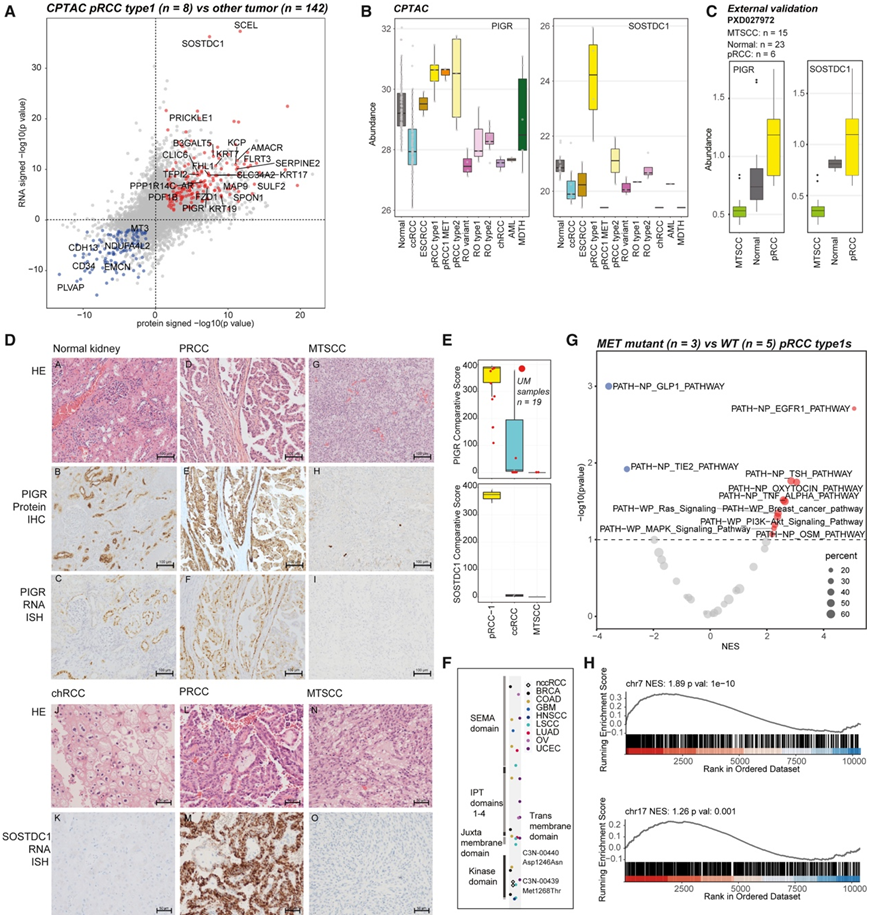
图6. 区分 pRCC 和 MTSCC 的蛋白质组生物标志物。
(A) 1 型 pRCC 和其他肿瘤之间蛋白质表达(x 轴)和 RNA 表达(y 轴)的显著差异事件。(B) pRCC 1 型蛋白标记物 PIGR 和 SOSTDC1 的特异性。(C) pRCC 1 型蛋白标记物 PIGR 和 SOSTDC1 的表达。(D)正常肾组织、pRCC、MTSCC肿瘤和chRCC、pRCC、MTSCC肿瘤中生物标志物PIGR的HE、蛋白质IHC和RNA-ISH图像(从上至下)。(E) 不同肿瘤类型中 PIGR 和 SOSTDC1 的 RNA-ISH 比较评分。(F) TCGA 队列中 MET 错义突变的位置。(G) PTM-SEA 分析显示 MET 突变 pRCC 样品中 EGFR 等通路随着磷酸化的增加而显著富集。(H) 通过 7 号染色体增益和无增益非 ccRCC 样本组之间的蛋白质表达差异来测试 7 号和 17 号染色体基因组的富集。
07
嗜酸性细胞瘤的调节子和鉴别诊断生物标志物
他们在本研究中分析的3个chRCC和15个RO之间进行了RNA和差异表达蛋白分析,以确定诊断性生物标志物(图7A)。与两个公开的数据集相比,CPTAC蛋白质组数据集对FOXI1和DMRT2的覆盖更好,转录因子蛋白及其大部分基因靶点(如ATPV0D2、HEPACAM2、DMRT2等)在肿瘤与正常比较中均表现出了预期的差异表达(图7A)。DE分析发现了候选蛋白,如微管相关蛋白RP/EB家族成员3,粘附G蛋白偶联受体F5 (MAPRE3、ADGRF5、RO特异性)和糖蛋白非转移性黑色素瘤蛋白B (GPNMB在chRCC上调)(图7B-C)。他们在独立公开的基于质谱的RO (PXD007633)和chRCC (PXD019123)蛋白质组学数据中验证了这些结果(图7C)。接下来,他们使用IHC独立地证实和验证了生物标志物的特异性,包括基因融合阳性RO、MAPRE3和ADGRF5中的CCND1蛋白过表达(图7D)在所有RO亚型中的表达,以及chRCC中的GPNMB。
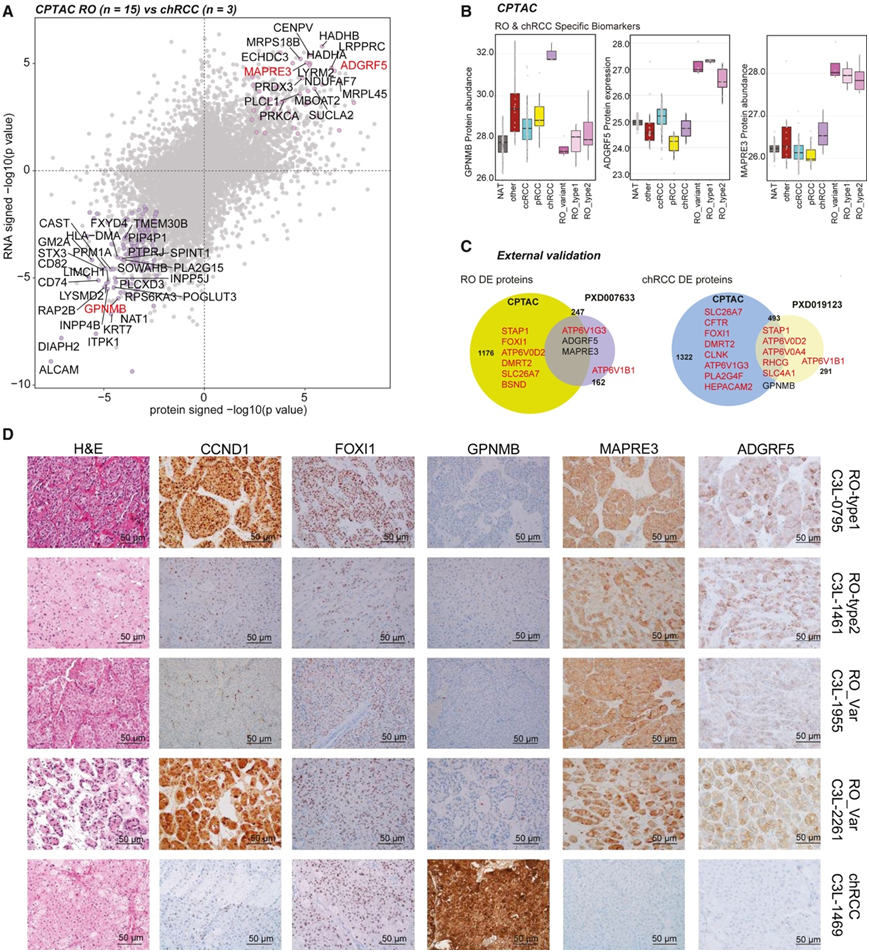
图7. 区分嗜酸细胞瘤 (RO) 和 chRCC 的蛋白质组生物标志物。
(A) 区分嗜酸细胞瘤 (RO) 和 chRCC 的蛋白质组生物标志物。(B) 不同亚型中的 chRCC 标记物 GPNMB(左)和 RO 生物标记物 ADGRF5 和 MAPRE3 蛋白丰度。(C) 本研究 (CPTAC) 中鉴定的 DE 蛋白与 RO 中公开的 PXD007633 数据集(左)和 PXD019123 chRCC 数据集(右)之间的重叠。(D) 对代表性肿瘤切片中所见指定标记物的免疫组织化学验证。
+ + + + + + + + + + +
结 论
本项研究对 48 个非 ccRCC 与 103 个 ccRCC 进行比较的多组学分析揭示了 RCC 亚型的蛋白质组学、磷酸化、糖基化和代谢畸变。具有高度基因组不稳定性的 RCC 显示 IGF2BP3 和 PYCR1 的过度表达。转录组数据的整合可预测不同的细胞来源并阐明 RCC 亚型特异性蛋白质组特征。生物标志物 MAPRE3、ADGRF5 和 GPNMB 的表达可区分肾嗜酸细胞瘤和嫌色细胞 RCC,PIGR 和 SOSTDC1 的表达可区分乳头状 RCC 和 MTSCC。这项研究扩展了对非 ccRCC 蛋白质组特征、生物标志物和潜在治疗靶点的了解。
+ + + + +



 English
English


