文献解读|Cell Rep Med(14.3):序列多组学分析可识别长期新冠肺炎的临床表型和预测生物标志物
✦ +
+
论文ID
原名:Sequential multi-omics analysis identifies clinical phenotypes and predictive biomarkers for long COVID
译名:序列多组学分析可识别长期新冠肺炎的临床表型和预测生物标志物
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2023.10.18
DOI号:10.1016/j.xcrm.2023.101254
背 景
从 SARS-CoV-2 感染恢复期的个体中,有 10%–30% 会继续经历 COVID-19 (PASC) 或长期 COVID 的急性后遗症,其特征是疲劳、睡眠障碍、意识混乱和呼吸困难,以及许多其他症状导致生活质量严重受损的衰弱症状,但是目前对疾病后遗症的异质性缺乏充分的认识。
实验设计

结 果
01
参与者的特征
研究者团队对2020年10月15日至2021年6月29日期间从COVID-19病房和重症监护病房招募的117名患者进行了临床研究,在6.3个月的中位持续时间内进行了重复血液采样(图1A)。最常见的 PASC 症状是疲劳、全身无力、呼吸J急促(SOB)、认知障碍和情绪障碍(图 1 B)。
他们根据病人的症状分了三个 PASC 组:恢复(无 PASC 症状)组、轻度组、重度组。整个队列的特点是中位年龄为 62 岁,其中有 66 名男性,糖尿病和高血压患病率很高。除吸烟外,PASC重度组的临床特征相似,重度组中当前或既往吸烟者的比例过高。相比之下,SF-12评分和EuroQol视觉模拟量表与PASC严重程度密切相关(图1C)。此外,急性感染出院后出现不良结果(全因死亡或再次住院)的个体比例更大,属于严重PASC类别(图1D)。这些结果表明,当患者从急性感染过渡到康复期时,他们仍然承受着持续较高的症状负担和不良结果的风险。

图1. COVID-19(PASC)急性后遗症症状和参与者的健康相关生活质量。
(A) 研究设计和分析概述。(B) 恢复期 PASC 症状患病率。(C) 恢复期 PASC 严重程度组的 SF-12 总分和 EuroQuol 视觉模拟量表 (EQ-VAS)。(D) PASC 严重程度与急性感染出院后不良临床结果(全因死亡率和再住院的综合结果)之间的关联。
02
急性感染和恢复期细胞因子、蛋白质组和代谢组的时间变化
他们进行了细胞因子分析、蛋白质组学和代谢组学分析,以确定急性感染和恢复期之间血浆分子特征的时间变化。主成分分析 (PCA)显示,与急性感染期相比,恢复期个体的分子谱发生了改变(图 2A)。在急性感染和健康对照之间,231 个分子发生显著改变,包括 24 种细胞因子、63 种蛋白质和 144 种代谢物(图 2B)。此外,他们在急性感染期和恢复期之间检测到157个差异表达分子(DEM),由8种细胞因子、34种蛋白质和115种代谢物组成(图2C)。最后,在恢复期和健康对照之间鉴定出 219 个 DEM,其中包括 9 种细胞因子、31 种蛋白质和 169 种代谢物(图 2D)。
热图显示了差异最显著的前 100 个分子,并分析了它们相对于健康对照在急性期和恢复期的个体变化轨迹(图 2 E)。从健康对照到急性期和恢复期的样本中,血小板反应蛋-1(TGF-β的重要激活因子)的水平逐渐升高(图2F)。相比之下,与健康对照相比,谷氨酰胺水平在急性期和恢复期仍然较低,这代表了 COVID-19 的代谢特征,与更严重的疾病严重程度相关。可溶性 CD40 配体的水平在急性感染中升高,其血浆水平在恢复期持续升高(图2F),这可能反映了持续的病毒介导的炎症。

图2. 急性期和恢复期相关的差异表达分子(DEM)。
(A) 利用蛋白质组学、代谢组学和细胞因子的主成分分析 (PCA) 。(B-D) 火山图,比较急性感染和健康对照之间的 DEM。 (E) 热图显示了使用 log10 转换数据的方差分析测试将健康对照与急性期和恢复期相比较的具有p 值最显著的前 100 个分子。(F) 箱线图显示血小板反应蛋白-1、谷氨酰胺、血清素和 sCD40L 的水平。
03
急性感染和康复期间差异通路发生改变
他们对急性感染和健康对照之间的 DEM 进行综合经典通路分析,确定了与刺激免疫细胞以及激活 IL-1、IL-6、TNF 和 Toll 样受体 3 信号传导相关的通路(图3A-B)。p -选择素、血小板反应蛋白-1、纤连蛋白和凝血因子XIII水平与血小板和淋巴细胞计数呈正相关,支持急性SARS-CoV-2感染中血小板与适应性免疫之间的密切相互作用。c反应蛋白和脂多糖结合蛋白与高敏感性肌钙蛋白正相关,代表了炎症诱导的心脏损伤的潜在特征。此外,代谢通路在急性感染期间发生改变,包括精氨酸生物合成、谷氨酸代谢和鞘脂代谢(图3C)。
为了阐明长期新冠肺炎的发病机制并确定治疗靶点,他们接下来研究了急性感染后 6 个月发生的分子变化。与健康个体相比,急性期反应、IL-1、TNF和IL-6通路与急性感染期相似,具有明显和持续的免疫激活(图3D-E)。
此外,他们发现恢复期对葡萄糖代谢至关重要的几种关键代谢物的失调,包括 2-酮戊二酸、鸟氨酸、亚精胺和尿囊素,这些代谢物与沉默调节蛋白 6 和葡萄糖-6-磷酸脱氢酶等细胞通路的激活有关。

图3. 急性感染和恢复期的通路失调。
(A) GO分析。(B) 基于 Ingenuity Pathway Analysis (IPA) 的急性 COVID-19 中分子和功能的主要调节作用。(C) 与健康对照相比,急性 COVID-19 代谢改变相关的通路。(D) GO分析。(E) 基于 Ingenuity Pathway Analysis (IPA)的恢复期间分子和功能的主要调节作用。(F) 与健康对照相比,恢复期间与代谢改变相关的通路。
04
蛋白质组和代谢组特征与临床参数之间的关联
他们对恢复期的dem与PASC症状进行了logistic回归分析,具有三个或更多显著相关的分子显示在热图中(图 4 A)。他们观察到一组分子甘油三酯与呕吐反应和疲劳呈显著负相关,但与心动过速呈正相关(图4A)。血浆胱抑素C和中性粒细胞明胶酶相关脂钙素是肾功能的标志物,与SOB、疲劳、恶心和不良结局呈正相关,提示某些PASC患者可能累及肾脏。此外,肠道来源的戊酸与恶心、疲劳、肌肉疼痛和SOB呈负相关。在重症 COVID-19 患者疾病缓解后 30 天以上,观察到粪便中短链脂肪酸(例如戊酸)浓度降低,并推测这反映了 SARS-CoV-2 介导的肠道微生物组的长期破坏。与SF-12和EQ-VAS评分呈负相关的代谢物有4-羟基脯氨酸和2-羟基异丁酸(图4B)。重要的是,代谢产物牛磺酸,其水平与恶心、情绪障碍、认知障碍、SOB、全身虚弱和不良后果的症状呈负相关。此外,牛磺酸和血清素水平也与生活质量评分(SF-12和EQ-VAS)呈正相关(图4A-B)。
在急性 SARS-CoV-2 感染期间,尤其是重症患者中,甘油磷脂、鞘脂、磷脂酰胆碱和脂肪酸发生下调。当检测恢复期和急性期之间的分子变化时,脂质水平的恢复与较低的 PASC 症状负担相关,包括恶心、疲劳和全身无力,同时生活质量得分更高。因此,涉及神经、免疫、胃肠道和代谢过程的各种分子特征与长期新冠病毒的症状和生活质量相关。
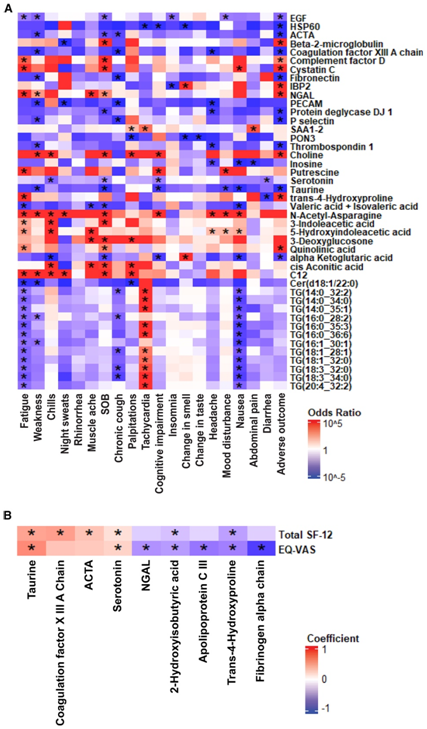
图4. 分子特征与PASC症状和恢复期健康相关生活质量之间的关联。
(A)与差异表达分子 (DEM) 相关的 PASC 症状和不良结果的热图。(B) 热图显示健康相关生活质量指数与DEM 之间的显著关联。
05
无监督聚类鉴定了恢复期的三种不同表型
接下来,他们根据急性期和恢复期之间分子(细胞因子、蛋白质和代谢物)浓度的变化对个体进行无监督聚类。大多数个体属于聚类A,其特征是分子谱没有显著偏差,并且具有已确定的PASC危险因素。相比之下,聚类B以甘油三酯和有机酸为主(图5A),而聚类C则表现出更不均匀的细胞因子、蛋白质和代谢物组成(图5B)。此外,聚类之间存在性别差异,与聚类B相比,聚类C的女性比例更高,并且具有更频繁的失眠、心悸、SOB、全身无力和疲劳等症状(图5C)。
有趣的是,基于聚类C分子鉴定的网络在HIF-1通路中富集,该通路调节细胞对缺氧和代谢适应的反应,同时在激活上表现出性别差异(图5D)。重要的是,聚类C的中肠道微生物群衍生的代谢物三甲胺 N-氧化物 (TMAO) 和苯乙酰谷氨酰胺的血浆水平升高与症状恶化和不良后果相关,这与长期感染新冠病毒的患者持续微生物失调和心血管疾病之间的关系一致(图5E)。

图5. 基于急性感染和恢复期分子特征时间变化的无监督聚类。
(A) 聚类B 中偏差≥ 65% 的分子特征。(B) 聚类C 中偏差≥ 65% 的分子特征。(C) 已识别疾病群之间临床特征和 PASC 症状的差异。(D) 使用 Ingenuity Pathway Analysis (Qiagen) 从聚类C 中的分子特征衍生的网络。(E) 与健康对照相比,按临床结果和 PASC 严重程度(恢复、轻度和重度)分层的三甲胺 N-氧化物 (TMAO) 和苯乙酰谷氨酰胺水平。
06
与康复期间不良临床结果相关的生物标志物特征
为了揭示与恢复期不良结果相关的分子,他们根据重复采样时的多组学概况,用最少的分子组对结果进行了分层,并开发了机器学习模型对它们进行验证,以预测急性感染出院后不良事件的发生率(图 6 A)。从训练队列中,优先选择至少 20 个变量,包括 7 种细胞因子和 13 种代谢物,达到 0.96 的曲线下面积 (AUC)(图 6 B)。与组合的多组学数据集相比,这个最小预测组在准确度、召回率和 F1 得分方面表现更好,但精度降低(图6C-D)。当在验证队列上测试模型时,该最小预测组正确预测了所有事件(图6D)。
网络分析表明,亚精胺和牛磺酸代谢物下调,同时伴随着保护性细胞因子[包括白细胞介素 22 (IL-22)和集落刺激因子 3(CSF3)]的减少以及促炎细胞因子[包括白细胞介素 15 (IL-15)、白细胞介素 10 (IL-10) 增加(图 6 E)。有趣的是,白介素 27 (IL-27) 是一种多功能细胞因子,是最小预测组中确定不良结果的最重要的生物标志物。
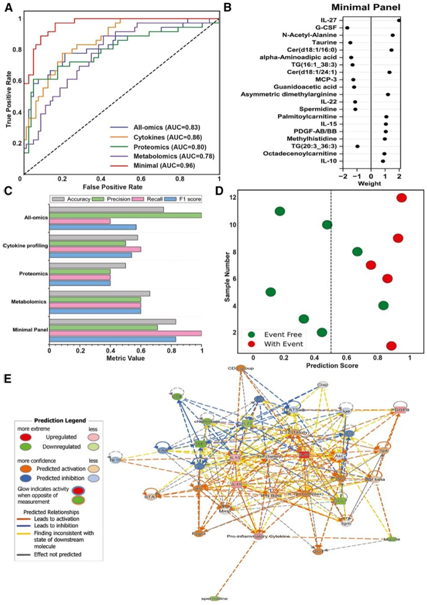
图6. 恢复期不良后果的预测生物标志物。
(A) 在每个单独的组学数据集、组合组学(细胞因子、蛋白质组学和代谢组学)以及使用恢复期分子谱的最小预测组上训练的预测模型的接收器算子特征曲线。(B) 7 种细胞因子和 13 种代谢物组成。(C) 使用每个单独的组学数据集、组合组学和最小预测组上的分类器性能指标。(D) 预测得分图展示了最小预测组对测试集进行分类。(E) 基于 Ingenuity Pathway Analysis (Qiagen) 的分子网络。
+ + + + + + + + + + +
结 论
本项研究从 117 名个体感染急性期期间和感染后 6 个月内采集了血浆样本,以全面分析和评估细胞因子、蛋白质组和代谢组的变化。网络分析揭示了恢复期持续的炎症反应、血小板脱颗粒和细胞激活,并伴有精氨酸生物合成、蛋氨酸代谢、牛磺酸代谢和三羧酸(TCA)循环过程的失调。此外,他们开发了一个由 20 个参与调节 T 细胞耗竭和能量代谢的分子组成的预测模型,能可靠地预测急性感染出院后的不良临床结果,准确率达 83%。本项研究揭示了恢复期与急性感染不同的相关生物过程,并支持为长期感染新冠病毒的患者开发特定疗法和生物标志物。
+ + + + +



 English
English


