文献解读|Cancer Cell(50.3):基因组改变导致食管癌发展中癌前病变至癌性病变
✦ +
+
论文ID
原名:Genomic alterations driving precancerous to cancerous lesions in esophageal cancer development
译名:基因组改变导致食管癌发展中癌前病变至癌性病变
期刊:Cancer Cell
影响因子:50.3
发表时间:2023.11.30
DOI号:10.1016/j.ccell.2023.11.003
背 景
食管鳞状细胞癌(ESCC)是一种遵循多阶段肿瘤发生过程的癌症类型,涵盖癌前病变阶段,即组织病理学可识别的低级别上皮内瘤变(LGIN)和高级别上皮内瘤变(HGIN)。已研究了食管鳞癌和正常食管组织的基因组特征,发现癌症基因组与正常基因组之间的主要差异如下:更频繁的染色体不稳定性和ESCC 中的拷贝数改变 (CNA),这在正常食管组织中很少见;正常食管组织中的NOTCH1更常见TP53突变相反;载脂蛋白 B mRNA 编码催化多肽样 (APOBEC)酶相关突变特征在 ESCC 中更为普遍,但这在正常食管组织中很少见。然而,这些改变发生在哪个阶段,以及它们是否是启动和促进恶性转化的先决条件,还是在该过程的后期获得的,仍不清楚。
实验设计
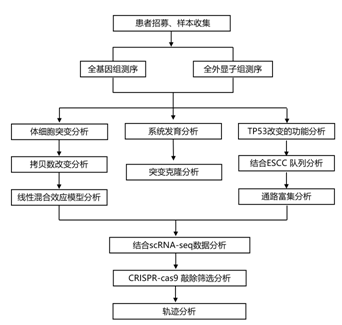
结 果
01
正常和不同癌变样本中的体细胞突变负担
研究者团队从 28 名患者中获取了 42 份食管活检样本,其中 22 例为正常食管上皮 (NOR),9 例为LGIN,7 例为 HGIN,4 例为ESCC(图 1 A)。他们通过激光捕获显微切割 (LCM)对 42 个活检样本进行 2 至 5 个连续冷冻切片,获得了总共 1275 个微活检样本(每个样本包含约 600 个上皮细胞),用于全外显子组测序 (WES)和全基因组测序 (WGS)(图1A)。他们在正常食管上皮中发现了各种体细胞突变,每个样本的突变负担中位数为 29.0,个体之间存在差异(图 1 B)。线性混合效应模型分析表明,每年衰老导致每个外显子组突变增加 0.42。中位体细胞突变数从<55岁个体的18.5增加到≥55岁个体的33.0。在LGIN、HGIN和ESCC样本中,他们观察到体细胞突变中位数分别为45.0(31−56)、66.8(44.0-107.5)和118.5(90.0-146.0),均显著高于NOR样本中的33.0(21.0-53.5),并且LGIN、HGIN到ESCC的突变中位数增加也具有统计学意义(图1B)。在LGIN、HGIN和ESCC中,疾病状态影响体细胞突变负担,每个显微活检样本增加8.1、48.5和76.6 个突变(通过线性混合效应模型估计),并且随着疾病阶段从正常进展到ESCC,突变负担显著增加(图1C)。
在本项研究的样本中,有 18 个基因发生了突变。TP53和NOTCH1是最常见的突变基因,但随着疾病阶段的进展,它们的突变频率呈现出相反的趋势(图1D)。NOTCH1突变频率在NOR(59.2%)和LGIN(67.3%)中较高,但在HGIN(9.3%)和ESCC(10.6%)中显著降低。相比之下, NOR中的TP53突变频率为29.2%,但从LGIN(58.4%)到HGIN(94.3%)和ESCC(100%)大幅增加。在其他基因中,只有CDKN2A突变频率在疾病进展过程中增加(图 1D)。
他们计算了 NOR、LGIN 和 HGIN 样本中非同义替换与同义替换(dN/dS) 突变的比率,发现NOR 阶段的NOTCH1、TP53、FAT1和KMT2D处于 LGIN 阶段的TP53、NOTCH1和FAT1, HGIN 阶段的TP53处于显著的正选择之下(图1E)。具体而言,在 NOR、LGIN 和 HGIN 样本中,最频繁突变的TP53 的dN/dS 比率 >50。然而,由于HGIN中的突变频率急剧下降,发现NOTCH1仅在NOR和LGIN中发生正选择,而在HGIN样本中未发生正选择(图1E)。这些结果表明,正常食管上皮和不同癌阶段的TP53和NOTCH1突变克隆处于不同的选择压力下。
WGS结果显示,随着ESCC肿瘤发生的进展,全基因组体细胞CNA的数量大幅增加。值得注意的是,这种增加是在从正常到 LGIN 的转变过程中开始的,并且在从 LGIN 到 HGIN 的进展过程中变得更加明显。他们发现 NOR 样本中 CNA 极其罕见,与体细胞突变不同,CNA没有表现出衰老增加的趋势(图1F)。LGIN升高了某些染色体臂水平的CNA: 5/8供者染色体3q增益(62.5%),2/8染色体5p增益(25.0%),3/8染色体8p和8q增益(37.5%),2/8染色体3p缺失(25.0%),2/8染色体4p缺失(25.0%),3/8染色体9p缺失(37.5%)。在HGIN和ESCC样本中,CNA更为普遍和明显:4/6的HGIN供者和3/4的ESCC供者染色体1q增益;2/6的HGIN供者和2/4的ESCC供者染色体11q增益;1/6的HGIN供者和3/4的ESCC供者染色体5q缺失(图1F)。与NOR相比,在LGIN、HGIN到ESCC的显微活检中,染色体臂水平的CNA数量显著增加(图1G),这种CNA的增加发生在食管发育异常(LGIN)的早期阶段。
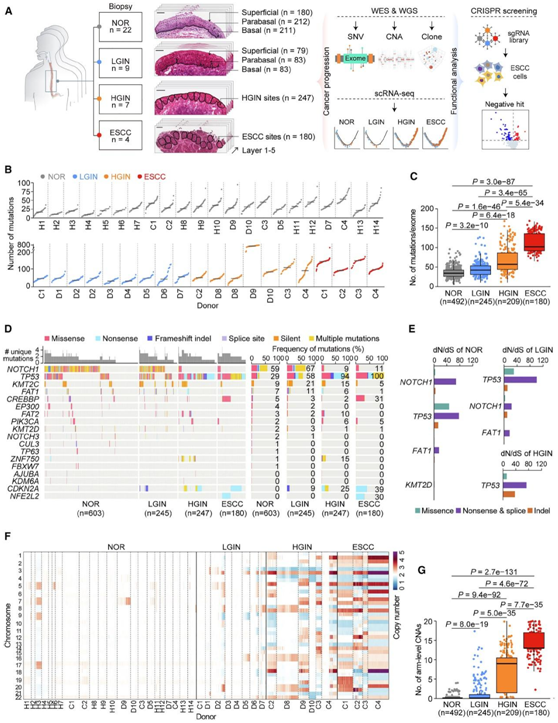
图1. 正常和不同癌变样本中的体细胞突变负担。
(A) 激光捕获显微切割 (LCM)、小型全外显子组/基因组测序 (WES/WGS) 和功能验证程序。(B) 在每个微活检的外显子区域中检测到的体细胞突变数量。(C) ESCC 发展过程中正常和不同病变的微活检中的突变负担。(D) ESCC 发育过程中 18 个癌症相关基因的突变情况。(E) NOR、LGIN 和 HGIN 阶段正选择基因的估计 dN/dS 比,按突变类型着色。(F) 在每次微活检中检测到的染色体臂水平拷贝数。(G) ESCC 发展不同阶段的微活检中的 CNA 负担。
02
系统发育重建揭示了ESCC的进化过程
利用空间排列的微活检及其相应的系统发育树,他们能够研究 ESCC 发育过程中的克隆动态。这种方法还使他们能够探索个体克隆内部以及不同克隆之间的进化过程。在不同的疾病阶段估计了 18 个癌症相关基因突变克隆的数量和相对大小。在从正常到 ESCC 的进展过程中,他们观察到主要突变克隆从NOTCH1突变克隆逐渐转变为TP53突变克隆(图 2A)。此外,突变克隆中的突变和 CNA 负担随着疾病状态的进展而增加(图2B)。与NOR样本(n = 48)相比,LGIN样本(n = 23)、HGIN样本(n = 7)和ESCC样本(n = 4)的突变分别增加了1.30倍、1.70倍和3.95倍(图2C)。同样,基因组不稳定性也从LGIN克隆中增加,在NOR、LGIN、HGIN和ESCC样本中分别为0.2、1.4、6.6和13.8(图2C)。
在 LGIN 阶段的克隆中,广泛的 CNA 经常与TP53双等位基因缺失同时发生。LGIN期主干突变数与正常克隆相当。然而,一些LGIN克隆显示了大量的主干改变,包括关键驱动基因(如TP53)的突变和缺失。以LGIN患者(供体D7)为例,27个LGIN和27个NOR显微活检样本的系统发育聚类显示出4个主要克隆(图2D)。LGIN克隆1和克隆2分别进行了22次和4次显微活检,而NOR克隆3和克隆4分别进行了17次和5次显微活检。他们发现,在LGIN克隆1中,12/22(54.5%)的显微活检样本中存在TP53突变(p.i ile251asn和p.Lys382fs)和LOH。CDKN2A突变是克隆1所特有的,而NOTCH1突变和LOH在所有4个克隆中普遍存在。
通过检测两个供体C3和C4的系统发育树,他们成功地将其肿瘤的起源追溯到一个与HGIN克隆共享突变的共同祖先(图2E)。在这两个个体中,所有检测到的假定驱动突变都位于ESCC和HGIN之间的共有分支上。例如,在供体C3的HGIN和ESCC克隆中(图2E),大量的突变包括TP53 LOH和p.a g175his突变,NOTCH1 LOH和NOTCH1 p.Cys429Ser突变是共有的。
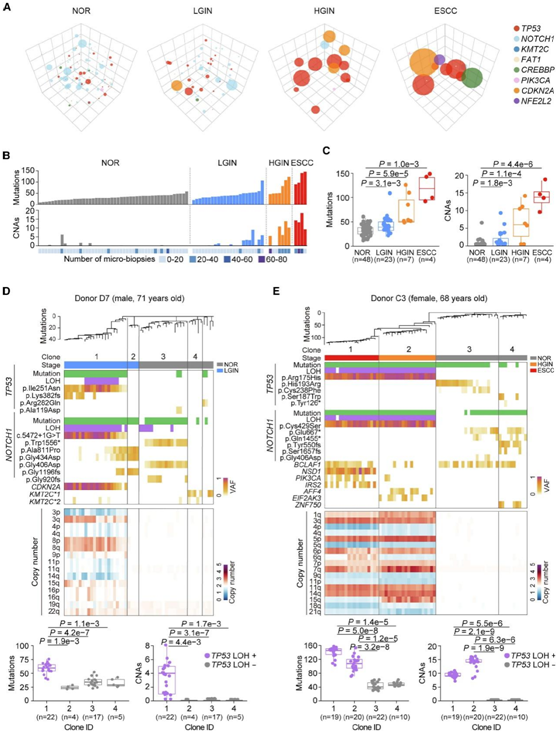
图2. TP53双等位基因丢失和CNA促进突变克隆的扩增。
(A) ESCC 发育四个阶段的 8 个驱动基因突变克隆的示意图。(B) 在 ESCC 发育的多阶段样本中鉴定出的 83 个主要克隆中每一个的基因组景观。(C) 不同阶段克隆的突变(左)和 CNA(右)负担的比较。 (D) LGIN期TP53双等位基因缺失和同时存在大量CNA的异常患者克隆结构和基因组改变的代表性例子(克隆1)。(E) ESCC 患者的克隆结构基因组改变与配对正常克隆和 HGIN 克隆的代表性示例。
03
TP53双等位基因丢失和CNA促进突变体克隆扩增
检测了总共 79 个具有确定TP53状态的克隆,包括 48 个 NOR 克隆、19 个 LGIN 克隆、8 个 HGIN 克隆和 4 个 ESCC 克隆。在 NOR 样本中,他们检测到大量NOTCH1 -LOH 克隆,但仅检测到少数TP53 -LOH 克隆。这些克隆中TP53突变的中度变异等位基因频率(VAF)表明它们中的大多数保留了至少一个正常的TP53等位基因,这可能足以维持基因组稳定性和正常的上皮细胞表型。然而,8.3% (4/48) 的 NOR 克隆和 36.8% (7/19) 的 LGIN 克隆存在TP53双等位基因缺失或超过 1 个TP53突变;对于 HGIN 和 ESCC 克隆,具有此类TP53改变的克隆比例分别为 75% (6/8) 和 75% (3/4)(图 3 A)。与没有TP53突变或仅有单一突变的克隆相比,这些克隆表现出显著升高的复发突变和CNA(图3B)。
接下来,他们探讨了TP53缺失可能促进突变克隆扩增和ESCC发生的机制。对79个突变克隆的病灶CNA区域的分析显示,与没有TP53突变的克隆相比,TP53双等位基因缺失/多重突变的克隆中扩增更为普遍(图3C)。他们比较了 LGIN 和 HGIN 样本中具有不同TP53状态的克隆中的 CNA 模式,并在TP53丢失相关的 CNA 区域中鉴定了 6713 个拷贝数缺失基因和 11412 个拷贝数增加基因。然后,他们使用两项研究的 RNA-seq 数据和未发表的样本集(总共包含 280 个 ESCC 和 121 个正常样本)检测这些基因的表达是否在 ESCC 中失调。结果显示,在拷贝数丢失基因中,195个基因下调,而在拷贝数增加基因中,605个基因上调(图3D-F)。对94个同时具有RNA和CNA数据的ESCC样本的进一步相关性分析显示,195个下调基因中有74个的表达水平与其DNA拷贝数损失呈正相关,这些基因大多属于TP53(如CDKN2B、FOXO3和KLF4)和凋亡(如FOXO3、JAK2和PDCD4)途径(图3D)。另一方面,他们在ESCC细胞系中进行了大规模CRISPR-Cas9敲除筛选,检测605个上调基因对癌细胞增殖的影响,发现有93个基因的沉默对至少一种细胞系的增殖有显著抑制作用(图3E-F)。在这93个上调基因中,84个RNA水平与DNA拷贝数显著相关,它们在细胞周期和DNA修复途径中富集,包括标记中的E2F靶点(如CKS1B、PAICS和TOP2A)和REACTOME中的DNA修复靶点(如FEN1、PRPF19和SLX1A)(图3G)。
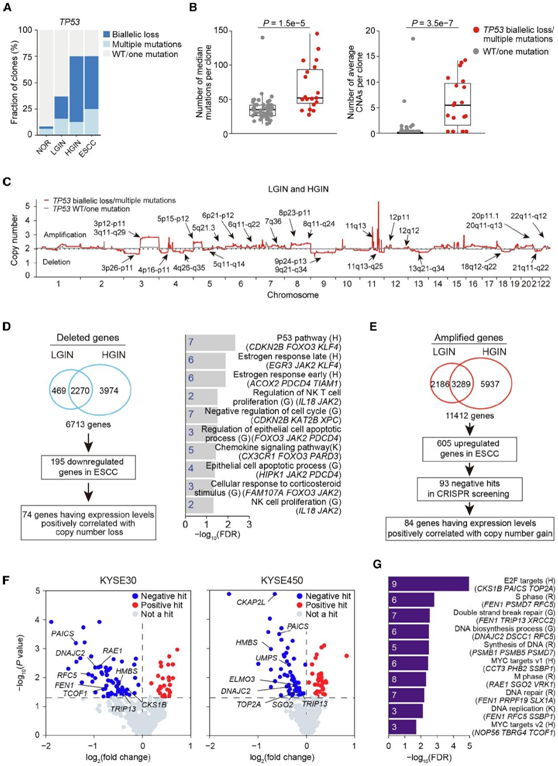
图3. ESCC癌前阶段克隆中TP53改变的功能分析。
(A) ESCC 发育不同阶段具有不同TP53状态的克隆分数。(B) 具有不同TP53状态的克隆的中位突变数(左)和平均染色体臂水平 CNA(右)的比较。(C) 具有不同TP53状态的 LGIN 和 HGIN 克隆的病灶拷贝数。(D-E) 鉴定具有TP53功能障碍的 LGIN 和 HGIN 克隆的缺失区域和扩增区域中的潜在功能基因。(F) KYSE30 和 KYSE450 细胞系中 CRISPR-Cas9 敲除筛选的结果。(G) 84 个上调基因的通路富集分析。
04
单细胞转录组(scRNA-seq) 证明 ESCC 发育中的基因组不稳定性和细胞增殖
最后,他们使用已发表的 scRNA-seq 数据验证了上述发现,其中包括本研究中招募的 4 名 ESCC 患者。他们推断了每个上皮细胞的倍性谱,并观察到NOR中非整倍体上皮细胞的比例为4.0%,LGIN中为7.9%;然而,HGIN 和 ESCC 中这一比例分别增至 69.7%和 67.5%(图4A)。这些结果与本项研究的基因组分析一致,证实 HGIN 和 ESCC 中的 CNA 显著增加。此外,他们鉴定出 3823 个基因在非整倍体上皮细胞中比在二倍体细胞中显著过度表达(图 4 B)。然后,他们观察了 84 个具有 DNA 扩增并对 ESCC 细胞增殖有显著影响的基因,如图3F中所述,发现其中 64 个在非整倍体上皮细胞中的 mRNA 水平显著高于二倍体细胞,细胞周期和 DNA 修复途径也发生富集(图 4B-C)。
上皮细胞的伪时间分析显示,随着疾病从 NOR 进展到 ESCC,上皮细胞逐渐从二倍体转变为非整倍体(图 4D)。此外,他们发现 ESCC 进展的伪时间与非整倍体细胞的增殖评分之间存在显著的正相关性(图4E)。他们还发现,沿着 ESCC 进展轨迹,细胞周期/DNA 修复途径中基因的mRNA表达水平逐渐增加,例如通过的基因组分析鉴定的FEN1、PFN1、TOP2A和CKS1B(图4F-G) 。
总的来说,这些结果验证了在基因组分析中的发现,表明上皮细胞在从 NOR、LGIN、HGIN 向 ESCC 转化过程中的克隆扩增可能是由与 CNA相关的细胞周期/DNA 修复途径中基因的异常表达以及 TP53 功能的丧失驱动的(图4H)。
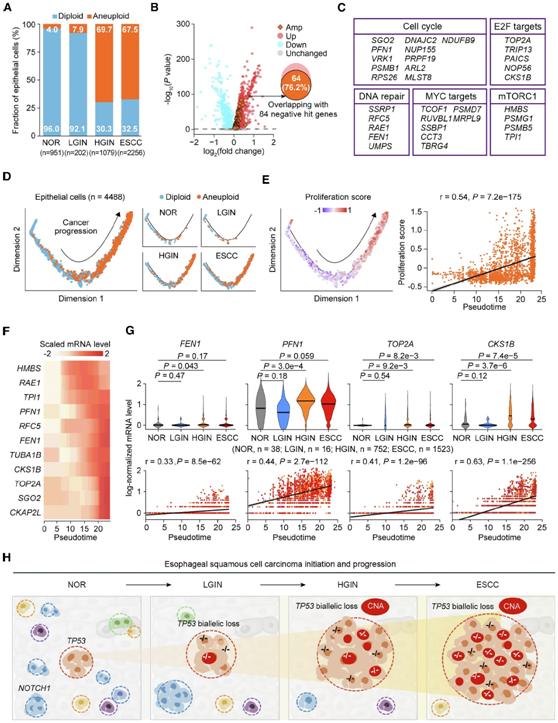
图4. scRNA-seq 证明 ESCC 发育中的基因组不稳定性和细胞增殖。
(A) ESCC 发育不同阶段的不同倍性食管上皮细胞的分数。(B) 不同倍性状态(非整倍体/二倍体)的食管上皮细胞的基因表达比较。(C) 根据途径对 CRISPR-cas9 敲除筛选中阴性选择并在非整倍体细胞中显著上调的基因进行分类。(D) 二维状态空间中不同拷贝数分布的食管上皮细胞伪时间轨迹图。(E) 食管上皮细胞的伪时间轨迹与增殖评分之间的相关性。(F) 所选细胞周期相关基因的相对表达水平以及 ESCC 进展轨迹的热图。(G)随着非整倍体上皮细胞中 ESCC 的发展,选定的细胞周期和 DNA 修复相关基因的表达水平升高。(H) ESCC 发生和进展中基因组变化和克隆扩增的示意图。
+ + + + + + + + + + +
结 论
本项研究分析了来自正常食管、早期和晚期癌前病变以及食管癌的 1275 个微活检,以探究每个阶段的基因组变化。TP53双等位基因失活的频率在早期癌前病变阶段显著增加,而 CNA和APOBEC 突变在晚期阶段显著增加。TP53双等位基因缺失是细胞周期、DNA修复和凋亡途径中基因CNA发育的先决条件,表明它可能是启动恶性转化的最早步骤之一。
+ + + + +



 English
English


