文献解读|Nat Aging(16.6):小胶质细胞衰老过程的转录和表观遗传分析
✦ +
+
论文ID
原名:Transcriptional and epigenetic decoding of the microglial aging process
译名:小胶质细胞衰老过程的转录和表观遗传分析
期刊:Nature Aging
影响因子:16.6
发表时间:2023.09.11
DOI号:10.1038/s43587-023-00479-x
背 景
小胶质细胞是中枢神经系统 (CNS) 中的常驻免疫细胞,在维持从胚胎大脑雏形到衰老大脑的大脑稳态方面发挥着重要作用。作为重要的免疫细胞,小胶质细胞在衰老过程中会经历一系列变化,增加大脑功能障碍的易感性,衰老大脑中的小胶质细胞与多种脑部疾病的病因有关。然而,小胶质细胞在转录和表观遗传水平上衰老特征尚不完全清楚。
实验设计
结 果
01
成年期小胶质细胞中年龄依赖性基因的特征
为了深入了解小胶质细胞在衰老过程中的反应,研究者团队通过荧光激活细胞分选(FACS) 和bulk RNA转录组测序 (bulk RNA-seq),对C57BL/6J小鼠(雌性为3个月、6个月、9个月、12个月、14个月、16个月和24个月;雄性为3、6、9、12、16、19和24个月龄)中的小胶质细胞 (CD11b+CD45low)的转录组进行了分析(图1a),结果显示,雌性小鼠的小胶质细胞的基因谱在衰老过程中逐渐发生变化,表明衰老的特征(图1b)。主成分分析(PCA)进一步表明,雌性小鼠的小胶质细胞大致可分为3组:幼龄(3个月)、中老年(6、9、12、14个月)和老年(16、24个月)(图1d)。出乎意料的是,雄性小鼠的小胶质细胞在衰老过程或中年中期并未表现出逐步转变。相反,雄性小胶质细胞在 9 个月之前表现出幼年的表型。此后,它们在12个月大后急剧转变为老年表型(图1c-e)。因此,雌性和雄性小鼠的小胶质细胞在大脑中表现出不同的衰老轨迹。
一些差异表达基因(DEG)与年龄呈正相关或负相关,如小鼠脑内Axl(雌性)和Cd74(雄性)呈正相关,而Hspa13(雌性)和Ccl24(雄性)呈负相关(图1f),他们将其命名为年龄依赖性小胶质细胞(ADEM)基因,在雌性和雄性小鼠中分别鉴定出57个和14个与年龄正相关的ADEM基因(P-ADEM基因)(图1g-h)。P-ADEM基因包括参与干扰素(IFN)信号通路(Ifitm3、ifif204、Cxcl16、Xaf1、Gas6和Tgtp2)、脂质代谢(Lpl、Apod和Spp1)、吞噬(Axl、Spp1、Cst7和Fcgr3a)、防御反应(Tnf、Il1rn、Ccl6和Ccl12)、活性氧(ROS)产生(Cybb和Hp)和抗原呈递(H2-D1、H2-Q7、Cd74、Tap1和H2-K1)的基因(图1g-h)。他们还在雌性和雄性小鼠中分别鉴定了 16 个和 4 个与年龄负相关的 ADEM 基因(N-ADEM 基因),包括小胶质细胞标记基因(Fcrls和 Il4ra)、趋化因子抑制和产生基因(Socs3、Tlr7和Il4ra)、内质网相关蛋白降解 (ERAD) 相关基因 (Hspa13) 和铁转运基因(Fth1和Hfe)(图1g-h)。GO分析显示ADEM基因的功能涉及白细胞迁移、趋化因子产生、IFN信号传导、防御反应、适应性免疫激活和先天免疫激活(图1i)。
Ingenuity通路分析(IPA)进一步表明,与LXR/RXR、FXR/RXR激活、α-生育酚降解、铁转运和铁稳态相关的通路在ADEM基因中富集(图1j),表明衰老与可能影响脂质和铁的代谢。
为了进一步破译 ADEM 基因的特征,他们将ADEM 基因与疾病相关小胶质细胞 (DAM)和激活反应小胶质细胞(ARM)的基因集进行比较。在85个ADEM基因中,21个基因与DAM基因重叠(图1k)。ADEM和DAM子集中重叠基因的倍数差异 (FC) 显示正相关(图1l)。相比之下,ARM 基因集中仅包含三个 ADEM 基因(Cd74、Cst7和Spp1)(图1m)。ADEM 基因更有可能与神经退行性疾病相关,而不是与小胶质细胞反应性相关,这表明小胶质细胞在老年大脑的神经系统疾病中发挥着积极作用。
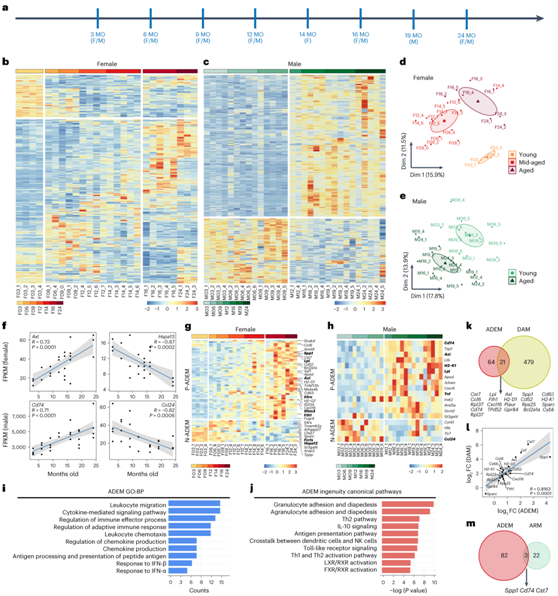
图1. 通过bulk RNA-seq 进行转录分析,以研究性别依赖性小胶质细胞衰老过程和 ADEM 基因集。
(a) 小胶质细胞bulk RNA-seq分析方案。(b-c) 雌性和雄性小鼠衰老过程中小胶质细胞 DEG 的热图。(d-e) 雌性和雄性小鼠衰老过程中小胶质细胞表型的 PCA 图。 (f) 散点图显示与衰老过程相关的代表性基因的线性回归。 (g-h) 雌性和雄性小鼠衰老过程中 ADEM 基因的热图。 (i) GO 注释的 ADEM 基因的前 10 个显著富集的 BP。 (j) IPA注释的前10个典型通路显著富集ADEM基因。(k) 维恩图显示了在ADEM和DAM基因集之间重叠的21个基因。 (l) 散点图显示ADEM和DAM基因集之间重叠基因的log2 FC的线性回归,揭示它们是正相关的。 (m) 维恩图显示 ADEM 和 ARM 基因集之间只有三个基因重叠。
02
单细胞分辨率雌性小鼠小胶质细胞衰老特征
为了在单细胞分辨率下剖析小胶质细胞如何衰老,他们对小胶质细胞进行了单细胞转录组分析(scRNA-seq)(图2a)。由于只有雌性小胶质细胞表现出逐步衰老过程,而雄性小胶质细胞没有表现出渐进过渡和中年阶段,因此后续的纵向分析(包括scRNA-seq和ATAC-seq)主要在雌性小鼠中进行,以更好地显示衰老过程。因此,他们共收集9976个小胶质细胞用于后续分析,其中幼年(3个月)4207个,中年(14个月)3272个,老年(24个月)2497个(图2b),基于无监督分类,他们将三个年龄的小胶质细胞分为17个聚类(C0-C16)(图2b)。幼年小胶质细胞主要位于C8、C11、C4、C10、C9、C3和C0。老年的小胶质细胞主要位于C14、C6、C16、C2、C15、C12和C7。相比之下,中年大脑的小胶质细胞主要分布在C13、C1和C5(图2b-c)。小胶质细胞稳态基因P2ry12、Tmem119、Cx3cr1、Cst3和Fcrls在所有小胶质细胞中都有表达,但它们在幼年聚类中高度富集(图2d)。相比之下,与神经炎症或疾病相关的基因Cd74、Ccl3、Il1b、Lpl、Cst7、Cybb、Axl、Spp1和Apoe在老年聚类中显著上调(图2d)。这些结果表明,小胶质细胞经历年龄依赖性改变,在衰老过程中从稳态转变为炎症或疾病程度更高的状态。
他们进一步使用伪时间分析来更好地可视化衰老轨迹的转录动态,确定了三个年龄主导分支,C0、C1和C2位于年龄动态转变的关键枢纽(图2e)。值得注意的是,他们发现大多数 ADEM 基因的伪时间表达与上调或下调趋势一致(图2f),证实 ADEM 基因可靠地代表了小胶质细胞衰老的核心特征。
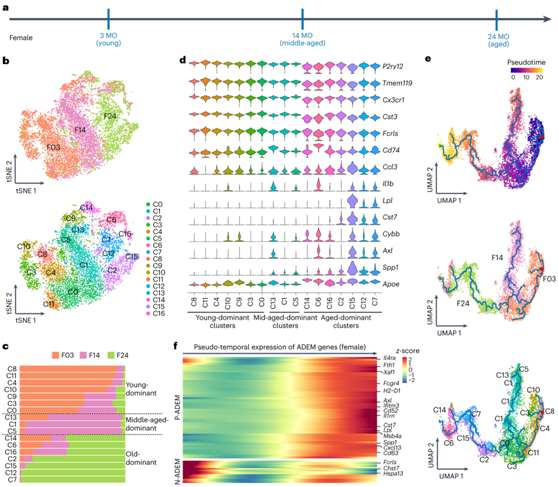
图2. 通过scRNA-seq分析小胶质细胞衰老的特征。
(a) 幼年(3 MO)、中年(14 MO)和老年(24 MO)雌性小鼠的小胶质细胞 scRNA-seq 方案。(b) 幼年(3 MO)、中年(14 MO)和老年(24 MO)小胶质细胞的 tSNE 图。(c) 三个年龄段小鼠细胞中的优势聚类。(d) 小提琴图显示了每个聚类中14个小胶质稳态相关基因和炎症相关基因的表达水平。(e) 三个年龄段小胶质细胞的伪时间轨迹。 (f) 热图显示与伪时间相关的ADEM基因的表达水平。
03
染色质景观揭示了 ADEM 基因的表观遗传调控
为了探索在整个生命周期中控制小胶质细胞转录动力学的潜在机制,他们通过转座酶可及的染色质测序(ATAC-seq)对幼年(3个月),中年(14个月)和老年(24个月)阶段的雌性小胶质细胞的染色质可及性进行分析(图3a)。
小胶质细胞中的峰主要富集在转录起始位点 (TSS) 周围 ±1 kb处,主要是在启动子区域,三个年龄段的基因调控区域的总体峰值分布相似。在幼年和中年小胶质细胞中发现的邻近区域内观察到 ATAC 峰的类似分布。衰老小胶质细胞中 ATAC 峰的数量有所增加(图3b),表明小胶质细胞可以在表观遗传水平上对衰老状态做出反应。此外,ADEM基因在不同年龄表现出不同的染色质可及性(图3c-d)。
转录因子(TF)是转录和表观遗传景观改变的关键决定因子。他们首先鉴定了 TF 的所有差异染色质结合位点,并观察到许多 TF 在衰老的小胶质细胞中表现出显著更高的活性(图3e)。他们确定了 50 个 TF 在三个年龄段的 ADEM 可及峰中显著富集,这些TF包括关键骨髓 TF(PU.1 和 IRF8)、IFN通路TF(IRF1, IRF2和IRF3)、CEBP家族成员(CEBPβ和CEBPε)和ETS家族成员(MEF2A和MEF2C)(图3f-g)。其中一些TF峰值计数随着小胶质细胞年龄的增长而逐渐上调,如Cebpb、Spi1(编码PU.1) 、Etv4、Junb、Irf1和Irf8(图3h)。相比之下,一些峰值计数逐渐下调,包括Mef2c、 Elf5、 Elf1、Cebp3、Mef2a.3和Mef2d(图3i)。尽管CEBPβ和MEF2C对总基因的结合活性均呈现出年龄依赖性增加的趋势,但CEBPβ和MEF2C对ADEM基因的结合活性分别增强和降低(图3j-k)。
CEBPβ在老年健康大脑和老年AD大脑中表达上调,小胶质细胞中的CEBPβ可以驱动促炎症和神经变性相关的基因程序。相比之下,MEF2C 活性与增强认知功能和赋予神经退行性恢复能力有关。
这些结果表明染色质可及性和 TF 结合活性负责在整个小胶质细胞生命周期中调节 ADEM 基因表达。因此,TF 诱导可能在整个小胶质细胞生命周期中充当 ADEM 基因动态的关键调节因子。
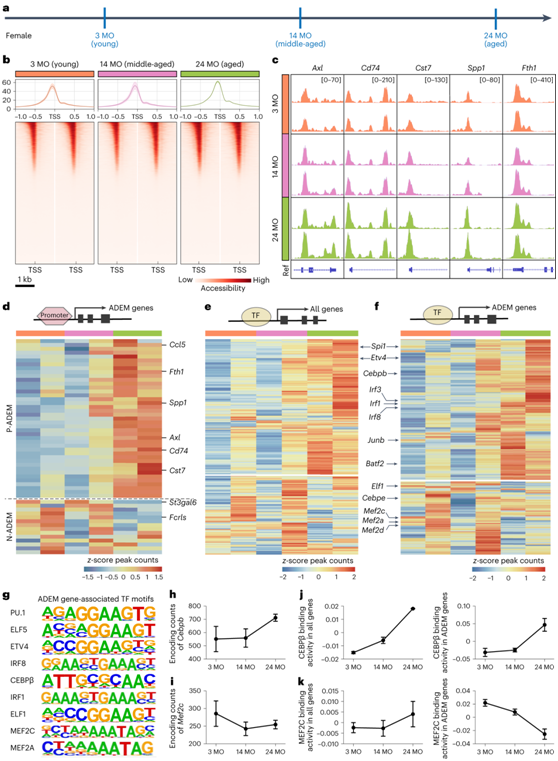
图3. ATAC-seq鉴定的染色质景观揭示了小胶质细胞在衰老过程中的表观遗传特征。
(a) 幼年(3MO)、中年(14MO)和老年(24MO)小鼠的小胶质细胞ATAC-seq方案。(b) ATAC 在三个年龄时在小胶质细胞的 TSS(−1 kb 至 1 kb)周围达到峰值。(c) 代表性基因组浏览器视图,显示Axl、Cd74、Cst7、Spp1和Fth1的 ATAC 峰。(d) ADEM 基因差异可及性染色质启动子区域的热图。 (e-f) 所有基因和 ADEM 基因的差异可及性TF 基序的热图。 (g) ADEM 基因相关 TF 基序的序列标识。(h-i) 折线图显示 TF 编码基因Cebpb(随年龄上调)和Mef2c(随年龄下调)的峰值计数。 (j-k) 折线图显示CEBPβ和MEF2C
与所有基因和ADEM基因的结合活性。
04
衰老的小胶质细胞对系统性脂多糖(LPS)刺激表现出受损的分子反应
接下来,他们用LPS或PBS处理幼龄(3个月)、中年(14个月)和老年(24个月)雌性小鼠(图4a)。scRNA-seq和bulk RNA-seq用于研究小胶质细胞对LPS的反应。scRNA-seq和bulk RNA-seq均显示,不同年龄的小胶质细胞对LPS刺激的反应存在差异(图4b-c)。基于无监督分类,他们将scRNA-seq数据中的小胶质细胞分为19个聚类(C0-C18)。在LPS处理组(C1、C2、C5-C7、C10和C13-C18),大多数聚类由相同年龄的细胞组成。有趣的是,C13-C16由LPS刺激后的所有三个年龄的细胞组成(图4b)。他们发现IFN信号激活相关基因(Ifitm1、Ifitm6和Ilr2)在C13-C16中高表达(图4d)。与IFN通路相关的基因(Il1β、Ifitm2、Ccl5、Ccl7、Ccl3、Ccl4、Ccl12、Ifi205和Il1rn)在C13-C16中富集,表明这些小胶质细胞亚群在不同年龄具有高度保守性,对LPS刺激表现出强烈的反应(图4d-e)。他们在 3 个月大时发现了 2435 个 DEG,而在 24 个月大时DEG数量减少到 1507 个(图4f)。他们将幼年小胶质细胞中的219和54个DEG分别注释为细胞因子和吞噬作用(图4g-h)。相比之下,衰老小胶质细胞中只有143个和39个基因在LPS刺激下表达差异(图4g-h)。
已有研究报道,LPS会诱导老年小鼠的过度神经炎症反应。他们首先分析了Myd88,它控制炎症因子的释放。虽然LPS显著增加了幼年和中年阶段的小胶质细胞Myd88水平,但它并没有诱导老年阶段Myd88的上调(图4i)。接下来,他们观察了一些与神经毒性相关的关键炎症介质,包括Il1b、Il6、和Tnf。在LPS刺激后,Il1b的表达显著上调(图4i)。然而,LPS并未诱导衰老小胶质细胞Tnf上调(图4i)。中年小胶质细胞比幼年小胶质细胞表现出更高的Il6和Tnf水平,而老年小胶质细胞的表达水平降低(图4i)。接下来,他们分析了 IFNγ 反应基因(Ccl5、S100a8、S100a9和Cxcl13)的小胶质细胞表达,这些基因在 IL-1β、TNFα 和 IL12 混合物诱导的脑组织中表现出年龄依赖性上调。
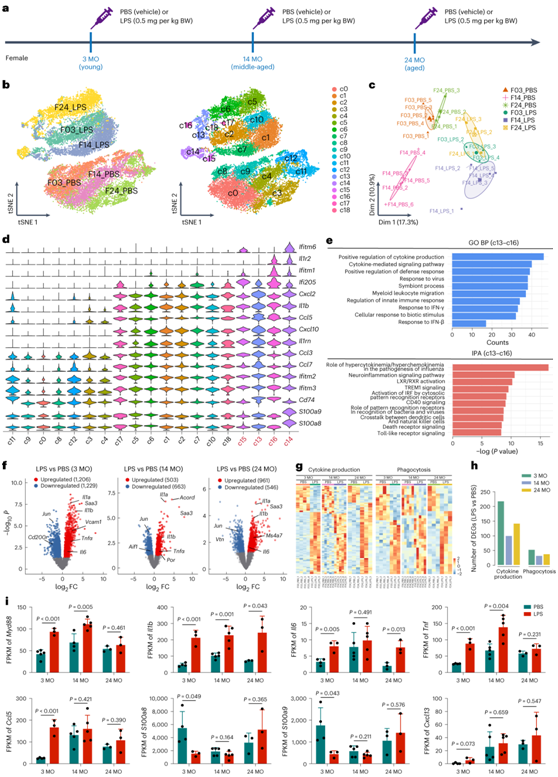
图4. scRNA-seq和bulk RNA-seq显示小胶质细胞以年龄依赖的方式响应LPS刺激。
(a) LPS和PBS的实验方案以及scRNA-seq和bulk RNA-seq的时间点。(b) scRNA-seq 的 tSNE 图显示幼年 (3 MO)、中年 (14 MO) 和老年 (24 MO) 小胶质细胞对 LPS 刺激的不同反应。 (c) bulk RNA-seq 的 PCA 图显示幼年、中年和老年小胶质细胞对 LPS 刺激的不同反应。 (d) 小提琴图显示Ifitm1、Ifitm6、Ilr2、Il1β、Ifitm2、Ccl5、Ccl7、Ccl3、Ccl4、Ccl12、Ifi205和Il1rn的表达水平,这些基因在c13-c16中富集。(e) c13-c16富集基因中GO和IPA注释的前10个显著BP (BP: 生物过程)。(f) 3个月、14个月和24个月龄时LPS刺激的小胶质细胞与PBS处理的对照的火山图。(g) 3 个月、14 个月和 24 个月时,LPS 刺激的小胶质细胞与 PBS 处理的对照的细胞因子产生和吞噬作用相关 DEG 的热图。 (h) 条形图显示细胞因子产生相关和吞噬作用相关基因的 DEG 数量。 (i) Myd88、Il1b、Il6、Tnf、Ccl5、S100a8、S100a9和Cxcl13的 FPKM 。
05
小胶质细胞在应对衰老和 LPS 刺激时表现出染色质景观的多样化变化
小胶质细胞在衰老的大脑中经历轻微且慢性的反应性反应,而 LPS 诱导的反应性是稳定且短暂的。为了进一步鉴别这两个过程之间的差异,他们检测了幼年、中年和老年阶段LPS和PBS刺激的小胶质细胞的表观遗传调节(图5a-b)。PCA结果表明,LPS刺激和衰老过程都会引起染色质修饰的显著改变,尽管LPS的影响更为明显(图5c)。在LPS刺激的小胶质细胞中,鉴定出44353个峰,并与基因组位点对齐。在3个月大时,LPS和PBS处理的小胶质细胞之间有2382个差异可及峰(DAP)。相比之下,在24个月和3个月大的小胶质细胞中仅鉴定出592个DAP(图5d)。此外,他们使用ChIPseeker annotatePeak对DAP的注释进行了检测。在LPS处理和PBS处理的小胶质细胞中发现的DAP主要位于第一个内含子(图5e-f)。相反,衰老调节了DAP,使得它们主要聚集在启动子区域周围(图5e)。
有趣的是,在不同年龄的LPS刺激的小胶质细胞中仅检测到少量染色质可及性(图5g),这表明不同年龄的LPS刺激时存在保守的表观遗传修饰。因此,这些结果表明衰老和炎症会诱导不同的染色质变化。
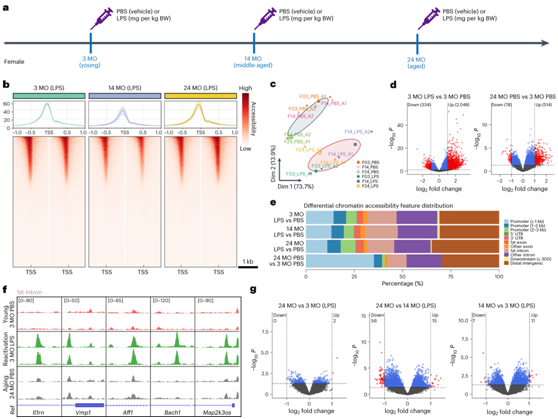
图5. ATAC-seq 揭示了小胶质细胞衰老和 LPS 刺激反应性之间染色质修饰的差异。
(a) LPS 和 PBS 实验方案以及 ATAC-seq 的时间点。(b) ATAC 在三个年龄时在 LPS 攻击的小胶质细胞的 TSS(-1 kb 至 1 kb)周围达到峰值。(c) PCA图显示不同年龄的小胶质细胞响应LPS刺激表现出不同的染色质修饰。(d) LPS 刺激后差异峰的火山图(3 MO LPS 与 3 MO PBS)和年龄相关变化(24 MO PBS 与 3 MO PBS),揭示了 LPS 刺激和衰老过程之间不同的染色质修饰。(e) 条形图显示基因编码和调控元件区域中差异峰的分布。(f) 代表性基因组视图,显示Il1rn、Vmp1、Aff1、Bach1和Map2k3os的 ATAC 峰。 (g) 不同年龄的LPS刺激的小胶质细胞的差异可及峰的火山图揭示了不同年龄的保守的表观遗传修饰。
06
三轮耗竭-再增殖 (3xDR)诱导的强制小胶质细胞更新加速小胶质细胞衰老
他们给雄性小鼠喂食 PLX5622 配制的饮食 14 天,以消耗大脑小胶质细胞,然后喂食对照饮食 (CD) 21 天以进行再增殖。为了确保小胶质细胞达到稳定状态,他们在第三轮耗竭-再增殖后将分析再延长14天,以使小胶质细胞完全恢复(图6a)。衰老导致端粒缩短,3xDR小胶质细胞的端粒长度也表现出类似的缩短趋势(图6b)。1xDR 小胶质细胞(又名重新增殖的小胶质细胞)显示出与幼稚小胶质细胞相似的形态、转录组谱和功能。相反,3xDR小胶质细胞的基因特征与CD处理的对照不同(图6c),3xDR小胶质细胞表现出较高的P-ADEM和较低的N-ADEM基因特征评分(图6d)。与此一致,3xDR小胶质细胞在LPS刺激下表现出与LPS刺激的衰老小胶质细胞相似的趋势(图6e),表明衰老样表型。共有545个基因出现差异表达,其中206个基因上调,包括涉及DAM的基因(Apoe、Axl、Spp1、Ms4a7和Vcam1)、免疫激活基因(Lyz2、Tspo、Il1b、Il10、Cst7、Ifi203、Ifitm3 )和Ifitm6)和 ROS 生产(Gsr和Prdx5)。相比之下,339 个基因发生下调,例如参与小胶质细胞稳态的基因(P2ry12、Klk8、Tmem119、Hexb、Sall1和Cx3cr1)和吞噬作用/吞噬体成熟(Mertk和Ctsf)(图6f)。
6 个月大的小鼠大脑中 3xDR 小胶质细胞失去了稳态,并表现出吞噬能力减弱。3xDR小胶质细胞主要位于老年小胶质细胞的近端,并且表现出比幼年和中年小胶质细胞更高的伪时间评分(图6g-h)。ARM基因集中仅包含5个3xDR DEG(图6i)。这些结果证实3xDR小胶质细胞不表现出LPS诱导的反应状态。另一方面,3xDR小胶质细胞表现为分枝较少,过程较简单,细胞体较大(图6j-l),表明衰老样状态。IPA鉴定了几种富集通路,包括糖皮质激素受体信号传导、IL-10信号传导、IL12和IL17a信号传导、NO和ROS产生、IFN诱导中的PKR、LXR和RXR激活以及NRF2介导的氧化应激反应(图6m)。接下来,他们将3xDR小胶质细胞的DEG与ADEM基因进行了比较,发现两者呈正相关(图6n),与3xDR小胶质细胞的衰老样表型相呼应。与衰老的小胶质细胞类似,他们发现3xDR小胶质细胞和DAM基因之间存在正相关(图6o),这表明与脑部疾病存在潜在关联。Spp1编码的OPN和AXL的免疫染色进一步证实了3xDR小胶质细胞的样衰老状态(图6p-q)。
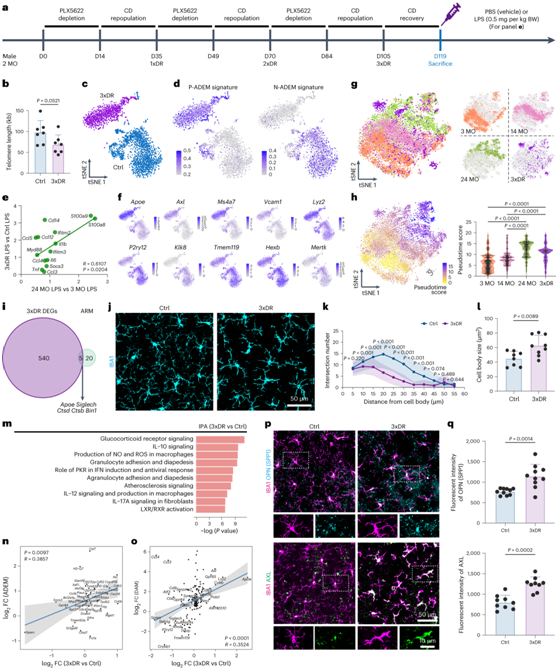
图6. 3xDR 小胶质细胞表现出衰老样表型。
(a) 3xDR 方案和实验时间点。 (b) 3xDR 缩短小胶质细胞端粒。 (c) 3xDR 小胶质细胞表现出与对照小鼠不同的转录特征。(d) 3xDR小胶质细胞表现出较高的P-ADEM和较低的N-ADEM基因特征得分。(e) 3xDR与对照小胶质细胞FC (qPCR)在衰老与幼年小胶质细胞FC (bulk RNA-seq)中表现出类似的趋势。(f) tSNE 图显示小胶质细胞激活相关和稳态相关基因的表达水平。(g) 3xDR小胶质细胞表现出与衰老小胶质细胞相似的表型。 (h) 3xDR 和 24 个月大的小胶质细胞表现出比 3 个月大和 14 个月大的小胶质细胞更高的伪时间值。(i) 3xDR DEG 和 ARM 基因集之间只有 5 个基因重叠。(j-l) 3xDR 小胶质细胞表现出独特的形态。 (m) 与 IPA 注释的对照小胶质细胞 DEG 相比,前 10 条显著富集的 3xDR 经典通路。 (n-o) 3xDR 与对照小胶质细胞 FC 与 ADEM 和 DAM 基因集呈正相关。(p-q) 代表性共焦图像显示 OPN 和 AXL 在 3xDR 小胶质细胞中上调。
07
小胶质细胞加速老化会抑制认知功能
接下来,他们通过 3xDR 建立了加速小胶质细胞衰老模型,首先进行新物体识别(NOR)来检测幼年(3个月大)、老年(22.5个月大)、3xDR和年龄匹配对照小鼠的识别记忆(图7a)。幼年小鼠和对照组小鼠在第三阶段花费更多时间探索新物体。相比之下,老年小鼠和 3xDR 小鼠均不会优先探索新物体(图7b)。其次,他们使用 Y 迷宫来评估空间工作记忆。尽管入臂时间没有变化,但正确交替和交替率在 3xDR 处理后均下降(图7c),表明其空间工作记忆的缺陷。然后,他们又采用Morris水迷宫评价空间长期记忆。尽管移动速度不变,但3xDR小鼠在训练阶段花费更多时间寻找平台,而在探测测试阶段花费更少时间在目标象限上(图7d )。NOR、Y 迷宫和Morris水迷宫测试的结果表明,3xDR 会导致学习和记忆的认知能力下降。因此,小胶质细胞的加速衰老直接抑制学习和记忆,表明小胶质细胞在认知功能中发挥着重要作用。
成人大脑中的髓鞘形成有助于空间记忆,因此,他们检测了大脑皮层中的髓磷脂碱性蛋白(MBP)。在 I-III 层中,3xDR 小鼠的 MBP 强度显著降低(图7e)。相反,皮质中少突胶质细胞前体细胞 (OPC) 的数量没有变化。
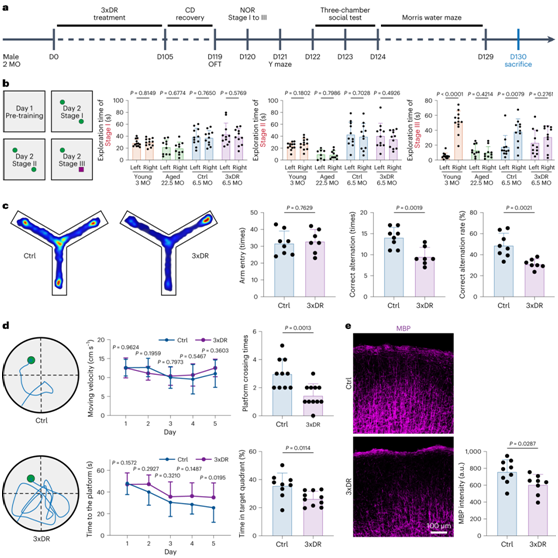
图7. 3xDR 导致非老年小鼠认知能力下降和髓鞘形成障碍。
(a) 3xDR 小鼠的实验方案。(b) NOR显示3xDR会导致识别记忆的认知能力下降,类似于老年小鼠的表型。(c) Y 迷宫揭示 3xDR 会导致空间学习认知能力下降。(d) 莫里斯水迷宫揭示3xDR导致空间学习认知能力下降。 (e) 皮质中 MBP 的代表性共焦图像以及对照和 3xDR 小鼠大脑中平均 MBP 表达的量化。
08
3xDR 诱导的小胶质细胞衰老影响细胞间相互作用
为了进一步表征衰老小胶质细胞对其他脑细胞的影响,他们以单细胞分辨率比较了 3xDR 和年龄匹配的对照大脑之间的转录组(图8a),在对照和 3xDR 大脑中鉴定出 16 种细胞类型(18 个群体)(图8b-c)。3xDR 小胶质细胞通过髓鞘形成减少来抑制认知功能,IPA 使成熟神经元中的髓鞘形成信号通路富集。他们通过 CellPhoneDB 在 3xDR 小鼠中鉴定出 60 种配体-受体相互作用的差异(图8d)。JAM2–JAM3、C5AR1–RPS19、TNF–DAG1 和 TNF–NOTCH1 信号通路与 OL 成熟和髓鞘形成相关。这些通路在对照大脑中富集,但在 3xDR 大脑中没有富集(图8d),表明老年样 3xDR 小胶质细胞的髓鞘形成支持减弱。
此外,他们通过 CellChat 确定了 42 种重要的传递者-接收者相互作用,其中 16 种在对照和 3xDR 之间存在差异(图8e)。这些分子间相互作用对于细胞存活、增殖、分化和吞噬作用至关重要。
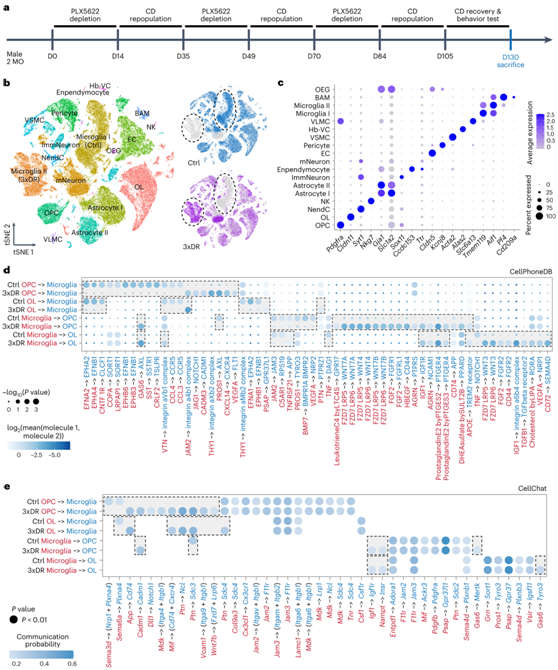
图8. scRNA-seq 表征了对照和 3xDR 大脑中小胶质细胞与 OPC 和 OL 的相互作用。
(a) 小胶质细胞转换模型方案及实验时间点。(b) tSNE图显示了3xDR小胶质细胞的衰老样表型。 (c) 点图显示所有 16 种细胞类型(18 个群体)中众所周知的代表性细胞类型富集标记基因的表达水平。 (d) CellPhoneDB 预测的显著配体-受体相互作用。(e) CellChat 预测的重要分子间相互作用。
+ + + + + + + + + + +
结 论
本项研究分析了 3 至 24 个月大小鼠小胶质细胞的转录和表观遗传图谱,首先发现了意想不到的性别差异,并确定了衰老过程中的ADEM基因。然后,在单细胞分辨率和表观遗传水平上比较了雌性小胶质细胞的衰老和反应性特征。为了分析衰老小胶质细胞的功能,排除其他衰老脑细胞的影响,本项研究建立了一种加速小胶质细胞衰老模型,而不直接影响其他脑细胞。通过这个模型,在非衰老大脑中实现了老年样小胶质细胞,并证实老年样小胶质细胞本身会导致认知能力下降。总的来说,本项研究为分析小胶质细胞的衰老过程提供了新的理论依据,揭示了小胶质细胞维持大脑功能分子特征。
+ + + + +



 English
English


