文献解读|Cancer Discov(28.2):结直肠癌类器官-基质生物库允许对个体化治疗反应进行亚型特异性评估
✦ +
+
论文ID
原名:Colorectal Cancer Organoid–Stroma Biobank Allows Subtype-Specific Assessment of Individualized Therapy Responses
译名:结直肠癌类器官-基质生物库允许对个体化治疗反应进行亚型特异性评估
期刊:Cancer Discovery
影响因子:28.2
发表时间:2023.10.05
DOI号:10.1158/2159-8290.CD-23-0050
背 景
在结直肠癌中,肿瘤微环境在预后和治疗效果中起着关键作用。患者来源的肿瘤类器官(PDTO)在临床前测试方面显示出巨大的潜力;然而,培养的肿瘤细胞失去了重要的特征,包括共有分子亚型(CMS)。
实验设计
结 果
01
结直肠癌类器官-基质生物库的开发
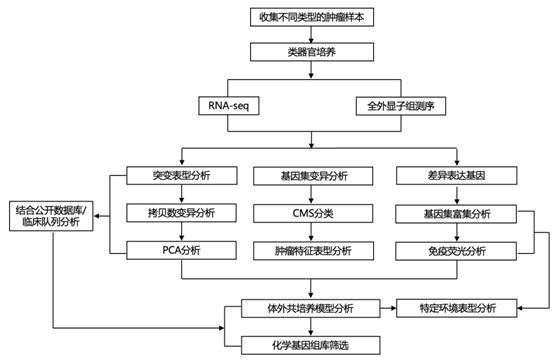
为了生成包含 PDTO 和 癌症相关成纤维细胞 (CAF)的结直肠癌类器官-基质生物库,研究者团队纳入了来自不同部位和疾病阶段的 30 个肿瘤并进行类器官培养,以反映结直肠癌的临床异质性(图 1A-B)。通过全外显子组测序 (WES) 与匹配的正常基因组 DNA 进行比较,鉴定了肿瘤和类器官中的体细胞变异,总突变计数显示 30 例中有 3 例出现超突变表型(图 1C)。一致性分析显示肿瘤和类器官之间有 大部分的重叠(图 1D)。与肿瘤组织 (13% ± 10%) 相比,类器官中的私人突变 (24% ± 1%) 更为丰富,表明缺乏正常基质的类器官的检测灵敏度更高。对反复突变的检测证实了已知驱动突变的存在(图1E)。高突变病例显示MSH3、MSH6和/或POLE的改变与BRAF、PIK3CA和FBXW7的突变同时发生,在类器官中存在拷贝数变异(CNV)(图1F)。
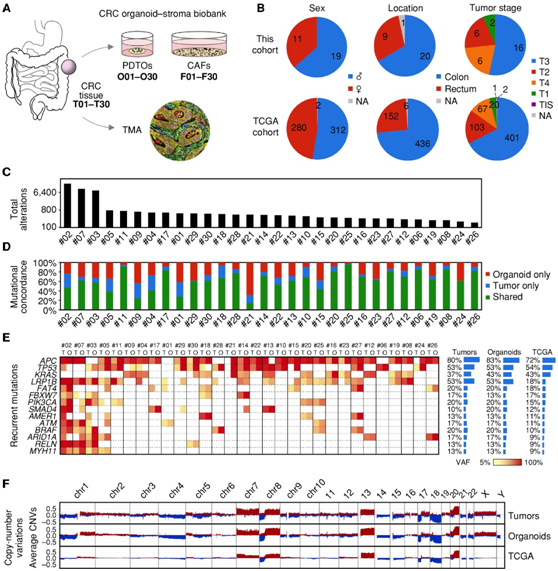
图1. 结直肠癌类器官-基质生物库的临床和遗传特征。
(a) 从原发性肿瘤 (T)、匹配的类器官 (O) 和成纤维细胞 (F) 收集的生物材料。 (b) 实验队列中临床参数的总结(另见补充表 S1)和公共数据(tcga) (c) T 和 O 中检测到的总改变。(d) 突变的一致性,个体突变在类器官中更为常见,这反映了在缺乏间质时检测灵敏度的提高。 (e) 癌症驱动基因的复发性突变(基于OncoKB)。变异等位基因频率(VAF)用颜色编码。该队列中的平均突变频率(右)反映了结直肠癌的公开数据。 (f) T、O和TCGA数据的平均拷贝数变化。
02
PDTO 在基质环境中重新表现出其原始分子亚型
为了评估如何在体外维持稳定的肿瘤特异性基因表达,他们对肿瘤组织、类器官和异种移植物进行转录组分析(RNA-seq)(图2A)。主成分分析(PCA)显示结直肠癌组织和相应的类器官之间存在明显的聚类,总体上更加同质(图 2B)。基因集变异分析(GSVA)显示,与原发肿瘤样本相比,类器官中基质和炎症特征下调,增殖和代谢基因上调(图2C)。
为了模拟基质影响,将类器官系统地异种移植到 NOD-scid IL2Rgamma null (NSG) 小鼠中。通过RNS-seq分析 13 个模型的肿瘤,然后对 mRNA 读数进行反卷积,以区分肿瘤(人类)和基质(小鼠)中的基因表达。在肿瘤区室中,异种移植增加了与临床组织的整体相似性(图2B),并部分恢复了PDTO中差异最大的基因特征(图2C)。
接下来,他们对所有样本的 CMS 进行分类。在肿瘤组织中,发现了所有亚型的典型代表(图2D)。与其他临床参数(性别、年龄、位置、既往抗肿瘤治疗、突变计数、CNV状态)相比,PCA 将 CMS 确定为最强的生物变异来源。大多数类器官归类为“混合或不确定亚型”(图2D),可能是由于基质对CMS的强烈影响,并且仅观察到与匹配肿瘤的16.6%的一致性(图2E)。异种移植后,CMS一致性增加到46.6%(图2D-E),10个模型中有8个模型恢复了CMS1/2/3肿瘤的准确亚型。PDTO 在标准培养条件下会失去其原始亚型,但它们可以在基质环境中部分恢复。
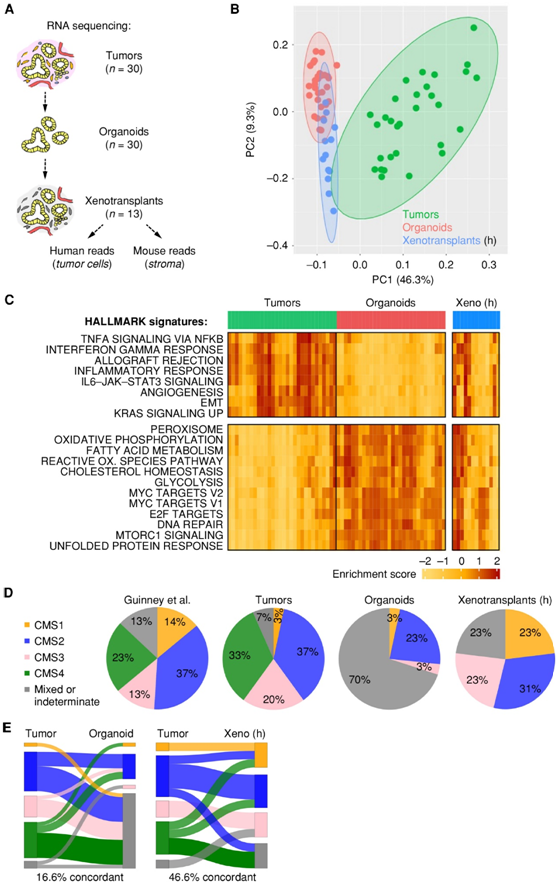
图2. 微环境背景对于转录组亚型的表现至关重要。
(a) 原发性肿瘤和类器官的匹配样本中的 RNA-seq策略示意图,以及 NSG 小鼠皮下 PDTO 移植后的策略。(b) PCA 显示肿瘤和类器官之间的转录组差异以及异种移植物中的部分正常化。(c) 单样本 GSVA分析。(d) 临床样本中的 CMS 分类和实验模型。(e) 桑基图显示肿瘤和类器官之间的弱重叠以及类器官异种移植的一致性增加。
03
TME 的癌细胞依赖性编程
为了探索癌细胞是否可以指示亚型特异性基质反应,他们检测了异种移植中的小鼠 mRNA 读数,比较了源自 CMS4 和 CMS2 的类器官,它们分别具有高和低 CAF 含量的特点。差异分析显示,CMS4衍生模型中成纤维细胞/肌肉基因(Myh1、Ttn和Ryr1)表达增加,CMS2衍生模型中炎症基因表达(Ccl6、Cd209f和Ifi27l2a)增加(图3A)。基因集富集分析 (GSEA)证实了在 CMS4 衍生模型中诱导成纤维细胞和 CMS4 特征并抑制炎症特征(图 3B-C),证明移植的 PDTO 诱导亚型特异性基质反应。CMS2和CMS4模型的自动图像分析和比较显示,CMS4肿瘤中α-SMA+/VIM+ CAF和平滑肌细胞的频率明显增加(图3D)。在 CMS2 肿瘤中,发现更高的肿瘤细胞百分比,导致肿瘤基质比率显著增加。相比之下,免疫细胞(CD45)的整体并没有发生显著改变。
与原始肿瘤相比,人E-钙粘蛋白(肿瘤细胞)和小鼠波形蛋白的免疫荧光分析显示出明显相似的组织学模式(图3E)。
图3. 类器官异种移植引起亚型特异性基质反应。
(a) NSG 小鼠中CMS2 衍生的和 CMS4 衍生的类器官异种移植后基质基因表达的差异分析。(b-c) CMS2 与 CMS4 肿瘤和相应的 PDTO 异种移植物中差异表达的 GSEA。研究了成纤维细胞和炎症的 MSigDB 特征和 CMS4 特征。(d) 匹配 TMA 的 TME 的多荧光分析。(e) TMA 的全细胞角蛋白和波形蛋白染色(上)以及匹配的 PDTO 异种移植后获得的肿瘤(下)的 E-钙粘蛋白和波形蛋白染色的组织学分析。
04
结直肠癌亚型测定的体外模型
接下来,他们检测了自体和异源CAF之间的差异。来自两个CMS2和两个CMS4肿瘤的荧光素酶/ gfp转基因类器官与匹配或不匹配的成纤维细胞在人工基底膜中结合。为了允许旁分泌信号,细胞在减少生长因子的培养基中培养(图4A)。然后,他们研究了对克隆数量(图4B)、类器官大小(图4C)和肿瘤细胞活力(荧光素酶活性)的影响(图4 d),类器官系之间的特征差异在很大程度上与 CAF 的来源无关。他们在Transwell共培养后评估类器官中的转录反应(图4E),他们观察到EMT 标记(LUM、SNAIL2、SPARC和VIM)的类器官特异性诱导,与 CAF 起源无关。转移CAF条件培养基后诱导较弱的反应(图4F),表明相互的信号传导活性。类器官的RNA-seq显示自体和异源共培养相似的整体转录组效应(图4G)。因此,CAF 本身的存在会引起整体的细胞和转录变化,这些变化在很大程度上是由肿瘤细胞的反应性决定的。CAF的RNA-seq表明,与自体或异源类器官共培养诱导了相似的基因表达模式(图4H),其特征在于干扰素和TGFβ信号传导(图4-J)。四种诱导基因(NPR3、IFI6、ID1和ANO1)的qPCR分析显示,共培养后CAF和匹配的正常成纤维细胞中表达相似,证明了肿瘤源信号的诱导作用(图4K)。然而,PDTO 条件培养基仅部分重现了连续共培养的效果,表明需要细胞与细胞直接接触和/或相互信号传导。
接下来,他们检测了 CAF 对 PDTO 表型的普遍影响。所有生物库模型的共培养导致类器官数量、大小和活力显著增加(图4L)。在各个品系之间,观察到与原始分子亚型不相关的深刻差异(图4M)。然后,他们探讨了体外培养环境的调节是否会影响亚型保真度。分别在常规PDTO培养下、生长因子减少后,或在与原发肿瘤组织进行额外的Transwell共培养后进行RNA-seq和GSVA(图4N)。在每种情况下,他们都关注CMS2和CMS4肿瘤模型之间的变化。该比较强调了原发性肿瘤组织中微环境诱导的基因表达(CMS4)和增殖相关特征(CMS2)的差异,这些差异在常规PDTO培养条件下基本上丢失(图4N)。相反,在生长因子减少和CAF共培养后观察到亚型特异性基因表达的逐步恢复,这通过MSigDB特征富集分数的整体相关性进一步证实(图4O)。
为了评估 CAF 是否也调节其他亚型,对错配修复缺陷 (dMMR) 和 CMS3模型进行了类似的比较。尽管减少的培养基具有一定效果,但CAF的存在并没有进一步提高dMMR和CMS3模型中的相似性(图4O),表明CMS4对共培养的选择性反应。由此产生的 CMS 和 CRIS 的总体一致性仅略有改善(图 4P)。总之,这些结果表明,个体结直肠癌特征的表现在很大程度上取决于培养环境,并且富含生长因子的培养基会扰乱亚型特异性表达。

图4. 共培养可恢复由肿瘤细胞区室决定的亚型特异性结直肠癌表型。
(a) 直接共培养:将荧光素酶转基因PDTO单细胞分散并与自体或异源CAF共包埋在人工基底膜中,然后在还原培养基中培养6天。(b-d) 交换实验表明,自体和异体CAFs对类器官数量、面积和活力的影响相当。 (e) Transwell共培养后肿瘤类器官中EMT基因的表达。(f) 从 CAF 转移条件培养基 (CM) 后肿瘤类器官 (O11) 中的 EMT 基因表达。 (g-h) Transwell共培养后类器官和 CAF的RNA-seq。PCA 图显示肿瘤类器官和 CAF 以类似的方式受到自体和异源共培养的影响。(i-J) Transwell 共培养后 CAF 的差异表达分析。 (K) 对 CAF 和匹配的正常成纤维细胞 (NAF) 中的基因表达进行 qPCR 分析。(L) 类器官/成纤维细胞共培养影响类器官数量、大小和活力。 (M) 表型与原始肿瘤亚型的Spearman相关性。 (N) CAF 诱导亚型特异性转录组特征。(O) MSigDB 特征 (GSEA) 与肿瘤的 Pearson 相关性。(P) 不同背景和匹配肿瘤中 PDTO 的 CMS 和结直肠癌固有亚型(CRIS)的一致性。
05
亚型特异性化疗反应的表现取决于 CAF
鉴于其转录组保真度的提高,他们推断类器官-基质共培养可以提供改进的临床前治疗模型。为了解决这个假设,他们开发了一个共培养药物测试平台。他们注意到,对 EGFR 抑制剂吉非替尼的敏感性与抗 EGFR 抗体西妥昔单抗的反应相关,很大程度上取决于肿瘤细胞密度。为了准确确定共培养物中肿瘤细胞的活力,将 Firefly 荧光素酶转基因类器官与 CAF 以 96 孔形式共同嵌入基质胶中(图5A)。CAF 对药物反应有显著影响,并且可能使 PDTO 更具耐药性或更敏感。自体和异源 CAF 的混合匹配实验表明,对治疗反应的影响是 PDTO 特异性的,而不是由 CAF 来源的分子亚型决定的(图 5B-C)。与类器官相比,CAF 通常表现出药物敏感性降低(图 5D)。
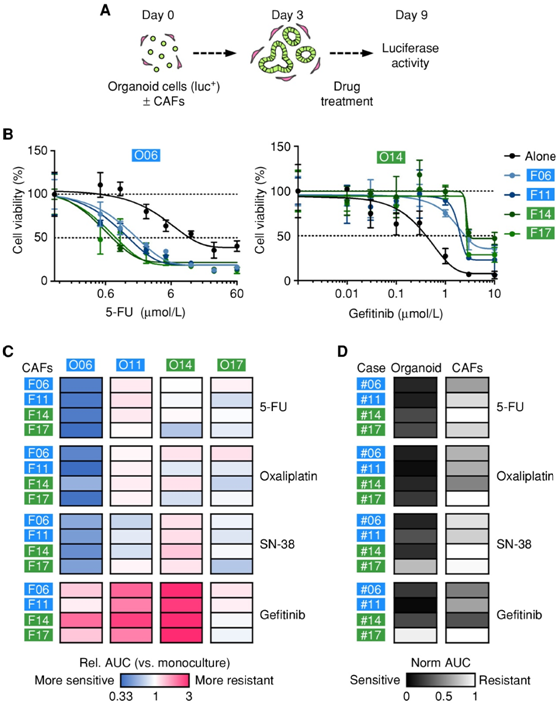
图5. CAF 对药物反应的影响取决于肿瘤细胞区室。
(a) 使用荧光素酶/GFP 转导的类器官进行共培养物药物测试的实验装置。(b-c) 代表性剂量反应曲线和药物敏感性热图。(d) 通过双荧光素酶表达检测不同药物对类器官和 CAF 的影响。
随后,所有生物库模型在存在和不存在CAF的情况下进行药物分型,通过归一化曲线下面积(AUC)确定了药物敏感性的异质性。尽管对5-FU、奥沙利铂和SN-38的剂量反应受到CAF的影响(图6A),CAF诱导对吉非替尼的普遍耐药。类器官面积与5-FU和奥沙利铂敏感性相关,与增殖肿瘤细胞的易感程度相关。相反,CAF对克隆数量的影响与化疗耐药相关(图6B-C)。相比之下,与cms2衍生的类器官相比,CMS4-共培养对SN-38和吉非替尼的抗性明显更高。对三种化疗药物的反应是相关的,反映了如前所述的普遍的药物敏感性和耐药表型(图6D)。然而,他们观察到,存在/不存在CAF时的药物敏感性差异在所有四种药物中显示出更强的相关性(图6E)。基于这一发现,他们为每位患者建立了CAF药物影响评分。与原始CMS相比,CAF诱导CMS2 pdto的药物致敏(图6F-G)。相比之下,CMS4 pdto对治疗性化合物的抗性更强。重要的是,当pdto在单一培养中处理时,没有观察到这种关联(图6H)。
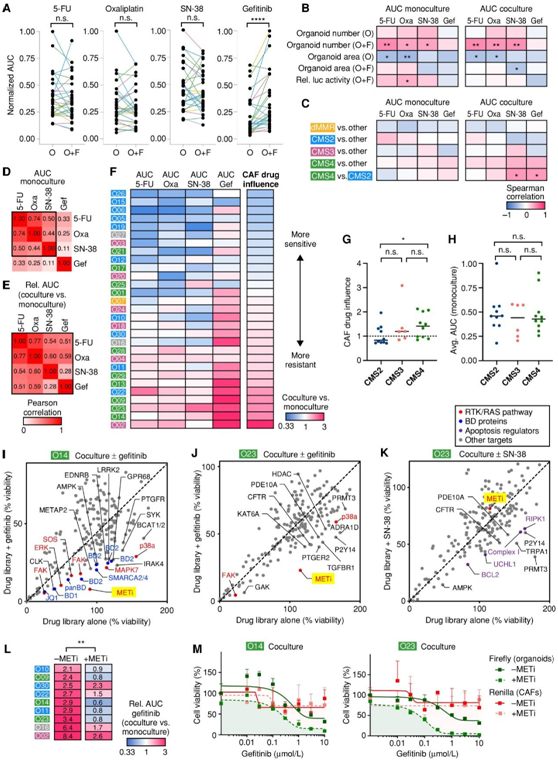
图6. 共培养导致亚型特异性治疗耐药性和个体化药物的脆弱性。
(a) 生物库中四种临床药物的药型分型。 (b-c) 药物反应与生长特征或原始肿瘤亚型之间的 Spearman 相关性。(d-e) 不同药物治疗之间的 Pearson 相关性。(f) 存在 CAF 时不同药物敏感性的热图。 (g-h) CAF 药物影响与单一培养物中平均 (Avg.) AUC之间的亚型比较。(I-K) 药理学筛选显示患者和治疗特异性的耐药机制。 (L) MET 抑制剂治疗可克服吉非替尼耐药性。热图显示了耐药共培养物中吉非替尼反应的差异。(M)共培养物中的双荧光素酶测定。
06
共培养物中的药物转录组学特征允许对结直肠癌进行预后分层
在存在或不存在 CAF 的情况下,计算肿瘤组织中的基因表达与相应 PDTO 中的药物反应之间的 Spearman 相关性(图 7A)。对于单一培养物和共培养物的平均 AUC,仅鉴定出一些显著的敏感性基因(图 7B)。随后,他们使用公开的基因表达队列(GSE39582、GSE39582)。个别药物的敏感性特征与风险比 (HR) 的改变无关。相比之下,基于 CAF 药物影响的敏感性基因的表达确定了无复发生存期(RFS) 显著改善的患者(图 7C-D)。相应的耐药特征确定了RFS明显恶化的患者(图7E-F),强调在类器官基质模型中进行药物测试,与单一培养相比,显示出更好的预后分层潜力。
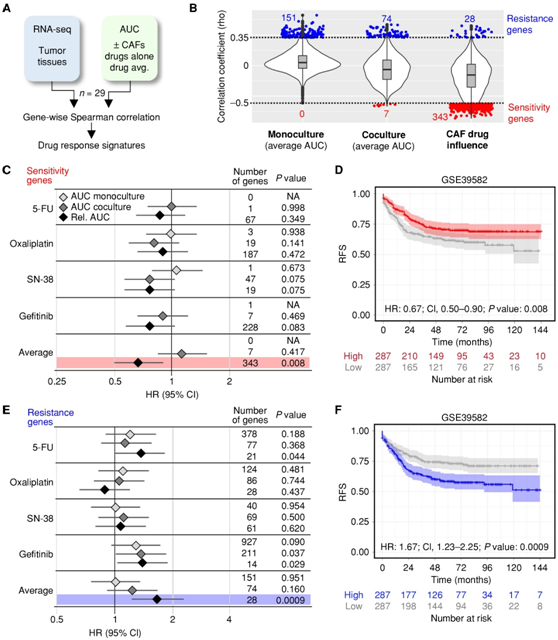
图7. 类器官-基质生物库中的药物反应与不同的结直肠癌患者的预后相关。
(a) 药物转录组学特征的鉴定策略。 (b) 小提琴图显示 Spearman 相关系数 (rho) 的转录组范围分布。 (c-d) 与药物敏感性相关的特征的预后价值。(e-f) 与耐药性相关的基因的预后价值。
+ + + + + + + + + + +
结 论
本项研究建立了来自 30 名患者的匹配 PDTO 和癌症相关成纤维细胞 (CAF) 的结直肠癌类器官-基质生物库。特定环境表型分析表明,异种移植或与 CAF 共培养可提高转录组保真度并诱导亚型特异性基质基因表达。此外,共培养中的功能分析揭示了 CMS4 对吉非替尼和 SN-38 的特异性治疗耐药性以及预后表达特征。化学基因组库筛选确定了患者和治疗依赖性基质抵抗机制,包括 MET 作为共同目标。这些结果表明,CAF 对于分子亚型和离体治疗反应的表型表示至关重要。
+ + + + +



 English
English


