文献解读|Cell Metab(29.0):猴下丘脑对肥胖和糖尿病的区域特异性转录组反应
✦ +
+
论文ID
原名:Region-specific transcriptomic responses to obesity and diabetes in macaque hypothalamus
译名:猴下丘脑对肥胖和糖尿病的区域特异性转录组反应
期刊:Cell Metabolism
影响因子:29.0
发表时间:2024.02.06
DOI号:10.1016/j.cmet.2024.01.003
背 景
肥胖(OB)和糖尿病(DB)的公共卫生负担仍然是一个重大挑战,在开发有效治疗方法方面取得的成功有限。下丘脑在肥胖和糖尿病的进展中起着至关重要的作用;然而,其结构复杂性和细胞异质性阻碍了靶向治疗。
实验设计
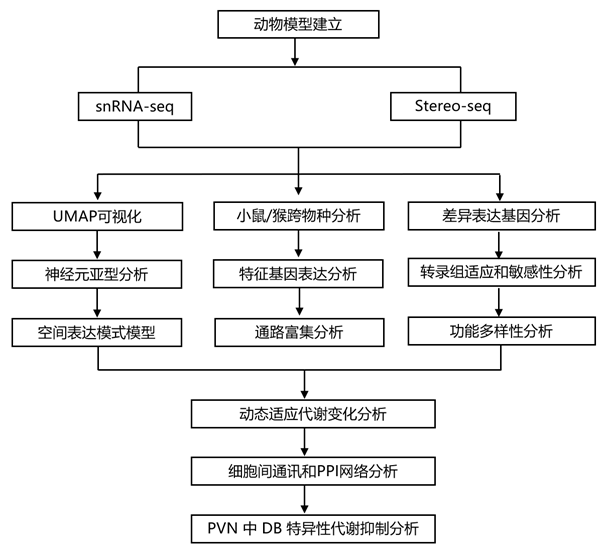
结 果
01
猴下丘脑的单细胞和空间解析转录组图谱
研究者团队在研究中使用了 8 只年龄为 16-18 岁的雄性成年食蟹猴(Macaca fasciculis),其中包括 3 只对照、3 只高脂饮食导致的肥胖和 2 只非肥胖的散发性 2 型糖尿病猴(图 1 A)。与对照组相比,肥胖猴的体重和血浆胆固醇水平显著升高,但空腹血糖正常。相比之下,糖尿病猴的体重没有差异,但它们的葡萄糖水平明显较高。他们对下丘脑样本进行了单细胞核转录组分析(snRNA-seq)和空间转录组测序(Stereo-seq)(图1A)。
根据关键神经递质或神经肽的表达,他们将神经元分为谷氨酸能、gaba能、组胺能和催产素能四种主要的神经元亚型。同样,使用已知的细胞类型特异性标记基因将非神经元细胞分为7种原代细胞类型(图1B)。许多细胞类型在不同的下丘脑区域具有特定的空间分布(图 1 C)。例如单胞细胞(TANY)在漏斗核(INF)中富集,而催产素神经元主要局限于室旁核(PVN)内。此外,室管膜细胞(Ependy)与心室边界对齐,能清楚地分别出第三脑室的轮廓。少突胶质细胞 (OLI) 在神经纤维轴突上形成绝缘鞘,在穹窿和视束等结构中富集(图 1 C)。
尽管对照组、肥胖组和糖尿病组的神经元细胞比例在很大程度上具有可比性,但他们仍然在非神经元细胞中观察到不同疾病状态下细胞组成的轻微变化,这突显了神经胶质细胞对能量中断的反应的易感性体内平衡(图1D)。
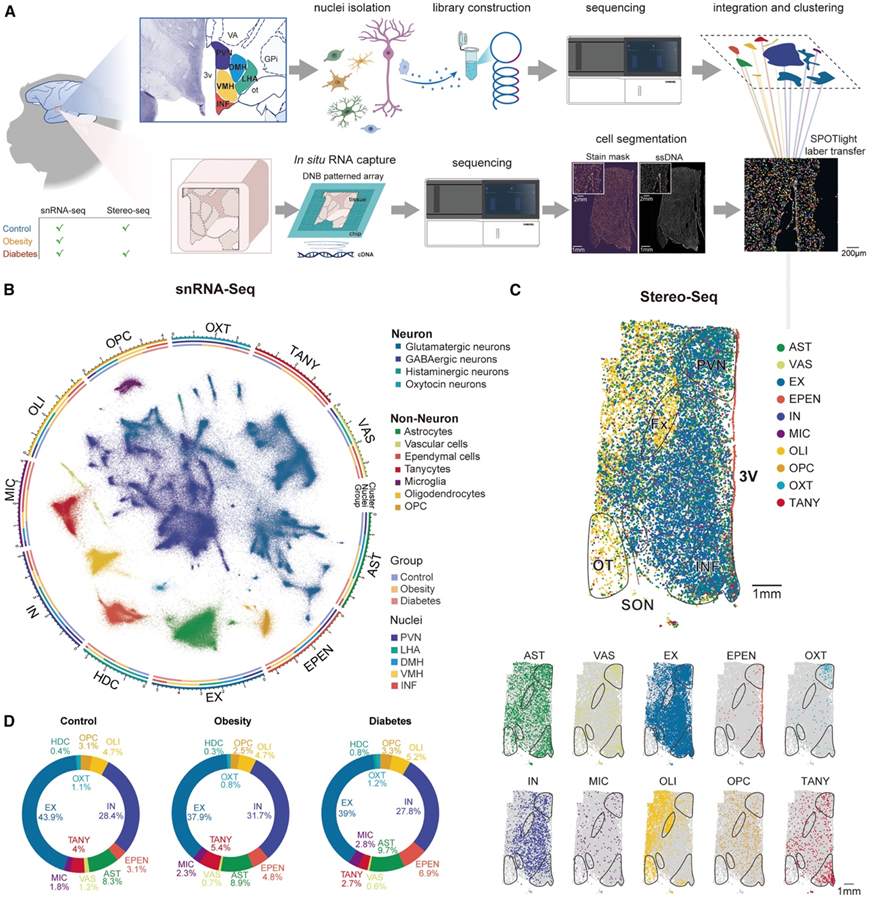
图1. 肥胖和糖尿病猴下丘脑结构snRNA-seq图谱。
(A) 显示了 snRNA-seq 和 Stereo-seq 的实验设计和流程。(B) UMAP 图(中)表示对来自 9 只猴 5 个下丘脑核的 465632 个细胞进行的无监督聚类分析。(C) 下丘脑切片中细胞类型的空间分布及其个体表示。(D) 列出了三个实验组中每种细胞类型的比例。
02
下丘脑神经元亚型的分类和空间组织
在对 332,130 个神经元进行无监督聚类后,他们观察到 48 个具有不同基因表达特征的亚聚类(图 2A)。这些亚聚类由 26 个兴奋性(谷氨酸能)和 19 个抑制性(GABA 能)神经元聚类组成,以SLC17A6和SLC32A1的显著表达为特征(图 2)。值得注意的是,以组胺(h44 和 h46)和催产素(o30)高表达为标志的三个神经元群明显与其他聚类分开,表明它们独特的神经调节信号通路。他们利用已知的神经肽、激素受体、转录因子来命名这些聚类,以及以前未鉴定过的新型标记基因(图 2 A)。
下丘脑包含许多解剖学上和功能上不同的结构和核。他们能够通过结合snRNA-seq的综合基因谱和Stereo-seq数据的空间协调细胞信息来揭示这种异质性,发现大多数神经元聚类,特别是那些表达神经肽的神经元聚类,显示出有限的离散位置(图2B-C)。例如,e9 (POMC/TBX3)的神经元主要来源于INF,而e12 (CRH/RNPC3)和o30 (OXT/PTGFR)的神经元主要来源于PVN(图2B-C)。与此一致的是,Stereo-seq数据显示,这些聚类显示的细胞核中具有明显的空间分布(图2C)。此外,主要标记基因如促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素释放激素(CRH)、前列腺素F受体(PTGFR)在各自下丘脑区域的空间表达也不同(图2D)。

图2. 下丘脑结构中的神经元分类及其对肥胖和糖尿病的反应。
(A) 神经元重新聚类。(B)UMAP可视化。(C) UMAP(上)和 Stereo-seq 切片(下)中所示的聚类的空间分布。(D) 聚类中标记基因的空间表达模式。
03
小鼠和猴的跨物种比较
为了比较小鼠和猴之间下丘脑细胞类型和聚类的转录差异,他们重新分析了 HypoMap4小鼠单细胞基因表达数据集,并使用 scVI 工具将其集成到本项研究的数据集中(图3A)。整合产生的数据集包含来自主要下丘脑区域的细胞类型,并显示出可辨别的聚类分离(图 3 B)。许多神经元聚类在小鼠和猴之间表现出密切的相关性,这表明这些神经元在跨物种代谢调节方面具有保守的功能。这些聚类及其遗传标记的表达在集成均匀流形近似和投影 (UMAP) 中也高度重叠(图3C)。例如,来自INF的针刺相关肽(AGRP)聚类和来自PVN的精氨酸抗利尿素(AVP)聚类在小鼠和猴之间的UMAP中显示出重叠模式(图3C)。然而,尽管有这些相似之处,CRH、神经紧张素(NTS)和催产素(OXT)的聚类及其标记基因表达在UMAP中显示出离散的位置(图3D)。此外,在小鼠中,将CRH聚类鉴定为gaba能聚类,但在猴中,却是谷氨酸能(SLC17A6)而不是gaba能标记物(SLC32A1和GAD1)的表达占优势(图3E),表明可能存在来自不同下丘脑核的不同CRH群体。
值得注意的是,他们发现除了神经元外,NTS在猴的室管膜细胞中也有显著的表达,而在小鼠中,NTS主要只在神经元中表达(图3D)。然而,这三种类型的NTS受体并没有表现出这种物种差异的表达(图3E)。来自人类大脑的Stereo-seq和Allen Brain Atlas的原位杂交进一步证实了NTS在小鼠和灵长类动物之间的异位存在(图3F-G)。
因此,NTS在室管膜细胞中的显著表达可能促进该神经肽在脑内的旁分泌和传递,可能发挥特定的生理作用,特别是在灵长类动物中。

图3. 小鼠与猴的跨物种比较。
(A) 集成数据集以进行跨物种分析的工作流程示意图。(B) UMAP 图中显示的小鼠和猴数据集的重新聚类。(C) UMAP 图中显示小鼠和猴中AGRP和AVP聚类的密度和空间位置。 (D) UMAP 图中按物种划分的神经肽表达谱。(E) 点图显示了小鼠和猴中特定CRH 亚聚类标记物(左)和 NTS 受体(右)的表达水平。(F) 立体序列分析揭示了室管膜细胞的空间分布(上)和NTS基因表达水平(下)。(G)通过原位杂交在从 Allen Brain Atlas 获得的小鼠(上)和人(下)的冠状脑切片中表达NTS 。
04
INF和PVN神经元对OB和DB的转录组敏感性
发现 OB 和 DB 都会引起下丘脑转录组的显著变化,正如 2000 多个差异表达基因 (DEG) 所证明的那样。值得注意的是,与 OB 相比,DB 诱导的 DEG 数量要多得多,其中 58% 的 DEG 是由 DB 独特诱导的,而只有 8% 是 OB 特异性的(图 4 A)。这些 DEG 在聚类和空间区域之间差异很大(图4B-D)。主要在INF中观察到OB反应的转录组变化,特别是在i23 (AGRP)、i40 (GHRH)、e9 (POMC)、i26 (GALP)和e33 (KISS1)中。相反,除了INF,在PVN中也发现了对DB有反应的deg,包括e39 (AVP)、e37(神经肽Y [NPY])、 e12 (CRH)和o30 (OXT)。此外,基因集富集分析(GSEA)显示,OB和DB改变的分子通路在下丘脑神经元中存在差异,INF和PVN之间具有高度的空间异质性(图4E)。
具体而言,OB抑制了PVN中参与神经突起生长和神经投射的deg,并减少了INF中的神经信号传递级联,可能表明PVN和INF之间的神经元连接和通信减少。相反,DB促进了INF中参与免疫反应的基因,但抑制了PVN主要聚类中ATP代谢过程相关通路中的基因,表明INF中炎症反应增加,PVN中细胞代谢减少。总之,这些发现表明下丘脑对OB和DB都高度敏感,特别是INF,这与它在脂质和葡萄糖代谢中的重要调节作用相对应。
INF 中的AGRP (i23) 和POMC (e9) 聚类是众所周知的神经群体,它们以相反的方式发挥作用来调节食欲和能量代谢。这些聚类在 OB 和 DB 中也表现出最多的 DEG(图 4 B)虽然AGRP和POMC都在INF中富集,但AGRP的表达位置相对于POMC略偏中间(图4F)。这些神经元共同表达重要的代谢调节因子,如NPY、瘦素受体(LEPR)和胰岛素受体(INSR)(图4G),它们对代谢调节至关重要。有趣的是,几种食欲调节基因,包括NPY、AGRP、necdin (NDN)和5 -羟色胺受体c型(HTR2C),在小鼠和猴之间的AGRP聚类中表现出差异表达(图4H)。这表明这些基因对不同物种之间代谢的调节影响程度不同。
在AGRP聚类中的deg中,OB和DB均导致AGRP、NPY和生长抑素(SST)等摄氧神经肽的显著减少(图4I)。与AGRP聚类相反,POMC神经元的异质性较高,根据POMC和LEPR独特的表达模式,可以客观地将其分为三个亚聚类,即POMClow、POMC highLEPR high和POMC high LEPR low(图 4J-K)。与小鼠数据相比,这种异质性在物种间存在,且具有不同的分子特征(图4L)。有趣的是,表达高水平POMC的亚聚类主要是谷氨酸能的,而pomClow神经元主要是gaba能的(图4K)。同时,两个代谢相关基因LEPR和HTR2C在POMClow亚类中反向表达,可能对应着分别感知瘦素和血清素的群体。因此,这些不同的POMC神经元群体对代谢变化表现出明显的敏感性,其中POMClow亚类显示出最多的deg,在较小程度上,LEPR富集的神经元(图4M-N)。这些数据表明,与POMC本身相比,LEPR可能在POMC表达神经元的能量稳态中发挥更重要的作用。
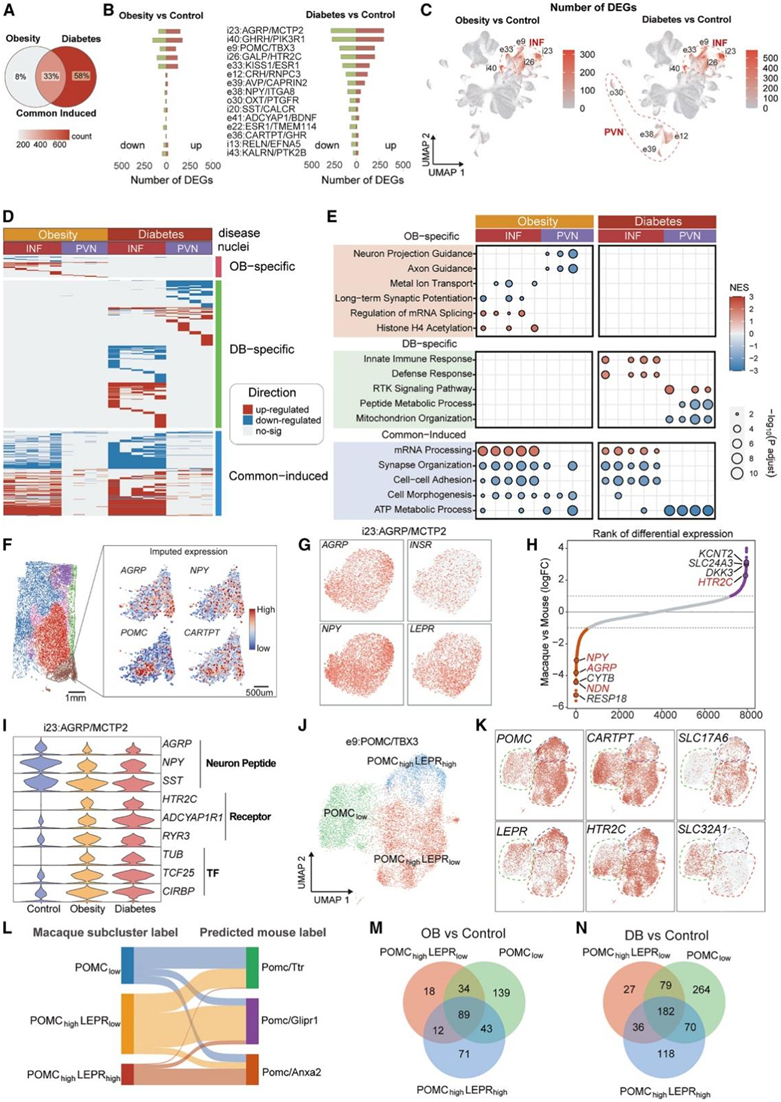
图4. 下丘脑神经元对肥胖和糖尿病的反应。
(A) 维恩图显示肥胖组和糖尿病组之间差异表达基因 (DEG) 的百分比。(B) 前 15 个富含 DEG 的神经元聚类中上调(红色条)和下调(绿色条)基因的数量。(C) UMAP 图显示了与对照组相比,肥胖组(左)和糖尿病组(右)神经元聚类中 DEG 的数量和分布。(D) 热图中DEG的分布。(E) 点图显示与指定组和聚类中的 DEG 相关的通路。(F) 所选基因的空间分布。(G) UMAP 图显示AGRP聚类中的基因表达特征。(H) 等级图,显示猴和小鼠之间基因的表达。(I) 小提琴图,说明AGRP聚类每组中选定基因的表达。(J) POMC聚类的重新聚类导致 UMAP 图中显示了三个亚聚类。(K) UMAP 图显示POMC聚类中的基因表达特征。(L) 桑基图,显示猴特征和预测小鼠特征之间POMC亚聚类的映射。(M-N) 维恩图,说明三个POMC亚聚类之间对肥胖和糖尿病的 DEG 重叠。
05
下丘脑非神经元的分子和功能多样性
参与代谢控制的下丘脑神经元亚群的功能相互作用受到下丘脑内不同非神经元细胞的影响。他们分析了 133502 个非神经元细胞,并确定了 8 种注释良好的细胞类型,这些细胞类型进一步分为 15 个亚聚类(图 5 A),鉴定出两种转录分离的成纤维细胞,根据其差异表达的遗传标记(例如LAMA2和SLC4A4)和生物通路的富集,它们可能具有不同的起源(图5B)。两个成纤维细胞亚群显示出不同的溶质载体基因表达模式(图5C),表明它们在小分子运输中具有不同的功能。
越来越多的证据表明,下丘脑非神经元参与代谢性疾病的发展。他们发现这些非神经元细胞对代谢变化的反应不同,取决于疾病状态、细胞类型和亚聚类,尤其是小胶质细胞(MIC)和TANY,它们在OB和DB期间表现出最多的deg(图5D-E)。
脑室壁容纳两种亚型TANY,即α-亚型和β-亚型,根据它们的背腹侧位置进行分类。通过先前定义的遗传标记,他们能够检测到两个亚型之间明显的转录组分离(图5F)。Stereo-seq进一步揭示了α-和β-亚型沿第三脑室自上而下的独特分布(图5G)。尽管TANY亚型在物种间表现出很强的相关性,但一些细胞类型特异性基因,如小鼠中的CRYM、COL25A1和SCN7A,在猴中的α-和β-亚型之间没有差异表达。GO分析显示,DB导致DNA损伤反应升高,凋亡信号传导增加,这可能导致TANY聚类的大小减小(图5H)。
他们确定了 MIC 的两个子集:Micro-1,主要表达稳态标记基因;Micro-2,主要表达与巨噬细胞激活功能相关的基因,例如HLA-DPB1、CD4、DPYD和CD74(图5I)。趣的是,尽管 Micro-2 仅占总 MIC 的一小部分,但与 Micro-1 相比,该激活群体在 DB 中升高,并且表现出更高数量的 DEG(图 5J-K)。值得注意的是,他们观察到与对照组相比,糖尿病猴中 Micro-2 从第三脑室向实质的空间漂移(图5L-M)。鉴于 MIC 在下丘脑免疫中的关键作用,DB 诱导的小胶质细胞激活和迁移可能会相互改变参与全身代谢调节的神经元的功能。
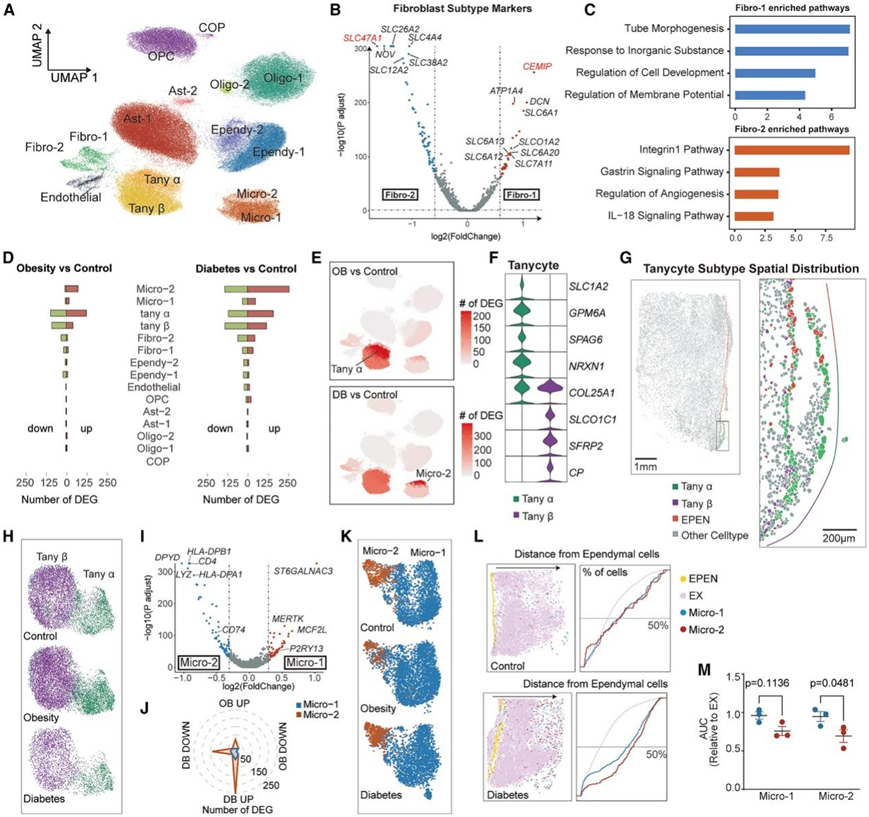
图5. 下丘脑非神经元在分子和功能水平上的多样性。
(A) 重新聚类非神经元的 UMAP 图。(B) 火山图显示成纤维细胞亚型中标记基因的表达谱。(C) 在 Fibro-1 和 Fibro-2 亚聚类中的富集的通路。(D) 非神经元聚类中上调(红条)和下调(绿条)基因的数量。(E) UMAP 图显示了与对照组相比,非神经元聚类中肥胖(上)和糖尿病(下)组中 DEG 的数量和分布。(F) 小提琴图显示单细胞亚型中遗传标记的表达谱。(G) tanycyte 亚型和室管膜细胞的空间分布。(H) 按组划分的单细胞亚聚类的 UMAP 图。 (I) 小胶质细胞亚型 1 和 2 之间 DEG 的火山图。(J)雷达图显示小胶质细胞中肥胖(OB)和糖尿病(DB)诱导的DEG上调和下调的数量。(K)小胶质细胞亚聚类的UMAP图。(L) 左:根据 Stereo-seq 得出的对照组和糖尿病组之间室管膜细胞、谷氨酸能神经元 (EX)、Micro-1 和 Micro-2 的空间分布。右:根据距室管膜细胞的距离绘制的细胞百分比。(M) 曲线下面积(AUC)。
06
INF 中通过 OB 和 DB 的交互式动态调整
MIC 和 TANY 对能量代谢的显著作用是通过它们与神经元的相互作用发生的。他们观察到 MIC、TANY 和 INF 中的神经元形成了复杂的连接,这些连接可以动态适应代谢变化(图 6 A)。代谢疾病期间具有高转录变异的神经元聚类表现出与 TANY 的牢固结合,这与它们在控制神经肽分泌以及血液和下丘脑细胞外液之间的营养交换中的作用一致。相反,MIC 与 INF 中其他细胞类型的连接较少,但在 OB 和 DB 期间,它们与神经元、TANY 和 MIC 本身的连接显著增加(图6 A-B),增强了局部细胞间通讯。
在 DB 期间,他们观察到 TANY 中 DNA 损伤和自噬增加(图 6 C),这可能导致细胞死亡,特别是 β TANY 中。这种细胞死亡可能会导致血脑屏障受损,导致暴露于高水平的有毒血源性分子,例如葡萄糖和脂肪酸,从而在中枢神经系统中形成不健康的炎症环境。伪时间分析揭示了激活的 MIC (Micro-2) 沿着预测的伪时间进程清晰分离。对照组的 MIC 主要处于非常早期的伪时间阶段,而 OB 和 DB 组的 MIC 则出现在中晚期伪时间阶段,表明疾病阶段特异性激活(图 6D)。DB 组的 MIC 分布在伪时间后期,显示出与动态免疫反应高度相关的基因的高表达,例如干扰素和 Toll 样受体信号通路相关的基因(图6 E)。
NicheNet分析显示MIC中白细胞介素-18 (IL-18)对神经元中干扰素相关信号的强烈输入(图6F)。数据显示,DB显著上调四个神经元聚类中的干扰素信号,包括AGRP和POMC群体,以及α TANY和激活的MIC(图6G-H)。这导致INF内的协调免疫反应,涉及各种细胞类型并激活一系列免疫信号分子,如ifi、irf、STAT和mx家族(图6I)。值得注意的是,TANY通过Reticulon 4 (RTN4)神经突生长调节剂与神经元中的STAT和MTOR信号通路建立了紧密的联系(图6F)。这些研究结果表明,DB引起的TANY门损伤可能促进了分子的交换,包括瘦素和葡萄糖,从而增强了TANY与神经元的相互作用,导致代谢调节神经元的STAT激活和MTOR抑制。

图6. INF 中细胞间网络因肥胖和糖尿病而重新编程。
(A) INF 聚类之间预测的通讯网络。 (B)细胞间通信网络概述。(C)糖尿病诱导的上调通路,按显著性排序。(D) Micro-2 聚类中对照组、肥胖组和糖尿病组的伪时间轨迹。(E) Micro-2 聚类中跨伪时间的基因表达模式和相关通路。(F) 圆形图显示了在小胶质细胞(黄色)、单胞细胞(绿色)或两种细胞类型(蓝色)中主要表达的配体与糖尿病诱导的相关神经元靶基因(红色)之间的预测相互作用联系。(G) 热图显示 INF 神经元中免疫和突触通路的标准化富集评分 (NES)。(H) INF 聚类中干扰素信号通路的富集。(I)干扰素信号传导的蛋白质-蛋白质相互作用(PPI)网络。
07
在PVN中db特异性代谢抑制
PVN 是自主神经和神经内分泌调节摄食、胰岛素敏感性和葡萄糖代谢的中枢。值得注意的是,DB下调了PVN中涉及细胞能量代谢、肽翻译和轴突重组的通路。此外,在e38 (NPY)和e39 (AVP)聚类中,与长期抑郁和NPAS4(一种加强兴奋性神经元抑制性输入的基因)相关的通路上调(图S7A-D)。GSEA显示,所有四个PVN神经元聚类的ATP代谢过程都明显减少(图S7E),这共同表明DB期间PVN的神经元活性和细胞代谢受到抑制。具体来说,DB组中涉及氨基酸、葡萄糖和脂肪酸代谢的通路显著下调(图S7F-G)。已知过量的葡萄糖会增加糖酵解和细胞ATP的产生并激活PVN中的神经元(图S7I)。然而,与糖酵解、三羧酸循环和线粒体ATP产生相关的基因和通路显著减少(图7A-7C),这意味着细胞葡萄糖代谢发生破坏。此外,DB组PVN聚类的两个标记基因OXT和AVP的表达明显降低(图7D)。Stereo-seq分析证实,与相同脑切片的SON相比,DB组PVN中OXT表达显著降低(图7E)。此外,在死后的人类下丘脑中,与匹配的对照组相比,2型DB患者PVN中的OXT神经元的免疫反应性显著降低(图7F-G)。
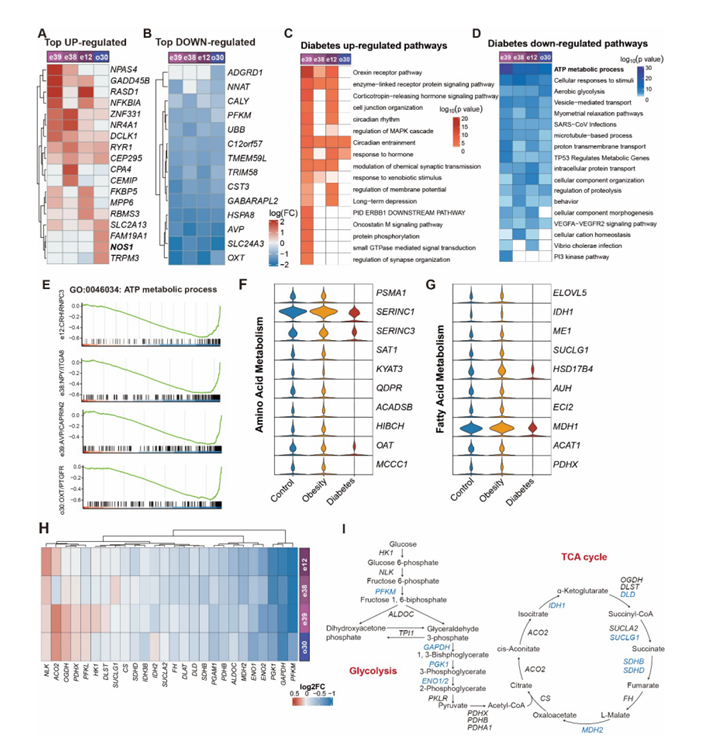
图S7. 糖尿病中PVN神经元的转录适应。
(A-B)热图显示糖尿病引起的PVN神经元deg变化。(C-D)显示糖尿病上调和下调通路的热图。(E)四个PVN神经元亚聚类ATP代谢过程通路的GSEA图。(F)代谢通路分析显示参与糖酵解和TCA循环的关键酶。(G)小提琴图显示参与氨基酸和脂肪酸代谢的基因表达。(H)糖尿病诱导糖代谢相关基因在PVN 4个神经元亚聚类中的表达变化热图。(I)糖酵解和TCA通路示意图。
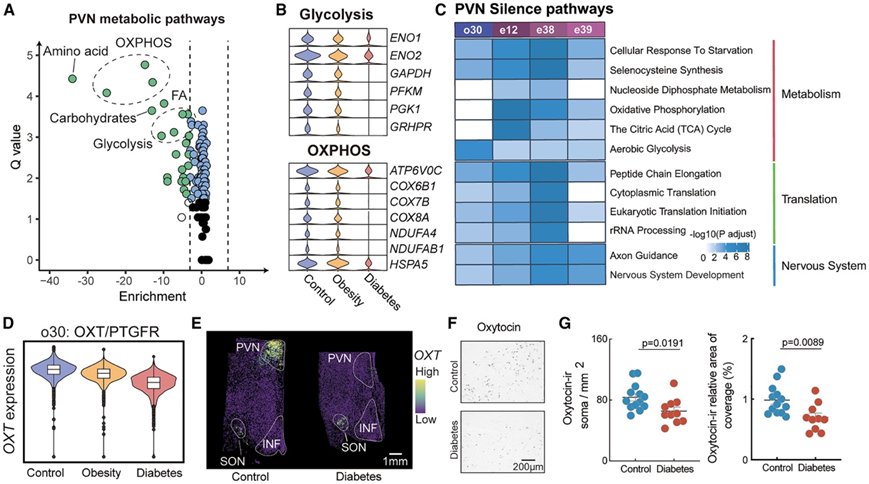
图7. PVN在对糖尿病的反应中保持代谢沉默。
(A) 根据通路富集评分绘制的单细胞通路分析 (SCPA) 的 Q 值,评估为与对照相比的平均通路变化,如火山图所示。(B) 小提琴图显示了对照组、肥胖组和糖尿病组中参与糖酵解和氧化磷酸化 (OXPHOS) 的关键基因的表达。(C) PVN 神经元亚聚类中富集通路的热图。(D)三组中 o30:OXT/PTGFR 聚类中OXT的表达如小提琴图所示。 (E)显示了对照猴和糖尿病猴的 Stereo-seq 的OXT表达的空间分布。(F)对照组和糖尿病患者 PVN 中OXT的免疫反应性。(G) 对照组和糖尿病患者中 PVN OXT统计结果的大小和相对覆盖面积。
+ + + + + + + + + + +
结 论
本项研究分析了肥胖和散发性 2 型糖尿病猴下丘脑的单细胞和空间转录组,揭示了灵长类特异性聚类和基因的分布,以及空间区域、细胞类型和基因特征的特异性变化。INF和PVN最容易受到代谢紊乱的影响,其中 PVN 对糖尿病更敏感。在INF中,肥胖导致突触可塑性和能量感知能力降低,而糖尿病涉及与受损的长细胞屏障、激活的小胶质细胞和神经元炎症反应相关的分子重编程。在糖尿病猴的 PVN 中,细胞代谢和神经活动受到抑制。本项研究结果提供了与肥胖和糖尿病相关的分子变化的全面视图。
+ + + + +



 English
English


