文献解读|Cell Rep(9.995):通过单细胞分析了解人骨髓浆细胞成熟和存活途径的异质性
原名:Understanding heterogeneity of human bone marrow plasma cell maturation and survival pathways by single-cell analyses
译名:通过单细胞分析了解人骨髓浆细胞成熟和存活途径的异质性
期刊:Cell Reports
影响因子:9.995
发表时间:2023.6.23
DOI号:10.1016/j.celrep.2023.112682
背 景
人骨髓(BM)浆细胞是异质的,包括早期抗体分泌细胞 (ASC) 和长寿的浆细胞(LLPC),其特征和成熟分化途径在很大程度上是未知的。
实验设计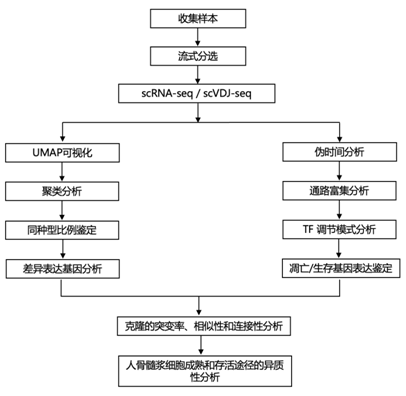
结 果01

BM 中人浆细胞的单细胞转录组分析
为了表征人骨髓浆细胞 (BMPC) 的异质性,研究者团队从5名近期未接种疫苗或未感染的健康成年人中分离出3个主要细胞群:pop A (CD19+CD38hiCD138−), pop B (CD19+CD38hiCD138+), and pop D (CD19−CD38hiCD138+)(图1A)。他们接下来进行了单细胞RNA测序(scRNA-seq)和单细胞V(D)J库测序(scVDJ-seq) 来表征BM ASCs。在排除非ASC污染细胞(包括B细胞)、低质量细胞、垂死细胞和双细胞后,剩余细胞鉴定为真正的ASC,其特征表达为XBP1、IRF4、PRDM1、CD27、CD138和CD19(图1B),根据基因表达谱确定了代表不同细胞状态或类型的 15 个聚类(图1C-E)。再根据人类白细胞抗原 (HLA) I类和II类的表达,这15个不同的类群可分为早期(聚类c1-3)、过渡性或中期(聚类c4)和晚期(聚类c5-8)ASC(图1F)。此外,他们确定了两个干扰素(IFN)反应为主的聚类 (c9-c10); 3个以IgM为主的聚类 (c13-15) 包含大多数BM IgM ASC(图1G)。最后,他们发现了一个线粒体-high聚类 (c11),具有早期ASC的特征,还有一个较小的聚类(c12),可能代表垂死的ASC。差异表达的标记基因用于判断每个聚类(表1)。
编码BLIMP1 的 PRDM1从早期 ASC 阶段开始表达,BLIMP1 驱动浆细胞 (PC) 定向并消除 II 类反式激活因子CIITA和 主要组织相容性复合物(MHC) II 类基因表达(图1F)。早期ASC的标记物还包括LYN和ZBTB32。LYN是BCR信号下游的一种酪氨酸蛋白激酶,可以抑制增殖,同时驱动终端PC分化(图1F)。B细胞标记物CD19和PTPRC (B220) 也标志着早熟的过程,它们在早期IgG主导的c1-c3以及c11和IgM主导的c13中强烈表达(图1G-H)。
他们在BM ASC中鉴定了所有五种同型(IgM、IgG、IgA以及IgD和IgE的一小部分),以及四种IgG亚类(IgG1-IgG4)(图1G)。大多数ASC聚集型以IgG为主,尤其以IgG1为主。与早期相比,晚期(c5-8和c10-12)IgG同型比例增加。
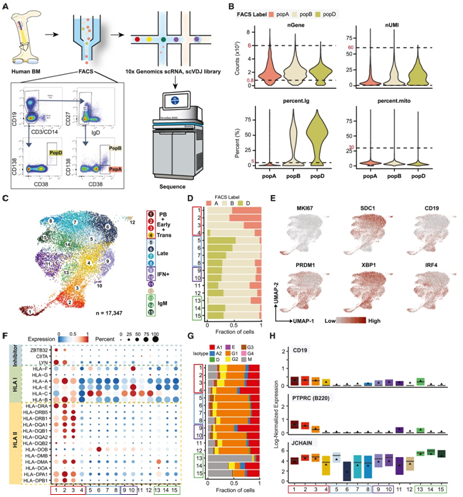
图1. 骨髓PC的单细胞转录组学分析
表1. 差异表达的标记基因代表的15个聚类
02

通过轨迹分析鉴定 IgG BM ASC 的四种成熟路径
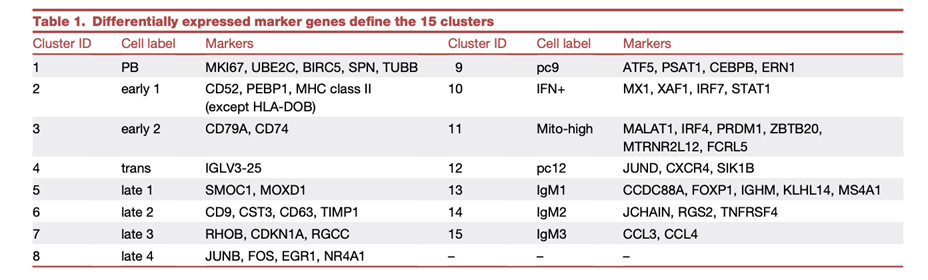
他们接下来进行了伪时间分析,将每条路径的基因集动态变化可视化到统一流形近似和投影(UMAP)上(图2A-B)。该方法预测了五种成熟轨迹:路径1和路径2分别指向c6和c7和c8。指向同一终点c9的路径3a和路径3b合并为一条路径3。最后,路径4指向c11。c1和c2之间存在明显的分离,但每条路径上剩余的非增殖性星团往往在相邻阶段/星团之间共存。这一结果表明,BM ASC的成熟更像是一个连续的功能过程,而不是一个有序的离散细胞状态序列。
接下来,使用标志通路富集分数发现了四种描述 BM ASC 成熟过程中基因组动态变化的模式(图2C-D)。模式 1、2 和 3 表现出前期呈线性减少,但后期富集模式略有不同(图2E)。模式 1包括未折叠蛋白质反应 (UPR)、活性氧 (ROS)、氧化磷酸化 (Oxphos) 和脂肪酸代谢 (FA_METAB) 途径减少,但随后在途径 1、2 和 3的成熟后期趋于平稳。只有路径4持续下降进入后期(图2E)。模式2包括标志通路缺氧、UV应上升和p53通路,表现出相同的成熟趋势,但路径2对应c7和c8的晚期状态有所增加。模式3包含IL6-JAK-STAT3信号、炎症反应和细胞凋亡,在这四种途径中显示出相似的成熟趋势。模式4,特别是包括通过NF-κB和KRAS信号传导下调的肿瘤坏死因子(TNF)-α。
图2. 轨迹和标志通路富集分析以区分预测的BMPC成熟路径
03

ASC成熟和存活的转录因子(TF)以及LLPC分化
为了了解特定 TF 调节的基因集的不同富集模式,他们估算了 TF 在调节 BM ASC 成熟中的潜在功能。富集程度最高的144个TF分配到基因表达最高的细胞聚类或成熟阶段(图3A),在15个细胞组中的9个中观察到这些“聚类相关”TF。为了描述路径1 (c5 vs. c6)和路径2 (c5 vs. c7)晚期IgG ASC成熟的分化,他们使用基因集富集分析 (GSEA) 进行排序分析,鉴定了6个和19个显著激活或抑制的基因集。虽然IFN-γ反应和同种异体移植排斥在c6中下调,但炎症和MYC靶点在c7中上调,只有通过NF-κB的TNF-α信号在c6中下调,在c7中上调(图3B-C)。
通过比较 c5 与 c6 以及 c5 与 c7 之间的 差异表达基因(DEG),维恩图显示了 c6 或 c7 中向上或向下的最高 DEG(图3D-E)。
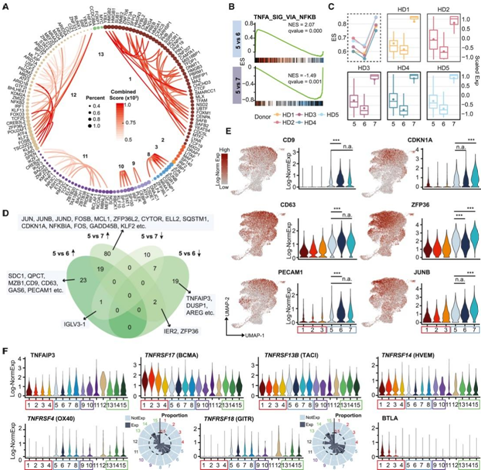
图3. 基因和标志通路决定了晚期成熟的命运
04

早期和晚期ASC之间差异表达的TNFRSF家族成员
TNF 和 TNF 超家族细胞因子信号传导在 B 细胞和 PC 存活和功能或细胞死亡中发挥重要作用。最著名的因子 BAFF 或 APRIL (TNFSF13) 及其识别的受体 BAFF 受体 (BAFFR: TNFRSF13C)、跨膜激活剂和 CAML 相互作用物 (TACI: TNFRSF13B) 和 B 细胞成熟抗原 (BCMA: TNFRSF13A/17) 对于 ASC 的生存至关重要。他们发现 TNFRSF 家族成员的表达在两条晚期 IgG 路径 1 和 2 之间几乎没有差异;然而,早期和晚期星团之间存在显著差异(图3F)。BCMA在早期ASC中表现出高表达,并在晚期ASC聚类中显著下调,而TACI表达在晚期聚类中显著增加(图3F)。
TNFRSF 中在 T 细胞激活中发挥作用的其他受体在早期和晚期 BM ASC 聚类中受到不同的调节(图 3F)。例如,OX40 (TNFRSF4) 和 GITR (TNFRSF18) 在晚期 ASC 聚类中均显著上调。相反,HVEM (TNFRSF14) 表达在c2、3、4、9和13早期显著增加。
虽然蛋白表达可能与基因表达一致,但BCMA和TACI的表达可能变化较大,与基因表达的一致性较差(图4A)。基于之前的 BM pop A、B 和 D,随着 pop D 的成熟,BCMA 和 TACI 都会降低表面蛋白表达。相反,随着 BM ASC 的成熟,流式表型分析显示 pop D 中 OX40 和 GITR 的表面表达更高(图3F,图4B)。通过流式细胞术检测,Pop D 具有较低的 CD38 平均荧光强度 (MFI),这与基因表达一致(图4C-D)。同时,他们观察到抗cd38治疗(daratumumab)可选择性地减少早期BM亚群。在等待第二次肾移植的具有广泛HLA抗体的致敏患者中,只有晚期成熟的ASC亚群在daratumumab和belatacept治疗14周后仍然存在(图4e),而pop A和pop B的减少量分别为100%和92.2%,而pop D仍然存在(图4E-F)。正如单细胞分析预测的那样,早期 BM ASC 最容易受到抗 CD38 疗法的影响。
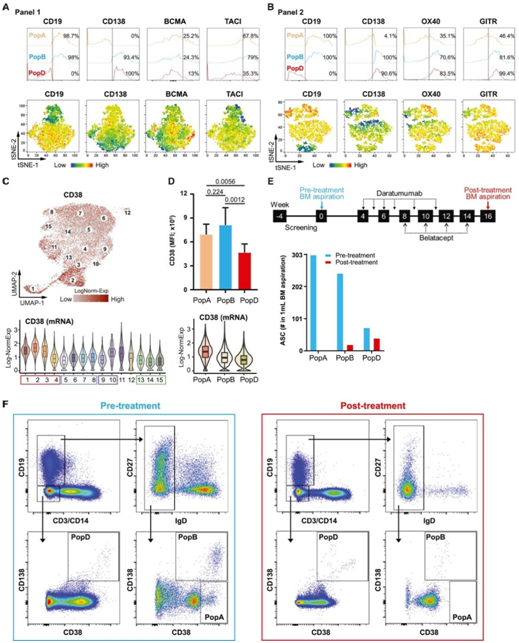
图4. 早期和晚期代表性标志物的实验验证
05

成熟的 BM ASC 下调促凋亡基因并上调促生存基因
他们接下来检测了15个细胞聚类中促存活、内在和外在促凋亡基因、细胞周期和细胞周期阻滞的单细胞表达(图5A)。TSC22D3、MCL1和BCL2是BM ASC成熟的重要促生存基因。TSC22D3(糖皮质激素诱导的亮氨酸拉链[GILZ])可以抑制FOXO3的转录活性,从而进一步抑制BIM诱导的细胞凋亡。在晚期集群中,TSC22D3在c5和c7中表达最高,在c12中表达最高,对应的BIM (BCL2L11)表达最高。BCL2在所有晚期LLPC (c5-8)中升高的程度相似,而MCL1在路径2晚期表达更高(图5A-B)。相反,内源性和外源性促凋亡基因在LLPC中均减少(路径1和路径2)。从早期到晚期 ASC 无法成熟可能会导致细胞死亡(图 5A-B)。BM ASC成熟的c1(PB) 和c2阶段似乎引发了凋亡,促凋亡基因表达较高,包括线粒体外膜渗透 (MOMP) 激活因子BAX和BAK1以及介质VDAC1,并从线粒体细胞色素c (CYCS)的膜间释放凋亡蛋白和丝氨酸蛋白酶OMI(由HTRA2编码),该酶中和caspase抑制蛋白,参与caspase激活,DNA断裂因子(DFFA)和凋亡膜泡基因ROCK1也发生上调。

图5. BMPC细胞聚类中凋亡基因表达的研究
06

V(D)J BM ASC聚类的整体特征
VH谱系包括 11853 个克隆谱系,其中大多数代表单细胞(10344个细胞)。较高的 IGHV1、IGHV3 和 IGHV4 家族基因反映了这些较大家族的预测分布(图 6A)。但VH 家族内的各个 VH 基因也不存在一致的偏差。
体细胞超突变 (SHM) 的频率和分布提供了有关 ASC 成熟和抗原选择的重要信息。BM ASC 相对于外周血初始 B (NB) 细胞具有更高的整体突变频率(图6B)。总体而言,SHM 频率范围为 4.8% 至 8.6%,其中 c13 中观察到的频率最低,c6中观察到的频率最高(图6B)。IgG和IgA通常比IgM同种型具有显著更高的突变频率,但在每个鉴定的细胞聚类内IgA和IgG同种型或IgG亚类之间没有差异(图6B)。最高的 SHM 突变数出现在聚类内的小 IgG4 部分中,平均为 27.8(图6C)。IgG谱系的早期ASC,特别是MHC II类基因表达(c1-c3)的ASC以及所有IgM谱系聚类的ASC的突变频率低于晚期IgG ASC。
他们在伪轨迹中使用98%的同源性来跟踪相同的克隆。由于IgG1 ASC是BM中的主要同型,显示了c1-c15中IgG1 ASC的相同克隆的整体和个体的连通性(图6D)。他们应用Morisita重叠指数来绘制种群间的谱系连通性,细胞群在早期(c1-c4)或晚期(c5-c8)高度连接(图6D-E)。
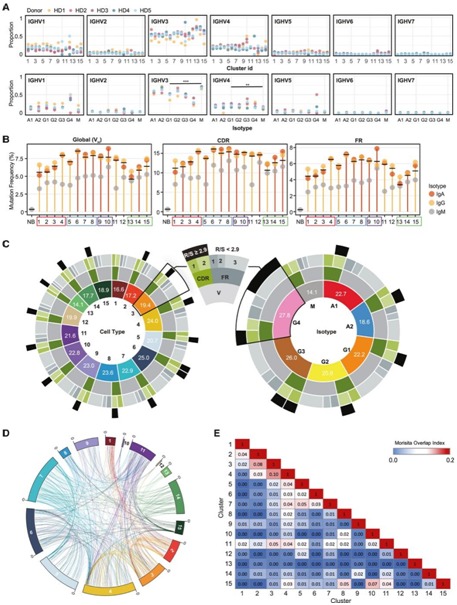
图6. scVDJ-seq测定克隆的突变率、相似性和连通性
+ + + + + + + + + + +
结 论
本项研究对来自 5 名健康成年人的BM ASC进行了scRNA-seq,鉴定出 15 个聚类,从表达 MKI67 的新生成的 ASC(聚类1)和 II 类MHC,发展到后期聚类 5-8 到中间聚类 2-4。其他 ASC 聚类包括以下聚类:以Ig M 为主、干扰素反应性和线粒体-high活性。晚期 ASC 涉及到G2M 检查点、哺乳动物雷帕霉素靶点 (mTOR) 信号传导、独特的代谢途径、CD38 表达、TNF受体超家族成员的利用、以及两种不同的成熟途径,涉及通过核因子 κB (NF-κB) 进行 TNF 信号传导。这项研究提供了 BM 微生态位中必需的 LLPC 成熟轨迹的单细胞图谱和分子路线图。总而言之,了解BM ASC在健康和疾病中的异质性,有助于开发新的策略来增强保护性ASC和减少致病性ASC。
+ + + + +



 English
English

