文献解读|(6.081):比较蛋白质组学和磷酸化蛋白质组学分析揭示约克夏猪和杜洛克猪精子可能的品种差异
✦ +
+
论文ID
原名:Comparative Proteomics and Phosphoproteomics Analysis Reveal the Possible Breed Difference in Yorkshire and Duroc Boar Spermatozoa
译名:比较蛋白质组学和磷酸化蛋白质组学分析揭示约克夏猪和杜洛克猪精子可能的品种差异
期刊:Frontiers in Cell and Developmental Biology
影响因子:6.081
发表时间:2021.7.16
DOI号:10.3389/fcell.2021.652809
背 景
精子质量是公猪重要的遗传性状,是人工授精成功的关键。精子独特的结构决定了蛋白质及蛋白质翻译后修饰(PTM)在精子发育过程中发挥重要的调控功能。近年来,精子受精过程中蛋白质功能日益受到人们的关注,对精子中差异表达蛋白质的鉴定有助于阐明不同猪种遗传背景差异的分子机制。此外,尽管蛋白质磷酸化调控在精子中发挥重要作用,但缺乏关于不同猪种间与精子运动相关的磷酸化蛋白表达差异研究,对造成猪精子品种差异的蛋白组或磷酸化蛋白组的研究也尚未开展。约克夏和杜洛克是现代猪商业化生产中最常用的两个品种,它们的繁殖性能存在很大的差异。本研究采用iTRAQ定量蛋白质组结合磷酸肽富集分析,对约克夏和杜洛克猪精子蛋白质组进行全面描述,发现了与品种差异相关的精子蛋白组差异,为理解杜洛克猪和约克夏猪繁殖效率差异的分子基础提供新的见解。
实验设计
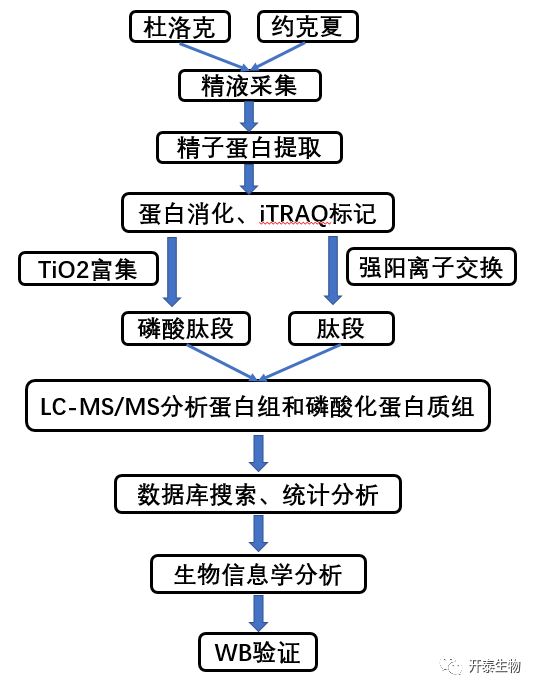
结 果
01

猪精子蛋白质组学和磷酸化蛋白质组学研究
iTRAQ定量蛋白质组学分析显示,在187889个光谱中鉴定了10876个独特的肽,对应1745个蛋白质。使用UniProtKB数据库对这1745个蛋白质进行注释,其中1697个注释到完整蛋白,48个注释到蛋白质片段上。在这些蛋白质中,成功定量了1738个,其中150个为差异表达蛋白(DEPs,图1A)。磷酸肽富集分析表明,从1064个独特的磷酸肽中鉴定出1140个磷酸化位点,这些磷酸肽对应363个猪精子蛋白,其中283个为差异表达磷酸化蛋白(DEPPs,图1B)。其中,86个DEPs的差异倍数在±1.30 ~ ±1.49倍之间,46个DEPs的差异倍数在±1.50 ~ ±1.99倍之间,18个DEPs的差异倍数在±2倍以上(图1C)。基于磷酸肽的表达模式,发现100个表达上调的磷酸肽属于54个磷酸化蛋白,183个表达下调的磷酸肽属于52个磷酸化蛋白(图1D)。
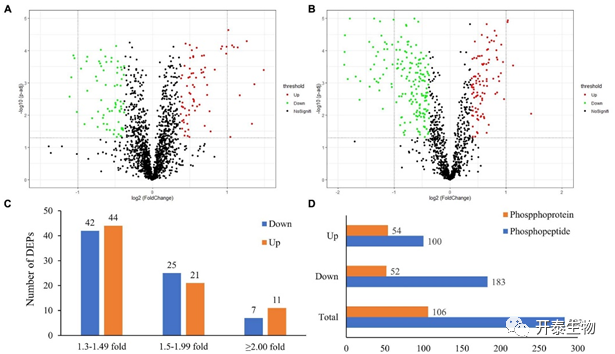
图1 约克夏和杜洛克猪精子蛋白组和磷酸化蛋白组分析
鉴定出来的蛋白质预测分子量变化很大,范围从1.7到763.6 kDa,平均值为57.3 kDa(图2A)。此外,还展示了肽的序列覆盖率(图2B)以及肽数量(图2C)和肽长度(图2D)的分布。在这些磷酸肽中,705个肽仅显示有1个磷酸化位点,274个肽显示有2个,49个肽显示有3个或更多的磷酸化位点。通过分析磷酸化蛋白质的磷酸化位点,发现208个蛋白质在蛋白序列上仅存在1个磷酸化位点,155个蛋白质存在2个或以上的磷酸化位点。其中,AKAP4磷酸化位点最多,含有45个磷酸化位点,包括了55个磷酸肽。如预期一样,1140个磷酸化位点包括990个磷酸化丝氨酸(pS)、140个磷酸化苏氨酸(pT)和10个磷酸化酪氨酸(pY)残基(图3A)。另外,从283个磷酸肽中鉴定出310个磷酸化位点,在这些磷酸化残基中,277个是丝氨酸,33个是苏氨酸(图3B)。由于缺乏在猪上专门带注释的激酶/磷酸酶基序数据库,使用人类蛋白质参考数据库对得到的基序进行分析。主要鉴定了三个磷酸基序,PKC和AKT的KXXpS、GSK-3、CDK和MAPK家族的pSP/pTP(图3C)。37种底物具有相同的KXXpS基序,其中3种磷酸肽(2种蛋白质,AKAP4和VAPA)在约克夏猪精子中低磷酸化。在这一类别中,两个AKAP4蛋白的磷酸肽(AVSKIASEMAHDA和AAEKGYSVGDLLQ)参与精子活力和信号转导途径的调节,在杜洛克猪精子中高磷酸化。此外,36种底物具有pSP基序,其中5种磷酸肽(4种蛋白,SPATA18、SPACA1、AKAP4和SPATA31D1)在约克夏猪精子中低磷酸化,4种蛋白(NT5C1B、CABYR-1、CFAP45和TMEM202)在杜洛克猪精子中低磷酸化。有趣的是,11种激酶底物共享pTP基序,其中4种(三种蛋白质,DNAH8、St6galnac2和NT5C1B)在约克夏精子中高磷酸化,三种蛋白质(ODF2、PRDX5和AKAP4)在杜洛克猪精子中高磷酸化。以上这些蛋白都和精子获能和运动有关,这表明杜洛克猪和约克夏猪精子通过磷酸化介导的信号通路调节蛋白磷酸化水平,从而调节两种猪精子运动和获能的差异。

图2 猪精子样品中的独特多肽特征
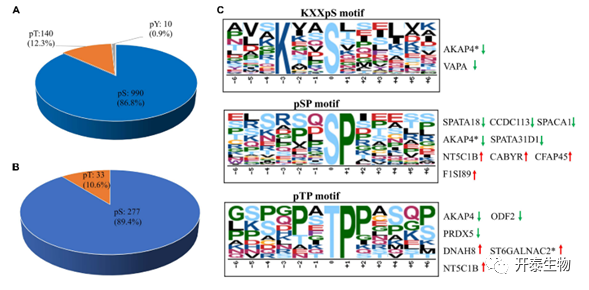
图3 磷酸化位点分布和磷酸化基序富集
274个蛋白在非磷酸化蛋白和磷酸化蛋白之间重叠,11个蛋白在下调DEPs和下调DEPPs之间重叠,仅1个蛋白在上调DEPs和上调DEPPs之间重叠(图4A-C)。然而,在总的110个DEPPs中,有71个未在DEPs中发现(图4D)。对DEPs和DEPPs之间重叠的12个蛋白进行PPI分析(图4E),发现ODF1和SMCP与其他7个蛋白存在联系,ODF1作为互作网络的核心,其参与精子活力的调节。
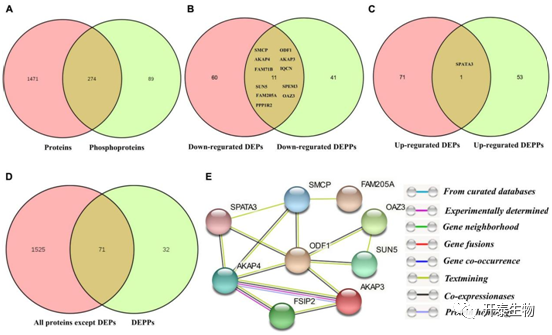
图4 DEPs和DEPPs之间的相关分析
02

GO和KEGG分析
GO分析显示,下调蛋白显著富集到和繁殖过程相关的生物过程(BP),如精子发生、雄性配子产生和多细胞生物繁殖;在分子功能(MF)方面,下调蛋白涉及氧气活度、分子载体活性、氧结合、催化活性和乳酸脱氢酶活性等类目;在细胞组分(CC)中,下调蛋白主要富集到精子纤维鞘、精子鞭毛、精子连接件、运动纤毛和分泌颗粒等类目(图5A)。反之,上调蛋白主要富集的CC类目为细胞外区域、细胞器膜、血红蛋白复合物和线粒体膜、无精子纤维和运动纤毛等;主要富集的BP和MF类目为转运过程和结合活性(图5B)。
为了解不同遗传背景下猪精子差异磷酸化蛋白质的生物学作用,同样对DEPPs进行GO和KEGG分析。GO分析显示,DEPPs显著富集的BP类目为纤毛组织、有性繁殖、纤毛运动、精子发生和纤毛组装等;显著富集的CC类目为精子鞭毛、精子纤维鞘、精子主件和轴丝等;显著富集的MF类目为蛋白激酶A结合、泛素蛋白连接酶结合、TPR结构域结合、跨模信号受体活性、分子传导活性和酰基磷酸酯酶活性(图5C)。使用KEGG数据库进一步分析发现,110个DEPPs显著富集10条KEGG通路,包括hedgehog信号通路、糖酵解通路、三酰甘油代谢通路、Notch信号通路和催产素受体介导的信号通路等(图5D)。这些GO富集分析结果表明,遗传背景与参与精子生育力调节的不同精子特异性蛋白磷酸化水平有关(图6)。其中,上调和下调的DEPPs,如AKAP3、AKAP4、ODF1、FSIP2和ODF2,含有卷曲螺旋结构域的蛋白家族(CCDC136、CCDC114、CCDC7和CCDC151)、SPACA1、DNAH1、SPA17和CABYR-1等与精子活力、精子获能和顶体反应相关。这表明,公猪精子活力的调节与细胞内激酶和磷酸酶的相反作用紧密相关。
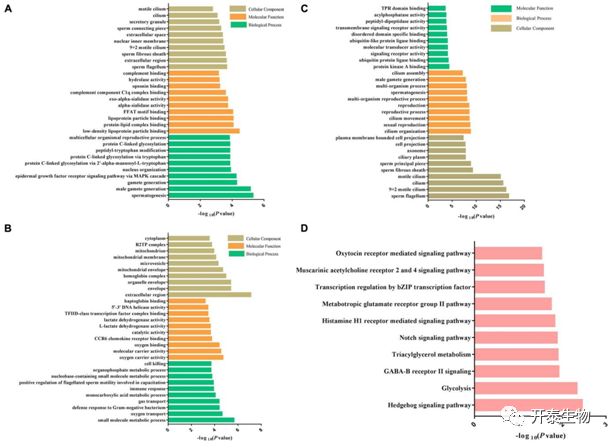
图5 DEPs和DEPPs的GO、KEGG分析
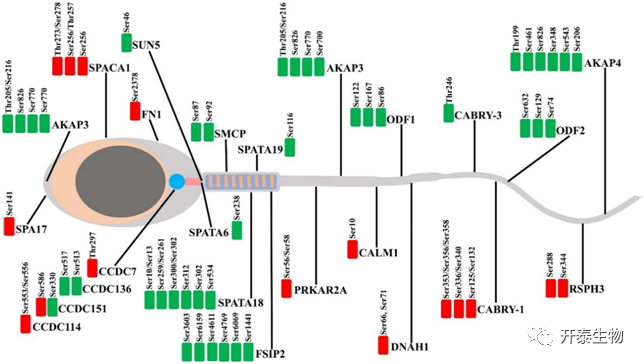
图6 DEPPs在精子中的定位
下调和上调的磷酸化位点分别显示为绿色和红色
03

磷酸化蛋白PPI网络分析
为了进一步研究这些磷酸化蛋白之间的关系,用String数据库对DEPPs进行PPI分析。结果表明,51个蛋白质涉及184个配对关系。首先,鉴定了一个与精子发生相关的子网络,它主要由杜洛克猪精子中上调的蛋白质组成(例如SPATA18、SPATA6、SPATA19、SMCP、ODF1、OAZ3和SUN5),其中SPATA18参与调控精子线粒体活性和精子发育。7个与钙组装相关的DEPPs形成另一个子网络,包括SPA17、FSIP、CABYR、AKAP3、AKAP4、TBATA和ROPN1,其中AKAP4是调控精子运动和获能的重要蛋白。第三个子网络由5个与精子鞭毛运动相关的DEPPs组成,包括CCDC114、CCDC151、DRC1、NME8和DNAH1。PPI网络中的其他子网络则与碳代谢、精子获能和cAMP信号传导相关(图7)。
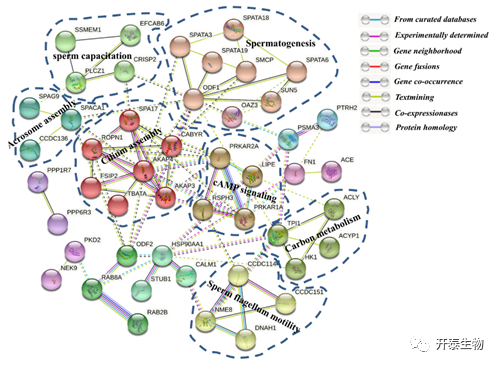
图7 DEPPs的PPI分析
04

WB验证DEPs
为验证蛋白组学数据的准确性,选择6个DEPs(HNRNPK、PTGDS、GK、AKPK4、AKAP3、ODF1)进行WB验证,结果表明,WB检测蛋白表达趋势和蛋白组学一致(图8)。
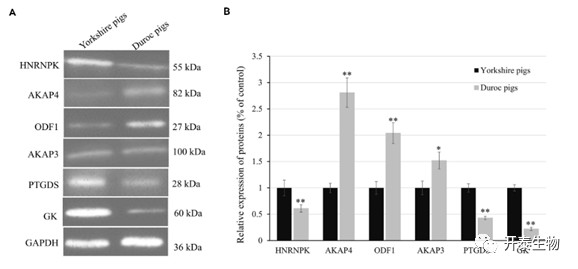
图8 DEPs的WB验证
+ + + + + + + + + + +
结 论
本研究充分揭示了约克夏猪和杜洛克猪精子中蛋白质水平和磷酸化状态的多重变化,探讨了猪繁殖效率与生育能力之间的关系。通过对猪精子蛋白组和磷酸化蛋白组的分析,发现了多种有助于理解精子发生、精子运动、精卵识别和能量代谢的新的分子机制。本研究阐明了蛋白质组学方法在畜牧业繁殖潜力诊断中的应用价值。
+ + + + +



 English
English

