文献解读|Cancer Cell(50.3):儿童 AML 治疗反应的纵向单细胞图谱
✦ +
+
论文ID
原名:A longitudinal single-cell atlas of treatment response in pediatric AML
译名:儿童 AML 治疗反应的纵向单细胞图谱
期刊:Cancer Cell
影响因子:50.3
发表时间:2023.11.16
DOI号:10.1016/j.ccell.2023.10.008
背 景
儿童急性髓系白血病(pAML) 的特点是细胞组成、驱动因素改变和预后异质。pAML患者的总生存 (OS) 率仍约为 75%,频繁复发导致无事件生存 (EFS) 率仅为 ∼50%。与成人 AML (aAML) 相比,大多数pAML病例缺乏有效的靶向治疗, 因为肿瘤在分子上与成人不同,这种异质性的特征及其如何影响儿童患者的治疗反应仍有待研究。
实验设计
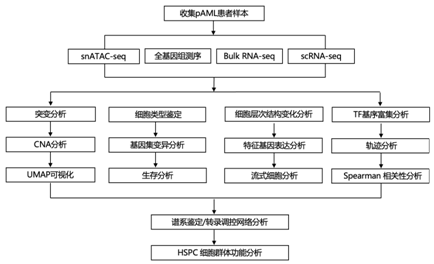
结 果
01
pAML 的纵向单细胞分析
研究者团队分析了28例pAML患者的诊断、缓解和复发样本:MLL(MLL;n = 11)、RUNX1 (RUNX;n = 5)、CBFB (CBFB;n = 4)、FLT3-ITD (FLT;n = 4)和其他改变(例如CEBPA和NPM1突变;N = 4)(图 1 A)。他们结合公开生成的全基因组测序 (WGS) 数据,鉴定体细胞突变和驱动改变(图 1 B)。他们从不同时间点的 75 个血液和外周血活检中生成了 146 个文库,产生了 684031 个高质量细胞的数据,在所有病例中,诊断时和复发时源自肿瘤的细胞均分开聚集(图 1C)。为了识别恶性和非恶性细胞聚类,他们使用进行了单细胞转录组分析(scRNA-seq)和单细胞 ATAC 测序 (scATAC-seq),他们将具有突变的细胞中的相对丰富的聚类定义为恶性(图 1D)。他们还利用scATAC-seq数据推断出了拷贝数改变(CNA),这证实了在推断的恶性细胞中存在肿瘤特异性CNA(图1E)。
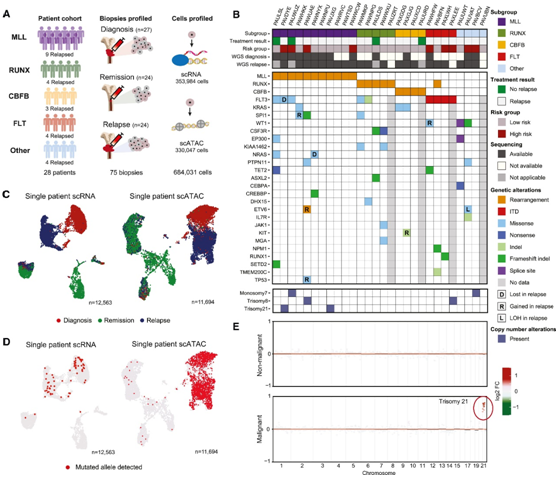
图1. 儿童 AML 的纵向单细胞分析。
(A) 研究中包括的患者和时间点的示意图。(B) Oncoplot 显示使用 WGS 识别的体细胞改变。(C) 来自患者 PAVJXG 的细胞的 scRNA-seq 或 scATAC-seq 数据的 UMAP 表示。(D) UMAP 可视化,颜色表示每个细胞内体细胞单核苷酸变异体(SNV)的检测。(E) 从 scATAC-seq 数据推断的拷贝数分析证实了患者 PAVJXG 恶性细胞中的21 三体性。
02
儿童AML肿瘤具有亚群特异性细胞类型组成
接下来,他们在诊断时对恶性细胞进行了细胞类型预测和分类,以确定 pAML 细胞类型组成的亚组特异性差异(图 2A),观察到不同亚组之间存在不同的细胞层次结构:MLL重排的肿瘤类似于更成熟的细胞;MLL 重排的肿瘤类似于更成熟的细胞。RUNX1-重排肿瘤富含祖细胞样和早期粒细胞-单核细胞祖细胞(GMP)样群体;CBFB重排的肿瘤富含单核细胞样和原始细胞,而FLT3 -ITD改变的肿瘤富含造血干细胞(HSC)样的细胞群体,与aAML类似。
然后,他们使用bulk RNA-seq 数据分析了参加 AAML1031 的 974 名患者(图 2 B)。通过从正常骨髓中鉴定出的标记基因,并使用基因集变异分析 (GSVA) 计算了样本的特征分数,并观察到与 scRNA-seq 数据中观察到的模式相似的模式(图 2C)。MLL重排的肿瘤表面CD34和CD117(通常用于识别原始细胞群体)的表达水平低,但髓系标志物CD11b和CD33的表达水平高(图2D)。CD34和CD117表面表达均与GSVA获得的HSC样特征评分相关(图2E)。原始细胞的相对丰度是AML预后的预测指标,在分化程度较高的MLL亚组中,原始标记的高表达与较差的结局相关(图2F)。
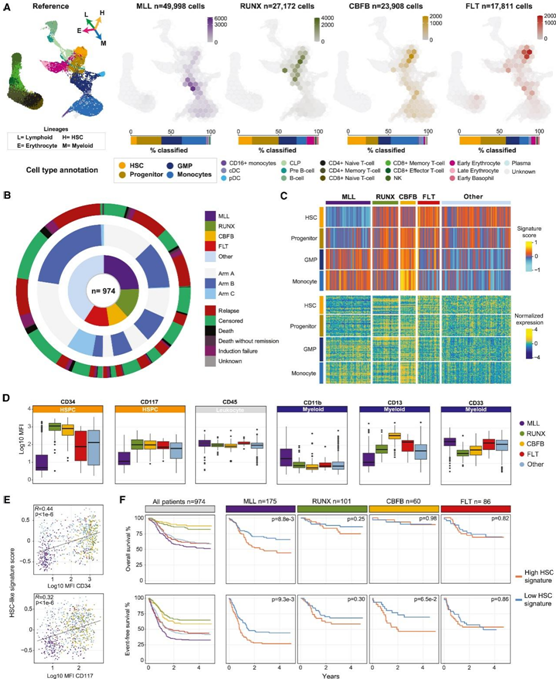
图2. 儿童 AML 肿瘤在诊断时具有亚组特异性细胞类型组成。
(A) 诊断时肿瘤中的恶性细胞投射到健康骨髓上。(B) 使用bulk RNA-seq对 974 名患者进行分析。(C) 对来自诊断时原始细胞含量 > 40% 的 422 个样本的bulk RNA-seq 数据进行监督聚类。(D) Log10 转换的标记物平均荧光强度 (MFI) 值,在诊断时使用流式细胞测量 789 个肿瘤。(E) 782 名患者的 HSC 样 GSVA 特征评分与平均荧光 CD34 和 CD117 的 Spearman 相关性。(F) Kaplan-Meier 曲线显示所有患者或按亚组分类的患者的五年 OS 和五年 EFS。
03
细胞层次结构在复发时丰富为更原始的状态
考虑到原始细胞群体和结果之间的相关性,他们接下来研究了细胞层次结构在复发时如何变化,使用正常骨髓(图 3A)和儿童骨髓确定了诊断时和复发时肿瘤之间不同的细胞组成。GMP 样细胞和早期单核细胞在复发时发生耗竭,特别是在诊断时 GMP 水平相对较高的亚组中,例如在 MLL和RUNX亚组(图 3 B)。同时,复发肿瘤的细胞层次结构在各个亚组的原始细胞中也同样富集,包括诊断时含有更多分化细胞的MLL亚组(图 3C)。
为了研究MLL 亚组内细胞层次结构的明显变化,他们直接比较了每位患者的所有活检细胞(图 3D)。复发样本中表达 HSPC 标记物(即CD34和IGLL)的细胞明显较多,而表达 GMP 和单核细胞标记物(即ELANE和S100A9)的细胞较少(图 3 E),这种模式在正常骨髓中每个细胞群的标记中都是可见的(图3F)。有趣的是,细胞类型标记是诊断和复发之间表达差异最大的基因之一。特别是,MLL和RUNX亚组在复发时表现出明显的髓系标志物下调(图3G)。为了证实复发后原始细胞的增加,流式细胞分析了MLL重排肿瘤的匹配诊断和复发样本对。事实上,与诊断时的匹配样本相比,在复发样本中观察到CD34+细胞和CD117+细胞的比例增加(图3H)。

图3. 细胞层次结构在复发时丰富为更原始的状态。
(A) 复发肿瘤的恶性细胞投射到健康骨髓上。(B) 比较每个亚组的匹配诊断 (Dx) 和复发 (R) 样本中分类为 GMP 样的恶性细胞的百分比。(C) 诊断时和参考复发时肿瘤的投射细胞密度,按亚组分开。(D) PAVDYE(MLL 亚组)中所有细胞(诊断、复发和缓解)的 UMAP 可视化。(E) UMAP 可视化,由CD34、IGLL1、ELANE和S100A9的表达着色。(F) 热图显示标记基因的表达。(G)比较每个亚组的匹配肿瘤细胞的差异基因表达。(H) 流式细胞检测 PAVDYE 诊断时和复发时匹配样本中原始细胞表面表达的情况。
04
复发肿瘤中的转录网络从骨髓谱系转变
他们使用关联表达数据来注释恶性细胞类型,确认 scATAC-seq 数据中复发肿瘤中向更原始细胞状态的转变(图 4 A),从配对诊断和复发样本中识别出恶性细胞之间差异富集的开放染色质峰(图 4 B),并进行转录因子(TF)基序富集分析以推断 TF 活性的差异(图 4 C)。在MLL重排的复发样本中,他们观察到 CEBP TF 及其二聚化配体(例如 ATF/CREB、MAF 和 AP-1 TF)的活性降低(图 4 D)。这些异二聚体在骨髓细胞命运特化中至关重要,证明了复发时骨髓细胞减少。CBF 因子在MLL重排肿瘤中上调,STAT 因子在RUNX1重排肿瘤中上调,AP-1 因子在RUNX1和CBFB中上调重新排列的肿瘤。AP-1 因子是RUNX1-RUNX1T1相关恶性肿瘤中融合蛋白的辅助因子,表明它们在复发时活性增加可能与RUNX1和CBFB重排肿瘤的驱动改变在功能上相关。所有亚组中的一些因素具有相似的模式:与诊断相比,复发时 CEBP 活性消失,TCF 活性增加。
为了进一步检测 TF 活性的这种明显变化,他们对从匹配的诊断和复发的肿瘤细胞进行轨迹分析,以确定谱系标记物表达、TF 表达和 TF 基序富集的逐渐变化(图 4 E)。他们证实,在复发时,髓系谱系标志物(MPO, LYZ, ELANE和S100A)下调,参与髓系分化的TF(RARA和CEBPA)活性丧失。相反,淋巴样细胞和红样细胞(CD9和GATA1)和HSPC(CD34和SPINK2)的标记物以及与原始细胞和淋巴样规范相关的TF(如RUNX1、GATA2、MEF2C和TCF3)的活性在复发肿瘤细胞中升高。
他们比较了参与 NF-κB 信号转导的 TF(例如RELA、RELB 和 NFKB1)的表达和活性,发现诊断时表达升高,基序富集,但复发时表达减少(图 4 F)。为了确定可能与 NF-κB 信号传导共同调节的因素,他们将 RELA 和 CisBP 数据库中其他 TF 在恶性和非恶性细胞中的基序富集分数相关联。这些相关性的层次聚类显示,与 NF-κB 信号传导相关的 TF 相比,基序富集模式相似或不同的因子(图 4 G),这分别意味着与 NF-κB 信号传导的共同或反调节。推测活性与RELA活性相关的因子(如CEBPA)在复发时的下调程度与RELA相似,而抗相关因子(如TCF因子)的活性类似或略有升高(图4H)。
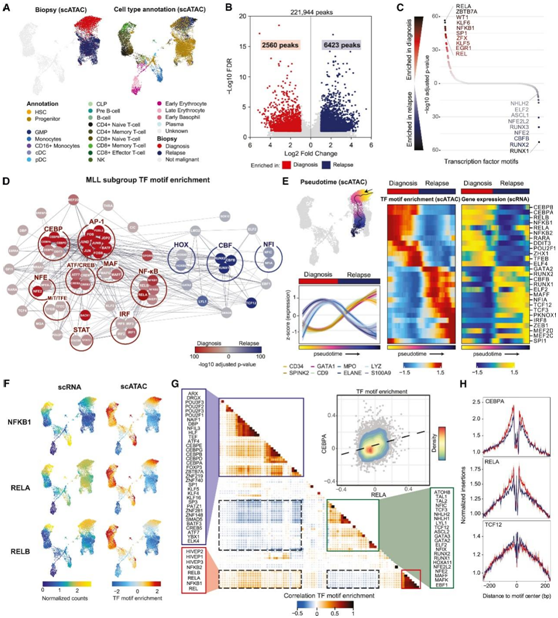
图4. 复发时转录网络转变。
(A) 使用来自 PAVJXG(MLL 子组)的 scATAC-seq 数据进行UMAP 可视化。(B) 火山图显示恶性细胞在诊断和复发时差异富集的峰。(C) 在诊断或复发样本中富集的峰之间计算出 TF 基序富集度。(D) MLL 亚组中诊断时和复发时肿瘤之间差异富集的 TFBS 基序网络。(E)轨迹分析和TF 基序富集分数。(F) 诊断和复发细胞的 UMAP 可视化,由属于 NF-κB 通路的因子的标准化基因表达值(左)和 TF 基序富集(右)着色。(G) 恶性和非恶性细胞中 TF 基序富集评分的整体 Spearman 相关性 (PAVJXG)。(H) TFBS 基序邻近序列 400 bp 区域中诊断时(红色)和复发时(蓝色)肿瘤中所有恶性细胞的组合 scATAC-seq 谱的可视化。
05
复发肿瘤的原始细胞表现出较少的髓系启动
由于NF-κB活性在复发肿瘤中更原始的细胞群中似乎减少,他们想知道在恶性HSPC样细胞与非恶性HSPC样细胞之间是否存在其他不同的活性基因或转录程序,这些基因或转录程序可能是潜在的治疗靶点。为此,他们利用scRNA-seq(图5A)和scATAC-seq(图5B)数据,将所有缓解样本中归类为HSPC样的非恶性细胞合并为一个聚类,用于与恶性HSPC进行比较。与非恶性 HSPC 相比,pAML HSPC 向骨髓谱系“启动”,其程度取决于驱动改变(图 5 C)。
与非恶性细胞相比,pAML中的重要癌基因,如MLL融合癌蛋白的下游靶基因MEIS1,在恶性细胞中异常激活。然而,与NF-κB信号传导不同,MEIS1在特定亚群(如HSPC样细胞群)中也发生上调(图5D)。为了确定在HSPC样pAML细胞内异常激活的其他重要因子,他们使用了类似于识别超级增强子的方法,并根据TF活性进行排序。染色质可及性的增加通常是由于TF活性较高,因此可以以类似的方式将scATAC-seq峰分组,以鉴定恶性HSPC样细胞群中富集的开放染色质区(eOCR)。与超级增强子类似,与eOCR相关的基因(即与eOCR在250kb内可及性相关的基因)通常比与eOCR无关的基因表达更高(图5E),这证明了eOCR的调控相关性。
他们将与附近基因表达相关的eOCR的ATAC信号聚类(图5F),并确定了7个与本项队列中发现的不同驱动改变基本一致的聚类:RUNX(1)和CBFB肿瘤(2)形成了不同的聚类,而MLL亚组形成了重排特异性聚类,包括MLL-AFF3(3)、MLL- AF10和其他重排(4)以及MLL-AF9(5)聚类。他们发现HOXA9、MEIS1和ZEB2附近的 eOCR 在MLL重排肿瘤中表现出增加的可及性,而ASXL1、ATF3和GATA2在RUNX或CBFB肿瘤中的可及性更高(图 5 F)。当比较诊断样本和匹配的复发样本之间的 eOCR 时,复发时与淋巴谱系相关峰重叠的 eOCR 的 ATAC 信号发生富集,而与骨髓相关峰重叠的 eOCR 则发生耗竭(图 5 G)。
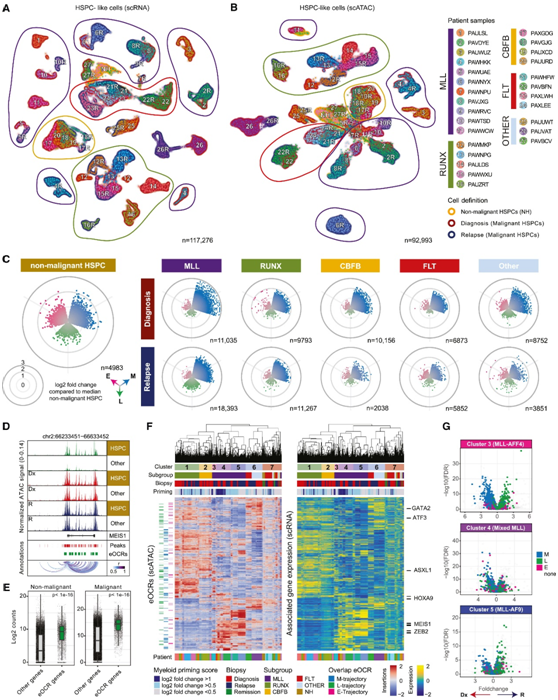
图5. 恶性 HSPC 在复发时改变了转录网络。
(A) 所有患者的 HSPC 样细胞的 UMAP 表示 (scRNA-seq)。(B)确定来自所有患者的 HSPC 样细胞的 UMAP 可视化。(C)来自诊断和复发肿瘤的 NH 和恶性细胞中scATAC-seq 衍生谱系评分。(D)比较诊断 (Dx) 和复发 (R) 时分析的非恶性缓解细胞和恶性细胞。(E) 所有患者的非恶性和恶性 HSPC 样细胞中与 eOCR 相关和不相关的基因的未转化表达计数。(F) 1000 个变化最大的 eOCR 中插入的无监督聚类。(G) 火山图显示了 MLL 相关 eOCR 聚类在诊断时和复发时 HSPC 样细胞之间 的差异倍数。
06
与不同驱动程序变更相关的 eOCR 监管的不同模式
在七个聚类中(图 5 F),他们确定了 2398 个 eOCR 与非恶性 HSPC 相比具有更高的可及性(图 6 A)。其中,大多数(59.4%)在单个聚类中上调,并且没有一个在所有聚类中普遍上调。由于这些聚类主要对应于不同的驱动改变(图5F),因此HSPC样群体中与恶性肿瘤相关的调节变化主要由于遗传背景而不同。为了确定TF在eOCR中潜在的结合,他们使用与恶性HSPC中上调的eOCR重叠的scATAC-seq峰分析了TFBS的富集。通过比较每个聚类中最富集的TFBS,他们得出了两组相关因素。AP-1相关位点在聚类1、2、3、6和7中富集,而MEF、ARID和FOX位点在MLL驱动的聚类3、4和5中富集(图6B-C),这与在MLL重排肿瘤中,MEF因子是致癌网络的主要驱动因素,而AP-1与其他pAML亚组相关。巧合的是,MEF家族成员MEF2C主要表达于MLL肿瘤的HSPC中,而AP-1家族成员JUN主要表达于缺乏MLL重排的肿瘤的HSPC中(图6D)。与诊断样本相比,复发时MEF2C表达升高,JUN表达降低(图6E)。AP-1 和 CEPB 基序富集与所有 HSPC 中的骨髓分化相关(图 6F)。
为了确定与正常造血相比,MEF2C在pAML环境中的功能是否相似(即通过抑制髓样分化),他们将MEF2C的表达与JUN、CEBP和LMO2关联起来(图6G)。此分析证实MEF2C的表达与关键的CEBP和AP-1相关基因呈负相关,而与LMO2呈正相关。巧合的是,MLL病例复发时,根据CEBP基序富集推断的CEBP和AP-1活性下调(图6H)。这些结果表明,复发性 pAML 中骨髓启动的减少可能是由于MLL重排肿瘤中 MEF2C 的上调所致,而 AP-1 信号传导的减少可能导致了其他亚组中的这种变化(图 6 I)。

图6. eOCR 的监管因基因驱动改变而异。
(A) 7 路维恩图显示每个聚类中与非恶性 HSPC 相比上调的 eOCR 之间的重叠。(B) 热图显示了聚类特定 eOCR 中 TF 基序占用率(包含基序的峰的百分比)的差异。(C)对所有恶性和非恶性 HSPC 样细胞的 TF 基序富集进行 Spearman 相关性分析。(D) UMAP可视化。(E) 小提琴图显示诊断和复发时 HSPC 样细胞中标准化MEF2C(上)和JUN (下)计数的分布。(F) 散点图显示了恶性和非恶性 HSPC 样细胞中AP-1和 CEBPD的基序富集度与骨髓谱系评分之间的 Spearman 相关性。(G) 散点图显示MEF2C表达与JUN、CEBPD和LMO2表达之间的相关性。
07
谱系转换导致 pAML 复发
他们观察到恶性 HSPC 样细胞在复发后似乎转向多能表型。尽管谱系转换在 pAML 中很少报道,但本项研究队列中的77 名两名患者(PAWHKK;MLL-AFF3和 PAUZRTRUNX1-RUNX1T1)在诊断时出现骨髓单核细胞样细胞,但含有丰富的淋巴细胞,涵盖 CLP 样至复发时的前 B 细胞样细胞(图 7 A)。在本项研究的队列中有2例患者(PAWHKK;MLL-AFF3和PAUZRT;RUNX1-RUNX1T1)在诊断时表现为粒单核细胞样细胞,但在复发时含有大量淋巴样细胞(从CLP样细胞到B细胞样前体细胞)(图7A)。两名患者的复发细胞均表达B淋巴样细胞标志物,包括CD79A和CD19(图7B)。此外,对标记基因的分析证实,与诊断时细胞的粒-单核细胞表达谱不同,来自PAWHKK的复发细胞也表达其他淋巴样标志物(图7C-D)。
此外,PAWHKK活检的流式细胞分析证实,复发后骨髓单核细胞(CD14+CD64+)减少,淋巴样细胞(CD19+ CD79+)增加(图7E)。
然后,他们通过分析scATAC-seq数据,并在HSPC人群中计算复发前后的“启动”评分,研究了转录网络是否在PAWHKK中经历了类似的转变。正如预期的那样,原始细胞群从诊断时以髓系“启动”的细胞群转变为复发时以淋巴系“启动”的细胞群(图7F)。为了确定与这种谱系转移相关的因素,他们推断了肿瘤从诊断到复发的轨迹(图7G)。从非恶性缓解细胞推断的淋巴谱系相关TF(如EBF1、TCF因子)。与诊断时相比,复发时恶性细胞中PAX5)的表达上调(图7G),并且类似于儿童B细胞急性淋巴细胞白血病(B-ALL)的TF谱。MEF2C的表达和推断活性在复发时也上调(图7G),显示出与非恶性淋巴样细胞相似的模式。
他们分析了诊断和复发时不同样本的bulk RNA-seq数据,探究原发组和复发组之间的原始含量和驱动因素变化。他们使用GSVA计算了不同细胞类型标志物和与儿童pAML预后不良相关的淋巴样标志物的特征评分(图7I)。除了复发性肿瘤中的原始细胞特征显著上调外,他们还观察到淋巴细胞特征、特定谱系的TF(如EBF1和PAX5)和B细胞标志物(如IGLL1、CD79A、DNTT和VPREB3)上调(图7J)。
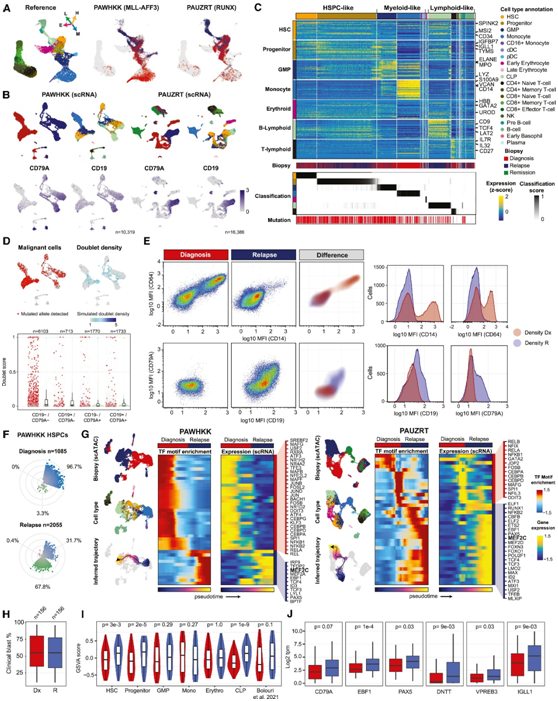
图7. 复发时的谱系转换与 B-ALL 样程序的激活有关。
(A-B) UMAP可视化。(C) 热图显示PAWHKK 中标记基因的表达。(D) PAWHKK 细胞的 UMAP可视化。(E) 流式细胞检测 PAWHKK 诊断时和复发时匹配样本的原始细胞表面表达。(F)显示了来自 PAWHKK 的 HSPC 样细胞在诊断(上)和复发(下)时的谱系评分。(G) UMAP(scATAC-seq 数据)显示来自 PAWHKK(左)或 PAUZRT(右)的所有细胞,通过活检着色(从上到下),由 Monocle 推断细胞类型和进行轨迹分析。(H) 诊断和复发时活检活检母细胞含量分布。(I) 诊断时和复发时的GSVA 特征评分的分布。(J) 箱线图显示诊断和复发样本中淋巴标记物的表达值。
+ + + + + + + + + + +
结 论
本项研究使用scRNA-seq和scATAC-seq 来分析 28 名代表不同 pAML 亚型的患者在诊断、缓解和复发时的情况。诊断时,遗传亚群之间的细胞组成有所不同。复发后,无论亚型如何,细胞层次结构都会转变为更原始的状态。复发肿瘤中的原始细胞与诊断时的细胞不同。在一些患者中,这伴随着 B 淋巴样层次结构的出现。因此,本项研究的数据揭示了pAML 肿瘤内的细胞群会响应治疗而发生纵向变化,并为潜在的可靶向过程提供新的理论依据。
+ + + + +



 English
English


