文献解读|Microbiome (15.5):表观遗传修饰在植物-微生物互作中的长期效应:植物促生菌诱导的DNA甲基化修饰介导了促进过程
✦ +
+
论文ID
原名:Long-term effect of epigenetic modification in plant-microbe interactions: modification of DNA methylation induced by plant growth-promoting bacteria mediates promotion process
译名:表观遗传修饰在植物-微生物互作中的长期效应:植物促生菌诱导的DNA甲基化修饰介导了促进过程
期刊:Microbiome
影响因子:15.5
发表时间:2022.2.24
DOI号:10.1186/s40168-022-01236-9
背 景
土壤微生物组,通常被认为是下一次绿色革命的基石,而植物促生菌(Plant growth-promoting bacteria, PGPB)是微生物组工程的关键。然而,从植物有益微生物的发现到应用于农业中这一过程仍然具有挑战性,因为在天然土壤中有益菌株与植物相互作用的机制仍然在很大程度上是未知的。目前,有众多研究表明,可改变微生物组的菌株通常会在土壤中被淘汰,而另一些研究则报道了PGPB作为接种剂的应用显著改善了植物的生长,但目前有关PGPB促进生长的相关机制还知之甚少。
实验设计
结 果
01
根际微生物组与植物发育息息相关
为了探究PGPB和植物发育对微生物组的影响,本研究探究了接种及植物栽培处理后30天内根际微生物组的变化。两种菌剂(菌株PGP5和PGP41)在第3天均检测到高丰度,随后迅速下降至对照土壤中的相同水平,表明菌剂在土壤中未能生长(图 1A, B)。α-多样性的测量揭示了植物发育过程中多样性随时间的变化(图 1C-E)。原始细菌群落(第0天)的α-多样性最高,而第3天群落最低。从第3天到第30天,所有群落的α-多样性均随时间增加而增加。植物培养处理(CK)与接种菌株PGP5 (PGP5)或菌株PGP41 (PGP41)处理的样品之间没有显著变化。15-30天后期的α-多样性变化较0-7天前期平缓,表明根系微生物逐渐趋于稳定。β-多样性分析也揭示了类似的结果(图 1F-H)。在所有土壤样品的主坐标分析(PCoA)中,第0天的样品聚集在一起,在第一坐标轴上远离植物居留(不同时期CK、PGP5、PGP41)的样品(图 1G)。对于有植物残留的土壤样品,在第二坐标轴上,晚期样品在植物发育阶段上偏离早期样品较远,在早期和晚期之间的边缘有重叠(图 1G)。不同处理的土壤样品未检测到分离,表明植物根际微生物组发育依赖在处理间的变化趋势一致。此外,在处理结束(第30天)时采集的所有处理根际微生物组与各时间点采集的根际微生物组之间的距离随着植物停留时间的增加而减小(图 1F)。此外,两两相关分析表明,无论是否接种,在根系发育的第3天,根际微生物组发生了显著变化,然后在根系发育的第15天之后逐渐趋于稳定(图 1H)。随后,进一步利用随机森林模型确定了与根系停留时间相关的操作分类单元(OTU),共检测到13个OTU。虽然前期相对丰度较低,但大部分OTUs在后期仍保持较高水平(图 1J)。在接种处理的样品中也检测到了后期高于前期的模式(图 1J)。这些结果表明,根际隔室对根际微生物组可能具有募集作用,在根系与特定细菌形成亲密关系后稳定了根际微生物组。
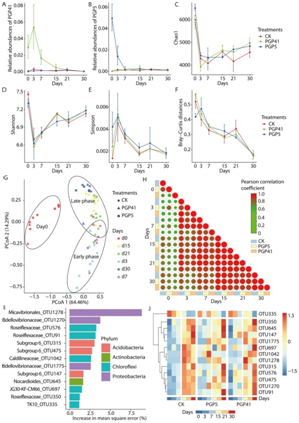
图1 根系诱导的根际微生物组的分类学变化
02
菌剂诱导的根际微生物组的变化仅限于菌剂前期
尽管根系的生长和发育是影响根际微生物组的主要因素,但接种诱导的根际微生物组的变化在早期就被检测到。与CK-Day 3相比,PGP5-Day 3和PGP41-Day 3共检测到58个丰度差异显著的属(图 2A, B)。这些结果表明,PGP41-Day 3或PGP5-Day 3的差异丰度属主要在早期发挥作用,在后期恢复到CK水平。此外,在共现网络分析中发现早期和晚期之间存在显著差异(图 2D-G)。此外,CK与PGP5或PGP41的网络在早期阶段存在显著差异,但在晚期阶段没有显著差异,这一点被节点级特征所证实(图 2F, G)。此外,接种PGP5或PGP41显著降低了前期的负相关性,由19.7% (CK)降至13.6% (PGP5)和10.5% (PGP41) (图 2D, E)。后期负相关性差异不显著,CK、PGP5和PGP41分别为26.4%、28.6%和27.2%。后期与前期相比负相关性的增强可能是由于根系对特定细菌的募集,排除了非相关细菌。总的来说,上述结果表明,在分类学水平上,根系对根际细菌的招募作用具有持久性,而接种主要影响早期的根际微生物组。
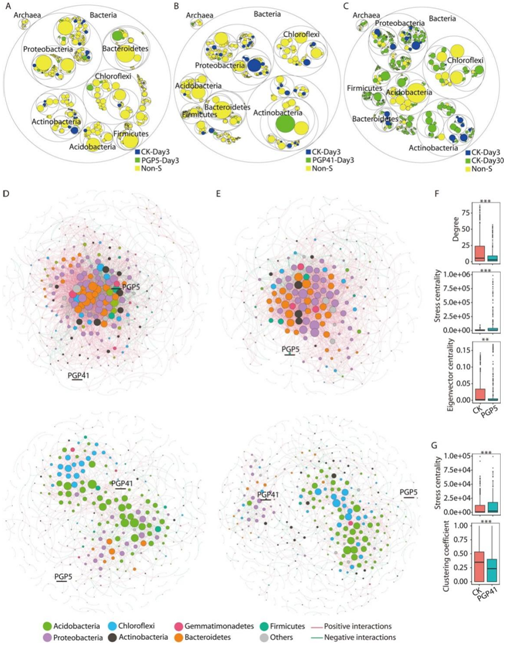
图2 菌剂诱导根际微生物组的分类学变化
为了明确根际微生物组之间的功能差异,又进行了宏基因组分析。选取第3天和第30天的样本分别代表早期和晚期。在功能图谱的主成分分析(PCA)中,第3天样品在第一坐标轴上与第30天样品分离,PGP5和PGP41样品在第二坐标轴上与CK在第3天分离(图 3A)。然而,在第30天时,PGP5和PGP41样品与CK之间没有检测到分离(图 3A)。所有注释到KEGG类别的基因在第3天显示出比第30天更高的变异(以所有样本的变异系数来衡量),此外,在碳水化合物或氨基酸代谢类别中均存在显著差异(图 3B)。对于第3天的样品,在PGP5-CK和PGP41-CK中分别鉴定出55和77个具有显著差异丰度的COGs (图 3C-E)。然而,这些COGs在第30天的样品间表现出相似的丰度(图 3D, E)。此外,第30天,在PGP5-CK和PGP41-CK的比较中没有检测到丰度有显著差异的COG或KEGG类别。这些结果表明,接种后引起的根际微生物组功能水平的变化仅限于早期阶段。
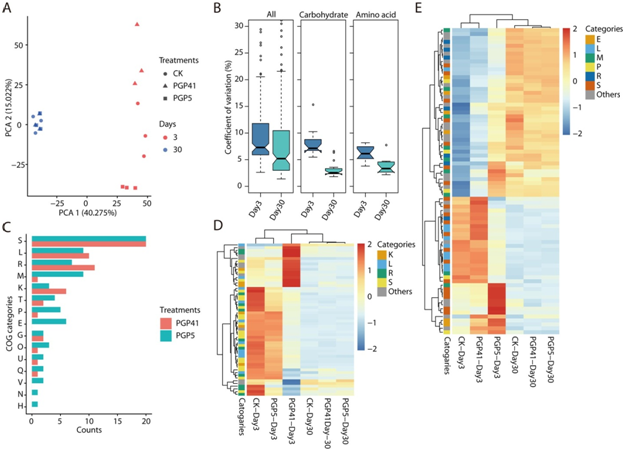
图3 根际微生物组的功能变化
03
微生物组诱导根系基因表达的变化可选择性的持续到后期
本研究使用RNA测序(RNA-seq)建立了在接种和未接种土壤中生长的植物在早期和晚期的基因表达差异模式。在第3天,PGP5-CK和PGP41-CK分别检测到20,968和11,825个差异表达基因(DEGs),表明接种和/或改变根际微生物组引起的基因表达在早期发生了彻底的变化。在第30天,PGP5-CK和PGP41-CK组分别检测到2825和1843个DEGs。有趣的是,在第30天,PGP5和PGP41分别有37.4%和40.6%的DEGs在第3天差异表达(图 4A)。这些结果表明,后期的DEGs可能是由前期接种诱导产生的,因为在第30天检测到的根际微生物组之间没有显著差异。此外,GO富集分析显示,DEGs涉及“过氧化氢代谢过程”、“碳水化合物代谢过程”和“细胞壁组织”,与植物和微生物之间的相互作用有关。根在早期阶段的更快、更强的反应可能是由激发引起的,导致抗性增加。
加权基因共表达网络分析(WGCNA)用于确定具有高度相关表达模式的DEGs的模块以及根系基因表达与根际微生物组的关联。共鉴定出16个共表达模块(图 4B)。该团队进一步考察了图 1G中微生物群落PCoA的3个主要主成分所代表的根际微生物组的模块特征基因与性状之间的关系。8个模块(P < 0.05)与PCoA2或PCoA3显著关联,另外5个模块(P < 0.06)仅与3个模块弱关联,与3个主成分不相关(图 4B)。结果表明,根中DEGs的表达与根际微生物组高度相关,特别是绿松石模块(图 4C, R=0.81, P < 0.001)。结合大部分差异表达基因及其在后期显著富集的功能在前期也被检测到的结果,这些结果表明微生物组诱导的根系基因表达变化选择性地维持到后期。
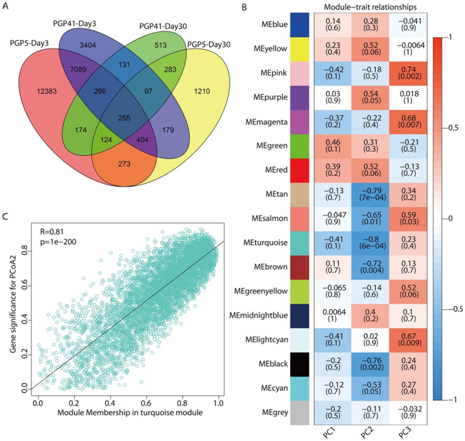
图4 根际微生物诱导根系基因表达谱的变化
04
接种后DNA甲基化修饰会影响根系的基因表达
为了检测接种是否影响根中的DNA甲基化,进行了DNA甲基化的WGBS分析。每个样品中共鉴定出1400-1900万个甲基化胞嘧啶(mCs)。与CG (9-20倍)和CHG (2-6倍)背景相比,在CHH背景中鉴定出多个差异甲基化区域(DMRs) (图 5A);因此,只关注CHH背景下的DMRs。这些结果表明,在植物-微生物互作过程中,某些区域的DNA甲基化变化从起始阶段一直维持到后期阶段。在PGP5-Day 3中,高甲基化的DMRs占主导地位,而在PGP41-Day 3中发现了几乎等量的低甲基化和高甲基化的DMRs (图 5B)。然而,在第30天,低甲基化的DMRs在PGP5和PGP41样品(图 5B)中占主导地位。相应地,在PGP5-Day 3中,高甲基化(优势型) DMRs与所有基因(P < 0.01; 图 5C)相比显示出更高的差异转录丰度水平,而低甲基化DMRs与所有基因相比显示出相似的差异转录丰度水平(图 5C)。PGP5-Day 30 (P < 0.05)和PGP41-Day 30 (P < 0.05)的优势型DMRs也存在显著差异,而非优势型则表现出相似的水平(图 5C)。对于PGP41 - Day 3,在未检测到显性DMR类型的情况下,低甲基化和高甲基化DMR均表现出转录本丰度差异(P < 0.05, 图 5C)。优势DMR类型与转录本丰度之间的关系表明,接种诱导的DNA甲基化修饰可能参与基因表达的调控。
紧接着,进一步检测了DMRs对基因表达的影响。首先,基于重叠的DEGs和DMRs分析了改变的基因表达和DNA甲基化水平之间的相关性。在第3天和第30天,基因表达的倍数变化与DNA甲基化(R > 0.7且P < 0.001, 图 5E, F)之间检测到强烈的正或负关系。此外,后期DMRs的GO分析显示,转录调控、激素水平调节、防御反应、核苷酸结合和G蛋白偶联受体信号通路显著富集,上述信号通路均与基因的表达调控相关(图 5D)。此外,在与接种最显著相关的模块中,有420个(7.6%)基因被鉴定为DMRs(图 4C)。这些数据表明,在菌株PGP5/PGP41与P. americana互作过程中,基因转录至少有部分受到DNA甲基化控制。

图5 DNA甲基化图谱的变化及其与基因表达的相关性
05
DNA甲基化的改变与接种诱导的P. americana生长促进有关
接种显著提高了(第3天和第7天)初期根际土壤中菌株PGP5和PGP41的丰度,二者在对照土壤中的丰度迅速下降至同一水平。菌株PGP5和PGP41的接种根与对照(未接种的根)相比均无显著差异。结果表明,两种菌剂在接种初期均存在于根际土壤中,后期从根际土壤中被清除,且菌剂在根系中没有定殖。通过原位杂交(FISH)、绿色荧光蛋白(GFP)标记菌株的荧光和16Sr RNA基因扩增进一步验证了这一结论。这些结果表明,接种菌株在P. americana根部没有定殖。为了检验根际微生物组的变化是否对PGPB促进植物生长是必要的,该团队使用灭菌土壤进行植物发育和接种处理。这些结果表明,根际微生物组的变化和菌剂在根中的定殖都不是促进植物生长所必需的。
为了研究DNA甲基化在接种诱导的P. americana生长促进中的作用,用DNA甲基化抑制剂Zeb处理P. americana幼苗(图 6A, B)。处理后,分别接种经Zeb处理和未经Zeb处理的P. americana,检测接种诱导的促生长相关基因(图 6C, D)的表达。在没有Zeb处理的情况下,参与维持DNA甲基化的基因在接种根和未接种根的早期表现出显著不同的表达模式,但在后期中没有表现出显著差异(图 6C)。然而,在Zeb处理下,这些基因在Zeb处理的根中的基因表达比非Zeb处理的植株发生了错误的调控,表明Zeb处理破坏了Zeb处理植株中接种诱导的DNA甲基化模式(图 6C)。为了进一步验证Zeb诱导的DNA甲基化的破坏对接种诱导的生长促进相关基因表达的影响,从重叠的DEGs和DMRs中随机选择了15个基因进行了表达分析(图 6D)。正如预期那样,在这些基因中,与未被Zeb处理的植株相比,在Zeb处理的根中检测到了基因表达的错误调控。这些结果表明,Zeb处理可以通过改变DNA甲基化模式来破坏接种诱导的基因表达模式。与此一致,在接种处理下,与CK样品相比,未接种Zeb处理的P. americana (PGP5和PGP41)在第30天根和茎的生物量显著增加(图 6F),但在第3天没有显著变化(图 6E),表明在没有Zeb处理的情况下,接种诱导了植物的生长。然而,在第30天,Zeb +接种处理(Zeb-PGP5和Zeb-PGP41)和仅接种Zeb处理(Zeb-CK)的生物量没有显著差异(图 6F)。此外,Zeb处理的对照样品(Zeb-CK)和未处理的CK样品在第30天的生物量没有差异。这些结果表明,Zeb处理极大地削弱了菌剂对植物生长的促进作用。这些结果表明,接种诱导的P. americana的生长促进至少部分是由DNA甲基化的变化介导的。此外,还在接种后60天检测到接种诱导的P. americana生长有促进效果,这表明接种诱导的早期DNA甲基化改变在接种诱导的植物生长促进中具有长期效应(图 6G)。

图6 DNA甲基化抑制剂处理后破坏了菌株PGP41和PGP5菌株对P. americana的促生长作用
+ + + + + + + + + + +
结 论
本研究为微生物-植物相互作用提供了重要见解,并强调了根中DNA甲基化修饰在响应PGPB中的重要性,提出了PGPB诱导的根中DNA甲基化修饰可促进植物生长的新机制。此外,即使从微生物组消除接种体后这些表观遗传修饰仍然具有相关功能。这些结果为通过应用PGPB调控微生物组进而促进植物生长提供了新的策略。在未来的研究中,仍需要更多的研究来揭示PGPB早期诱导DNA甲基化修饰的详细过程,以证明PGPB产生的专一性分子/代谢物是否可以调节根系DNA甲基化,这对于未来PGPB广泛应用于田间十分重要。
+ + + + +



 English
English


