文献解读|Cell(64.5):局部微环境驱动人脑肿瘤中中性粒细胞的激活
✦ +
+
论文ID
原名:The local microenvironment drives activation of neutrophils in human brain tumors
译名:局部微环境驱动人脑肿瘤中中性粒细胞的激活
期刊:Cell
影响因子:64.5
发表时间:2023.10.12
DOI号:10.1016/j.cell.2023.08.043
背 景
中枢神经系统肿瘤包括原发性和转移性恶性肿瘤,通常预后不良。在原发性脑肿瘤中,弥漫性神经胶质瘤是最具侵袭性的类型,根据异柠檬酸脱氢酶 1 和 2 (IDH) 突变的发生情况进行分类。IDH突变型 (mut) 肿瘤通常是低级别胶质瘤,而IDH野生型 (WT) 肿瘤则代表高级别侵袭性胶质母细胞瘤 (GBM), 脑转移(BrM)更为常见,主要源自原发性肺肿瘤、乳腺癌、黑色素瘤和肾肿瘤。
中性粒细胞是循环系统中丰富的免疫细胞,经常大量浸润肿瘤。然而,它们在不同癌症类型中的精确功能仍不完全清楚,包括在大脑微环境中。
实验设计
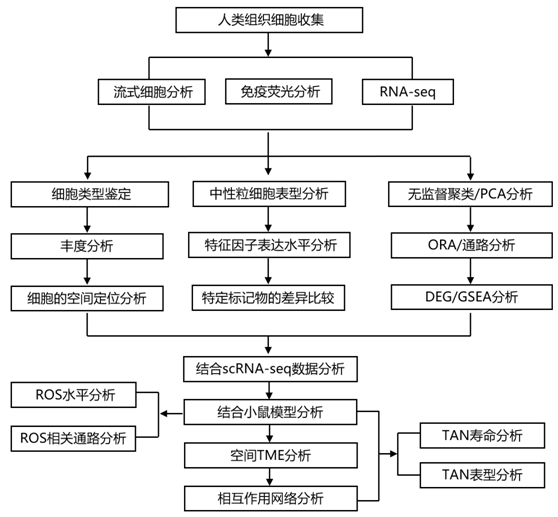
结 果
01
人类 BrM 中的中性粒细胞比原发性神经胶质瘤更丰富,并且它们的表型在大脑 TME 中发生了改变
在这项研究中,研究者团队研究了颅内和颅外肿瘤中不同的脑肿瘤微环境(TME)是否会改变中性粒细胞。他们使用了一系列方法[流式细胞术 (FCM)、用于空间 TME 分析的免疫荧光 (IF) 染色、转录组分析(RNA -seq)、微环境培养物(MEC)、蛋白质阵列和各种离体功能测定](图 1 A),首次全面研究大脑肿瘤相关中性粒细胞 (TAN)和外周血中性粒细胞 (PBN) 的表型、转录组和功能。
与IDH mut 胶质瘤和非肿瘤组织相比,IDH WT 胶质瘤和 BrM 中的相对 TAN 丰度显著增加,其中 BrM 中的 TAN 比例最高(图1B)。同样, IDH WT 胶质瘤和 BrM 患者的血液中性粒细胞与淋巴细胞比率 (NLR) 显著高于健康供体(HD)(图1C)。
通过对整个组织切片进行 IF 染色,他们分析了中性粒细胞 (CD15 + CD45 +) 相对于脉管系统 (CD31+) 的定位,并证明中性粒细胞确实穿透脑(肿瘤)组织(图1D-F)。对中性粒细胞与血管的接近程度量化分析显示,它们在脑肿瘤组织的血管周围生态位中密度较高(图1D)。值得注意的是,brm表现出最高的空间TAN密度(图1D),证实了FCM测定的总体丰度升高(图1B)。
他们分析了典型的中性粒细胞激活标记物和功能分子,这些标记物在其他肿瘤中由 TAN 差异表达。
与匹配的PBN相比,脑tan(与肿瘤类型无关)表现出明显的激活特征,其特征是CD11B、CD15、CD66B和S100A9的表达增加、CD62L的表达减少,同时趋化因子受体CXCR1、CXCR2和CXCR4的水平显著改变(图1G)。
在功能上,他们观察到细胞内基质金属蛋白酶 9 (MMP9) 和精氨酸酶 1 (Arg1) 水平较低(图1 G),这可能表明它们分泌到TME。TAN 还表达较高水平的程序性死亡配体 1 (PD-L1)(图 1 G),它不仅抑制 T 细胞还可以延缓中性粒细胞凋亡。
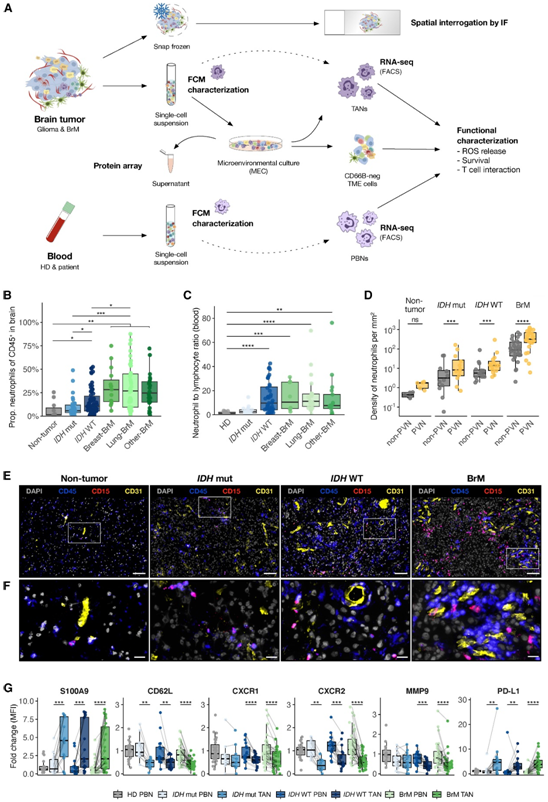
图1. 人类 BrM 的 TME 中性粒细胞比原发性胶质瘤更丰富,并且表型发生改变。
(A) 分析人脑肿瘤组织和匹配血液的实验设计和方法。(B)非肿瘤组织和肿瘤组织中CD45 +免疫细胞中的中性粒细胞比例。(C)中性粒细胞与淋巴细胞比值测定。(D)非血管周围生态位(non-PVN)、非肿瘤组织和肿瘤组织PVN的中性粒细胞密度。(E-F)代表性 IF 图像。(G) 荷瘤患者的匹配 PBN 和 TAN 中的差异倍数的中值荧光强度 (MFI)。
02
大脑中性粒细胞富含炎症基因特征,这种特征在 BrM 中更为明显
他们接下来采用一种无监督的方法来分析来自脑肿瘤患者的匹配的 PBN 和 TAN、来自 HD 的 PBN 以及来自非肿瘤脑组织的中性粒细胞的转录组,每个都通过荧光激活细胞分选 (FACS) 和然后进行 RNA-seq。无监督聚类和主成分分析 (PCA) 显示,TAN 具有与 PBN 不同的转录特征(图2A),而患者 PBN 与 HD PBN 非常相似。这种广泛的分离不受治疗史、肿瘤分级或突变状态的影响(图2A)。过度代表性分析 (ORA) 揭示了 BrM PBN 和 TAN 与 HD PBN 之间共有的三个重要通路,均与炎症信号传导广泛相关。
与HD pbn相比,非肿瘤脑组织中的中性粒细胞表现出明显不同的转录谱,与脑tan聚集在一起,大多数差异表达基因(DEG)与tan重叠(图2A-B)。非肿瘤脑中性粒细胞与HD PBN中升高的几个基因包括与代谢改变相关的基因(OLR1/LOX1、ALOX15B、CH25H、AREG、PTN和APOC2)和多种神经营养因子(NR4A1、NR4A2、NR4A3、RAB3IL1、SYNDIG1、TSPAN7和RASGEF1C)(图2C)。
为了评估非肿瘤脑中性粒细胞和脑 TAN 与 HD PBN 之间共有哪些转录改变(图 2 B),他们进行了 ORA分析,主要鉴定炎症通路(图 2 D)。大脑 TAN 与非肿瘤脑中性粒细胞相比,乳腺和肺 BrM TAN 中的 DEG 明显多于IDH mut 和IDH WT 胶质瘤 TAN,表明胶质瘤 TAN 几乎没有发生肿瘤特异性改变(图 2 E)。无论突变状态如何,BrM 和神经胶质瘤 TAN 之间都没有重叠(图 2 E-F)。虽然乳腺和肺 BrM TAN 在炎症和免疫激活信号通路中进一步富集(图 2 G),但IDH mut,尤其是IDH WT TAN 主要表现出增加的细胞外基质相关特征(图 2 G)。
然后,他们通过交叉分析从BrM与胶质瘤TAN(疾病特异性改变)中的DEG,以及TAN与匹配的pbn(组织特异性改变)中的DEG,汇总了核心DEG特征。虽然只有30个基因在胶质瘤TAN中较高,但247个基因是BrM TAN特异性的(图2H),并且在促炎信号通路中大量富集,特别是在肿瘤坏死因子α (TNF-α)信号通路(图2I)。
接下来,他们将本项研究的数据与公开的单细胞转录组分析 (scRNA-seq)数据集进行了比较,这些数据集用于原发性肺癌和黑色素瘤- brm的人类TAN。在肺癌中发现的促炎和肿瘤特异性中性粒细胞聚类N4-5的在肺- brm tan中显著富集(图2J),这表明原发性肺癌和肺- brm的微环境之间存在相似性。与黑色素瘤-BrM scRNA-seq数据集的比较显示,胶质瘤TAN富含与干扰素响应相关的基因,而BrM TAN具有更多的促炎白细胞介素(IL)-8和钙保护蛋白聚类。这表明了TAN的转录异质性,不仅在不同级别和突变背景的胶质瘤和BrM之间(图2J),而且在每个组织中不同的亚群。
与乳腺癌 BrM 相比,肺癌 TAN 与肺 BrM 具有更多相似性(图 2 K)。27 个 DEG 的仅在乳腺和肺 BrM TAN 之间共同存在(图 2 K),揭示了 BrM TAN 中特异性诱导的 TNF-α 信号传导和广泛的促炎信号传导(图 2 L)。
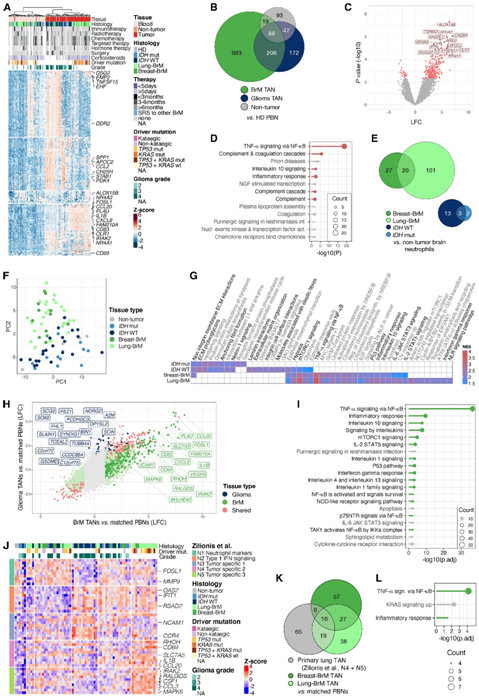
图2. 中性粒细胞转录在脑组织环境中发生改变。
(A) 无监督热图显示了前 250 个变化最大的中性粒细胞基因。(B) 欧拉图显示 BrM/神经胶质瘤 TAN 和非肿瘤脑中性粒细胞与 HD PBN 中上调差异表达基因 (DEG) 的交集。(C)火山图显示非肿瘤脑中性粒细胞与HD pbn中的deg。(D) 对 Hallmark、KEGG 和 Reactome 数据库中非肿瘤脑中性粒细胞、神经胶质瘤和 BrM TAN 与 HD PBN 之间共享的上调 DEG 的通路进行过度表征分析 (ORA)。(E) 欧拉图显示肺、乳腺 BrM、IDH WT 和IDH mut 神经胶质瘤 TAN 与非肿瘤脑中性粒细胞中上调 DEG 的交集。(F) 非(肿瘤)脑组织中中性粒细胞转录谱的 PC 图。(G)基因集富集分析 (GSEA)。(H) 点图显示 BrM/神经胶质瘤 TAN 与匹配的 PBN 之间各个 DEG 的 LFC。(I) 来自 Hallmark、KEGG 和 Reactome 数据库的前 20 个最重要通路的 ORA。(J) 热图显示每个中性粒细胞聚类中与前 10 个最可变基。(K) 欧拉图描绘了肺和乳腺 BrM TAN 与匹配的 PBN 中上调的前 100 个 DEG 之间的交集。(L) 来自 Hallmark、KEGG 和 Reactome 数据库的重要通路的 ORA。
03
在含brm患者的循环中性粒细胞中ROS释放升高,并在脑 TME 中消除
考虑到观察到的患者大脑 TAN 中组织和 TME 特异性的改变,他们使用乳腺癌 BrM 和 GBM 小鼠模型进一步研究了它们的功能改变。这些完全免疫功能的模型密切反映了在人类肿瘤中的 TAN 丰度增加(图 3 A)。BrM 和神经胶质瘤中 TAN 的表型也因物种间保守的标记而发生类似改变(图 3 B)。
接下来,他们检测了分离的小鼠pbn和TAN产生活性氧(ROS)的能力,ROS是活化中性粒细胞与细胞杀伤、诱变和T细胞抑制相关的标志性特征。有趣的是,与匹配的pbn相比,BrM和GBM tan产生的ROS更少(图3C)。
在功能测定中, BrM 患者的 PBN 比神经胶质瘤和 HD PBN 释放更多的 ROS(图 3D-E)。与匹配的 PBN 相比,从神经胶质瘤和 BrM 样本中分离出的 TAN 产生的 ROS 显著减少(图 3 F),这与在小鼠模型中的结果相似。在转录水平上,大脑 TAN 显示出与 ROS 产生和氧化稳态相关的基因的明显失调(图 3 G)。与 PBN 相比,TAN 中NCF1、NCF2和NCF4 (NADPH 氧化酶亚基)的表达降低,同时诱导了有效抗氧化反应机制的成分(例如谷胱甘肽成员GCLC、GCLM、GPX3、GPX8;过氧化还原蛋白PRDX1、PRDX2、PRDX4)和超氧化物歧化酶亚基SOD1、SOD2和SOD3)(图 3G)。相比之下,非肿瘤脑中性粒细胞表达高水平的促ROS相关基因和抗ROS相关基因(图3G),表明健康大脑环境具有适度的ROS抑制潜力。
为了检测脑 TME 对离体中性粒细胞 ROS 水平的影响,他们将 TAN (CD66B+) 从 TME 的其余部分(即 CD66B-细胞)中分离出来,发现 ROS 水平立即增加(图 3 H),表明ROS 损伤是部分可逆的、短暂的。他们发现TAN ROS释放在phorbol 12-肉豆酸酯13-乙酸酯(PMA)的响应下显著增加,PMA是中性粒细胞ROS产生的有效驱动因子,并且这种激活克服了CD66B - tme驱动的ROS抑制(图3H)。为了使用离体培养物模拟PBN进入大脑TME ,他们将PBN或TAN与匹配的CD66B-TME共同孵育,证实了ROS迅速释放的特征且细胞比例依赖性抑制特征(图3H)。总之,这些数据表明大脑 TME 可以抵消中性粒细胞 ROS 的释放。
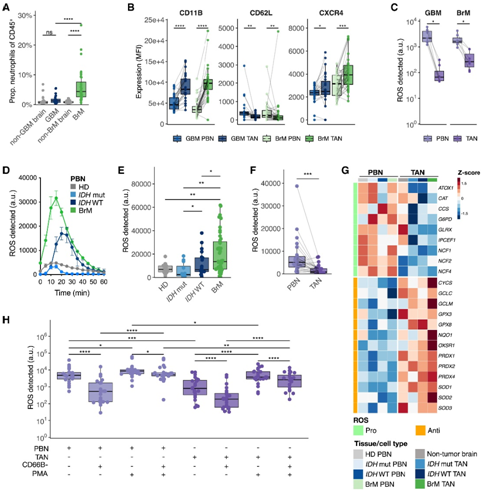
图3. 鼠脑 TAN 在表型和功能上发生改变,人类中性粒细胞 ROS 水平也发生改变。
(A) 中性粒细胞的比例。(B) 标记物的 MFI。(C) 在 Ntv-a 中分离的 PBN 和 TAN 中检测到任意单位 (au) 的 ROS。(D) HD 和脑肿瘤患者的 PBN 中随着时间的推移测量的 ROS 的代表性曲线。(E) 在 HD和荷瘤患者的 PBN 中检测到的最大 ROS。(F) 在匹配的 PBN 和 TAN 中检测到 ROS。(G) 热图显示 BrM 和神经胶质瘤 TAN 与匹配的 PBN 中 ROS 相关的显著 DEG。(H) 在匹配的 PBN 和 TAN 与 CD66B – TME 的共培养物中检测到 ROS。
04
空间 TME 分析揭示 TAN 与 PD-1+ CD8+T细胞和内皮细胞的关联
在早期肺癌中,TAN 显示出抗原呈递能力。然而,与小胶质细胞(MG)和单核细胞衍生的巨噬细胞 (MDM)相比,只有少数脑TAN表达抗原呈递分子(例如HLA-ABC、HLA-DR、CD80和CD86)(图4A)。
他们还检测了与 PBN 或 TAN 共培养时CD3+ T 细胞细胞因子的产生,发现细胞毒性介质的分泌没有变化(图 4 B),这表明脑 TAN 不会改变 CD3 + T 细胞细胞因子的分泌。在空间上,与所有 TME 细胞与该群体的平均距离相比,CD4+T 辅助细胞、Treg 和 CD8+T 细胞与 TAN 的距离更近(图4C)。他们还评估了 CD8 + T 细胞上的程序性细胞死亡蛋白 1 (PD-1) 和 TAN 上的 PD-L1的表达,这表明 PD-L1 + TAN距离 PD-1 + CD8 + T 细胞最近(图 4D),并且在PD-1+ CD8+ T细胞生态位中最丰富的PD-L1+细胞类型确实是tan(图 4 E),这表明 TAN 可能在大脑 TME 中具有免疫抑制功能。
他们发现IDH WT 胶质瘤和 BrM 中的血管生成因子降低,尤其是在血管周围生态位 (PVN)中(图 4F)。此外,无论脑肿瘤类型如何,TAN 优先位于较大血管的 PVN 内,并且更靠近增殖的内皮细胞(图 4 G)。与匹配的 PBN 相比,神经胶质瘤和 BrM TAN的血管生成通路显著富集(图 4H-I)。一些促血管生成因子在非肿瘤脑中性粒细胞中也上调,尽管程度不如IDH WT 和 BrM TAN(图 4 I)。
此外,他们揭示了血管畸形与 TAN、MG 和 MDM中几种促血管生成基因的表达水平之间存在显著相关性(图 4 J)。总之,这些结果证明骨髓区室在促进神经胶质瘤和 BrM 异常血管生成中的重要作用。

图4. 大脑 TAN 与 PD-1 + CD8 + T细胞和脉管系统共定位。
(A) 匹配的 MDM、MG 和 TAN 中表达抗原呈递分子的细胞比例。(B)细胞因子浓度(pg/mL)。(C) BrM和IDH WT胶质瘤中单个T细胞到最近的TAN的距离。(D) 代表性肺 BrM 图像显示 TAN和 CD8 + T 细胞的 IF 细胞类型定量。(E)细胞类型的平均比例。(F)在PVN中存在(Pos)或不存在(Neg)中性粒细胞时的平均因子。(G) Ki67−和 Ki67+内皮细胞到最近 TAN 的距离 (μm)。(H) 神经胶质瘤中 Hallmark 血管生成通路的 GSEA 和 BrM TAN 联合分析。(I) 按脑组织类型和 PBN/TAN 分层的 Hallmark 血管生成通路中各个基因的热图。(J) 平均血管生成因子与脑(肿瘤)中性粒细胞中血管生成相关基因的标准化基因计数之间的相关性。
05
大脑 TME 对中性粒细胞有不同的影响,并延长其寿命
与培养中的匹配 PBN 相比,分离的小鼠乳腺 BrM TAN 显示出显著延长的存活期(图 5 A)。考虑到离体评估中性粒细胞寿命的局限性,他们接下来使用中性粒细胞命运图谱小鼠系(iLy6GtdTomato)研究其体内衰变;这是首次应用于临床前癌症模型。
在 BrM 和 GBM 中,与健康大脑中性粒细胞相比,大脑 TAN 的平均寿命更长的趋势(图5B-C)。
接下来,他们通过在离体肿瘤 MEC 中分离和培养这些细胞,分析了人类 TAN 的寿命。高达 80% 的 TAN 可以存活 24 小时,甚至高达 20% 的 TAN 在 48 小时后仍然存活,这在所有脑肿瘤类型中都是相似的,并且与治疗史无关(图 5D)。24 小时内存活的 PBN 数量明显减少,几乎所有 PBN 在 48 小时内死亡(图 5 D)。在 CD66B-TME 内培养的 PBN 表现出显著增加的存活率,达到与 TAN 相似的水平(图5D),表明 TME 确实延长了中性粒细胞的寿命。
中性粒细胞不断从骨髓中大量释放,因此,程序性细胞死亡对于维持体内平衡至关重要。与单独培养的 PBN 相比,在 TME MEC 内培养的 PBN 保持存活/凋亡前的时间更长(图 5 E)。在 BrM 和神经胶质瘤中,与 PBN 相比,TAN 中有大量促凋亡基因下调,相反,一些抗凋亡基因上调,特别是在 BrM-TAN 中(图5F)。非肿瘤脑中性粒细胞表现出介于 PBN 和 TAN 之间的中间表型,表明大脑环境已经影响中性粒细胞的凋亡过程(图 5 F)。
在CD66B−TME中培养患者pbn 24小时,大致重现了TAN表型(图5G)。对 10 个 TAN 表型标记物(通过 FCM)分析的单细胞的轨迹分析表明,在 CD66B−TME中培养 24 小时的 PBN 与TAN 融合(图 5 H),而单独培养的 PBN 沿着单独的轨迹。
当在从不同脑肿瘤中分离出的 24 小时 MEC 的条件培养基 (CM) 中培养时,HD PBN 中也会诱导寿命延长和 TAN 表型(图 5 I-J)。此外,BrM-MEC-CM抑制pbn释放的ROS的程度与ROS抑制剂二苯二胺(DPI)效果相似(图5K)。
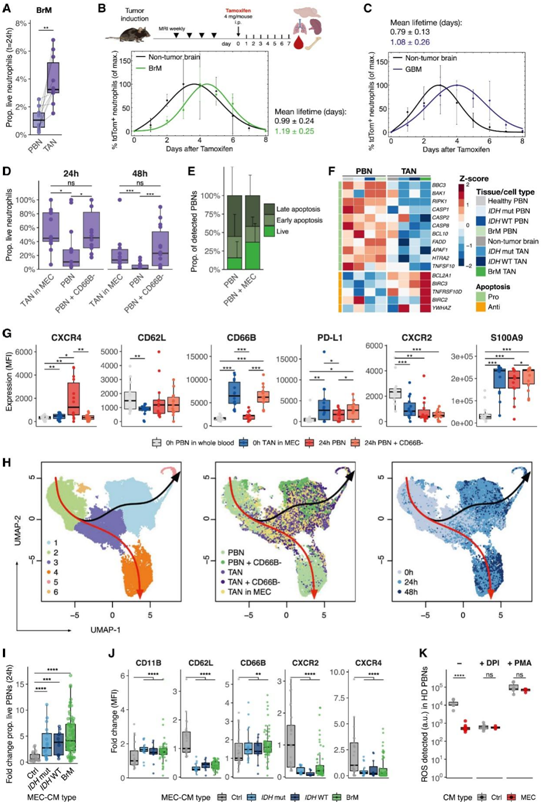
图5. 大脑 TME 调节中性粒细胞存活和表型。
(A)中性粒细胞的比例。(B) 实验设计显示 iLy6G tdTomato小鼠和tdTom+ 中性粒细胞比例在 8 天内在非肿瘤和具有BrM 的小鼠大脑中标准化至最大值。(C) Ntv-a;iLy6G tdTomato非肿瘤和 GBM 小鼠脑中tdTom+中性粒细胞的比例标准化至最大值。(D) 24 小时和 48 小时时肿瘤中活 TAN、匹配的 PBN 和与 CD66B– TME 群体共培养的 PBN 的比例。(E) 单独和与匹配的 MEC 共培养的不同活力阶段的 PBN 比例。(F) 与 PBN 与脑(肿瘤)组织中性粒细胞凋亡相关的 DEG 热图。(G)在CD66B−TME存在的情况下,pbn中表型标记物随时间(0和24 h)的MFI变化。(H)UMAP可视化。(I) 在 MEC-CM 中培养后 HD PBN 24 小时存活的差异倍数。(J) 与对照培养基相比,在 MEC-CM中培养的 HD PBN的 MFI 差异倍数。(K) ROS水平分析。
06
mec衍生的分泌因子调节TAN表型和寿命
当在来自肿瘤细胞系的CM(称为TCM)中培养HD pbn时,与匹配的MEC-CM相比,没有检测到任何寿命延长(图6A)。TCM 和任何非 TCM 都没有重现由完整的 MEC-CM 诱导的中性粒细胞的完整表型转变(图 6 B)。这些结果表明,大脑微环境调控的群体产生的相关因子(而不是肿瘤细胞),影响了中性粒细胞改变。
大多数BrM-MEC紧密聚集在一起,与神经胶质瘤MEC有一些区别。与对照组相比,蛋白质表达上调的亚组,以及在CM类型之间存在显著差异表达,这揭示了57种MEC特异性蛋白质(图6C)。
对这些 MEC 特异性上调蛋白应用相互作用网络分析,揭示了几个以高度互连的促炎细胞因子为中心的聚类(图 6D),TNF-α是一种有效的招募和中性粒细胞激活因子,位于该聚类的核心(图6D-E)。他们还在MEC-CM中检测到高水平的铜蓝蛋白(CP)、Glyoxalase 1 (GLO-1)和IL-9(图6D-E),它们是减少ROS产生和延长中性粒细胞寿命的重要调节因子。
值得注意的是,TNF-α处理的HD pbn具有更类似tan的表型,包括CD11B/CD66B上调和CD62L下调,但CXCR2/CXCR4水平没有变化(图6F)。在MEC-CM 中,通过抑制 CD11B/CD66B 表达来部分逆转 TAN 样表型,而其他促炎信号传导抑制剂则不会产生这种效应,甚至会加剧这种效应(图 6 G)。CP是唯一能够诱导部分tan样表型的可溶性因子,并可增加CD11B/CD66B表达(图6F)。TNF-α和CP联合处理进一步增加了TAN样表型,并且CXCR2表达显著降低(图6F)。CP 处理后 HD PBN 中的 ROS 水平降低(图 6 H)。同样,当与 CP 一起孵育时,活 PBN 的比例增加(图 6 I)。其他MEC-CM特异性可溶性因子(例如GLO-1、IL-6、IL-9和TNF-α)不会引起此类变化(图6H-I)。
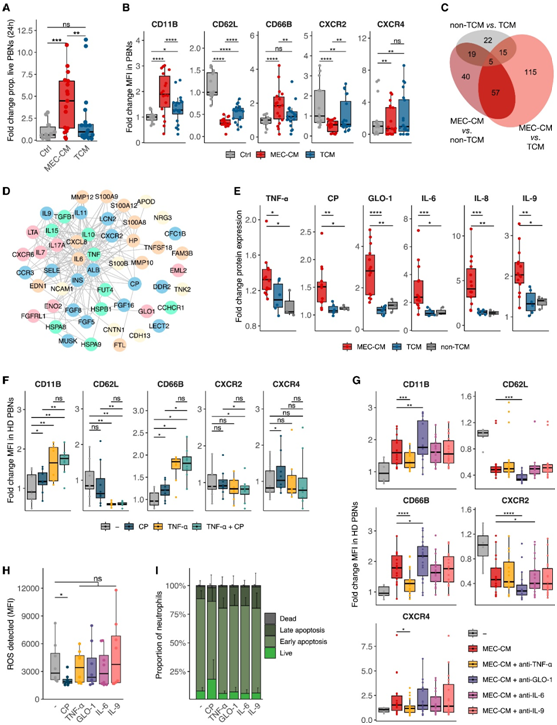
图6. 中性粒细胞的改变是由大脑TME中的可溶性因子引起的。
(A)差异倍数分析。(B) HD PBN 中指示标记的 MFI 差异倍数分析。(C) 欧拉图显示 MEC-CM、TCM 和非 TCM 之间差异检测到的蛋白质的重叠。(D) MEC-CM 与 TCM 和非 TCM 中 51 个差异表达蛋白的蛋白质相互作用网络。(E)蛋白质的检测标准化为对照培养基。(F) 在用 TNF-α 和/或 CP 处理的 HD PBN中测量的指示标记物的MFI差异倍数。(G) 在 MEC-CM中培养的 HD PBN和指定抑制剂中指定蛋白质的MFI差异倍数。(H) 在用 MEC-CM 特异性介质处理的 HD PBN中检测到 ROS (MFI)。(I)用MEC-CM特异性可溶性因子处理后不同活力阶段的PBN的比例。
07
中性粒细胞主要与骨髓室相互作用
他们表征了离体MEC的细胞组成,24 小时后,CD45 -细胞和所有主要免疫群体仍然存在(图 7 A-B),但细胞数量逐渐减少。他们分析了大脑 TME RNA-seq 数据,以确定哪些细胞类型产生这些 MEC-CM 特异性因子(图 6 D),发现骨髓室,包括 MDM、MG 和 TAN,都大量表MEC 特异性促炎细胞因子(图7 C),鉴定了三个髓细胞特异性聚类:(1)主要由TAM产生的促炎因子(如TNF、IL6和IL10)、(2)主要由中性粒细胞产生的与募集和髓细胞活化相关的因子(如CXCR2、IL9、IL11和CP),以及(3)由整个髓细胞室产生的激活/募集因子(如MMP10、MMP12、CXCL8、S100A8、S100A9和S100A12)(图7 C)。TAM 特异性炎症聚类包含许多在分泌蛋白网络核心的因子(图 6D和7C),这表明其在塑造 MEC-CM 中发挥着关键作用。
在一组IDH WT胶质瘤和BrM组织样本中,他们使用IF量化了TAN周围20 μm半径内的细胞类型。观察到TAN主要与PVN内外的其他TAN相互作用(图7D-E)。与肿瘤细胞的相互作用主要发生在非pvn区。相比之下,MG 和 MDM 是靠近 TAN 的最丰富的非 TAN 免疫细胞,特别是在 BrM PVN 中,它们占细胞邻域的约 20%(图7E)。
他们分析了本项研究的中性粒细胞募集因子的RNA-seq数据(图7F),发现tan和tam显示出这些趋化因子(CXCL8, CXCL5, CXCL1, CSF3, CXCL2和CCL20)的最高表达,并且在更多的恶性肿瘤类型(IDH WT胶质瘤和BrM)中逐渐增加(图7F)。
总之,这些结果揭示了脑肿瘤的髓样细胞生态位内存在高度交互的网络,这在 PVN 中尤其明显。这种骨髓网络不仅对于 PBN 到 TAN 表型和功能的转变至关重要,而且对于中性粒细胞聚集到大脑 TME 中至关重要。
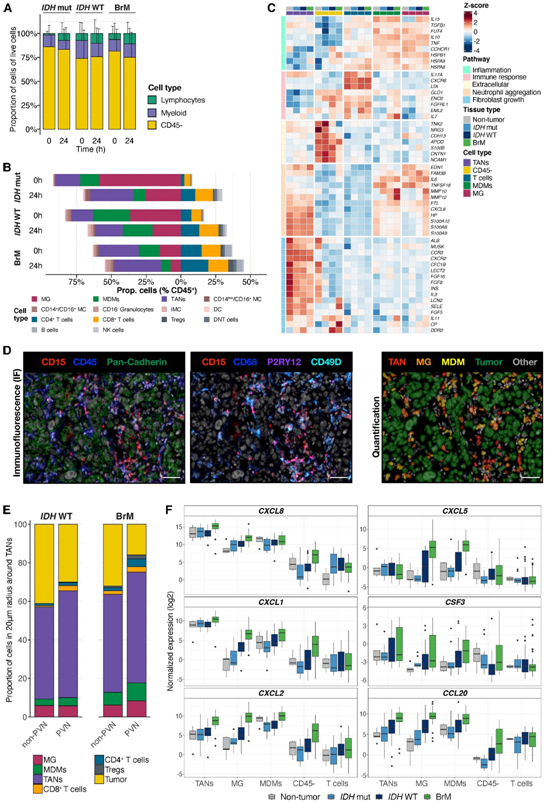
图7. 中性粒细胞与骨髓室相互作用。
(A) 0、24 小时时离体MEC中活细胞的比例。(B) 免疫细胞群的平均比例为(A) 中所示培养物中CD45 +细胞的百分比。(C) 主要 TME 群体中 MEC-CM 特异性上调蛋白的基因表达水平热图。(D) 肺 BrM 中 QuPath 的代表性 IF 图像和细胞类型定量。(E)细胞类型的平均比例。(F)不同脑 TME 群体中嗜中性粒细胞募集细胞因子。
+ + + + + + + + + + +
结 论
本项研究探索了神经胶质瘤和脑转移患者肿瘤组织中的中性粒细胞以及匹配的外周血,并对这些组织中的中性粒细胞表型和功能进行深入分析。人类和小鼠的正交分析策略表明,脑肿瘤相关中性粒细胞(TAN)与血液中性粒细胞显著不同,并且具有延长的寿命以及免疫抑制和促血管生成的能力。TAN 表现出独特的炎症特征,由TNF-ɑ和铜蓝蛋白等可溶性炎症介质的组合驱动,与神经胶质瘤相比,脑转移瘤中的 TAN 更明显。骨髓细胞,包括肿瘤相关巨噬细胞,出现在促炎介质网络的核心,证明了调节人脑肿瘤整体免疫抑制的关键骨髓生态位。
+ + + + +



 English
English


