文献解读|Cell Rep(9.995):癌症化疗药物 5-氟尿嘧啶是一种有效的具核梭杆菌抑制剂并且其活性受瘤内微生物群的影响
✦ +
+
论文ID
原名:The cancer chemotherapeutic 5-fluorouracil is a potent Fusobacterium nucleatum inhibitor and its activity is modified by intratumoral microbiota
译名:癌症化疗药物 5-氟尿嘧啶是一种有效的具核梭杆菌抑制剂并且其活性受瘤内微生物群的影响
期刊:Cell Reports
影响因子:9.995
发表时间:2022.11.15
DOI号:10.1016/j.celrep.2022.111625
背 景
具核梭杆菌 ( Fusobacterium nucleatum, Fn ) 是结直肠癌 (CRC) 组织中的主要细菌种类,与癌症进展和较差的患者预后相关。化疗对于CRC患者的治疗程度有限,特别是在晚期中其作用微乎其微,因此临床需要更有效的治疗方法来对抗这种疾病。过去十几年的研究表明,Fn有助于肿瘤发生和加速癌细胞生长,并且发现在Fn阳性的人类 CRC 异种移植瘤的小鼠中用抗生素甲硝唑处理可显着降低肿瘤生长和癌细胞增殖, 表明靶向Fn可能是部分 CRC 患者的潜在治疗方法。这项研究通过1,846 种生物活性化合物的小分子筛选出了对Fn的有效抑制剂——5-氟尿嘧啶 (5-FU),并且这个物质是用于治疗CRC患者的主要化疗药物。因此,研究者团队进一步探究瘤内微生物群和化疗药物之间的相互作用和分子机制,从而为CRC 患者设计个体化治疗方案提供新的理论指导。
实验设计
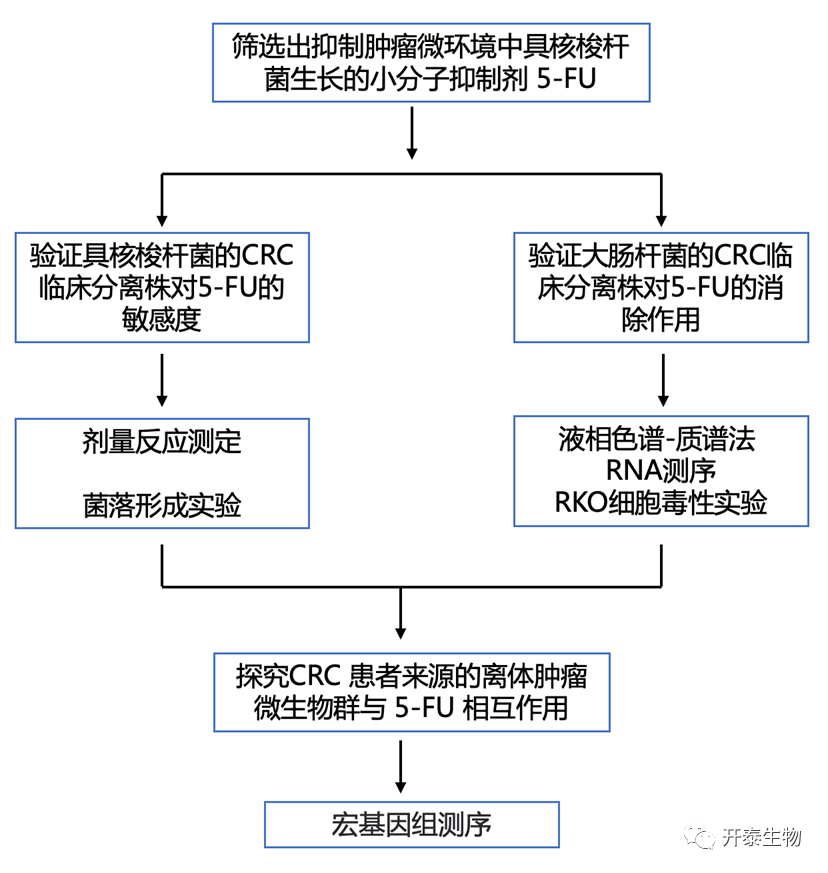
结 果
01

Fn抑制剂的生物活性化合物库筛选
研究者团队首先从数据库中随机选择了1846种小分子探究它们对人类CRC分离株Fn亚种 (Fna SB010) 生长的能力 (图1A-B)。采用8点剂量-反应曲线 (范围为0.23 ~ 30 μM) 检测不同化疗药物存在下的Fn生长, 确定了CRC 化疗药物替加氟 (tegafur) 及其活性代谢物 5-FU是致癌微生物Fn的有效抑制剂 (图1C-D)。
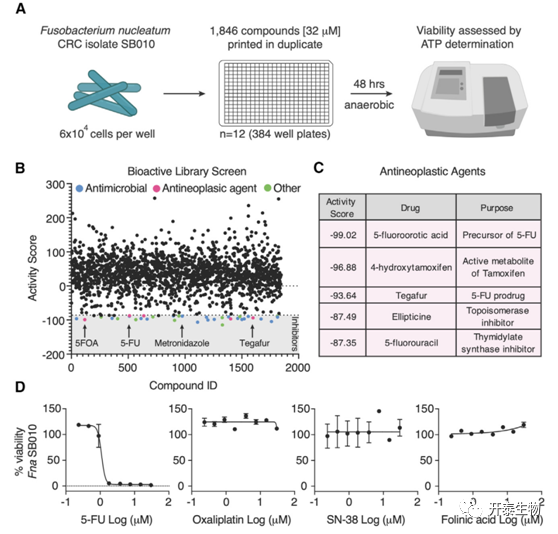
图1. Fn抑制剂的生物活性化合物库筛选
(A) 描述确定Fn药物敏感性的小分子筛选工作流程的示意图。(B) n = 1,846 种化合物对Fn活性的活性评分,通过 ATP 测量确定。(C)根据各自的活性评分排列的发现为Fn抑制剂的抗肿瘤药物列表。(D)八点剂量反应曲线。
02

验证5-FU对Fn CRC 临床分离株的抑制作用
研究者团队评估了5-FU 在 14 株Fn中的半数最大抑制浓度 (IC50) ,包括来自 CRC 肿瘤组织 (n = 11)、口腔(n = 2) 和发炎的肠易激疾病组织的分离物 (n = 1) 以探究CRC中 Fn临床分离株对 5-FU 的敏感性 (图2A)。分析表明,5-FU 是大多数测试的Fn菌株的有效抑制剂,IC50 值范围为 0.14 至 4.3 μM。并且进一步证实了5-FU 是代表所有四个亚种的 CRC Fn分离株 (Fna SB010, Fnp SB013, Fnv SB054, Fnn SB011)的有效生长抑制剂,表明对5-FU 的敏感性是Fn物种的核心特征 (图2B)。

图2. Fn分离株对 5-FU 的生理浓度敏感
(A) 热图描绘了 5-FU 的浓度。(B)每个亚种的单个代表的Fn活力的八点剂量反应曲线。
03

大肠杆菌的 CRC 分离株修饰 5-FU 并消除对Fn和 CRC 上皮细胞的毒性
研究者团队假设CRC 肿瘤中的共生细菌物种可能通过隔离或修饰化合物来保护Fn免受 5-FU 的侵害,从而降低药物对定植的微生态位附近细胞的毒性。因此测量了CRC 肿瘤分离株的 5-FU 敏感性,这些菌株包括脆弱拟杆菌B. fragilis (SB210)、大肠杆菌E. coli (SB209)、短双歧杆菌 B. breve ( SB213 ), 和微小微单胞菌P. micra (SB214),发现它们对一定浓度的5-FU (2.5–10 μM) 具有抗性(图3A),同时又通过液相色谱-质谱法 (LC-MS) 发现CRC大肠杆菌存在的情况下能大量消耗5-FU,并且该菌种对5-FU的修饰挽救了Fna SB010 的生长 (图3B-3C)。之后,研究者团队培养了一种对 5-FU 敏感的人 CRC 上皮细胞系 (RKO) 与大肠杆菌在5-FU存在下共同培养。值得注意的是,CRC来源的大肠杆菌 SB209 和另一种大肠杆菌pks+菌株大幅度消除了 5-FU 对人 CRC 上皮细胞的毒性 (图3D)。这些结果表明大肠杆菌介导的 5-FU 消耗或修饰可以降低化疗药物对邻近细菌和人类 CRC 肿瘤上皮细胞的抗癌功效。

图3. 大肠杆菌分离消耗了 5-FU 并降低药物对Fn和人类 CRC 细胞的毒性
(A) 十三点剂量反应曲线。(B) 测量上清液中 5-FU (4 μM) 消失的情况。(C) Fna SB010 在指定细菌种类的条件上清液中孵育 48 小时时的生存能力。(D) 在指定细菌种类的条件上清液中孵育 72 小时时,RKO CRC 上皮细胞的相对生长。
04

验证CRC 患者来源的离体肿瘤微生物群与 5-FU 相互作用
研究者团队通过宏基因组测序发现6名CRC 患者来源的离体肿瘤微生物群在5-FU存在的情况下,细菌成员的相对丰度会发生改变并且50% 的患者来源的离体CRC 微生物群落可以降低 5-FU 水平 (图4A-C)。有趣的是,通过LC-MS进一步验证了大肠杆菌菌株是导致 5-FU 耗竭的主要因素 (图4D-E)。
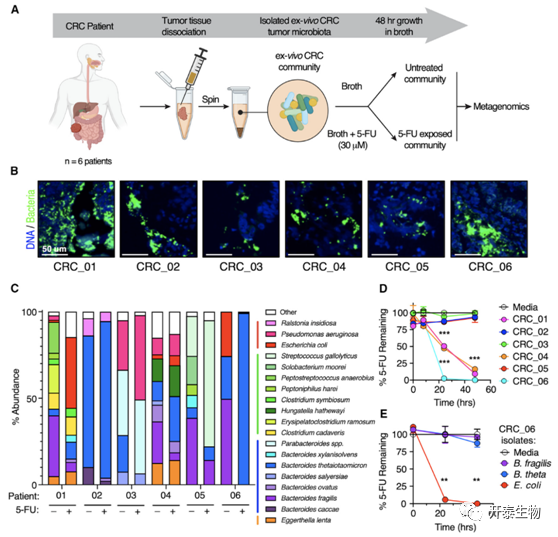
图4. 患者来源的离体CRC 微生物群可消耗 5-FU 并降低化疗毒性
(A)患者组织处理的工作流程示意图。(B)来自 CRC 患者 (n = 6 名患者)的肿瘤组织的基于 RNAscope 的荧光原位杂交 (FISH)。(C) 各自组织样本中细菌种类的相对丰度大于 1% (n = 6 名患者)。(D-E) 上清液中 5-FU (4 μM) 消失的测量情况。
+ + + + + + + + + + +
结 论
通过小分子筛选发现 5-氟尿嘧啶 (5-FU) 是致癌微生物Fn生长的有效抑制剂。通过探索 5-FU 对通常与Fn共同出现的其他主要 CRC 相关细菌物种的毒性,表明从 CRC 肿瘤中分离出的大肠杆菌、脆弱拟杆菌、短双歧杆菌和微单胞菌对生理相关浓度的 5-FU 具有抗性。宏基因组测序发现CRC细菌群落成员可以抵抗 5-FU 毒性并可能降低药物生物利用度,从而保护 CRC 肿瘤细胞和敏感细菌菌株,使得化疗药物5-FU不再抑制癌症或致癌微生物的生长。这些结果提示在将患者分为 5-FU 耐药风险类别时考虑肿瘤相关微生物群的相互作用,尤其是在肿瘤切除前进行新辅助化疗的情况下。也明确了临床治疗中,化疗和靶向抗菌药物的联合治疗重要性。
+ + + + +



 English
English

