文献解读|Nat Commun(14.919):单细胞转录组学揭示了横纹肌肉瘤中的免疫抑制和细胞状态预测患者结果
原名:Single-cell transcriptomics reveals immune suppression and cell states predictive of patient outcomes in rhabdomyosarcoma
译名:单细胞转录组学揭示了横纹肌肉瘤中的免疫抑制和细胞状态预测患者结果
期刊:Nature communications.
影响因子:14.919
发表时间:2023.03
DOI号:10.1158/1078-0432.CCR-22-3350.
背 景儿童横纹肌肉瘤(RMS)是一种间充质来源的软组织恶性肿瘤,当前研究认为其是肌源性分化紊乱的结果,尽管目前有强化治疗方案,但高危患者的预后仍然堪忧。RMS背后的细胞分化状态以及这些状态与患者结果的关系在很大程度上仍然难以捉摸。在这里,作者使用单细胞mRNA测序来生成RMS的转录组图谱,RMS肿瘤生态位的分析揭示了免疫抑制微环境的证据。作者还确定了NECTIN3和TIGIT之间的假定相互作用,特异于更具攻击性的融合阳性(FP)RMS亚型,是肿瘤诱导的T细胞功能障碍的潜在原因。在恶性RMS细胞中定义了反映正常肌源性分化的转录程序,并表明这些细胞分化状态可以预测FP RMS和侵袭性较低的融合阴性亚型的患者结果。本研究揭示了针对RMS免疫微环境的疗法的潜力,并表明评估肿瘤分化状态可以实现更精细的风险分层。
实验设计
结 果01

儿童RMS肿瘤的单细胞图谱
作者对可存活冷冻的原发性RMS肿瘤样本和最近建立的患者来源的肿瘤类器官模型进行单细胞mRNA测序(SORT-seq)(图1a)。每个原始样本的恶性细胞的中位百分比为56%,尽管差异很大(2%-97%),并且在分子亚型之间没有显著差异(图1f)。假定的恶性细胞表达高水平的经典RMS标记基因DES、MYOD1和MYOG(图1e)。然后使用SingleR细胞类型相似性评分和已知标记基因的表达来辨别非恶性细胞的身份(图1e)。与恶性细胞的总体百分比一样,每种非恶性细胞类型的比例在肿瘤之间差异很大,但根据融合状态没有显著差异(图1f)。在统一流形近似和投影(UMAP)空间中投影已分类的原代单细胞转录组显示,肿瘤间异质性和分子亚型分类(FN或FP)驱动了恶性细胞的聚集,而非恶性细胞则按细胞类型聚集(图1d)。

图1 RMS肿瘤的单细胞转录组图谱。
a 用于从初级样本生成scRNA-seq数据的样本处理工作流程的示意图。b RMS样本队列概述,包括患者临床特征,以及肿瘤中相关突变和拷贝数变异(CNV)的总结,使用批量DNA测序进行定义。c代表性的苏木精和伊红(H&E)染色肿瘤切片,描绘了该队列中两种主要RMS组织学亚型(肺泡型和胚胎型)。d来自按样品着色的原始样品(n=7364)的单细胞RMS转录组的UMAP投影。e描绘每个注释细胞类型的所选标记基因的平均比例基因表达的点图。f比较分子亚型之间恶性细胞(左图)和每种非恶性细胞类型(右图)的比例的箱线图。
02

RMS微环境的特征揭示了一般和亚型特异性免疫功能障碍
首先对原代RMS样品的骨髓和T/NK区室进行了基于图的聚类(图2a,e),标记基因在髓系簇中表达的检查显示存在未分化(M0)和分化(Mq)巨噬细胞,以及常规(cDC)和浆细胞样(pDC)树突状细胞(图2b)。对分化的巨噬细胞进行M1/M2特异性基因标记的评分表明,它们主要以M2极化状态存在(图2c)。这一发现得到了原发性肿瘤组织免疫荧光(IF)显微镜的支持(图2d)。在T/NK细胞簇中,可以识别出几种亚型,包括初始和γ-δ(GD)T细胞、调节性T细胞(Tregs)、细胞毒性(CD8+)T细胞和多种亚型的CD4+T辅助细胞(IL7R+和ISG+)(图2f)。
比较RMS亚型之间CD8+T细胞的基因集富集分析(GSEA)表明,功能障碍在FP样本中更为普遍,FP样本富含与PD-1信号传导、氧化磷酸化和T细胞耗竭相关的基因集,而FN肿瘤的细胞富含干扰素反应和刺激信号(图2g)。

图2 RMS免疫微环境的特征。
a.骨髓细胞的UMAP投影。b.描绘所选细胞类型特异性基因(Mq=分化的巨噬细胞,M0=未分化的巨噬细胞,cDC=常规树突细胞和pDC=浆细胞样树突细胞)的平均表达图。c. Violin/Box和UMAP组合图显示了M1(左图)和M2(右图)特征分数在未分化(M0)和分化(Mq)巨噬细胞中的分布。d.代表性免疫荧光(IF)显微镜图像。e.T细胞和NK细胞的UMAP投影。f.描绘所选细胞类型特异性基因的平均表达的点图。g.通过比较RMS亚型之间的CD8+T细胞的基因集富集分析(GSEA)确定的所选基因集的归一化富集分数(NES)。h.代表性IF显微镜图像。
03

FN RMS中NMF定义的分化轨迹反映了早期肌发生
在RMS scRNAseq队列中,每个分子亚型独立地应用非负性基质因子分解(NMF)来定义在每个原发肿瘤的恶性细胞中活跃的潜在转录程序。在FN RMS样本中,该分析揭示了三簇高度相关的转录程序,作者将其合并为三个元程序(图3a左图)。对每个元程序的FN细胞进行评分显示,成肌细胞样程序和间充质样程序的表达是互斥的,而高增殖祖细胞样状态的表达仅限于间充质和成肌细胞状程序得分较低的细胞(图3b)。
通过在扩散图空间中投影单细胞转录组并使用假时间和RNA速度来评估方向性,将数据建模为分化轨迹(图3e)。结果表明,细胞从高度增殖的祖细胞样状态转变为分化程度更高的间充质样或成肌细胞样状态,当将恶性细胞状态评分与正常肌源性细胞类型的相似性评分进行比较时,分化状态的变化也很明显(图3f)。
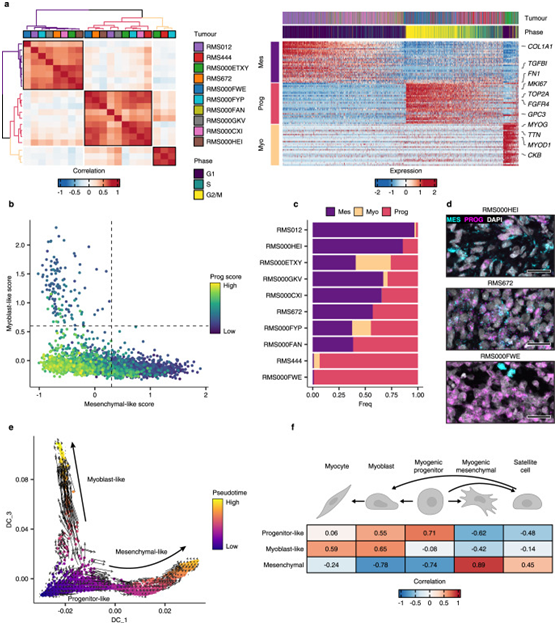
图3 NMF定义了FN RMS肿瘤中的恶性细胞状态。
a左图:热图显示FN样本中所有NMF定义的转录程序之间的成对Pearson相关性。右图:每个元程序中前30个基因在所有FN细胞中的比例表达。b描述间充质样(x轴)、成肌细胞样(y轴)和祖细胞样(点色)元程序评分的散点图。c每个FN肿瘤在每个离散状态下的细胞比例。d代表性RNA荧光原位杂交(RNA-FISH)图像,描绘了FN组织样品中间充质样(MES=TGFBI)和祖细胞样(PROG=FGFR4)细胞状态标记基因的表达。e FN RMS单细胞的扩散图投影,用假时间值着色,覆盖RNA速度矢量场。f描绘细胞状态评分之间皮尔逊相关性的热图,以及每种正常肌源性细胞类型的逻辑回归定义的相似性评分(logits)。
04

FP RMS镜像骨骼肌再生中的分化状态
扩展NMF分析揭示了三个特异于原代FP RMS的元程序。结果表明几乎所有推断处于S期或G2/M期的细胞在该元程序中得分都很高(图4a右图)。对每个元程序的单个细胞进行评分揭示了成肌细胞样程序和SC样程序之间的互斥关系,而增殖程序与两者都不相关,并且通常仅限于前两个程序的评分较低的细胞(图4b)。与FN样品一样,肿瘤之间的离散细胞状态比例存在高度变化,特别是在增殖状态和SC样状态之间(图4c)。使用RNA-FISH验证了每个元程序的表达,以及成肌细胞样和SC样程序的相互排他性(图4d)。
元程序评分和逻辑回归定义的细胞相似性评分之间的比较表明,成肌细胞样程序与经历终末分化的细胞类型(成肌细胞和肌细胞)密切相关,而SC样程序与产后卫星细胞最具可比性(图4e)。轨迹推断表明,成肌细胞样或SC样程序得分较高的细胞位于分化连续体的两端,而增殖细胞表现为未分化的中间状态(图4f)。

图4 FP RMS肿瘤中的细胞状态反映了骨骼肌肌源性分化。
a左图:热图显示FP样本中所有NMF定义的转录程序之间的成对Pearson相关性。右图:每个元程序中前30个基因在所有FP细胞中的比例表达。b描述每个单元元程序得分的散点图。c每个FP肿瘤在每个离散状态下的细胞比例。d代表性RNA荧光原位杂交(RNA-FISH)图像。e描绘FP细胞状态评分之间的Pearson相关性的热图,以及每种正常肌源性细胞类型的逻辑回归定义的相似性评分(logits)。f FP RMS单细胞的扩散图投影。
05

恶性细胞状态可以预测患者的预后
总之,NMF定义的转录程序的分析结果使作者能够提出FN和FP RMS肿瘤中细胞状态和分化轨迹的统一模型(图5a、b)。肿瘤分化评分高(间充质样+成肌细胞样)的FN RMS患者比评分低的患者表现出明显更好的OS概率(图5c左图);相反,未分化祖细胞样程序的高分表明OS明显比低分的FN肿瘤差(图5c右图)。接下来比较了分化和祖细胞样评分与先前验证的元基因评分对FN RMS患者分层的预测能力(MG5.FN),虽然使用MG5.FN评分的高风险和低风险病例之间的差异略高于祖细胞样分,分化评分预测了一组预后明显较差的患者(图5c)。在FP RMS患者中,SC样程序的高表达与OS延长有关,而高增殖评分表示OS缩短(图5d)。

图5 恶性细胞状态可以预测患者的预后。
a RMS中微分轨迹的示意图。b热图显示RMS分子亚型(y轴)和正常肌源性细胞类型的离散恶性细胞状态之间的平均预测相似性(概率)。c,d Kaplan-Meier图显示了(c)FN(n=47)或(d)FP(n=44)患者的总体生存概率。
+ + + + + + + + + + +
结 论
在作者对儿科RMS的单细胞转录组的综合分析中,表征了TME的免疫成分并定义了反映正常肌源分化轨迹的细胞状态。基于这些发现,作者提出靶向免疫检查点分子和抑制性M2巨噬细胞是RMS的有前途的治疗方法,值得进一步研究。此外,鉴于分化状态有可能改善患者风险分层,因此应优先验证和临床实施分化状态作为预后指标。
+ + + + +



 English
English

