文献解读|BMC Genomics(4.547):转录组m6A表达谱分析揭示猪精子冷冻保存过程中mRNA转录后修饰
✦ +
+
论文ID
原名:Transcriptome-wide m6A profiling reveals mRNA post-transcriptional modification of boar sperm during cryopreservation
译名:转录组m6A表达谱分析揭示猪精子冷冻保存过程中mRNA转录后修饰
期刊:BMC Genomics
影响因子:4.547
发表时间:2021.8.3
DOI号:10.1186/s12864-021-07904-8
背 景
冷冻保存是精液长期保存的重要方法,具有广泛的应用前景。然而,由于使用冷冻精液进行人工授精会导致受胎率和窝产仔数下降,在全世界范围内的商业猪群中,只有约1%的人工授精使用冷冻精液。因此,研究与冷休克和抗冻相关的分子标记及其机制对于改善冷冻精液人工授精的负面效应具有重要意义。精子表观遗传标记和受精成功率、后代健康密切相关。研究表明,冷冻保存会导致转录组发生表观遗传修饰,严重损害精子质量,从而降低繁殖性能。N6-甲基腺苷(m6A)RNA甲基化在环境应激过程中发生变化,并参与多种重要的生物学过程,包括mRNA转录后的加工、细胞代谢和细胞凋亡。本研究旨在探讨冷冻保存是否诱导与精子能量代谢、冷冻损伤和抗冻能力相关的mRNA发生m6A修饰,研究结果将进一步理解表观遗传修饰对冷冻精子生理功能的调控提供理论基础。
实验设计

结 果
01

猪精子冷冻保存对m6A修饰酶表达的影响
首先,使用RT-qPCR和蛋白质印迹(WB)检测Fs和Fts组中负责m6A修饰的五种主要酶的表达,包括METTL3、METTL14、FTO、ALKBH5和YTHDF2。在Fts组中,METTL3、METTL14、ALKBH5和YTHDF2的mRNA表达水平显著降低,而FTO显著升高(图1A)。METTL3、METTL14和FTO的蛋白水平在Fts组显著下调,而ALKBH5和YTHDF2在Fts组中显著上调(图1B和1C)。这表明,冷冻保存可以调节负责m6A修饰的主要酶的表达变化,进而诱导m6A甲基化修饰发生变化。

图1. 猪新鲜、冷冻精子m6A修饰酶的表达情况
02

猪精子转录组m6A甲基化测序概述
通过MeRIP-Seq,从所有样本文库中获得超过78000000个clean reads,参考基因组比对结果表明map ratio超过75.09%。在Fs和Fts中分别鉴定到3647和4033个m6A 峰(peaks),其中1048个peaks为FS和Fts所共有(图2A)。与Fs相比,在Fts组中的1442个mRNA中鉴定到1613个显著上调的peaks,在312个mRNA中鉴定到315个显著下调的peaks(图2B)。
为了确定所有peaks中存在保守的RRACH序列(R = 嘌呤,A= m6A,H =非鸟嘌呤碱基),对所有精子样品的前2000个m6A峰进行富集分析,得到了5个共有序列,它们都符合RRACH序列特征,表明测序数据是可靠的(图2C)。此外,在Fs和Fts组中,m6A峰在基因元件上集中分布于编码区(CDS)、起始密码子和终止密码子附近;Fts在CDS中的m6A峰富集比例高于Fs(53.2% vs 44.3%, 图2D和2E)。在Fs和Fts中,大约70%~80%的基因仅有1个m6A峰,而Fts中含有2个或更多m6A峰的转录本数量比Fs多(图2F)。

图2. Fs和Fts的m6A甲基化谱
03

差异m6A甲基化位点(DMMS)分布
将所有差异m6A甲基化位点(DMMS)定位到染色体上,以评估其分布特征(图3A)。DMMS相对密度最高的前5条染色体为12、3、14、2和7号(图3B)。使用IGV软件,从MeRIP-Seq结果中选择SORD(高甲基化峰)和NAGK(低甲基化峰)两个代表性的DMMS进行可视化展示(图3C)。进一步,随机选择10个具备DMMS的基因,使用MeRIP-qPCR检测它们的总m6A水平。研究表明,6个高甲基化基因FOXO 3、NADK 2、ACLY、HIF 1A、SLC9A3R1和PKM,以及1个低甲基化基因FASN参与精子质量的调节。通过MeRIP-qPCR测定, 9个基因的m6A水平变化与MeRIP-Seq数据一致(图3D)。这进一步表明测序数据的准确性。

图3. 差异m6A甲基化位点(DMMS)的分布及MeRIP-qPCR验证
04

差异m6A甲基化基因 (DMMGs)的GO和KEGG分析
为了探究mRNA上m6A甲基化修饰在冷冻精子中的生物功能,对差异m6A甲基化基因(DMMGs)进行GO和KEGG通路分析。GO分析(生物过程,BP;细胞成分,CC;分子功能,MF)发现,Fts中的高甲基化基因显著富集到代谢过程,包括大分子代谢和有机物代谢过程、基因表达和转录。此外,这些基因还在细胞和细胞内细胞器、蛋白质结合(图4A)中发挥作用。Fts中的低甲基化基因显著富集在RNA聚合酶II启动子的转录、RNA代谢过程的调节、转录调节和DNA模板、外侧质膜,以及转录调控区DNA结合、酶结合(图4B)等。此外,KEGG通路分析显示,DMMGs显著富集在mTOR、AMPK、MAPK和TGF-β信号通路(图4C、4D)。

图4. 差异m6A甲基化基因 (DMMGs)的GO和KEGG分析
05

DMMGs和差异表达基因(DEGs)的联合分析
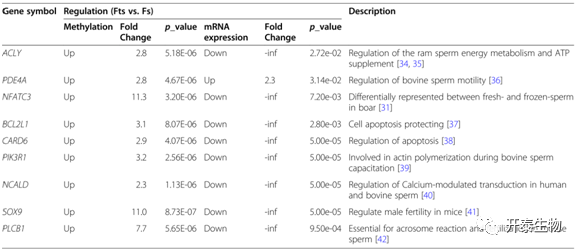
考虑到m6A修饰在调节基因表达中的重要功能,通过RNA-Seq分析新鲜、冷冻精子的转录组变化,评估m6A甲基化对冷冻精子转录水平的影响。差异分析表明,和新鲜精子相比,冷冻精子共有295个基因显著上调,2071个基因显著下调(图5A)。DMMGs和DEGs的联合分析共鉴定了13个高甲基化-上调基因(hyper-up)、19个低甲基化-下调基因(hypo-down)、149个高甲基化-下调基因(hyper-down)以及3个低甲基化-上调基因(hypo-up)(图5 B)。GO和KEGG分析显示,差异m6A甲基化的DEGs涉及精子获能、钙介导的信号传导、精子活力和细胞凋亡等生物学过程(图5C、5D)。表1列出了Fs和Fts之间的9种差异m6A甲基化的DEGs,这些DEGs与精子质量和功能相关,包括精子活力和获能的调节。

图5. DMMGs和差异表达基因(DEGs)的联合分析
表1 差异m6A甲基化的DEGs的功能
+ + + + + + + + + + +
结 论
本研究全面描述了猪精子转录组m6A甲基化的特征,揭示了猪新鲜精子和冷冻精子m6A修饰和甲基化谱的差异。MeRIP-Seq和RNA-Seq联合分析表明,含有差异m6A甲基化的DEGs参与精子代谢、凋亡和运动。猪精子在冷冻保存过程中mRNA m6A甲基化修饰的异常,可能是导致猪精子冷冻损伤、活力下降的原因。
+ + + + +



 English
English

