文献解读|(8.554): 综合分析确定BGN和THBS2是结肠癌转移特异性生物标志物和不良生存关键调控因子
✦ +
+
论文ID
原名:Identification of BGN and THBS2 as metastasis-specific biomarkers and poor survival key regulators in human colon cancer by integrated analysis
译名:综合分析确定BGN和THBS2是结肠癌转移特异性生物标志物和不良生存关键调控因子
期刊:Clinical and translational medicine
影响因子:8.554
发表时间:2022.11.12
DOI号:10.1002/ctm2.973
背 景
结直肠癌(CRC)是全球范围内发病率及死亡率均较高的一种癌症,由于缺乏有意义的生物标志物,导致其早期诊断和治疗均困难,患者预后和存活率较差,其中淋巴结转移和远处转移仍然是患者死亡的主要原因。肿瘤转移涉及多种生物学过程,包括异常的细胞周期调控,正常细胞外基质的破坏,邻近组织的侵袭和淋巴结转移等。当上皮细胞获得间质表型时,发生上皮-间充质转化(EMT),是肿瘤形成中的关键,而且与迁移、侵袭和转移相关。因此,开发新的转移特异性诊断生物标志物或前瞻性治疗靶点至关重要。
本研究采用一种新的联合筛选策略,通过临床多组学图谱分析和细胞功能分析相结合的方法,寻找可能在结直肠癌转移中起关键调节作用的新的生物标志物。
实验设计
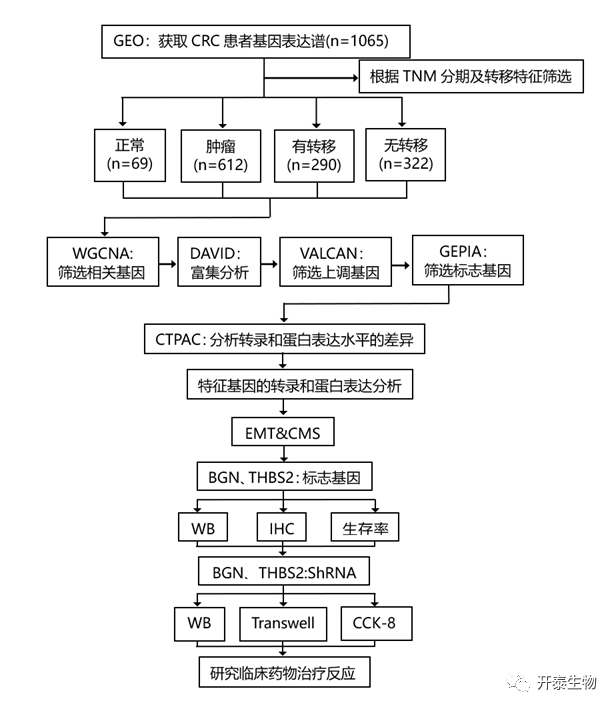
结 果
01

与CRC转移显著相关的模块和基因的确定
首先,作者将肿瘤转移的特征基因表达谱数据聚类并划分为21个模块(图1),用模块显著性和统计量确定与病理学特征的相关意义,发现绿色模块(p=0.003)、红色模块(p=3e-05)和黑色模块(p=6e-05)均与结肠癌转移的病理学特征呈显著正相关。通过计算和比较模块相关性和基因重要性,将绿色(cor=0.34,p=2.1e-173)、红色(cor=0.44,p=1.5e-104)和黑色(cor=0.29,p=4.3e-41)鉴定为与肿瘤转移相关的显著模块,其中红色模块与肿瘤转移状态的相关性最强(图2A-C)。
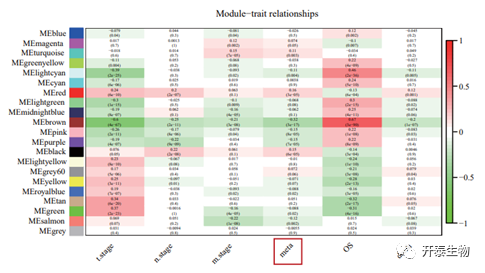
图1
02

功能和途径富集化分析及特征基因筛选
接着,作者在红色模块中选择了有较高显著性的191个基因,用DAVID富集分析检索了到181个基因,并进行了生物学功能研究,总结了十大信号通路,比如血管生成和细胞生长调节(图2D),这两者都与结肠癌转移有关。此外,通过UALCAN数据库筛选上调的前250个基因,确定17个基因是利用过度表达筛选的候选特征基因(图2E)。最后,使用GEPIA数据库中的临床病例来评估候选基因在肿瘤和正常组织中的表达水平。将8个在肿瘤组织中显著过表达的基因(BGN、THBS2、SPARC、CDH11、MFAP2、MMP11、SPP1和THY1)定义为与结肠癌转移有关的显著特征基因(图2F)。
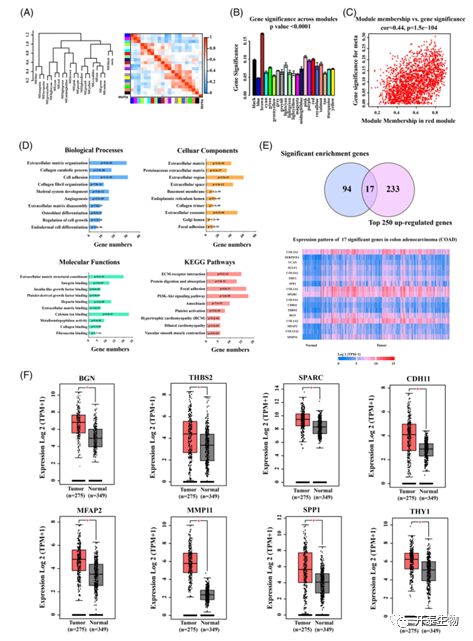
图2与结肠癌转移显著相关的标志性基因的确定
03

标志性基因的表达模式
根据病理特征将原始基因表达谱数据分为正常、未转移、转移和远处转移四组,探讨8个标志性基因与结肠癌转移的相关性。创建了一个热图来表示每组中八个特征基因的表达模式(图3A)。在三个肿瘤组中,八个特征基因的表达水平显著高于正常组(p<.0001)(图3B)。此外,在肿瘤组中,转移组的表达水平显著高于非转移组(p<.001),而转移组与远处转移组之间的表达水平无显著差异(p>0.05)。

图3正常、无转移、有转移和远处转移结肠癌样本中八个标志性基因的表达模式
04

转录组和蛋白质组学特征基因的相关性
接下来,作者对来自CPTAC的CRC转录和蛋白质组学数据进行了分析。在转移性癌组织中,有5个基因(BGN、THBS2、SPARC、CDH11和SPP1)在转录水平上显著高于非转移性癌组织(图4A),而在蛋白水平上只有BGN和THBS2有显著差异(图4B)。此外,7个标志性基因的转录和蛋白表达水平在所有肿瘤样本中均呈显著正相关(图4C),然而,它们在癌组织中的蛋白表达水平明显高于正常组织。有趣的是,标志性基因(THBS2、SPARC、MFAP2、MMP11和THY1)在正常组织中的蛋白表达水平显著低于非转移性和转移性癌组织(图4D),而无转移和转移患者之间没有显著差异。此外,EMT肿瘤组织中7种标志性基因的转录表达水平显著高于上皮性肿瘤组织和高突变肿瘤组织,EMT肿瘤组织中的蛋白表达也显著高于上皮型或突变表型(图4D)。该表明,这些标志性基因可能是结肠癌转移过程中的重要调节因子。
结肠癌有CMS1~ 4四个亚型,EMT与肿瘤转移有关,是CMS4患者的重要特征。特征基因(BGN、SPARC、CDH11和MMP11)在CMS4患者中的蛋白质组表达水平明显高于其他亚型(CMS1∼3)(图4E)。在EMT状态下表达水平较高,可能因为这些基因通过EMT过程参与显著的转化生长因子β激活、基质侵袭和血管生成过程,并与结肠癌转移相关。这些结果提示,这些标志性基因可能通过影响上皮细胞向间充质细胞的转化过程来影响结肠癌的转移,并参与肿瘤转移过程。
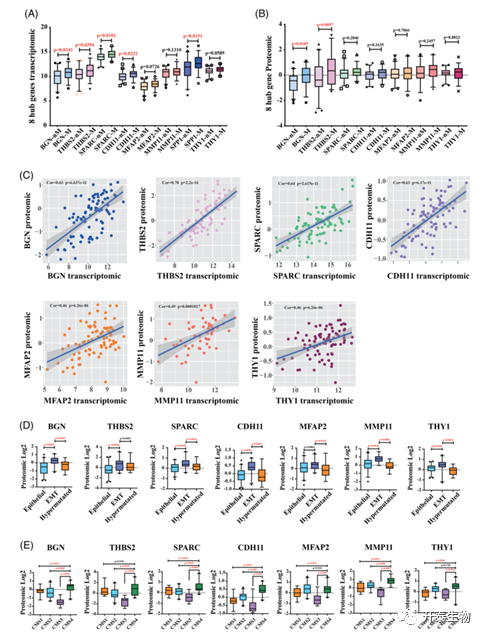
图4来自CPTAC的特征基因的转录和蛋白质组表达模式分析
05

已确定的标志性基因与CRC转移患者的不良生存率相关
作者通过GEPIA数据库研究标志性基因与患者生存率的关系,发现BGN和THBS2高表达的结肠癌患者的生存时间显著缩短(图5A)。因此,将这两个基因选为具有代表性的标记基因并进行了实验。IHC显示,BGN和THBS2在大多数结肠癌组织中的表达明显高于癌旁组织(图5B)。此外,非转移和转移患者中两种基因的表达差异无统计学意义(p>0.05)(图5B)。作者认为这可能是因为发生转移的样本较少,统计结果并不能准确反映这种差异。提示这些标志性基因可能在肿瘤的发生、发展和转移中发挥重要作用。
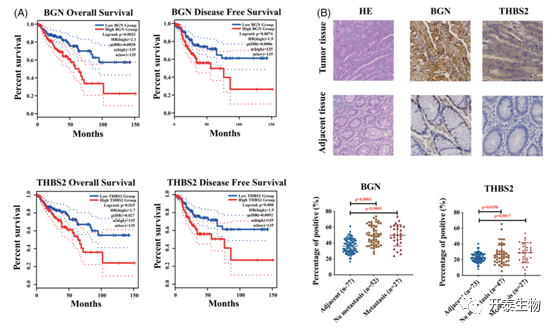
图5结肠癌转移患者的主要标志基因与生存不良相关
06

基因敲除BGN和THBS2对结肠癌细胞增殖、迁移和侵袭的影响
接着,作者成功地在HT29和HCT116细胞中构建了慢病毒shRNA,导致标志基因(BGN,THBS2)的敲除,并通过Western-Blot验证了其下调(图6A)。BGN基因敲除后HT29细胞的增殖(图6B)、体外克隆形成数(图6C)、迁移和侵袭能力(图6D)均显著降低,而THBS2基因敲除对HT29细胞的增殖和集落形成能力影响不大,仅显著降低HCT116的迁移和侵袭能力。提示BGN和THBS2在促进结肠癌细胞增殖和致瘤以及转移中起重要作用。此外,结肠癌转移和EMT进展中的关键调控分子Snail、Vimentin和N-C在基因敲除的结肠癌细胞中显著下调(图6E-F),这强烈提示,降低这些基因(BGN、THBS2)的表达可能会阻断结肠癌转移中的主导信号分子。作者还提出了BGN和THBS2调节结肠癌细胞EMT和转移过程的潜在作用模型(图6G)。
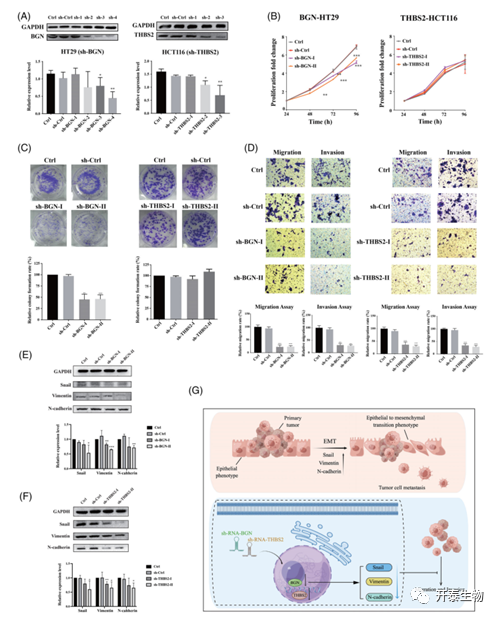
图6 基因敲除对结肠癌细胞增殖、迁移和侵袭的影响
07

与临床药物治疗相关的标志性基因表达
以5-氟尿嘧啶(5-FU)为基础的药物,包括奥沙利铂或伊立替康、贝伐单抗、卡培他滨等,已被用作中晚期或转移性结直肠癌的标准治疗方案。为了进一步了解这些标志基因在临床用药中的作用,作者评估了基因表达与患者的药物治疗反应和临床结果的相关性。发现,对5-FU、伊立替康和奥沙利铂治疗有反应的患者BGN表达水平显著高于未接手治疗的患者(图7A),而对5-FU和伊立替康治疗有反应的患者THBS2水平显著高于未接受治疗的患者(图7B)。此外,5-氟尿嘧啶和奥沙利铂分别处理BGN基因敲除的HT29细胞(图7C)和THBS2基因敲除的HCT116细胞(图7D)分别显著抑制细胞的增殖。提示这些基因(BGN、THBS2)可能不仅是新的EMT指标,而且可能为结肠癌的临床用药提供指导。
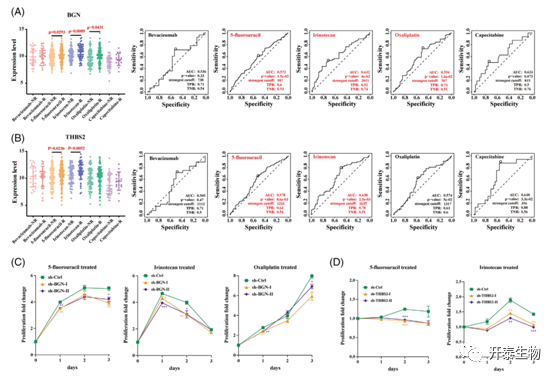
图7 临床药物治疗反应与两种标记基因表达水平的相关性
+ + + + + + + + + + +
结 论
本研究初步确定了五个基因(BGN、THBS2、SPARC、CDH11和SPP1)作为潜在的预后标志物和治疗靶点,其中BGN和THBS2与CRC转移的相关性最显著,这两种基因的在肿瘤中的高表达与较低的生存率有关,而且基因敲除后可显著降低CRC细胞的迁移和侵袭能力,并可为5-FU、伊立替康和奥沙利铂的临床应用提供指导。
总之,BGN和THBS2有可能成为CRC患者治疗的潜在生物标志物或潜在的临床治疗靶点。
+ + + + +



 English
English

