文献解读|Cell(64.5):健康和神经系统疾病中头骨骨髓的独特分子特征
✦ +
+
论文ID
原名:Distinct molecular profiles of skull bone marrow in health and neurological disorders
译名:健康和神经系统疾病中头骨骨髓的独特分子特征
期刊:Cell
影响因子:64.5
发表时间:2023.08.17
DOI号:10.1016/j.cell.2023.07.009
背 景
中枢神经系统(CNS)边界免疫细胞与CNS常驻免疫系统之间复杂的相互作用是当前的研究热点,脑膜的硬脑膜通过颅-脑膜连接(SMC)直接连接到邻近的颅骨骨髓,SMC允许免疫细胞的运输,并可能促进免疫细胞从颅骨骨髓优先募集到脑膜。
在人类中,头骨中的骨髓对于塑造大脑和脑膜的免疫反应非常重要,但其在骨骼中的分子组成以及与人类疾病的相关性仍不清楚。
实验设计

结 果
01
骨骼、硬脑膜和大脑的单细胞转录组分析
为了检测颅骨骨髓对脑损伤反应的参与,研究中团队使用了中大脑动脉闭塞(MCAo)小鼠作为研究中风的模型(图1A)。在 MCAo 中,小鼠首先进行颈部切口以暴露颈动脉,然后再闭塞大脑中动脉(图 1 A)。没有 MCAo 的假手术模拟了局部损伤,但不会诱发中风。
他们对三个扁平骨(颅骨、肩胛骨和骨盆[髂骨])、两个长骨(肱骨和股骨)和一个不规则骨(从胸椎T5到腰椎L3)以及硬脑膜和脑样本进行了单细胞转录组分析(scRNA-seq),这些样本分别来自未手术、假手术和MCAo手术的动物。对骨骼和病症中超过 100000 个细胞的单细胞转录组学揭示了 17 种粗细胞和 50 种细细胞类型(图1B-D)。他们发现大量的骨特异性粗细胞类型,而脑膜和脑特异性细胞是分离的(图1B)。他们检测到大量中性粒细胞 (∼25%) 和红系细胞 (∼30%) 以及其他预期的细胞类型(图1E)。中性粒细胞群在不同条件下明显分离(图 1C)。标准细胞类型比例均匀分布在不同骨骼中(图1E-F)。通过使用单核苷酸多态性(SNP)和流式细胞术对合并样本进行去卷积来验证每只小鼠的细胞类型比例,总体相关性为 0.88(图 1 F)。
层次聚类显示长骨、股骨和肱骨与骨盆聚集在一起。同样,肩胛骨和颅骨这两个扁骨也聚集在一起。未手术条件下和 MCAo 手术后,不规则的椎骨与扁骨分叉,假手术条件下则与长骨和骨盆分叉(图1 G)。在未手术条件和假手术的条件下,颅骨与肩胛骨聚集。值得注意的是,颅骨在 MCAo 条件下形成了自己的分支,表明对脑损伤的颅骨特异性免疫反应。

图1. 骨骼根据细胞类型的转录特征而分化。
(A) 骨骼、硬脑膜和大脑的单细胞 RNA 测序的实验设计,以及中风大脑中动脉闭塞 (MCAo) 模型的示意图。(B–D) scRNA-seq 的均匀流形近似和投影 (UMAP) 可视化。(E) 粗细胞类型的相对比例。(F) scRNA-seq 中细胞类型的相对比例与使用 15 色面板通过流式细胞术测量的独立动物之间的相关性。(G) 未手术、假手术和 MCAo 条件的树状图。
为了评估每种细胞类型的一个骨骼群体的基因表达谱与其他骨骼汇集群体的基因表达谱的差异程度,他们使用了主成分(PC)回归分析(图2A)。在三种条件下,颅骨的中性粒细胞与其他骨骼的中性粒细胞的差异最大。在差异表达基因(DEG)显示,在所有条件下颅骨中的DEG数量最多(图2B)。在这三种调节下,颅骨中大多数差异下调的基因出现在前中性粒细胞、粒细胞-单核细胞祖细胞和红系祖细胞中,而上调的基因主要出现在髓系(图2B)。
在未手术条件下,颅骨骨髓细胞的DEG与凋亡过程和程序性细胞死亡通路的调节有关,颅骨特有的DEG多为转录因子,即刻早期基因和趋化相关基因(图2C)。转录因子包括Nr4a1和Nr4a2参与细胞增殖、凋亡、代谢和T细胞调节,在缺血性中风后具有抗炎和限制损伤的作用。趋化因子相关的DEG包括趋化因子和趋化因子受体,如Cxcr4, Ccrl2, Ccl4和Cxcl2。最后,颅骨主要在中性粒细胞中表现出差异表达的促炎和抗炎基因,如Il1b, Ptgs2和Thbs2,其中一些还参与细胞黏附和迁移。
在MCAo条件下,中性粒细胞表达最多的差异上调基因(DUG)。其中,很多DUG则是中风状态特有的,如Cd69(T细胞迁移)、Gpr35(炎症调节)和Nr4a3(T细胞和祖细胞增殖)。他们使用免疫染色和RNAscope验证了Nr4a1在颅骨中的上调(图2D-F)。
在使用CellPhoneDB研究配体受体 (LR) 相互作用时,他们发现了骨骼类型的独特相互作用(图2G)。在这三种条件下,他们都发现了所有骨骼共同的LR相互作用的核心模块。MCAo中常见LR对数量增加。
由于大多数颅骨特异性基因位于中性粒细胞中(图 2B),接下来,他们使用RNA速率分析和伪时间分析来检测它们的发育轨迹(图2H)。颅骨的成熟中性粒细胞亚群聚集在硬脑膜中另一组中性粒细胞旁边。与其他骨骼相比,颅骨中晚期中性粒细胞的比例更高。受伤后,硬脑膜中出现晚期中性粒细胞的转变,尤其是在 MCAo 中。
为了研究脑颅和硬脑膜中成熟中性粒细胞的相似性,他们使用基于分区的图抽象(PAGA)进行了分支轨迹分析。他们观察到在硬脑膜位于中间的未手术组和手术组之间有明显的区别(图2I)。硬脑膜和颅骨之间的共同差异基因的数量也从未手术组的6个上调和7个下调基因增加到MCAo组的29个上调和15个下调基因(图2J)。
总的来说,骨骼在病理过程中会改变它们的转录组,而颅骨的转录组特征与脑膜非常接近。
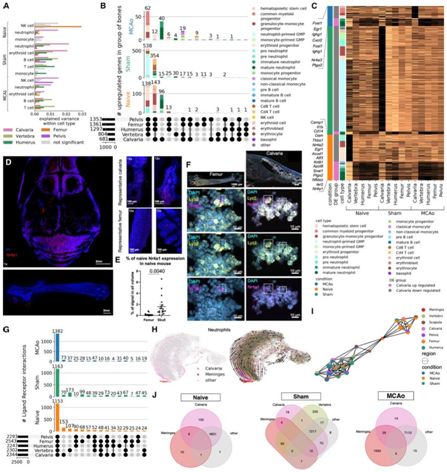
图2. 不同细胞类型显示骨骼之间独特的差异表达基因和配体-受体对。
(A) PC 回归图显示了每个骨骼的细胞群与其他骨骼的汇集群的差异程度。(B) 在初始条件、假条件和 MCAo 条件下差异表达的基因。(C) 三种条件下 Calvaria 独特的上调基因。(D)透明和光片荧光显微镜检查后Nr4a1标记的代表性图像。(E) Nr4a1的量化。(F)使用 RNAscope,Nr4a1转录本显示分别与Lyz2和Mpo (骨髓细胞标记物和祖细胞标记物)共定位。(G) 粗细胞类型注释的三种条件下的配体-受体相互作用。(H) 左:在中性粒细胞亚群中,颅盖和硬脑膜中性粒细胞在基于区域的 UMAP 中突出显示。右图:使用 scVelo 预测的 MCAo 中性粒细胞子集的发育轨迹。(I) 对中性粒细胞亚群的 PAGA 分析证明了基于条件的样品分离。(J) 三种条件下硬脑膜、颅骨和其他骨骼之间的DEG。
02
小鼠蛋白质水平的骨异质性
他们接下来使用质谱蛋白质组学研究小鼠骨骼、脑膜和大脑中的蛋白质组谱(图3A)。主成分分析(PCA)显示大脑和脑膜与骨骼分离。颅骨样本分布在 PC1 上,在 MCAo 条件下聚集最靠近脑膜(图 3 B)并靠近股骨(图 3 C)。
矩阵图和树状图证实了颅骨、脑膜和股骨 MCAo 样本在所有条件下与所有其他骨骼的分离(图 3D)。
使用加权相关网络分析(WGCNA),他们确定了三个具有颅盖特异性差异的模块。模块 1[主要与细胞外基质 (ECM) 组织相关]在所有三种情况下的颅盖样本以及脑膜 MCAo 和椎骨 MCAo 样本中均有所增加(图3E-F)。模块 2(主要涉及中性粒细胞脱颗粒和免疫以及 mRNA 加工)显示大脑、颅骨和脑膜中的表达减少(图 3G-H)。模块3在颅盖和脑膜中也下调(图3I),该模块与蛋白质运输、中性粒细胞脱颗粒和免疫通路相关(图3J)。
蛋白质组学分析证实中性粒细胞是颅骨和其他骨骼之间差异的主要来源。
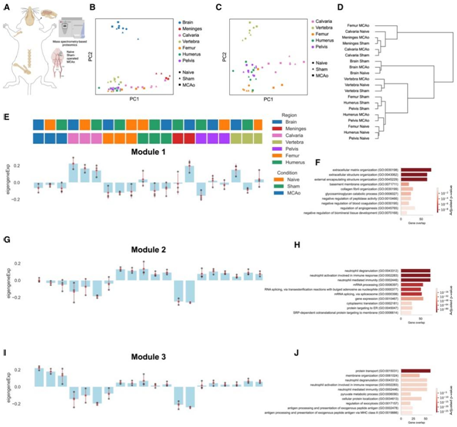
图3. 蛋白质组学鉴定表征骨间表达差异的蛋白质模块。
(A) 实验流程示意图:收集三只动物的小鼠颅骨、肱骨、椎骨、骨盆和股骨,在三种不同条件下进行质谱分析。(B-C)主成分分析 (PCA)。(D) 树状图分析。(E-J)骨、脑和脑膜中WGCNA鉴定的蛋白表达模块。
03
人体样本中 SMC 的表征
首先,他们使用组织透明化和光片荧光成像对来自 7 个人类头骨的额叶、顶叶和颞区的 23 个头骨和硬脑膜样本进行了 SMC 的表征(图 4 A)。使用免疫荧光来标记骨髓细胞 (LYZ2) 和巨噬细胞 (IBA1),使用碘化丙啶(PI)来标记细胞核,使用凝集素来标记脉管系统(图4B-4D)。人类 SMC 常横穿硬脑膜,通向硬脑膜下空间,形成蛛网膜颗粒。他们使用脱钙人类头骨的未清除福尔马林固定石蜡包埋 (FFPE) 切片的明场成像证实 SMC 横穿硬脑膜(图 4 E)。他们对 500 多个 SMC 进行了量化,发现它们大多为 40-90 μm 宽(图 4 F),基于区域的分析未显示显著差异(图 4 G)。利用头骨+硬脑膜的组织学,他们发现PDGFR-B信号同时存在于血管和SMC管腔处(图4H)。
SMC 结构显示,除了成纤维细胞层外,内部还存在免疫细胞以及充满脂质(图4H),这些发现表明,与小鼠不同,人类 SMC 可能充满脂肪,允许免疫运输,同时作为造血干细胞的能量来源。
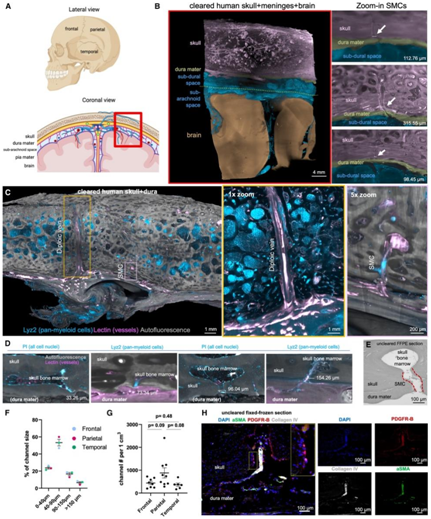
图4. 组织透明化可以全面表征人类颅骨-脑膜连接。
(A) 颅骨的额叶、顶叶和颞叶区域以及描绘脑膜层和大脑的冠状视图。(B) 对应于 (A) 中红色框的透明组织的代表性光片显微镜图像。(C)人类头骨不同区域的 SMC 量化。(D) 具有代表性的不同大小的颅骨-脑膜-通道:~ 33、~ 73、~ 96和~ 154 μm。(E) 来自 1 μm 厚 FFPE 嵌入颅骨硬脑膜切片的人类 SMC 示例。(F) 额叶、顶叶和颞区通道大小百分比的量化。(G) 量化带注释的通道数。(H) 人类 SMC 示例,动脉从 8 μm 厚的固定冷冻颅骨硬脑膜切片穿过颅骨,标有 DAPI(蓝色)、aSMA(绿色)、PDGFR-B(红色)和 CollagenIV(灰色)。
04
人类头骨蛋白质组不同于椎骨和骨盆
接下来,他们从两个独立尸检中心获得了 20 个死后人类头骨、椎骨和骨盆样本,用于蛋白质组分析(图 5 A)。在过滤前检测到 8526 个蛋白质组,在过滤后检测到 5320 个蛋白质组(图5B)。头骨中检测到的独特蛋白质数量最多,有 105 种独特蛋白质(图 5 C)。GO 分析揭示了 27 个头骨特异性突触和突触信号相关通路,如“化学突触传递”由 SYP、SYN3、SNAP25 和 SLC17A7 等蛋白质代表(图5D)。小鼠蛋白质组在颅骨中的Syp和Snap25蛋白也显示出阳性趋势。这可能表明,与其他骨骼相比,头骨更多地参与神经肽或基于神经递质的通讯。
PCA 图的 PC1 描绘了头骨的独特性质,而 PC2 表明头骨样本具有较大的方差(图 5 E)。成对之间的欧几里得距离显示头骨和骨盆之间的差异最大,椎骨和骨盆之间的差异最小(图5F)。
使用 WGCNA,他们确定了在人类蛋白质组数据集的头骨样本中下调的模块(图 5G), GO 分析结果与小鼠蛋白质组模块非常相似:最显著的是中性粒细胞脱颗粒和 mRNA 加工(图 5H)。
他们对一个人类死后的头骨进行了scRNA-seq(图 5 I)。在注释了 10 种细胞类型后(图 5 J), 评估了独特的颅骨蛋白的存在和表达水平(图 5 C)。在数据集中检测到6个独特的突触相关基因,主要集中在成纤维细胞中(图 5K)。
人类 scRNA-seq 数据证明了 mRNA加工和中性粒细胞脱粒模块的存在。蛋白质组学数据和 scRNA-seq 数据分别与这些 GO 分子中基因的 R 值相关(图 5 L-M)。人类头骨在转录组和蛋白质组水平上都不同于其他骨骼。
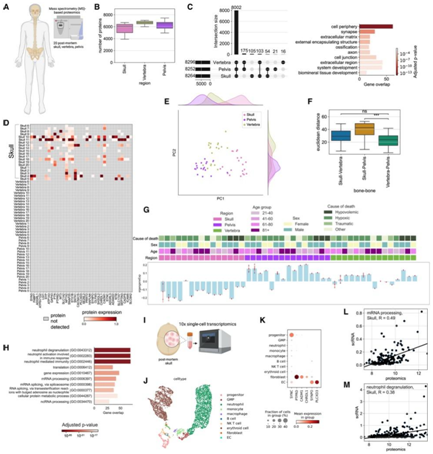
图5. 人体骨骼差异表达不同的蛋白质模块。
(A) 实验流程示意图,总共收集了 60 块骨头,对 20 块头骨、20 块椎骨和 20 块骨盆进行基于质谱的蛋白质组学分析。(B) 从每块骨头检测到的蛋白质数量用箱线图显示。(C) 从不同骨骼中检测到的常见蛋白质和独特蛋白质的数量以翻转图显示。(D) 属于与突触项相关的 GO分析的精选蛋白质的表达水平。(E) 所分析的三个骨骼的主成分分析。(F) 箱线图使用前 2 个主成分描述了骨骼对之间的欧几里德距离。(G) 骨骼中的 WGCNA 揭示了一个重要模块,其中与其他两块骨骼相比,颅盖基因下调。(H) 来自颅骨下调蛋白模块的 GO 分析。(I) 死后头骨样本的单细胞转录组分析图示。(J) UMAP可视化。(K) scRNA-seq 数据中检测到的独特头骨蛋白质的表达。(L) (G) 模块的相关图,mRNA 的GO分析。(M) (G) 模块的相关图,中性粒细胞脱颗粒的 GO 分析。
05
颅骨中的 TSPO 信号与炎症、缺血和神经退行性中枢神经系统疾病相关
接下来,他们检查了患者头骨对不同神经系统疾病的反应。移位蛋白(TSPO) 是一种在神经炎症期间大脑中显著上调的蛋白质,常用作正电子发射层析成像 (PET) 生物标志物。他们使用 CT 模板上的 3D 表面投影来显示阿尔茨海默症(AD)患者与健康对照之间的显著相对 TSPO-PET 差异(图 6 A)。发现AD患者的额叶、顶叶和运动皮质附近的颅骨区域的 TSPO-PET 信号明显增加(图 6 A-F)。同样,在不同病理条件下具有不同模式的每个患者队列中均观察到颅骨炎症信号升高(图6B-F)。

图6. 在患有炎症、缺血和退行性中枢神经系统疾病的患者的颅骨中观察到不同的 TSPO 信号。
(A) 3D 表面投影显示 AD 患者和健康对照之间在组水平上的TSPO-PET 差异。(B) 阿尔茨海默病 (AD)、中风、原发性进行性多发性硬化症 (PPMS)、复发缓解型多发性硬化症 (RRMS) 和 4 次重复 tau 蛋白病 (4RT) 患者的平均 TSPO-PET 信号。(C–F) 与不同大脑区域相邻的颅骨区域中的 TSPO-PET 信号量化。
接下来,他们对中风和 AD 患者进行纵向分析。根据临床需要选择时间点,通过将 13 名 AD 患者与 15 名连续成像的年龄匹配的健康对照进行比较,发现 AD 患者的头骨 TSPO-PET 信号平均增加 11%,而健康对照显示没有变化(图7A)。相比之下,他们观察到中风患者(13 名中风患者,11 名对照)在中风发作后 3 个月的头骨 TSPO-PET 信号下降了 17%(图 7B)。通过统计参数映射 (SPM)生成表面投影,以反映SPM12 头骨表面上纵向 TSPO-PET 变化的模式(图 7 C)。在中风患者中,他们观察到整个颅骨的纵向下降(图7C)。
他们将脑组图谱(Brainnetome Atlas)中246个脑区的TSPO-PET变化与AD患者的整体颅骨TSPO-PET信号变化进行了相关性分析,发现脑内局部小胶质细胞活化增加与整体颅骨炎症进展相关(图7D),这种关联存在于与 AD 病理学高度相关的大脑区域,即后扣带皮层 (PCC)(图7E),但在对照中仅发现弱相关性(图 7D)。这些结果表明头骨对 AD 中的脑部炎症有反应,并且可以作为监测人类神经炎症的指标。
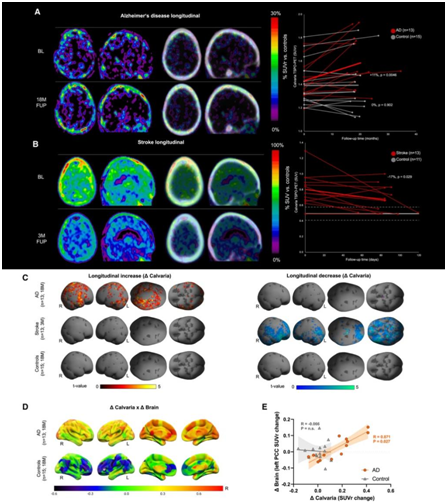
图7. AD和中风患者的颅骨TSPO-PET成像。
(A-B) 轴向和矢状切片显示A d患者和中风患者的PET 差异图像。(C) 表面投影显示 AD 患者、中风患者和健康对照者纵向 TSPO-PET 变化的统计参数映射 (SPM)。(D) 大脑表面投影显示颅骨中纵向 TSPO-PET 变化与 AD 患者和健康对照大脑中纵向 TSPO-PET 变化的区域相关性分析。(E) 左后扣带皮层中颅盖骨与大脑 TSPO-PET 变化之间的相关性分析。
+ + + + + + + + + + +
结 论
本项研究发现,与健康和受伤状态下的其他骨骼相比,小鼠头骨具有最独特的转录组特征,其特征是晚期中性粒细胞表型。在人类中,蛋白质组分析表明,颅骨骨髓是最独特的,具有差异表达的中性粒细胞相关通路和独特的突触蛋白特征。3D 成像展示了人类颅骨脑膜连接 (SMC) 与静脉的结构和细胞细节。使用移位蛋白正电子发射断层扫描(TSPO-PET)成像发现,头骨骨髓反映了患有各种神经系统疾病的患者的炎症性脑反应,具有疾病特异性的空间分布。头骨独特的分子特征以及解剖和功能连接显示了其作为诊断、监测和治疗脑部疾病的潜力。
+ + + + +



 English
English


