文献解读|Science(44.7):转录组范围的剪接网络揭示了核心剪接体的特殊调控功能
✦ +
+
论文ID
原名:Transcriptome-wide splicing network reveals specialized regulatory functions of the core spliceosome
译名:转录组范围的剪接网络揭示了核心剪接体的特殊调控功能
期刊:Science
影响因子:44.7
发表时间:2024.10.31
DOI号:10.1126/science.adn8105
背 景
从信使 RNA 前体中去除内含子(pre-mRNA 剪接)对于大多数真核基因的表达至关重要,这一过程由剪接体完成,剪接体是真核细胞中最复杂、最活跃的分子机制之一。剪接体由五种小核糖核蛋白颗粒(U1、U2、U4、U5 和 U6 snRNP;U4/U6.U5 形成三 snRNP 复合物)和 100 多种其他蛋白质组成。这些因子通过一系列高度动态的组成和构象转变在每个内含子上组装,进行两次 RNA 催化的酯交换反应,导致内含子去除和侧翼外显子序列剪接在一起。在超过 90% 的人类基因中观察到内含子去除的替代模式[可变剪接(AS)],并有助于调节细胞分化和体内平衡。AS 的改变经常导致或改变从遗传疾病到神经退行性疾病和癌症等多种病症的进展。
虽然AS 具有生物学和病理学意义,但调节剪接位点选择的分子机制仍不太清楚。传统观点认为,剪接调节因子与位于pre-mRNA 中的调节序列(增强子和沉默子)结合,并调节内含子边界(分别为 5′ 和 3′ 剪接位点)上早期组装的核心 U1 和 U2 snRNP 复合物的组装。然而,剪接体中随后构象重排的复杂性在多大程度上用于调节剪接位点选择仍是一个悬而未决的问题。
实验设计
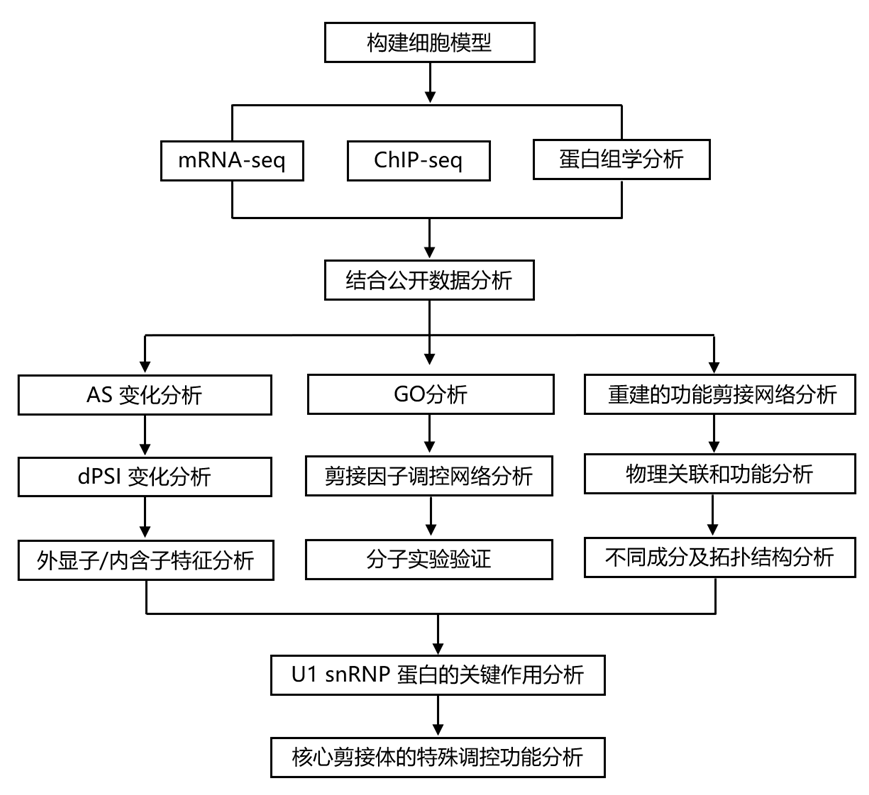
结 果
01
剪接因子敲低后转录组发生改变
为了系统地研究剪接体成分和调节剂在剪接过程中的作用,研究团队从 HeLa 细胞中纯化了一批聚腺苷酸 (polyA)+ RNA 样本,其中 305 个剪接相关蛋白质编码基因 (SF) 的表达由小干扰 RNA (siRNA) 单独敲低 (knockdown, KD)。SF 包括核心剪接体成分(来自主要剪接体和次要剪接体)和相关因子、在 AS 中具有已知调节功能的 RNA 结合蛋白以及与剪接调控相关的 RNA 修饰酶和染色质相关因子。对该 polyA+ RNA 集合进行深度 mRNA 测序 (mRNA-seq) 分析[双端、125 个核苷酸 (nt) 长、100 M Illumina 读段/样本],然后定量基因表达 [edgeR] 和 AS [VAST-TOOLS],该方法能够评估超过 270000 个 AS 事件(超过 82000 个事件在所有 KD 中具有足够的读段覆盖率),其中包括外显子跳跃 (ES)、5′ 端或 3′ 端可变剪接位点(Alt5′ss 或 Alt3′ss)和内含子保留 (IR) 事件(图 1A)。
通过比较不同 KD 中的 AS 扰动情况,可以推断出连接功能相似的 SF 的调控网络。以前,通过比较一组有限的 35 个盒式外显子的情况,可以识别介导细胞应激和细胞内铁过量影响的剪接体组分,重新发现抗肿瘤药物的靶点,更广泛地说,有助于揭示核心剪接体组分的一些调控潜力。同样,对 1500 多个基因的 KD 后与细胞多能性、重编程和神经分化相关的 52 个 AS 事件的分析揭示了转录因子对 AS 调控网络的多层控制。现在,转录组范围数据的可用性为以下工作提供了机会:(i) 全面分析不同的 AS 类型以及分析任何所需的 AS 事件或 SF 子集,(ii) 整合来自其他剪接扰动(例如与癌症进展相关的扰动)的 RNA 测序数据以研究其潜在机制,(iii) 发现交叉调控 SF 网络,以及 (iv) 系统分析与任何特定剪接变化子集或 SF KD 相关的序列特征(图 1A)。
单个SF KD导致AS发生显著变化,范围从几百到6000多个事件,优先导致IR(45%)和ES(37%)事件发生(图1B-C)。参与 5′ 或 3′ss 识别早期步骤的因子,例如 U1 或 U2 snRNP 的成分,更频繁地影响 ES 事件,而参与剪接体组装和激活晚期阶段的因子,例如保留和剪接成分 (RES)、pre-RNA 加工 19 (PRP19) 或 C 复合物,更频繁地影响 IR 事件(图 1B-C),这表明 IR 的限速步骤通常发生在初始剪接位点识别之后。属于同一亚复合物(例如 U2 snRNP SF3A、SF3B 或 Bact)的 SF 的 KD 显示出常见的 AS 变化模式,但是各个因子的模式仍然可以区分,这表明物理连接的因子对剪接位点选择有不同的贡献。他们对与 U1、U2 或 U4/U6.U5 snRNP 或 PRP19 复合物的成分进行完整的蛋白质组分析,证实了相应 SF 的蛋白质水平大幅降低,对同一亚复合物中其他蛋白质因子水平的影响有限,但也上调了其他复合物中的 SF,这表明存在补偿机制(图 S3A)。
虽然剪接变化在人体组织中表现出生理调节的内含子和外显子上更为明显,但也检测并验证了组成性外显子的跳跃、非调节内含子的保留以及主要在 U2 snRNP 成分的 KD 上使用新的 Alt5′ 或Alt3′ ss(图 1B)。特定因子优先参与激活新的 Alt5′ss(例如 USP39,U4/U6.U5 snRNP 的泛素肽酶成分)或新的 Alt 3′ss[例如 XPA 结合蛋白 2 (XAB2),一种也参与转录、DNA 修复和 R 环加工的 SF](图 1D)。外显子插入百分比 (dPSI) 和内含子保留百分比 (dPIR) 的变化通常对于对照样本中显示中等 PSI/PIR 值的外显子更明显,从而概括了先前描述的剪接扰动的标度定律效应(图 1E)。与非开关样 (PanAS) 事件相比,组织限制性开关样 AS 外显子(例如在少数组织中完全包含,但在所有其他组织中完全跳过的外显子)似乎较少受 U1 或 U2 snRNP 成分的调控(图 S3B-D)。这与这些 SF 在组织中的不同表达模式相关(图 S3E)。
该数据集允许识别调节样本中检测到的任何感兴趣的 AS 事件的 SF。大多数事件对KD 为 3.05(平均值)的 SF 有反应(|dPSI| > 0.15)(图 1F),不同的事件显示出不同的调节器数量、子集和排名(图 1G)。这也延伸到了组成性外显子的调控。在一个或多个 KD 中,只有有限部分可检测到的 AS 事件发生了改变,由特定 SF 调控的事件数量与 KD 实现的转录水平降低仅有轻微相关性,这证明了观察到的影响的特异性。该数据集概括并提供了有关先前单个事件筛选中确定的调节因子的更多见解,例如,对于参与控制细胞凋亡的 AS 事件,例如 Bcl-2 样蛋白 1 (BCLX) 或诱导性髓系白血病细胞分化蛋白 1 (MCL1)。此外,该数据集揭示了跳过外显子和保留其侧翼内含子的不同调节因子(图 1G),再次验证了不同类别或亚类 AS 事件的调控中存在不同的限速步骤。最新的研究揭示了 AS 调控的不同特征,取决于转录基因的中心(核斑点相关)或外周(层蛋白相关)核定位。本项研究数据确定了 KD 对 AS 事件表现出更强的调控作用的 SF,具体取决于基因在细胞核内的位置(图 1H)。
与 ES 事件相关的整体序列特征分析表明,较长的内含子两侧的短外显子,特别是当显示外显子与内含子鸟嘌呤/胞嘧啶 (GC) 含量比差异时,对 SF 的 KD 最为敏感,这是一种与外显子定义机制的靶向性相兼容的调控结构(图 1I)。具有差异长度和/或差异 G-C 含量结构的 ES 剪接单元更有可能在 ES 中发生错误剪接,而具有水平结构的单元更有可能在剪接体受到干扰时产生内含子保留的特征(图 1J)。对 SF KD 最敏感的内含子通常长度较短,两侧是较长的外显子,与靶向内含子定义机制相一致。然而,出乎意料的是,与非调控内含子相比,它们与两侧外显子相比显示出更大的 GC 含量差异(图 1I)。如预期的那样,非调控的外显子和内含子通常与比对 SF KD 更敏感的外显子和内含子更强的剪接位点序列相关。
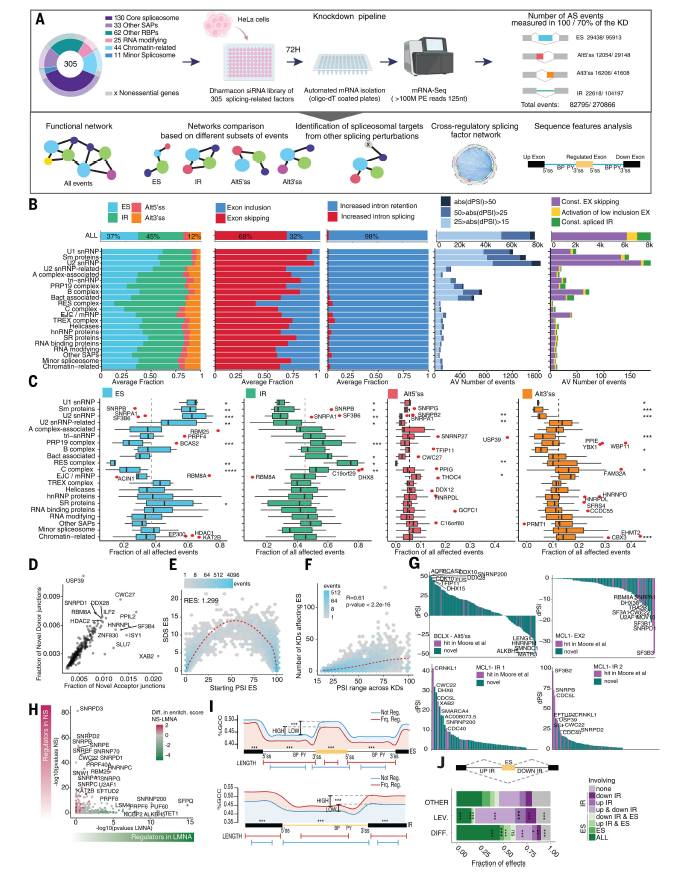
图1. 305 个剪接和剪接相关因子的系统 KD 的转录组分析。
(A) 样本收集和数据分析工作流程概述,包括功能剪接网络重建和应用以揭示 AS 调控机制。(B) AS 变化指标。(C)箱线图说明了在整个数据集中观察到的完整 AS 变化集的分数。(D) 新型 5′(供体)或 3′ 剪接位点(受体)连接的归一化分数图。(E) BinHex 图说明了 AS 变化强度与盒式外显子的起始 PSI 值之间的关系。(F) BinHex 图说明了所有 KD 中受调控外显子的 dPSI 范围与调控该事件的 KD 数量之间的关系。(G) 条形图表示 BCLX Alt5′ss 选择、MCL1 外显子 2 跳跃和 MCL1 内含子 1 和 2 保留的 SF KD 的排序 dPSI 值。(H) 散点图说明了调节 ES 事件的 SF 在位于两个不同细胞区室的转录本中的富集。(I) 频繁受到调节(Frq. Reg.)变化的外显子和内含子中最具统计学意义的差异序列特征的示意图。(J) 堆积条形图显示由两个内含子和一个外显子组成的单位的可能剪接结果的分布。
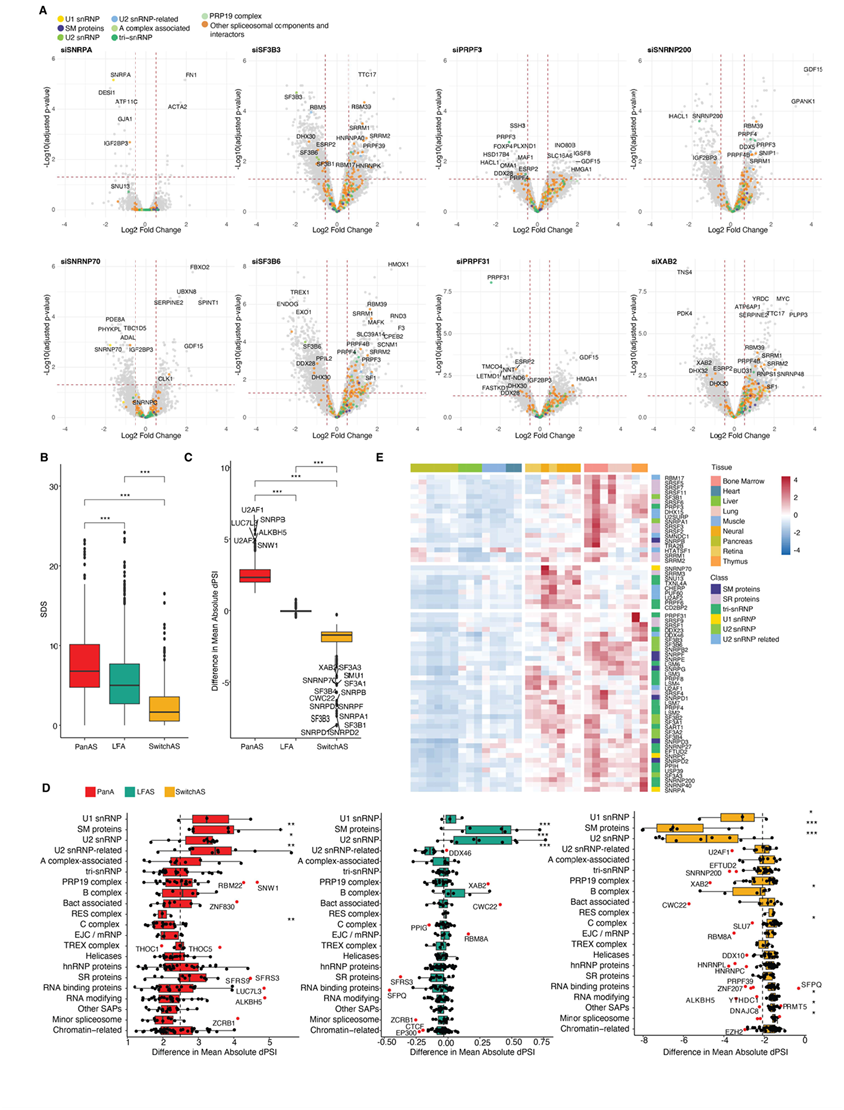
图S3. 所选SF的KD全蛋白质组分析。(A) 蛋白质水平变化的火山图。
(B) 箱线图显示了三组不同AS事件类型中SF的KD诱导的剪接变化幅度。(C) 箱形图显示了PanAS、LFA和SwitchAS的平均绝对dPSI相对于所有事件的dPSI的差异。(D) 箱形图显示了各种剪接复合物和相关蛋白的平均绝对dPSI的差异。(E) 不同组织类型中sf相对mRNA表达水平的无监督聚类热图。
02
广泛的交叉调控剪接因子网络分析
GO分析表明,编码SF和RNA结合蛋白的基因是SF KD在AS水平上最常受到影响的基因之一(图2A)。编码 SF 的基因中的 AS 事件会因六个 SF 基因的 KD 而发生显著改变(|dPSI| > 0.25),调节器的数量与基因的转录复杂性(即其包含的 AS 事件数量)没有紧密联系(图 2B)。平均每个SF KD 影响 24 个其他 SF 基因的 AS,剪接因子 3b 亚基 1 (SF3B1)、CWC22 或 XAB2 等因素影响超过 100 个其他 SF 基因(图 2B)。80% 的 SF 基因通过 AS 受其他 SF 调控,其中 43% 参与 AS 自调节回路(图 2C),约 50% 的 ES 和 SF 基因中超过 60% 的 Alt5’ss 或 Alt3’ss 事件不会破坏开放阅读框 (ORF),这导致mRNA编码不同的蛋白质同工型(图 2D-E)。某些类型的 SF,例如 U2 snRNP 或 B 复合物成分,倾向于优先影响其他特定的 SF 类,例如转录输出复合物 (TREX) 的成分、解旋酶或 A 复合物相关蛋白,这表明交叉调节网络内存在的功能结构可能有助于缓冲剪接活性的降低,以维持细胞稳态(图 2F)。
该数据集可用于区分剪接扰动的直接和间接影响。例如,SF3B1(抗肿瘤药物的靶点,例如 Pladienolide B、Spliceostatins 或 Herboxidiene)的 KD 会诱导基因 RNA 结合基序 10 (RBM10) 外显子 6 的跳跃,该基序编码一种在多种癌症类型中经常发生突变的肿瘤抑制因子(图 2G)。外显子 6 跳跃导致 RBM10 蛋白水平逐渐降低(图 2H)。RBM10 至少部分通过抑制 NUMB 外显子 9 发挥其肿瘤抑制功能,从而产生抗增殖异构体。虽然SF3B1 KD 最初会诱导 NUMB 外显子 9 跳跃,但这种效果在后期会逆转(图 2I)。这种转换可能是通过 SF3B1 KD 诱导的 RBM10 蛋白水平降低引起的,因为 (i) 这种转换不会发生在不受 RBM10 调控的其他 AS 事件中以及 (ii) RBM10 的过表达会减弱 NUMB 外显子 9 包含中的转换,但不会减弱其他 RBM10 独立的 AS 事件中的转换(图 2I)。SF 交叉调节效应导致AS 变化的复杂特征,在这种情况下可能有助于减弱 SF3B1 靶向药物的抗肿瘤作用。事实上,用 Spliceostatin A 治疗会导致 150 多个编码 SF 的基因的 AS 发生变化,随着时间的推移,这些基因通常会下调其蛋白质水平,例如致癌 SR 蛋白、富含丝氨酸/精氨酸的剪接因子 1 (SRSF1)。这种间接作用导致与药物抗肿瘤活性相关的 AS 变化,例如促进 MCL1 死亡诱导异构体的变化。
RBM10 过表达对 NUMB 外显子 9 剪接的部分挽救可能反映了受 SF3B1 调控的其他 SF 的贡献。事实上, NUMB 外显子 9 受 42 个 SF KD 调控(图 2J)。ENCODE 数据集仅报告了这些 SF 中三分之一是NUMB 转录本的直接结合物。然而,考虑到交叉调控网络,其余影响中约三分之二可通过其他 SF 的 KD 引起的直接结合物的基因表达以及 AS 变化(图 2J-K),SF之间的交叉调节代表了最强的差异贡献。
结合染色质免疫沉淀测序(ChIP-seq)数据,他们发现 EP300(一种与剪接调控相关的组蛋白乙酰转移酶)促进剪接调节子 PTBP1 的表达,同时发生 EP300 结合、组蛋白 H3K27 乙酰化(H3K27ac)和 PTBP1 启动子的脱氧核糖核酸酶 (DNase) I 超敏反应性过程(图2L-N)。
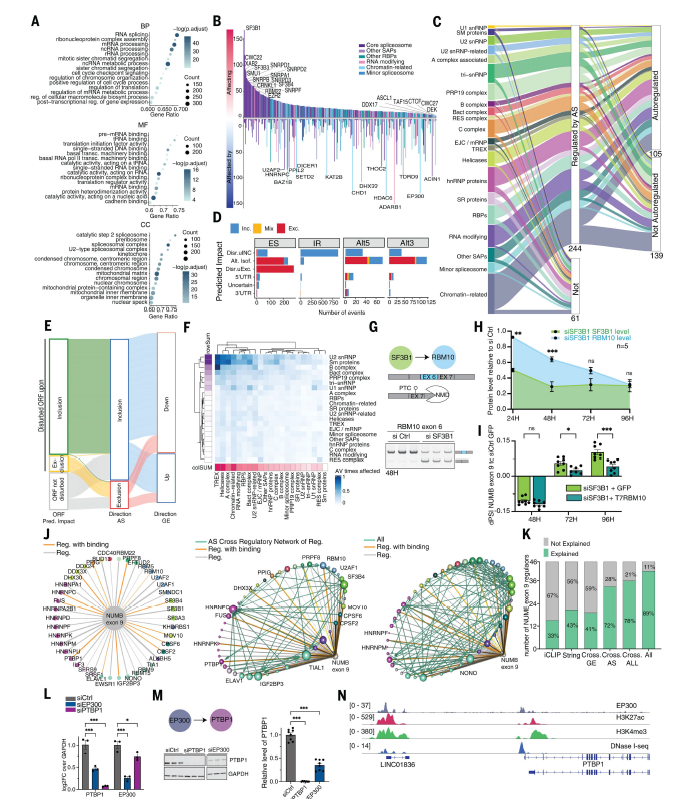
图2. 剪接交叉调控网络。
(A)GO分析。(B) 条形图说明在单个 SF 的 KD 时受 AS 影响的 SF 基因数量(上方y轴)以及 KD 影响单个 SF 的 SF 数量(下方y轴)。(C) 桑基图说明 SF 类别的调节模式,表明在 SF KD 时受 AS 调节(或不受 AS 调节)的 SF 基因数量,无论是自动调节还是非自动调节。(D) 条形图显示了 SF 基因中发生的 AS 事件对 SF KD 的预测影响。(E) 桑基图显示了 SF 基因中 AS 事件对 SF KD 对 ORF 的预测影响、AS 变化的方向以及对基因表达 (GE) 的影响之间的关系。(F) 热图显示了属于不同类别的 SF 之间的交叉调节聚类。(G) SF3B1 KD 时,基因RBM10的外显子 6(EX6)跳跃,导致产生过早终止密码子 (PTC),这可能使 mRNA 受到无义介导的 mRNA 衰变降解。(H) 基于蛋免疫印迹的定量结果。(I) 条形图显示 SF3B1 KD 后 NUMB 外显子 9 的“剪接百分比”(dPSI) 的变化。(J) 网络图提供 SF 对 NUMB 外显子 9 纳入调节的多层次概览。(K) 堆叠条形图说明了有助于解释 NUMB 外显子 9 SF 调节剂影响的各种数据层。(L) RT-PCR 分析。(M)免疫印迹分析。(N) 基因组浏览器视图,显示 EP300 的 ChIP-seq 谱以及染色质标记 H3K27ac 和 H3K4me3 以及 HeLa 细胞中 PTBP1 基因座启动子区域的 DNAse I-seq 可及性数据。
03
整个剪接体循环中的调节潜力
在剪接体和调控因子的每个成分耗竭后,转录组范围的数据可用性提供了一个机会,可以根据在最佳灵敏度、特异性、F分数和错误发现率条件下 KD 之间剪接扰动概况之间的相似性重建 SF 之间的功能相互作用网络。网络是通过联合比较所有类别的 AS 事件生成的(图 3A),重点关注特定子集,例如 ES、IR、Alt5′ss 或 Alt3′ss。这些具有不同功能模块的密集互连网揭示了许多以前未知的关联(图 3A-C)。一些突出的关联包括 Sm 复合物的成分(D2 和 D3)、U2 snRNP 亚复合物成分(SF3A1 和 SF3B4)之间的间接接触,以及 CWC22 与晚期剪接体的其他成分(如 CRNKL1 或 XAB2)之间的功能性联系。值得注意的是,CWC22 对于外显子连接复合物 (EJC) 的募集很重要,并且与 SF3B1 一起是 SF 交叉调节网络中的关键节点(图 2B)。
网络的核心是两个不同的早期(包括 U1 和 U2 snRNP 成分)和晚期(包括 U4/U6.U5 tri-snRNP 和 PRP19 复合物成分)核心剪接因子聚类(图 3D-E),这些模块与其他模块之间的联系更为松散,包括剪接调节剂[异质性核RNP(hnRNP)和SR蛋白]、RBM17复合物或小剪接体的组分(图3A)。总体而言,功能连接的强度随着剪接体组装、构象变化导致的催化和剪接体循环的进展而单调下降。然而,根据各种网络连接性标准,连接最紧密的 SF 属于整个通路上的复合体。对 SF 的 KD 转录组谱进行比较重建了剪接体组装和催化过程中发生的功能相互作用网络,并强调了整个剪接体循环中的调控潜力。
功能网络在高分辨率下重现 SF结构排列的程度的三个例子是涉及 SF3B6 的连接、对外显子跳跃的 U4/U6.U5 三 snRNP 因子的全面分析以及外显子与内含子中的差异连接。尽管 SF3B 复合物的七个组分中有六个彼此紧密相连,并且与早期复合物的其他组分紧密相连,例如 U1 snRNP、U2 snRNA 辅助因子 (U2AF) 或pre-mRNA 加工因子 40 (PRPF40)(图 3D), SF3B6(已证明可以稳定早期复合物中的分支点-U2 snRNA碱基配对),从一般网络分析中可以看出,它与晚期复合物的组分(如PRPF8)在功能上相关(图3E)。该网络重建结果与 Bact 复合物低温电子显微镜结构中观察到的 SF3B6 和 PRPF8 之间的物理相互作用非常吻合(图 3F),这与 SF3B6 在 U2/U6 螺旋 II 形成中的作用相一致。这些结果表明,U2 snRNP 的不同成分在剪接体组装或激活的不同阶段在 AS 中表现出调节活性。
U4/U6.U5 tri-snRNP 在 U1 和 U2 snRNP 初步识别剪接位点后在早期剪接体复合物上组装,并引发构象变化,导致内含子去除。通过 U4/U6.U5 tri-snRNP 组分 KD 时外显子跳跃或包含模式的相似性建立的功能连接的详细拓扑结构与粒子的结构物理组织非常吻合(图 3H)。基于低温电子显微镜的 U4/U6.U5 tri-snRNP 网络由 39 种蛋白质和 134 条边组成。他们基于转录组的 U4/U6.U5 网络数据,分析了 33 种(85%)蛋白质,并将 62/80(76%)已知物理相互作用归类为与调节替代外显子插入功能相关的相互作用。将公共转录组数据整合到不同细胞系中 snRNA 的 KD 上,也会产生功能连接,这些连接重现了剪接体 snRNP(包括 tri-snRNP)的结构组织(图 3I),认为该网络相互作用具有普遍适用性和价值。将这些连接整合在一起时,该网络重现了 U4/U6.U5 tri-snRNP 中已知的 66/80 (81%) 物理相互作用。
网络重建结果揭示了现有低温电子显微镜分析或相互作用数据库中未报告的物理相互作用的因子之间的功能联系。其中一些连接是在 ES 中发现的,而不是在 IR 网络中发现的。最近发表的蛋白质交联结果证明这些因子在 B 和 B 样复合物中存在密切(可能是短暂的)物理接触,这与在 ES 与 IR 网络中发现的功能联系一致(图 3G),这些结果凸显了剪接体中复杂(即使是短暂的)结构转变的调控能力,可以通过功能网络方法捕获。
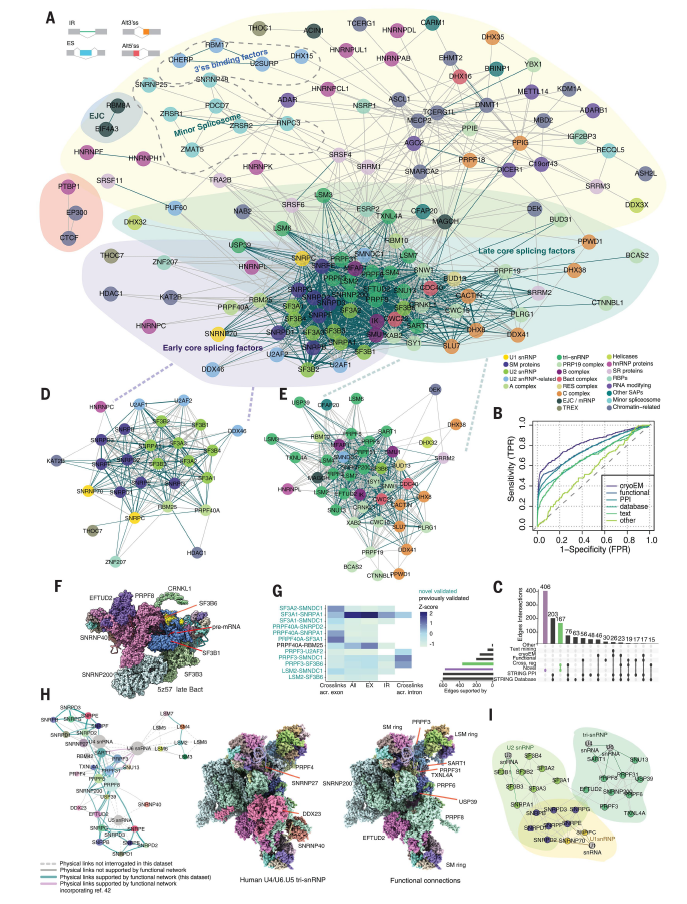
图3. 功能网络准确捕捉已知的物理和功能关联并识别新的关联。
(A) 使用数据集中检测到的所有 AS 事件(ES、IR、Alt5′ss 和 Alt3′ss)重建的功能剪接网络的图形表示。(B) 接收者操作特性 (ROC) 曲线图评估剪接网络中的边缘分类器。(C) 显示跨多个数据源的边缘分类的扰动图。(D) 早期核心 SF 聚类内的详细功能相互作用。(E) 晚期核心 SF 聚类内的详细功能相互作用。(F) Bact 复合物低温电子显微镜结构细节 (5z57),突出显示了 U2 snRNP 成分 SF3B6 和晚期 SF PRPF8之间的物理接触,通过功能网络重建重现。(G) 功能网络连接重现了新近描述的化学诱导蛋白质-蛋白质交联。(H) U4/U6.U5 内的功能连接重现了三 snRNP 的拓扑组织。(I) 涉及 U1、U2 和 U5.4/6 三 snRNP 蛋白成分的功能相互作用。
04
U1 snRNP 蛋白在不同剪接位点选择事件中发挥的不同作用
对不同类别的 AS 决策进行网络重建,确定了跨类别的功能连接核心,以及特定类别或子类的连接子集(图 4A-B)。通常,连接的强度与发现连接的不同网络的数量以及使用引导分析发现的特定网络中的出现次数相关。通过使用在剪接体组装、催化和拆卸阶段的复合物的低温电子显微镜结构中确定的物理接触作为参考,验证了核心功能连接中存在的剪接体循环的物理接触,用于 ES 和 Alt5'ss 发挥功能;相比之下,晚期复合物(Bact 以外)中发生的物理接触与 IR 更相关,并且参与 Alt3'ss 选择的功能连接在 U2 snRNP 成分中明显更强,这与复合物在 Alt3'ss 识别中的关键作用一致(图 4C-D)。
比较在不同 AS 类别上重建的网络可以揭示剪接体复合物的不同调控机制。鉴于其在 5′ 剪接位点识别中的核心作用,他们专注于 U1 snRNP 成分的功能连接,虽然在基于 Alt5′ss 信息构建的网络中,三种 U1 特异性蛋白质(U1A、U170K 和 U1C)彼此紧密相连并与 U1 snRNA 紧密相连,但在居于外显子跳跃信息重建的网络中,U1A 明显缺失(图 4D-E),该观察结果在两个 AS 类的具体实例以及转录组分析数据(图 4F-G)得到了验证。这些结果表明,U1A 在 Alt5′ss 选择中发挥作用,核心剪接体复合体中出现了明显的分工特征(图 4H)。
为了直接验证这一假设,他们使用纯化的、成分明确的重构 U1 snRNP来补充 HeLa 细胞核提取物,其中内源性 U1 snRNP 由核糖核酸酶 (RNase) H 介导的 5′ 端消化所灭活。U1 snRNP 失活导致在上游 5′ 剪接位点(含有两个Alt5′ss的模型pre-mRNA 底物)的利用率增加(图 4I)。用含有 U1A 和 U170K 的纯化 U1 snRNP 补充灭活提取物可逆转这种效应,但用缺少这两种蛋白质的 U1 snRNP 颗粒则不会逆转这种效应(图 4J),该结果与以 Alt5’ss 事件为重点的功能网络重建结果一致,该重建结果映射了这些因子与其他 U1 snRNP 成分之间的功能连接(图 4E-G)。
为了评估 U1 snRNP 对外显子包含的影响,他们使用了包含 Fas/CD95 外显子 6 的模型外显子定义底物,该底物两侧是 Alt3′ss 和 Alt5′ss 序列,其中复合物 A 的形成(U2 snRNP 结合)不仅如预期的那样需要 3′ 剪接位点,而且对 U1 snRNP 的 5′ 剪接位点识别也很敏感,如 U1 snRNP 失活后复合物 A 的形成减少所示(图 4K),这种效应可通过重组含有 U1A 和 U170K 的 U1 snRNP 或缺乏 U1A 的 U1 snRNP 恢复,但不能通过缺乏 U170K 的 U1 snRNP 恢复(图 4L)。缺乏 U170K 的粒子与模型 5′ 剪接位点寡核苷酸的结合降低,而缺乏 U1A 的粒子则表现出与完整 U1 snRNP 粒子相似的结合。U1A 虽然是 U1 snRNP 在 Alt5′ss 选择中发挥作用所必需的,但与外显子功能无关(图 4E-G)。
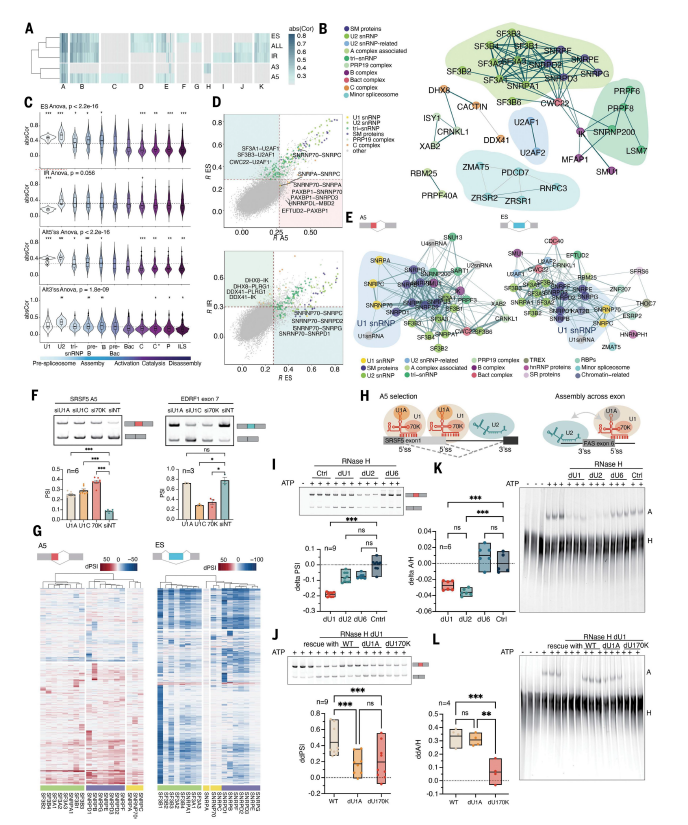
图4. 不同类别 AS 事件之间的功能关系。
(A) 热图显示不同 AS 类型[包括 ES、IR、Alt5′ss (A5)、Alt3′ss (A3) 及其概要 (ALL)]之间的 SF 功能关联的检测和大小。(B)表示在所有网络类型中一致存在的连接。(C) 小提琴图显示了剪接体循环各个阶段的核心连接强度。(D) 散点图比较了 ES 与 Alt5′ss 网络和 IR 与 ES 网络中 SF 之间的功能性连接强度。(E) 基于 Alt5′ss 和 ES AS 事件的网络显示 U1 snRNP 复合体成分的第一和第二邻居之间的功能连接。(F) 半定量 RT-PCR 检测验证 U1A、70K 和 U1C 成分在 Alt5′ss 和 ES 事件中的不同作用。(G) U1 snRNP 蛋白 U1A、U170K 和 U1C 的 KD 对 Alt5′ss 和 ES 的转录组范围差异效应热图。(H) U1 或 U2 snRNP 在底物剪接位点上的占有率示意模型,用于体外测定直接测试 U1 snRNP 蛋白对 Alt5′ss 选择和跨外显子的相互作用。(I) 使用 SRSF5 pre-mRNA 中的 Alt5′ss 事件进行体外 Alt5′ss 选分析。(J) 代表性半定量 RT-PCR 检测和定量添加所示 U1 snRNP 颗粒后近端 5′ 剪接位点利用率 (ddPSI) 变化的差异。(K) 体外剪接体组装试验。(右)代表性剪接体组装试验检测在对照 (Ctrl) 条件下和 U1、U2 或 U6 snRNA 失活后在 Fas 外显子 6 RNA 底物上 A(U2 snRNP)和 H(hnRNP 蛋白)复合物的形成。(左)与对照条件相比,A/H 复合物比率变化的箱线图定量。(L) Fas 外显子 6 需要 U170K 而不是 U1A。
+ + + + + + + + + + +
结 论
本研究报告了对人类癌细胞中 305 个剪接体成分和调节因子进行系统敲除的转录组分析数据,以及重建控制不同类型可变剪接决策的功能性剪接因子网络,分析了剪接因子交叉调节的复杂回路,揭示了后期组装的 U4/U6.U5 snRNP 复合物的精确结构调节剪接位点配对,并发现 U1 snRNP 的蛋白质成分在调节外显子定义和Alt5′ss选择方面存在前所未有的分工特征。因此,本研究为探索剪接调节的生理和病理机制提供了新的理论依据。
+ + + + +



 English
English


