文献解读|Nat Genet(31.7):多组学分析突出了与非小细胞肺癌免疫化疗耐药性相关的因素
✦ +
+
论文ID
原名:Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small-cell lung cancer
译名:多组学分析突出了与非小细胞肺癌免疫化疗耐药性相关的因素
期刊:Nature Genetics
影响因子:31.7
发表时间:2024.12.10
DOI号:10.1038/s41588-024-01998-y
背 景
免疫检查点阻断 (ICB) 治疗彻底改变了非小细胞肺癌 (NSCLC) 的治疗,甚至治愈了一些晚期患者。新辅助免疫化疗比单独使用 ICB 更有效,平均缓解率为 32%。许多NSCLC患者仍然对新辅助免疫化疗具有耐药性,这种耐药性背后的分子机制仍不清楚。
实验设计
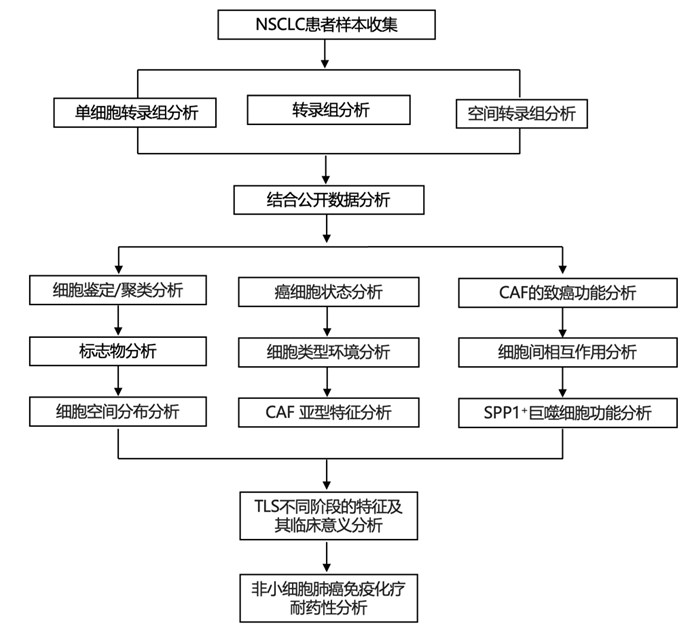
结 果
01
研究设计和研究队列概述
为了揭示ICB-化疗前后NSCLC的变化,研究团队采用scRNA-seq对19例NSCLC患者在抗PD-1和化疗新辅助治疗前后的26个肿瘤样本进行了分析(图1a-b)。根据病理学评估,该评估在评估ICB-化疗治疗效果和预测生存率方面是可靠的,将六名患者归类为应答者[其中五名患者病理完全缓解(pCR),一名患者病理主要缓解(MPR)],其余13名患者为无应答者[表现出非主要病理缓解(NMPR)](图1b)。三名应答者和四名无应答者的治疗前后肿瘤标本相匹配(图1b)。经过质量控制后,他们获得了 232080 个单细胞的转录组,平均每个细胞捕获 2645 个读数和 1205 个基因。他们进行了无监督聚类分析以解析细胞组成,并使用典型的细胞类型特异性标记进行细胞类型注释(图1c-d)。
他们获得了 64947 个上皮细胞,它们形成了两个不同的主要聚类(图1c),大概代表具有不同转录组特征的正常细胞和恶性细胞。为了更好地表征上皮细胞的异质性,他们对这些细胞进行了重新聚类。他们使用 InferCNV 平台根据它们的拷贝数变异(CNV)分离正常细胞和恶性细胞(图1e)。无监督分析确定了 21 个上皮亚聚类:八个具有不同标志物的正常亚聚类和 13 个恶性亚聚类。在上皮细胞区室中,ICB 化疗后应答者的恶性细胞基本上消除(图1e),他们还观察到免疫和基质区室内的改变。在免疫细胞区室中,治疗后无应答患者的单核细胞/巨噬细胞和树突状细胞比例与治疗前水平相比有所增加(图1f)。此外,在 CD31 −基质细胞区室中,无论是在基线还是治疗后,无应答患者的 XI 型胶原蛋白 α 1 链阳性 (COL11A1+) 癌症相关成纤维细胞 (CAF) 比例均显著高于应答患者(图1g)。这些结果表明此类细胞在影响 ICB 化疗反应性方面可能发挥作用。虽然scRNA-seq 为 NSCLC TME 的细胞组成提供了有价值的见解,但它缺乏有关肿瘤内细胞空间分布的信息。因此,他们分别使用 GeoMx 数字空间剖析器 (DSP) 平台和 10x Genomics Visium 平台对 14 例未治疗标本和 17 例治疗后标本进行了空间转录组分析(图1b-i),发现了众多异质性特征。
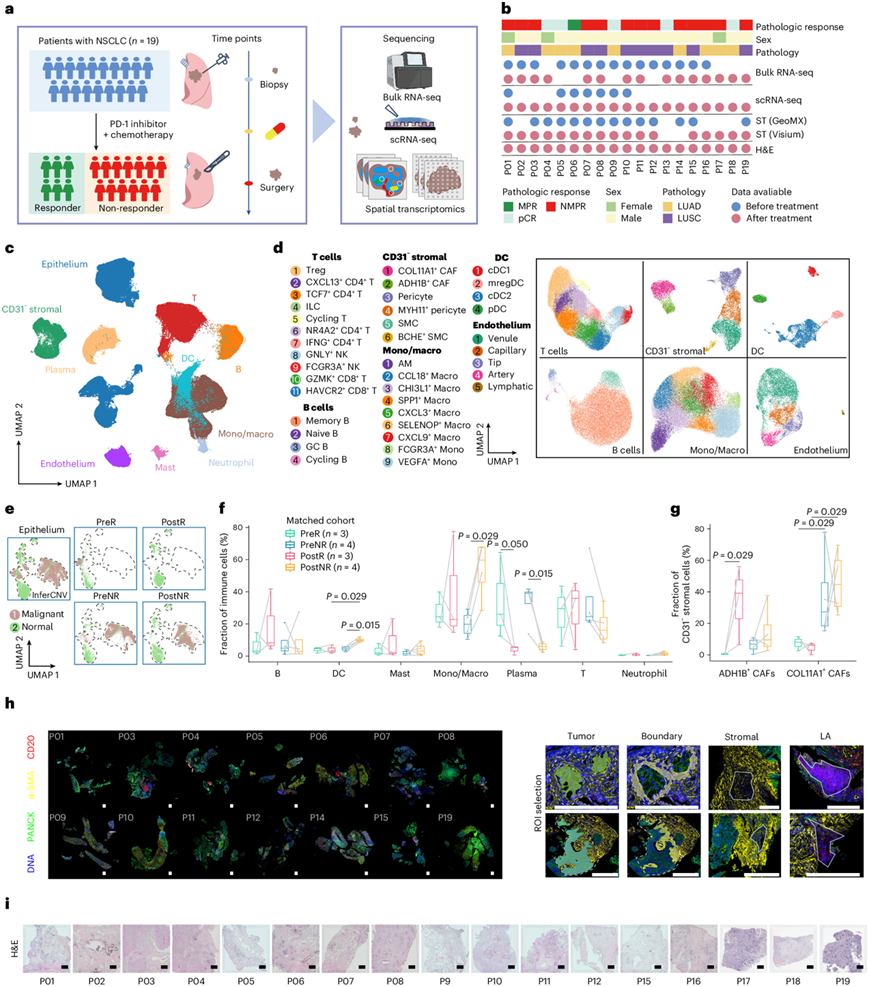
图1. 使用联合 scRNA-seq 和空间转录组分析对 ICB 化疗前后 NSCLC 组织进行细胞和分子表征。
(a) 研究设计的工作流程。(b) 参与本研究的每位患者的样本信息。每个相关检测的点表示数据可用性。(c-d) 样本中所有 232080 个细胞的 UMAP 图。(e) 上皮细胞的 UMAP 图。(f) 箱线图展示了基线(治疗前)和治疗后来自三名应答者和四名无应答者的匹配样本中免疫细胞亚型的比例。(g) 箱线图显示基线和治疗后来自三名应答者和四名无应答者的匹配样本中 CD31−基质谱系中成纤维细胞亚型的比例。(h) 空间转录组学分析。(i) 对接受免疫治疗的队列(n = 17)中的标本进行H&E 染色。
02
定义与治疗结果相关的癌细胞状态
肿瘤中的转录异质性是支持肿瘤发生、进展、转移和治疗耐药性的基础。最近的研究已将基因模块确定为定义细胞状态的关键特征。利用 scRNA-seq 数据,他们最初分享了癌细胞的细胞状态。通过 Harmony,他们将这些细胞分为 14 个子集,并通过基因集富集分析对它们进行注释,其中标记物表达水平较高(图2a-b)。细胞状态聚类为两组:一组包括干扰素 (IFN)、肺泡、雌激素、细胞外基质和凝血细胞状态,另一组包括鳞状、核因子红细胞2相关因子2 (NRF2) 靶标和细胞周期相关细胞状态(图2c)。这两组中的癌细胞状态评分呈强烈的负相关性(图2c)。一些癌细胞状态评分(例如,缺氧、鳞状、细胞周期、E2F 靶标、NRF2 靶标和 Myc 靶标评分)与来自癌症基因组图谱肺腺癌 (TCGA-LUAD) 队列的患者生存率低有关(图 2d)。相反,包括凝血、肺泡、细胞外基质、雌激素和 IFN 在内的癌细胞状态与延长生存期有关。
为了研究癌细胞状态在治疗中的作用,他们使用 scRNA-seq 数据比较了免疫治疗期间癌细胞的细胞状态评分。治疗前无应答者的 NRF2 靶标评分明显高于治疗前应答者,而 IFNγ 评分则呈现相反的趋势(图2e)。这表明癌细胞的生物学特征可能影响免疫治疗的临床结果。利用 DSP 数据,他们检测了治疗前的肿瘤细胞状态。与细胞状态评分类似,IFNγ 和 NRF2 靶标的相关基因在应答者和无应答者中分别显著富集(图2f-g)。他们进一步探索了这两种细胞状态与其他细胞类型之间的空间关系(图2h)。IFNγ 评分与相邻免疫细胞比例呈正相关,而 NRF2 靶标评分呈负相关(图2h-i)。这表明癌细胞状态在塑造多样化肿瘤微环境(TME)方面发挥着潜在作用。
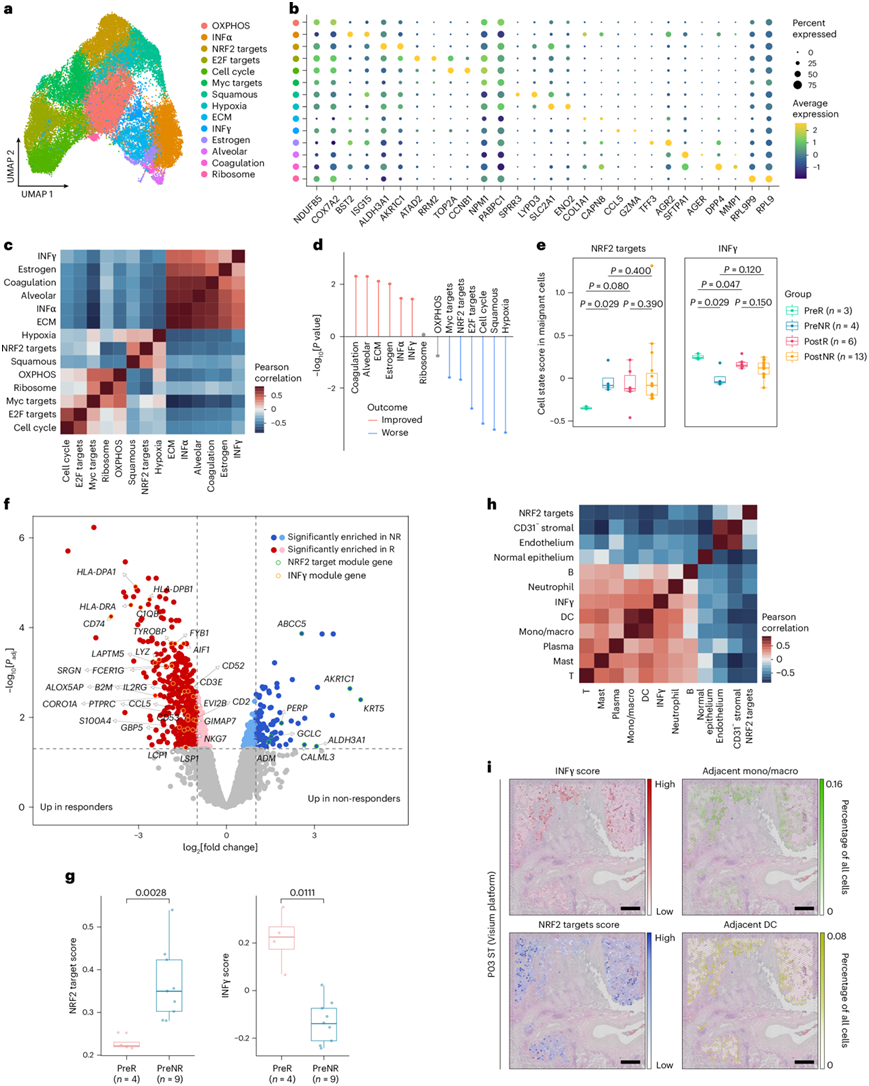
图2. 癌细胞的细胞状态可能决定对 ICB 化疗的反应。
(a) UMAP 图显示按癌细胞状态着色的癌细胞。(b) 点图显示每种癌细胞状态的代表性标志物的平均表达量和表达百分比。(c) 癌细胞状态评分的Pearson相关性。(d) Lollipop图显示 将癌细胞状态与 TCGA-LUAD 队列患者临床结果联系起来的 Cox 回归分析的P值。(e) 箱线图显示治疗期间应答者和无应答者的恶性细胞中 NRF2 靶标(左)和 IFNγ(右)的细胞状态评分。(f) 火山图比较应答者和无应答者的调整后P 值和肿瘤 ROI 之间的差异倍数。(g) 使用 DSP 数据显示应答者和无应答者的肿瘤 ROI 中 NRF2 靶标(左)和 IFNγ(右)的细胞状态评分的箱线图。(h) Visium 载玻片中所有恶性斑点的细胞状态评分(针对 NRF2 靶标、IFNγ 和相邻细胞类型)的 Pearson 相关性。(i) P03 的 TME中IFNγ 评分、NRF2 靶标评分和相邻单核细胞/巨噬细胞和树突状细胞的丰度的空间分布。
03
NSCLC 细胞组成的空间图
为了研究细胞成分的空间组织和相互作用,他们使用 Visium 数据对治疗后的 TME 进行了分类。根据苏木精和伊红 (H&E) 染色和先前研究中对肿瘤区室的定义,将肿瘤分为四个不同的区域:肿瘤核心、侵袭性边缘、孤立肿瘤和肿瘤基质区域(图3a)。由于 Visium 载玻片上的每个点代表多种细胞的混合物,他们使用 STRIDE 23基于匹配的 scRNA-seq 数据执行细胞类型反卷积分析。与 H&E 图像一致,肿瘤核心主要由恶性细胞占据,而侵袭性边缘和孤立肿瘤同时包含恶性细胞和非恶性细胞,在肿瘤基质区域几乎没有可见的恶性细胞 (图3a)。基于细胞类型组成对所有空间转录组学点进行无监督聚类,他们确定了 15 种不同的细胞类型环境(编号0-14)(图3b)。他们假设这些环境代表了可以在患者之间共有的潜在空间架构,从而有助于在不同样本之间进行比较。他们观察到三种恶性肿瘤相关细胞类型环境(3、10 和 13)和两种成纤维细胞类型环境[4:富集乙醇脱氢酶 1B 阳性 (ADH1B+) CAF]和8:富集COL11A1+ CAF)],以及四种免疫细胞类型环境(1、7、9 和 12)(图3c-d)。
空间可视化揭示了它们的位置关系和与空间结构的相关性。例如,恶性肿瘤相关环境 3 和 13 由成纤维细胞环境8 包围,这意味着肿瘤细胞与肿瘤边界处的成纤维细胞相互作用(图3e)。此外,富含生发中心 B 细胞和 CD4+ CXCL13 + T 细胞的细胞类型环境 9 的位置与淋巴细胞聚集的位置相对应(图3e)。
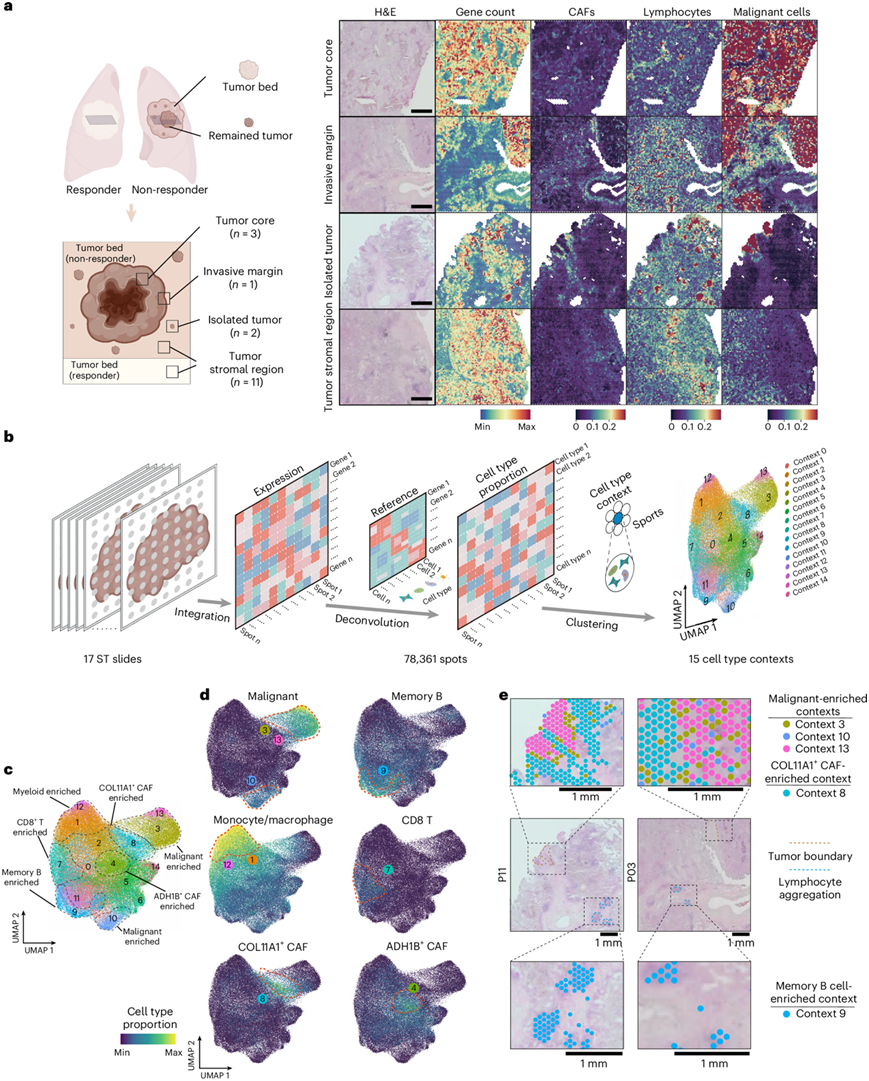
图3. ICB化疗后NSCLC的空间细胞组织。
(a) 左:组织取样示意图。右:H&E 染色。 (b) 定义 15 种细胞类型环境的示意图。(c) 基于细胞类型环境的 15 种空间转录组学点的 UMAP。(d) 基于细胞类型环境的 UMAP突出显示恶性细胞、记忆 B 细胞、单核细胞/巨噬细胞、CD8 + T 细胞、COL11A1 + CAF 和 ADH1B +CAF。(e) 细胞类型的空间映射展示了三种恶性细胞环境、COL11A1+ CAF 富集背景和记忆 B 细胞富集环境的空间分布。
04
COL11A1+ CAF 表现出促肿瘤表型
他们比较了治疗前应答者和无应答者肿瘤边界的细胞比例。无应答者的 CD8 + T 细胞比例低于应答者,而 COL11A1 + CAF比例高于应答者(图4a)。因此,他们假设肿瘤边界的 COL11A1 + CAF可能阻止了 T 细胞的浸润。他们进一步探讨了肿瘤标本中 COL11A1 + CAF 和 ADH1B + CAF的空间分布。有趣的是,COL11A1 + CAF聚集在孤立肿瘤的边界,但在无应答者中远离恶性细胞的基质区域急剧减少(图4b)。在肿瘤核心区域和侵袭性边缘,肿瘤由COL11A1+ CAF包围(图4c-d)。同时,这些 COL11A1 + CAF 在应答者和无应答者的肿瘤基质区域几乎不存在。相反,ADH1B + CAF在肿瘤基质区域富集,但在孤立的肿瘤边界上不存在(图4b-d)。始终如一的是,肿瘤核心区域几乎没有任何 ADH1B + CAF(图4c)。然而,ADH1B + CAF在肿瘤基质载玻片中占主导地位。
COL11A1+CAF与癌细胞之间的空间关系表明它们存在潜在的细胞间相互作用。因此,他们进行了细胞间相互作用分析以确定潜在的相互作用。在肿瘤细胞和 COL11A1⁺ CAF 之间观察到盘状结构域受体 1 (DDR1) 与胶原蛋白(COL1A1、COL3A1、COL5A2 和 COL11A1)之间的受体-配体相互作用(图4e)。鉴于 COL11A1 表达特定于 COL11A1+ CAF,他们主要关注 DDR1-COL11A1 共定位以进行进一步分析。据报道,肿瘤中 DDR1 的细胞外结构域可促进胶原纤维排列并阻碍免疫细胞浸润。此外,DDR1-COL11A1 的共定位水平以及胶原形成特征在肿瘤边界高度富集,而在远离癌症的区域则下降(图4b)。免疫荧光标记也证实了 ICB 化疗后,COL11A1+ CAF 位于 NSCLC 中的 DDR1+恶性细胞周围(图4f)。
为了探究 COL11A1+CAF是否阻碍免疫细胞浸润,他们分析了 COL11A1+CAF与 T 细胞之间的关联。观察到含有恶性细胞的斑点周围的 COL11A1+CAF丰度与所有含有恶性细胞的样本中的 T 细胞丰度呈显著负相关(图4g)。同时,他们发现 T 细胞浸润也与未接受治疗的队列中的 COL11A1+CAF丰度呈负相关(图4h)。
他们进一步评估了 COL11A1+CAF的丰度是否可以作为 NSCLC 预后的可靠预后因素。接受 ICB 治疗的队列的风险比高于未接受治疗和化疗的队列(图 4i),这表明 COL11A1+ CAFs 可能在 ICB 治疗队列中发挥更重要的作用。为了进一步验证 COL11A1+ CAF的丰度是否可以预测对 ICB 治疗的反应性,他们分析了另外两个独立队列。在 ICB 治疗之前,无应答者的 COL11A1+ CAF 比例再次明显高于应答者(图4j-k)。有趣的是,即使在黑色素瘤队列中,他们也观察到了类似的趋势(图4l)。总之,上述分析表明,COL11A1+CAF可能是预测预后和 ICB 治疗反应的有效生物标志物。
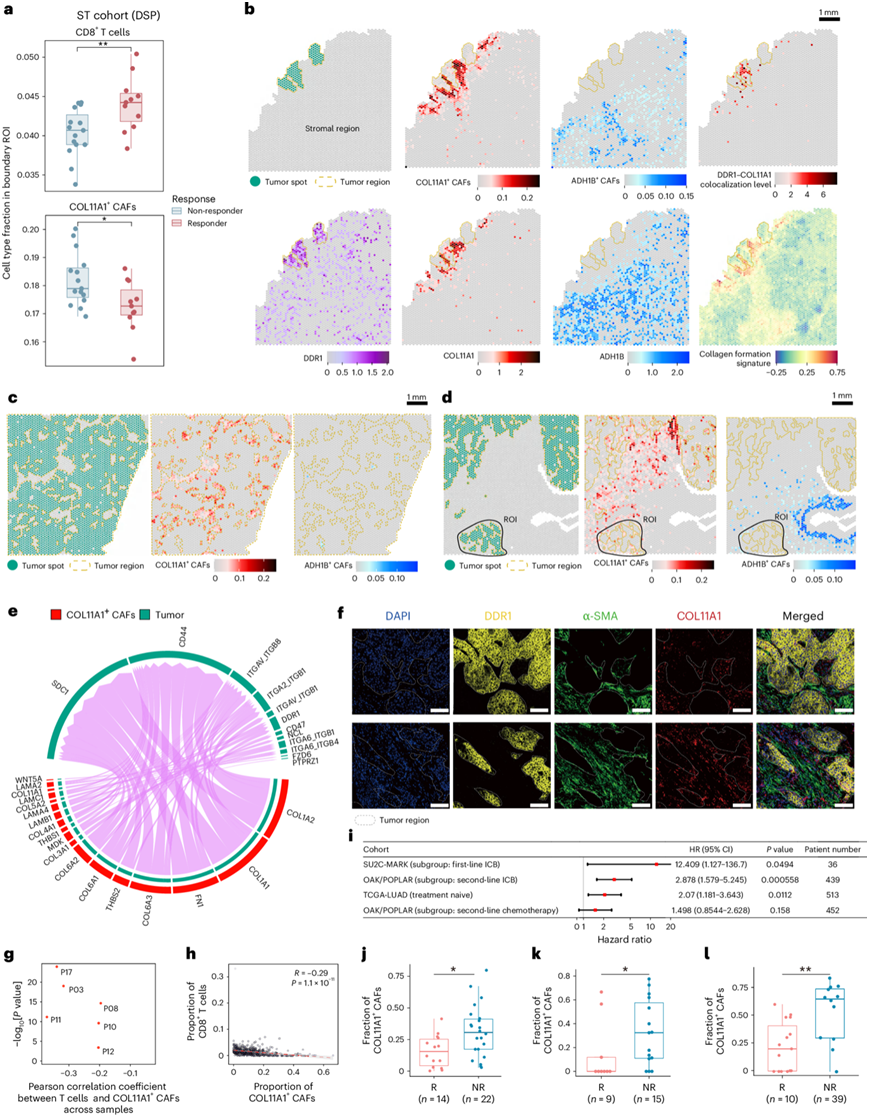
图4. COL11A1+ CAF的空间位置和潜在的致癌功能。
(a) 箱线图显示 治疗前应答者和无应答者边界 ROI 中的 T 细胞和 COL11A1+ CAF 的比例。(b) 来自P11 (NMPR)的分离肿瘤样本中肿瘤点、COL11A1 + CAF 和 ADH1B+ CAF 的空间分布、DDR1、COL11A1 和 ADH1B 的表达水平、DDR1-COL11A1 的共定位水平和胶原形成特征评分。(c) 来自P08 (NMPR)的肿瘤核心样本中肿瘤点、COL11A1+ CAF 和 ADH1B+ CAF的空间分布。(d) P03(NMPR)侵袭性边缘样本中肿瘤斑点、COL11A1+CAF 和 ADH1B+CAF的空间分布。(e) P11 中恶性细胞与 COL11A1+ CAF之间的细胞间通讯网络。(f) 多重免疫荧光染色显示ICB化疗后标本中 COL11A1 +成纤维细胞(COL11A1 +和 α-SMA +)和 DDR1 +恶性细胞的空间位置。(g) 散点图显示 ICB 化疗后 Visium 空间转录组学队列中肿瘤细胞附近 COL11A1+ CAF 和 T 细胞比例的 Pearson 相关性检验结果。(h) CD8 + T 细胞比例[使用估计免疫和癌细胞比例 (EPIC) 算法计算]与 COL11A1 + CAF比例之间相关性的散点图。(i) NSCLC 队列研究的单变量 Cox 回归分析的森林图。(j-l) COL11A1+ CAF分数的箱线图。
05
分泌性磷蛋白 1 阳性巨噬细胞与 COL11A1 +CAF共定位,阻断 T 细胞
先前的研究表明,CAF-巨噬细胞相互作用促进结肠癌和肝癌中的肿瘤生长。因此,他们探讨了 NSCLC 中巨噬细胞与 COL11A1 + CAF 之间的关系。他们在 scRNA-seq 数据中观察到 COL11A1+ CAF 的丰度与分泌型磷蛋白 1 阳性 (SPP1+) 巨噬细胞的丰度之间存在正相关性(图5a)。与 COL11A1+CAF的结果一致(图1g),治疗前后无应答者的 SPP1+巨噬细胞比例也显著较高(图5b)。与 COL11A1 + CAF 一样,SPP1+巨噬细胞也在肿瘤边界聚集,在远离癌症的基质区域丰度较低且分布分散(图5c-e)。通过 SPP1+巨噬细胞和 COL11A1+CAF之间的细胞-细胞相互作用,他们注意到 SPP1-CD44 对的富集(图5f)。巨噬细胞分泌的 SPP1 促进 CAF的增殖和活化,并增加胶原蛋白的沉积。有趣的是,与 COL11A1 + CAF-high区域相比,T 细胞浸润水平较高的 COL11A1+ CAF-low 区域的 SPP1-CD44 共定位水平也明显较低(图5g-i)。这表明 SPP1 +巨噬细胞可能与 COL11A1 + CAF协同作用,保护肿瘤免受 T 细胞浸润。在 TCGA-LUAD 队列中,COL11A1+ CAF和 SPP1+巨噬细胞水平均较高的患者生存率始终最差(图5j)。
此外,多重免疫组织化学染色显示 SPP1+巨噬细胞(以 SPP1 标记)倾向于与 COL11A1+ CAF(以 α 平滑肌肌动蛋白 (α-SMA) 和成纤维细胞活化蛋白标记)一起定位在肿瘤边界,而 T 细胞(以 CD3 标记)由这两种细胞类型的组合阻断(图5k)。此外,在 COL11A1+ CAF存在的情况下,CXCL9+巨噬细胞和细胞毒性免疫细胞无法进入肿瘤床。
总之,这些结果表明与 SPP1+巨噬细胞和 COL11A1+CAF相关的肿瘤边界结构的形成可能有助于 NSCLC 的免疫抑制微环境。
COL11A1+CAF与癌细胞之间的空间关系表明它们存在潜在的细胞间相互作用。因此,他们进行了细胞间相互作用分析以确定潜在的相互作用。在肿瘤细胞和 COL11A1⁺ CAF 之间观察到盘状结构域受体 1 (DDR1) 与胶原蛋白(COL1A1、COL3A1、COL5A2 和 COL11A1)之间的受体-配体相互作用(图4e)。鉴于 COL11A1 表达特定于 COL11A1+ CAF,他们主要关注 DDR1-COL11A1 共定位以进行进一步分析。据报道,肿瘤中 DDR1 的细胞外结构域可促进胶原纤维排列并阻碍免疫细胞浸润。此外,DDR1-COL11A1 的共定位水平以及胶原形成特征在肿瘤边界高度富集,而在远离癌症的区域则下降(图4b)。免疫荧光标记也证实了 ICB 化疗后,COL11A1+ CAF 位于 NSCLC 中的 DDR1+恶性细胞周围(图4f)。
为了探究 COL11A1+CAF是否阻碍免疫细胞浸润,他们分析了 COL11A1+CAF与 T 细胞之间的关联。观察到含有恶性细胞的斑点周围的 COL11A1+CAF丰度与所有含有恶性细胞的样本中的 T 细胞丰度呈显著负相关(图4g)。同时,他们发现 T 细胞浸润也与未接受治疗的队列中的 COL11A1+CAF丰度呈负相关(图4h)。
他们进一步评估了 COL11A1+CAF的丰度是否可以作为 NSCLC 预后的可靠预后因素。接受 ICB 治疗的队列的风险比高于未接受治疗和化疗的队列(图 4i),这表明 COL11A1+ CAFs 可能在 ICB 治疗队列中发挥更重要的作用。为了进一步验证 COL11A1+ CAF的丰度是否可以预测对 ICB 治疗的反应性,他们分析了另外两个独立队列。在 ICB 治疗之前,无应答者的 COL11A1+ CAF 比例再次明显高于应答者(图4j-k)。有趣的是,即使在黑色素瘤队列中,他们也观察到了类似的趋势(图4l)。总之,上述分析表明,COL11A1+CAF可能是预测预后和 ICB 治疗反应的有效生物标志物。
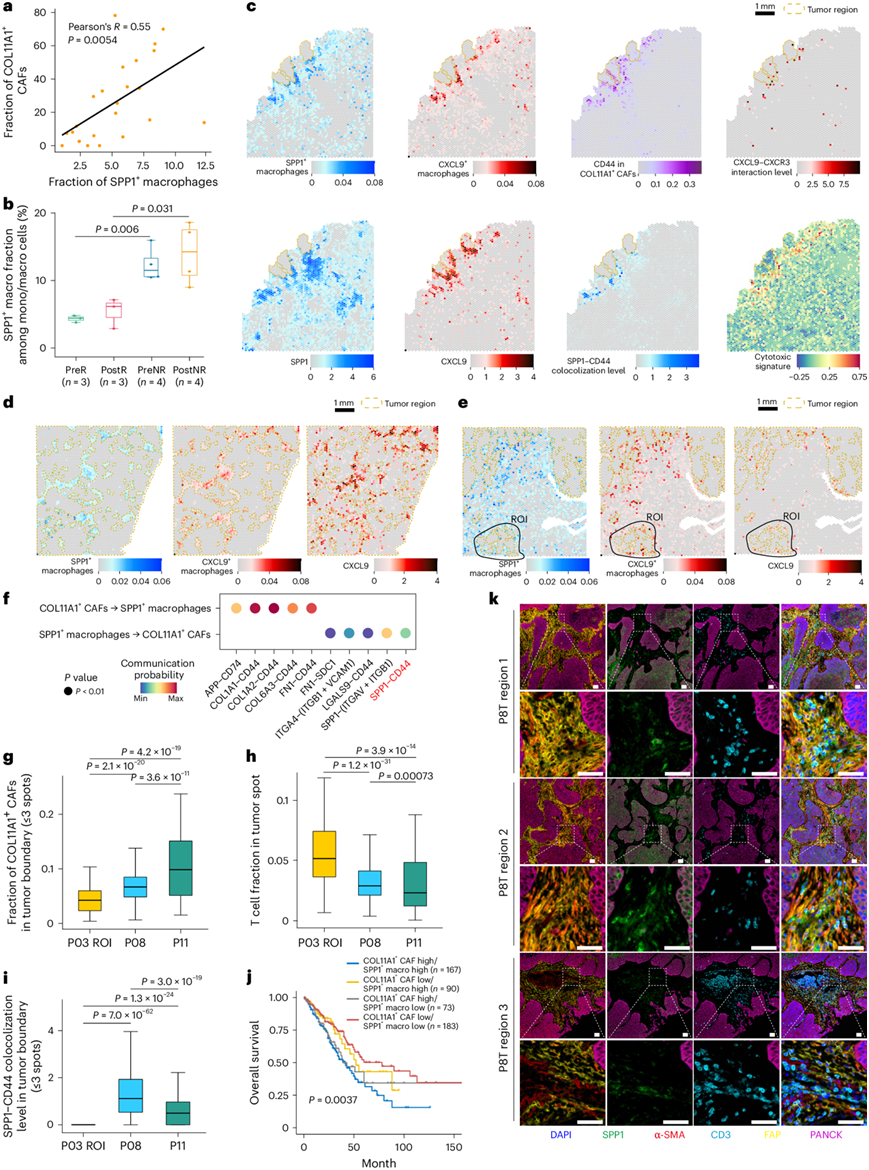
图5. SPP1+巨噬细胞与 COL11A1+ CAF 共定位,阻断 T 细胞。
(a) 散点图显示单细胞样本中COL11A1+ CAF 的比例与SPP1+巨噬细胞的比例之间存在显著的正相关性。(b) 箱线图显示治疗前后三名应答者和四名无应答者的匹配样本中 SPP1+巨噬细胞的比例。(c) P11(NMPR)分离肿瘤载玻片中肿瘤斑点、SPP1 +巨噬细胞和 CXCL9 +巨噬细胞的空间分布、COL11A1+ CAF 特异性 CD44 表达、SPP1 和 CXCL9 的表达以及 SPP1 与 CD44 之间和 CXCL9 与 CXCR3 之间的共定位水平。(d) P08(NMPR)肿瘤核心载玻片中肿瘤斑点、SPP1+巨噬细胞和 CXCL9 +巨噬细胞的空间分布以及 CXCL9 的表达。(e) P03侵袭性边缘载玻片中肿瘤斑点、SPP1+巨噬细胞和 CXCL9 +巨噬细胞的空间分布以及 CXCL9 的表达。(f) 细胞间相互作用分析。(g-i) 箱线图比较了 COL11A1 + CAF低区域和两个 COL11A1 + CAF 包膜区域中肿瘤边界处 COL11A1 + CAF的分数、T 细胞的分数和 SPP1-CD44 的共定位水平。 (j) TCGA-LUAD 队列的 Kaplan-Meier 生存曲线。(k) 接受 ICB 化疗的另一例 NSCLC 样本 (P8T) 的多重免疫荧光染色。
06
三级淋巴结构 (TLS)成熟度和衰退的综合评估
免疫检查点阻断化疗后,TLS 在 NSCLC 的 TME 中普遍存在。多项研究报告称,TME 中的 TLS 遵循连续的成熟阶段。TLS是从局部产生细胞因子(如白细胞介素 7)开始的,这些细胞因子将淋巴组织诱导 (LTi) 细胞募集到炎症部位。然后,LTi 细胞通过淋巴毒素 α1β2-LTβ 受体信号通路与基质细胞相互作用,从而启动TLS的形成。有趣的是,尽管大多数样本中都存在 TLS,但仅在少数载玻片中检测到 LTβ-LTβ 受体信号的空间分布。因此,他们推测不同样本中 TLS 的明显异质性可能反映了 TLS 的不同成熟阶段。为了全面表征 TLS 的成熟过程,他们收集了所有样本的 TLS 并将它们投影到同一低维空间上(图6a)。编码 TLS 起始标记(RORC和IL7R)的基因确实在相似的分布中富集,而编码功能性细胞因子(LTB和CXCL13)的基因在 TLS 的不同亚群中富集(图6b)。使用K均值聚类来区分 TLS 的不同成熟阶段(图6c),其中包括早期淋巴聚集体(以 LTi 标记高表达和低细胞因子表达为特征)、活化 TLS(高细胞因子表达)、衰退 TLS(细胞因子表达降低)和晚期 TLS(非常低的细胞因子表达)(图6c)。
他们进一步研究了TLS在不同阶段的免疫细胞亚型组成(图6d)。这些结果共同表明,生发中心B细胞、效应记忆CD4 T细胞和滤泡辅助T细胞对TLS的激活和功能至关重要,而记忆B细胞与TLS的长期影响更相关。为了探索 TLS 成熟与 ICB-化疗反应性之间的关系,他们将每个标本中不同状态下 TLS 的分布可视化。成熟阶段在患者之间表现出显著的多样性,甚至在同一载玻片内也存在差异(图6e-f)。在无应答者中,免疫治疗后残留肿瘤负荷减少,检测到更多 TLS 的趋势意味着 TLS 具有潜在的抗肿瘤作用(图6e)。在非 pCR 组中,具有激活 TLS 的患者残留肿瘤分数较低(图6g),表明激活 TLS 与更好的预后相关。令人惊讶的是,与无应答者相比,pCR 患者的 TLS 较少,而且几乎所有都处于晚期(图6e)。这些发现可能表明应答者的 TME 中存在免疫应答衰退的状态。此外,不同成熟状态的 TLS 表现出不同的位置偏向。具体来说,大多数肿瘤内TLS属于早期淋巴聚集状态,而衰退性TLS与激活的TLS相比更接近残留肿瘤细胞(图6f),这意味着肿瘤细胞附近可能存在免疫抑制环境。
他们进一步研究了TLS在不同阶段的免疫细胞亚型组成(图6d)。这些结果共同表明,生发中心B细胞、效应记忆CD4 T细胞和滤泡辅助T细胞对TLS的激活和功能至关重要,而记忆B细胞与TLS的长期影响更相关。
为了探索 TLS 成熟与 ICB-化疗反应性之间的关系,他们将每个标本中不同状态下 TLS 的分布可视化。成熟阶段在患者之间表现出显著的多样性,甚至在同一载玻片内也存在差异(图6e-f)。在无应答者中,免疫治疗后残留肿瘤负荷减少,检测到更多 TLS 的趋势意味着 TLS 具有潜在的抗肿瘤作用(图6e)。在非 pCR 组中,具有激活 TLS 的患者残留肿瘤分数较低(图6g),表明激活 TLS 与更好的预后相关。令人惊讶的是,与无应答者相比,pCR 患者的 TLS 较少,而且几乎所有都处于晚期(图6e)。这些发现可能表明应答者的 TME 中存在免疫反应衰退的状态。此外,不同成熟状态的 TLS 表现出不同的位置偏向。具体来说,大多数肿瘤内TLS属于早期淋巴聚集状态,而衰退性TLS与激活的TLS相比更接近残留肿瘤细胞(图6f),这意味着肿瘤细胞附近可能存在免疫抑制环境。
上述分析表明,不同应答患者的 TLS 成熟状态存在高度异质性。他们进一步研究了同一状态下应答者和无应答者的 TLS 之间的差异。鉴于在 pCR 患者中观察到的几乎所有 TLS 都处于晚期阶段,他们对 pCR 和 NMPR 患者的晚期 TLS 进行了差异表达分析。与应答者相比,无应答者的晚期 TLS 表达更高水平的HIF1A和ENO1,据报道它们分别参与对缺氧的反应和糖酵解过程(图6h)。此外,编码热休克蛋白的基因,如HSP90B1和HSP90AA1,在无应答者的晚期 TLS 中高度表达(图6h)。考虑到热休克蛋白通常在不同的应激条件下上调,包括缺氧,他们推测无应答患者的晚期 TLS 处于缺氧环境下。进一步的功能分析表明,与糖酵解和缺氧反应相关的途径在无应答患者的晚期 TLS 中也富集(图6i)。有趣的是,在 pCR 患者的晚期 TLS 中未发现高表达的基因(图6h),表明这些 TLS 处于衰退和静止状态。总之,这些结果表明位于缺氧 TME 中的无应答患者的晚期 TLS 可能不利于维持功能性 TLS。
有趣的是,缺氧特征评分的增加也与 ICB 化疗后无应答者的早期 TLS 有关(图6j)。先前的研究报告称,缺氧可导致 TME 中调节性 T 细胞增强,与淋巴聚集状态下调节性 T 细胞的富集一致(图6d)。另一项研究发现,缺氧可以通过抑制 CD4 效应 T 细胞来增强免疫抑制。事实上,他们观察到 TLS 中的缺氧特征评分与调节性 T 细胞的比例呈正相关,与效应记忆 CD4+T 细胞呈负相关。因此,他们推测缺氧可能产生免疫抑制性 TME,从而抑制 TLS 活化。为了检验这一点,他们分析了另一个 NSCLC 队列中缺氧评分与 TLS 活化评分之间的相关性。这两个评分之间的总体负相关性意味着缺氧TME可能对TLS形成产生抑制作用(图6k)。总之,这些结果表明缺氧TME可以促进调节性T细胞浸润并抑制CD4效应记忆T细胞以抑制TLS的形成和维持。
此外,他们还研究了 TLS 成熟状态作为患者生存期和对 ICB 化疗反应的预测指标的可能性。使用空间转录组学数据,将MPR 患者中的大多数 TLS 鉴定为活化的 TLS,而在非 pCR 组中,具有活化 TLS 的患者残留肿瘤百分比较低(图6e-g)。另一个独立的 NSCLC 队列也显示,在基线时应答者的活化 TLS 特征明显高于无应答者(图6l)。此外,在 TCGA-LUAD 队列患者中,较高的活化 TLS 特征与更好的总体生存率相关(图6m)。简而言之,这些结果表明活化的 TLS 对患者生存有益,并可能作为未来免疫疗法的潜在生物标志物或治疗靶点。
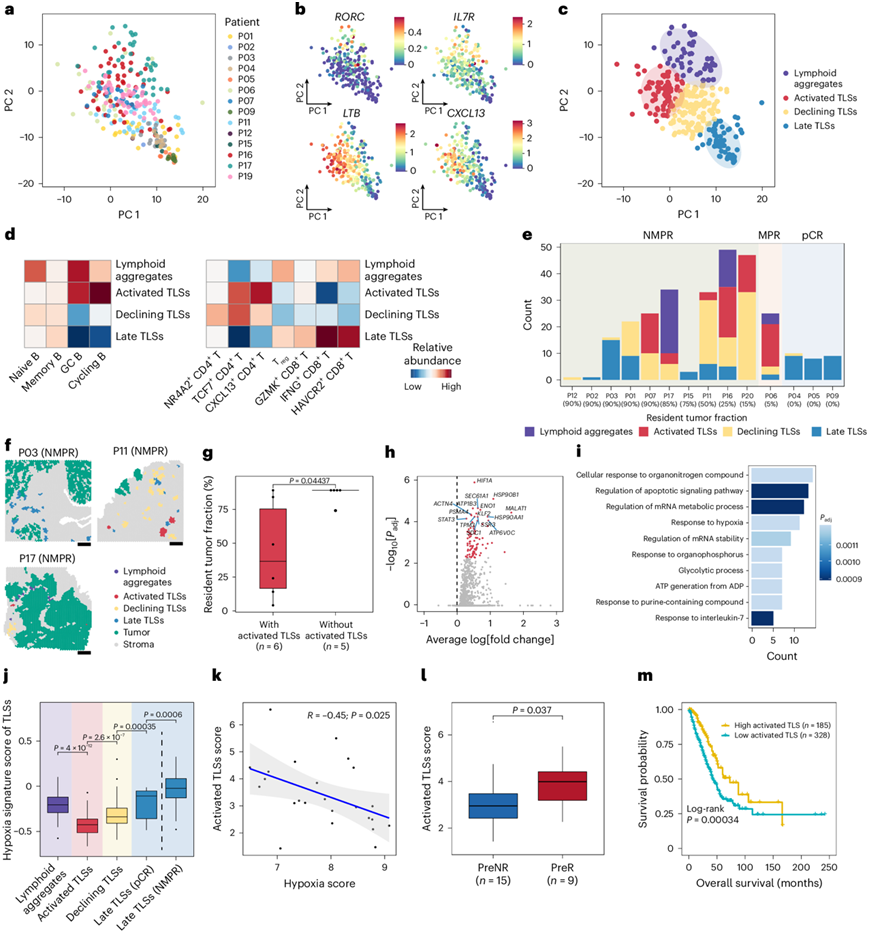
图6. TLS不同阶段的特征及其临床意义。
(a) 所有样本中所有 TLS 的 PCA 可视化。(b) TLS 相关标记基因表达的 PCA 可视化。(c) 所有TLS 的k均值聚类和注释的 PCA 可视化。(d) 热图显示不同 TLS 状态下 B 细胞(左)和 T 细胞(右)亚型的富集。(e) 所有样本中不同状态下 TLS 的分布。(f) 三个无应答者的肿瘤样本中不同阶段 TLS 的空间分布。(g) 箱线图显示非 pCR 组中有和没有激活 TLS 的患者之间残留肿瘤分数的差异。(h) 火山图显示 NMPR 组与 pCR 组的晚期 TLS 中的差异表达基因。(i) 条形图显示与来自 pCR 的 TLS 相比,来自 NMPR 的 TLS 中显著升高的基因的富集基因本体-生物过程 (GO-BP) 通路。(j) 箱线图显示不同状态下 TLS 的缺氧特征分数的分布。(k) TLS 评分与缺氧特征评分之间的相关性。(l) TLS 特征评分。(m) TCGA-LUAD 队列的 Kaplan-Meier 生存曲线。
+ + + + + + + + + + +
结 论
本研究通过分析 ICB 化疗前后 19 名患者的单细胞转录组数据和肿瘤的空间转录组数据来分析 NSCLC TME的肿瘤细胞状态和空间细胞组成,本研究发现肿瘤细胞和分泌性磷蛋白 1 阳性巨噬细胞与 XI 型胶原蛋白 α 1 链阳性癌症相关成纤维细胞相互作用,刺激胶原纤维在肿瘤边界沉积和缠结,阻碍 T 细胞浸润并导致不良预后。本研究还揭示了 TME 中TLS的不同状态。激活的 TLS 与预后改善相关,而缺氧微环境似乎会抑制 TLS 发展并与不良预后相关。本研究对 NSCLC ICB 化疗反应所对应的不同细胞和分子成分提供了新的见解,这将有利于未来个性化的免疫化疗。
+ + + + +



 English
English


