文献解读|Oncogene(8.0):神经嵴相关的 NXPH1/α-NRXN 信号通过抑制器官转移来对抗神经母细胞瘤恶性肿瘤
✦ +
+
论文ID
原名:Neural crest-related NXPH1/α-NRXN signaling opposes neuroblastoma malignancy by inhibiting organotropic metastasis
译名:神经嵴相关的 NXPH1/α-NRXN 信号通过抑制器官转移来对抗神经母细胞瘤恶性肿瘤
期刊:Oncogene
影响因子:8.0
发表时间:2023.06.10
DOI号:10.1038/s41388-023-02742-2
背 景
神经母细胞瘤(NB)是婴儿最常见的癌症,也是儿童期最常见的颅外实体瘤,占癌症相关儿童死亡的 15%,可表现为低风险肿瘤(LR-NB)或高风险肿瘤(HR-NB),后者由于转移和对当前治疗的强烈抵抗而表现出不良预后。已有研究证明LR-NB 和 HR-NB 均源自交感肾上腺(SA)谱系细胞的改变。SA 谱系代表神经嵴细胞的多种细胞命运分支之一,由四种主要细胞特性组成:雪旺细胞前体 (SCP)、桥细胞、嗜铬细胞和交感母细胞。目前,仍不清楚不同 SA 起源的转录程序是否导致NB不同的恶性行为。
实验设计
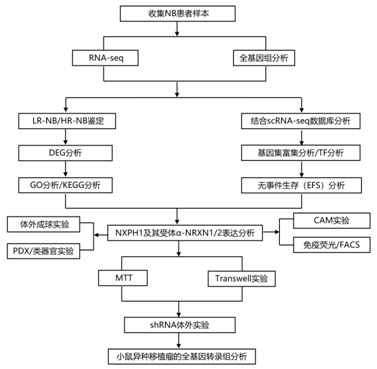
结 果
01
鉴别 LR-NB 和 HR-NB 的转录特征
研究者团队分析了18例NB患者的原发肿瘤样本的转录组,根据他们的肿瘤分期,他们的MYCN扩增状态和诊断时的年龄,将他们分为LR-NB或HR-NB,人胎儿肾上腺(fAG)样本用作正常参考组织(图1A)。
首先,他们独立地将LR-和HR-NB组与fAG样本进行比较,从而鉴定出4932个LR与fAG和3782个HR与fAG差异表达基因(DEG)(图1B-C)。GO分析显示,两次比较中检索到的下调DEG主要与代谢和生物合成相关的通路有关(图1D-E)。相比之下,在这两次比较中发现上调的 DEG 在神经同一性或复制应激(即细胞周期和 DNA 修复)相关的通路中显著富集(图1D-E)。
接下来,他们交叉分析了 LR vs fAG 和 HR vs fAG DEG 列表,并鉴定了 3096 个常见基因,其中包括 NB 恶性肿瘤的公认标记:ALK、ATRX、MYCN、PHOX2A和PHOX2B。在这个列表中,发现了 LR-NB 和 HR-NB 之间差异表达的 503 个基因,无偏层次聚类分析将其细分为 4 个聚类(c1-c4)(图1F)。最具代表性的聚类(c1)包含338个基因,这些基因在LR-NB中比在HR-NB中表达得更强烈,其中337个基因在HR-NB中比在fAG样本中表达得更多,只有1个基因(SOX6)在HR-NB中比在fAG样本中表达得更少(图1F)。这些c1基因(如NXPH1、PRPH和TFAP2B)与神经识别相关的通路显著相关,其表达水平与良好的患者预后相关(图1G)。
c2聚类由33个基因(包括CDCA7、C4orf46、THOC4)组成,在HR-NB中比在LR-NB中比在fAG样本中表达更强烈,并且呈现癌基因的特征(图1F-G)。另一方面,c3 和 c4 聚类由在 LR-NB 和 HR-NB 中比在 fAG 样本中表达更弱的基因组成。c3聚类中发现的32个基因呈现抑癌基因的特征,而c4聚类中发现的100个基因在HR-NB中的表达水平高于LR-NB,并且主要与不良预后相关(图1F-G)。
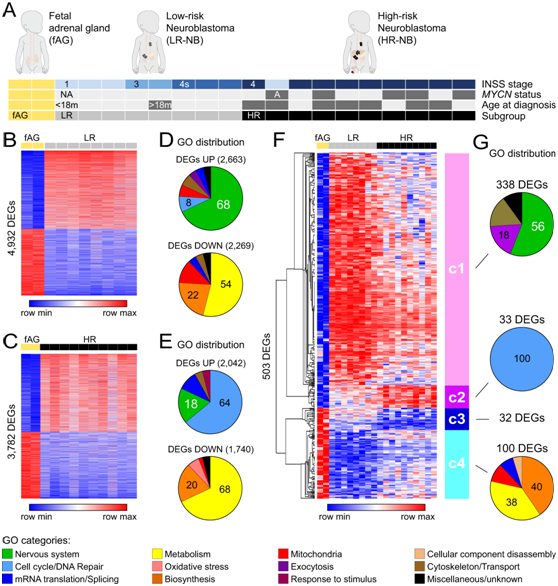
图1. 识别区分 LR-NB 和 HR-NB 的转录特征。
(A) 样品分类。(B-C) 差异表达基因 (DEG) 的热图。(D-E) GO分析。(F) 通过比较 HRvsLR 确定的 503 个 DEG 的热图。(G) 按聚类 C1、C2 和 C4 的注释分组的最富集(最多 50 个)GO分布。
02
LR-NB 富含核心交感肾上腺信号,与更好的患者预后相关
接下来,他们利用公开的单细胞转录组(scRNA-seq)数据评估了定义和区分 LR-NB 和 HR-NB 的转录特征是否与其交感肾上腺(SA)起源相关(图 2A)。有趣的是,4个SA细胞特征都显示了来自LR与HR比较的基因的显著富集,他们鉴定了342个deg,它们是在LR- nb中表达水平高于HR- nb的基因(图2B)。他们注意到 SCP、桥细胞、嗜铬细胞和交感细胞特征很大程度上重叠(图2C)。与hr-nb相比,lr-nb中表达水平较高的基因富集程度较高(图2D)。503个LR和HR基因中有一半以上组成了核心SA特征(图2E)。该核心SA特征列表中的 92% 基因属于 c1 聚类的基因(262 个 c1 基因中有 242 个)(图2E)。在核心SA特征和c1(后称为“SA-c1”模块)共有的242个基因中,发现了调节早期神经嵴发育的转录因子(TF)(SOX6和TFAP2B),与染色质细胞分化相关的转录因子(GATA2和FOXO3)或参与交感神经元的产生(HAND2)(图2E)。
为了检验SA-c1基因模块对NB预后的预测潜力,它们根据242个SA-c1基因的联合表达将SEQC NB队列细分为四分位数,其中四分位数Q1和Q4分别由SA-c1基因表达高于平均水平的最高和最低患者样本组成。SA-c1基因的联合表达对患者预后、NB分类和疾病进展具有显著的预测作用,SA-c1表达越高,预后越好(图2F-H)。因此,这些SA-c1基因可能在抑制NB恶性肿瘤中发挥关键作用。
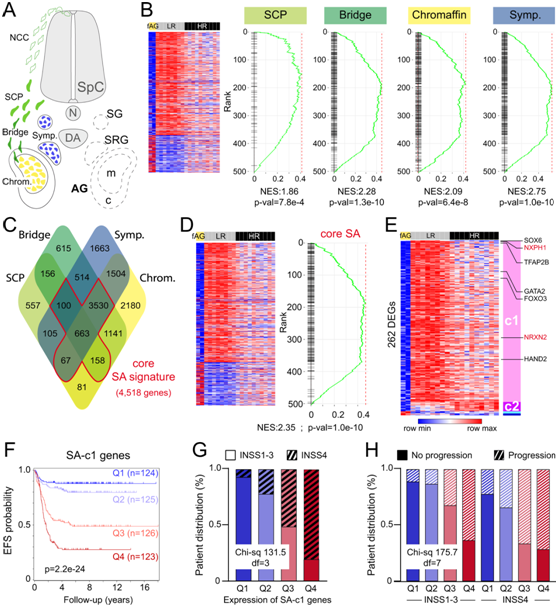
图2. LR-NB 中富含核心交感肾上腺特征,并且与更好的患者预后相关。
(A) 交感肾上腺 (SA) 谱系的示意图。(B) 对 HR vs LR DEG 列表中的人类 SCP、桥细胞、嗜铬细胞和交感细胞的特征进行基因集富集分析 (GSEA)。 (C) 维恩图显示了人类 SCP、桥细胞、嗜铬细胞和交感母细胞特征的重叠,突出了核心 SA 特征。 (D-E) DEG分析。(F) 无事件生存(EFS)分析。(G) 基于 INSS 肿瘤分期(1-3 期或 4 期)的 SA-c1 四分位数分布。 (H) 8 个 SEQC 亚组(INSS1-3 或 INSS4 的四分位数 Q1-Q4)根据疾病进展的分布。
03
NXPH1及其受体α-NRXN1/2的表达与良好的患者预后相关
为了在功能上验证 SA-c1 基因对 NB 恶性肿瘤的影响,他们选择了Neurexophilin-1 (NXPH1)。在 LR-NB 中表达水平高于 HR-NB 中的 241 个 SA-c1 基因中,NXPH1显示出最高的富集差异倍数(图2E)。在桥细胞、染色质细胞和交感神经母细胞的特征中检测到NXPH1,其表达水平与良好的患者预后、疾病进展减少和不良反应状态密切相关(图3A-B)。NXPH1主要表达于神经系统,编码一种分泌糖蛋白,它特异性结合并调节α-Neurexins (α-NRXN1-3)(图3C),已知其在突触发生和神经传递中起关键作用的跨膜受体家族。有趣的是,NRXN2也是SA-c1中的基因(图2E)。NRXN1和NRXN2均存在于4个SA特征中,其表达水平与预后良好相关,而NRXN3的表达水平与预后良好无关(图3D)。他们首先在10个具有不同遗传谱和形态特征的人NB细胞系中表征了NXPH1和α-NRXN的表达(图3E)。
在限制性培养条件下培养NB细胞系可导致球体的形成,球体中逐渐富集具有干细胞样特征和更特定的神经嵴细胞(NCC)特性的细胞。按照该方案进行5周体外实验,10个NB细胞系中有8个显示出球形生长的能力,其形成与典型干细胞标记物CXCR4、NANOG和KIT, NCC标记物p75NTR和与化疗耐药相关的MDR1基因的转录水平增加相关(图3E)。值得注意的是,NXPH1和α-NRXN1/2 mRNA水平在所有具有球形形成能力的NB细胞系中均升高(图3E),表明它们的表达与神经嵴干细胞身份呈正相关。
利用荧光偶联抗体识别人α-NRXN1的细胞外区域,他们在3个人NB细胞系中发现了一小群α-NRXN1+细胞,这些细胞在3个不同的NB患者来源的异种移植物 (pdx) 中表现出最高的球形形成能力(图3F)。与α-NRXN1low和α-NRXN1-细胞相比,从SK-N-SH细胞系或从PDX细胞系中分选的α-NRXN1high细胞表现出更高的球体形成能力(图3G)。在极度稀释α-NRXN1条件下,相对于纯化的α-NRXN1细胞或未分选的细胞,高SK-N-SH细胞也表现出增强的增殖能力(图3H)。此外,他们还将SK-N-SH细胞植入10日龄鸡胚胎血管丰富的绒毛膜-尿囊膜(CAM)的卵细胞中(图3I)。鉴于可通过流式细胞分选(FACS)纯化的α-NRXN1+细胞数量有限(图3F),他们选择将总 SK-N-SH 细胞的生长与其中 α-NRXN1+ 细胞的生长进行比较。NRXN1+亚群已通过 FACS 去除(即α-NRXN1+剥夺)。孵育7天后,相对于对照,α-NRXN1+剥夺细胞的每个肿瘤切片定量的细胞数量减少了约 50%(图3J-K),表明去除 α-NRXN1+细胞强烈在 CAM 测定中损害 NB 肿瘤生长。这些结果证明了NXPH1/α-NRXN表达与NB细胞的致瘤潜能之间的相关性,使他们假设NXPH1/α-NRXN信号可能控制NB的生长和/或恶性肿瘤。
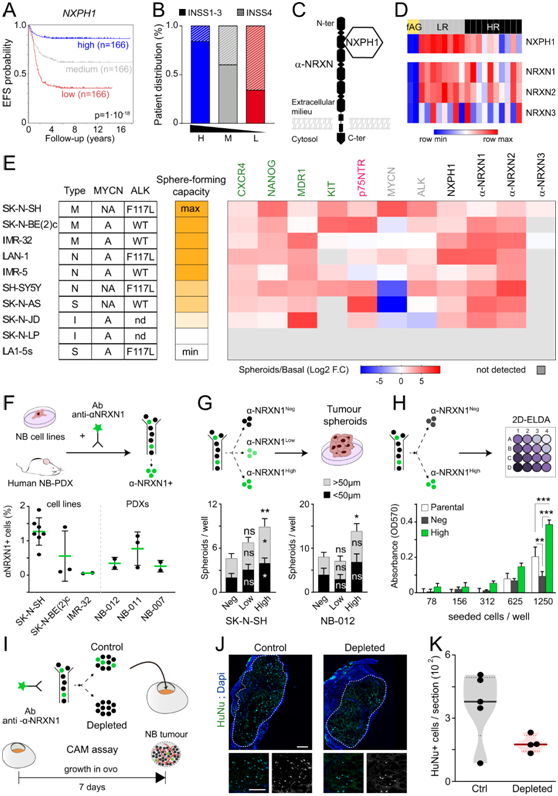
图3. NXPH1 及其受体 α-NRXN1/2 的表达与良好的患者预后相关,并可识别具有神经嵴干细胞特性的 NB 细胞。
(A) 根据 NXPH1 mRNA 表达(高、中或低),SEQC 队列的 EFS 概率细分为 3 组。(B) 基于 NXPH1 转录本水平和 INSS 肿瘤分期(1-3 期或 4 期)的 SEQC 队列分布。(C) NXPH1 及其 α-NRXN 受体的示意图。 (D) fAG、LR-NB 和 HR-NB 样本中 NXPH1 和 NRXN1-3 表达的热图。(E) 干细胞标记物(绿色)、神经嵴细胞标记物(粉色)、致病性 NB 标记物(灰色)、NXPH1 和 α-NRXN1-3(黑色)的转录水平热图。 (F) 使用抗 α-NRXN1-Alexa488 抗体通过 FACS 纯化的 3 个 NB 细胞系和 3 个 PDX 样品中 α-NRXN1+ 细胞的平均百分比。(G) 细胞的直径 < 或 > 50 µm 的球体的平均数 (H) 体外极限稀释测定。(I) 鸡绒毛尿囊膜 (CAM) 测定的图示。(J-K)免疫荧光和HuNu +细胞平均数量分析。
04
NXPH1/α-NRXN信号通路刺激NB生长
为了确定 NXPH1/α-NRXN 信号传导是否确实是 NB 生长所必需的,他们生成了 NB 细胞的稳定克隆,这些细胞持续表达针对人NXPH1或α-NRXN1 的sh-RNA。表达sh-RNA靶向NXPH1或α-NRXN1的4个不同克隆的SK-N-SH细胞在体外3天后均表现出细胞活力严重下降,1周后完全停止生长(图4A)。在SK-N-BE(2)c、IMR-32和SK-N-AS NB细胞中敲除NXPH1或α-NRXN1也获得了类似的结果。为了尽量减少细胞活力的下降,他们产生了SK-N-SH和IMR-32细胞的诱导克隆,其中sh-RNA和eGFP的产生依赖于多西环素(doxycycline)(图4b)。MTT试验和增殖和细胞死亡的免疫荧光分析证实,在这些诱导克隆中,由NXPH1和α-NRXN1敲低引起的生长停滞最小(图4C-G)。体外transwell实验显示,NXPH1或α-NRXN1敲低对SK-N-SH或IMR-32细胞的迁移或侵袭能力无明显影响(图4H-K)。然而,当在限制性培养条件下生长时,这些sh-NXPH1和sh-αNRXN1细胞仍保持着减弱的成球能力(图4L-M),这表明NXPH1/α-NRXN1抑制可能会损害NB细胞的干性。
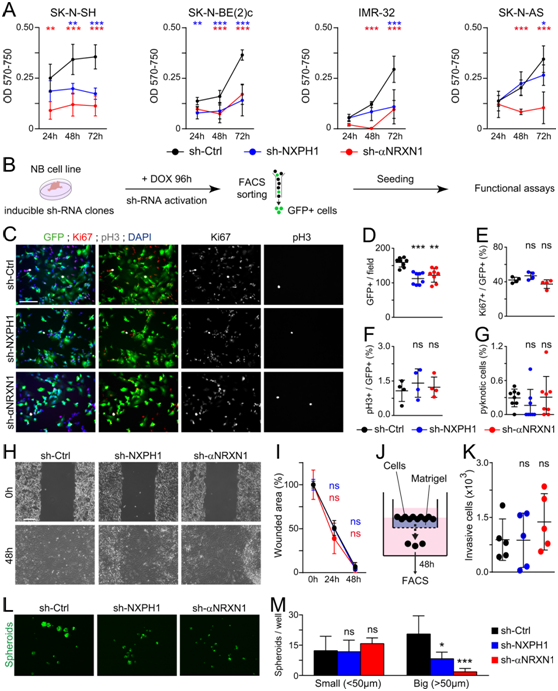
图4. 抑制 NXPH1/α-NRXN1 信号传导会改变 NB 细胞的体外行为。
(A) MTT测定。 (B) 使用诱导型 sh-RNA 克隆的实验设计。(C) 免疫荧光分析。(D-G) 每个视野量化的细胞平均数量。(H-I)划痕实验和定量。(J)Transwell实验。(K)细胞量化。 (L-M)球状体的免疫荧光和量化。
接下来,他们在体内分析了NXPH1/α-NRXN1对NB生长的抑制作用。为此,将sh-nxph1、sh-αNRXN1和sh-ctrl细胞移植到免疫受损的NOD/SCID小鼠的胁腹中(图5A)。来自SK-N-SH系的sh-NXPH1和sh-αNRXN1细胞比其对照产生更少的肿瘤(图5B)。此外,sh-NXPH1和sh-αNRXN1 SK-N-SH细胞形成的肿瘤较小(图5C-D)。当使用来自IMR-32的sh- nxph1和sh-αNRXN1细胞时,观察到更强的表型(图5E-G)。因此,抑制NXPH1/α-NRXN1信号可以在体内抑制NB肿瘤的形成,影响肿瘤的发生和生长。
接下来,他们进行了CAM实验,在存在或不存在重组人NXPH1 (rNXPH1)的情况下,将亲代SK-N-SH细胞嵌入人工基底膜(Matrigel)中(图5H)。
通过对接种后7天恢复的肿瘤进行分析,他们发现rNXPH1处理后每个肿瘤切片和每个区域的NB细胞数量分别增加了62%和71%(图5I-L)。由于 SK-N-SH 细胞在接种到 CAM 之前在体外与 BrdU 一起孵育最后 24 小时,因此他们还可以确定 rNPHX1 的补充增加了在卵内孵育期间活跃循环的 NB 细胞的比例(图5M-N)。
总之,这些数据表明 NXPH1/α-NRXN1 信号传导刺激体内 NB 肿瘤生长。
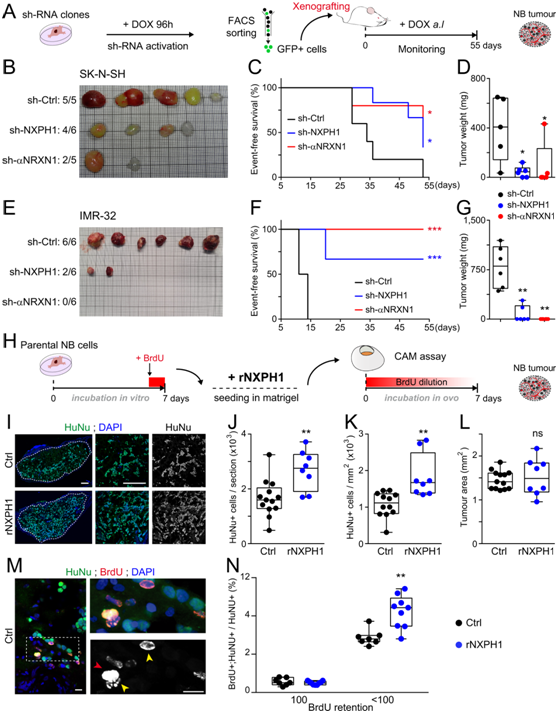
图5. NB 生长需要 NXPH1 和 α-NRXN1 的活性。
(A) 用于评估 NXPH1/αNRXN1 抑制对体内 NB 生长的影响的实验设计。(B-G) 肿瘤形成分析、生存分析。(H) 用于在 CAM 测定中评估人重组 NXPH1 (rNXPH1) 对 NB 细胞生长的影响的实验方案。 (I-N)免疫荧光和细胞量化。
05
NXPH1/α-NRXN 信号传导抑制 NB 器官转移
他们还着手确定 NXPH1/α-NRXN 信号传导是否调节 NB 细胞的体内转移潜力。为此,将sh-NXPH1、sh-αNRXN1和sh-Ctrl细胞注射到免疫缺陷NOD-SCIDγ(NSG)小鼠的左心室中。用生物发光(BLI)法监测这些细胞的定植能力和转移生长(图6A)。注射后几分钟,可见SK-N-SH细胞系的sh-ctrl、sh-nxph1和sh-αNRXN1细胞在动物体内扩散(图6B)。在最初的3-4周内,它们的BLI恢复到背景水平,这表明绝大多数细胞在此期间消失(图6B)。9周后,注射sh-NXPH1和sh-αNRXN1 SK-N-SH细胞的小鼠中有86%和57%出现了可检测到的转移肿块,而注射sh-Ctrl细胞的小鼠中只有29%发生了转移肿块(图6B-D)。此外,sh- nxph1和sh-αNRXN1 SK-N-SH细胞发生转移瘤的时间更早,产生的光子计数远高于sh-ctrl细胞(图6C-E)。重要的是,尽管来自sh- ctrl SK-N-SH细胞的少数转移灶发生在胸部区域,但来自sh- nxph1和sh-αNRXN1细胞的转移灶也定植在肝脏和骨髓(图6B-F),这是转移性NB所在的两个主要器官部位。
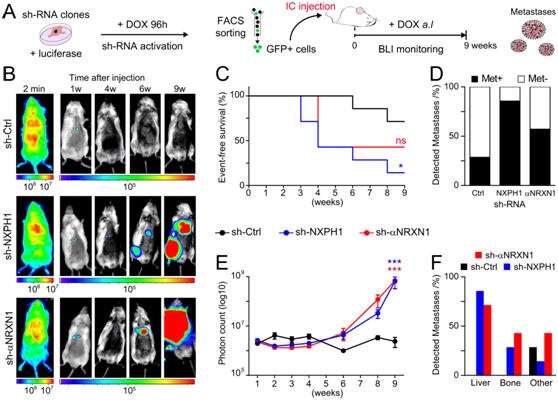
图6. 抑制 NXPH1/α-NRXN1 信号传导可增加 SK-N-SH 细胞的转移生长和定植潜力。
(A) 用于评估 NXPH1/α-NRXN1 抑制对体内 NB 转移定植的影响的实验设计。 (B) 体内荧光素酶衍生生物发光的代表性图像。 (C) 小鼠的EFS 分析。(D) 转移瘤分析。(E) 总光子计数。(F) 在肝脏、腿骨或其他部位检测到转移瘤。
06
降低 NXPH1 活性迫使 NB 细胞转化为间充质状态
为了研究 NXPH1/α-NRXN 信号对 NB 生长和转移影响的分子机制,他们通过全基因组分析鉴定了异种移植的 sh-NXPH1 和 sh-Ctrl SK-N-SH 细胞生长的肿瘤的转录组(图7A)。他们的检测了sh-NXPH1衍生样本中的202个上调和94个下调的DEG(图7B)。GO分析显示下调和上调DEG列表主要与发育和形态发生、细胞粘附和运动或神经系统相关(图7C)。这两个列表中都包含了大量编码细胞外信号蛋白的基因,其中有几种介导BMP、TGF-β、WNT、Semaphorin或GPCR信号的生长因子和受体(图7D)。
值得注意的是,20个上调的tf编码基因和9个下调的tf编码基因包括几个已知的调节早期神经嵴发育(DLX5、DLX6、EYA1、LMO4和SOX6),外周神经元的分化(ASCL1)或上皮-间质转化(EMT)(BNC2、EPAS1、KLF4、LMO4和PRRX1)(图7E)。因此,EMT和顶端连接的调节出现在两个DEG列表中丰富的少数标志特征中(图7F)。总之,这些结果表明,减少NXPH1的表达会迫使NB细胞从肾上腺素能状态转变为间质状态(图7H)。
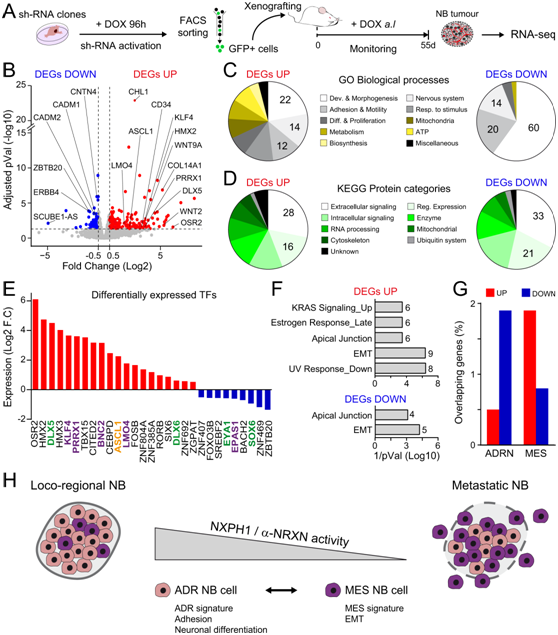
图7. 降低NXPH1活性迫使NB细胞进入间质状态。
(A) 用于评估 NB 肿瘤中 NXPH1 抑制引起的转录变化的实验设计。(B) 火山图显示 sh-NXPH1和 sh-Ctrl细胞生长的肿瘤之间的 DEG。(C-D) GO分析和KEGG分析。(E) 转录因子 (TF) 表达分析。(F) Hallmark 特征显著丰富,与上调和下调 DEG 列表相关。 (G) 在上调和下调的 DEG 中检测到 ADRN 和 MES 状态的基因的比例。(H) 模型显示NXPH1/α-NRXN信号活性的下调和/或低活性促进NB细胞从肾上腺素能状态向间充质状态的转化,从而增强它们形成器官性转移的能力。
+ + + + + + + + + + +
结 论
本项研究区分了LR-NB 和 HR-NB 的转录特征,该转录特征主要由属于核心交感肾上腺发育程序的基因组成,并且与良好的患者预后和减缓疾病进展相关。功能获得和功能丧失实验表明,该特征的首要候选基因Neurexophilin-1 (NXPH1)对体内 NB 细胞行为具有双重影响,而 NXPH1 及其受体 α-NRXN1 通过以下方式促进 NB 肿瘤生长:它们刺激细胞增殖,相反抑制器官定植和转移。RNA-seq 分析表明,这些效应可能是由于 NXPH1/α-NRXN 信号传导抑制 NB 细胞从肾上腺素能状态向间充质状态转变的能力所致。因此,本项研究结果揭示了交感肾上腺程序的转录模块,该模块通过阻止转移来对抗神经母细胞瘤恶性肿瘤,并将 NXPH1/α-NRXN 信号传导确定为治疗 HR-NB 的有希望的靶点。
+ + + + +



 English
English


