文献解读|Cancer Cell(50.3):时间进化揭示侵袭小细胞神经内分泌前列腺癌转分化中的分叉谱系
✦ +
+
论文ID
原名:Temporal evolution reveals bifurcated lineages in aggressive neuroendocrine small cell prostate cancer trans-differentiation
译名:时间进化揭示侵袭小细胞神经内分泌前列腺癌转分化中的分叉谱系
期刊:Cancer Cell
影响因子:50.3
发表时间:2023.11.22
DOI号:10.1016/j.ccell.2023.10.009
背 景
小细胞神经内分泌(SCN) 癌是一种侵袭性变体,起源于多种组织,例如肺和前列腺。从腺癌向小细胞神经内分泌状态的转分化与多种癌症类型的治疗耐药性相关,但目前缺转分化的潜在分子基质。
实验设计
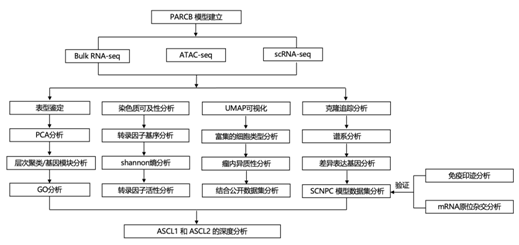
结 果
01
(PARCB )泛小细胞神经内分泌癌模型转化模型的时间基因表达程序揭示了转分化途径
为了确定前列腺癌发展过程中SCN分化事件的时间,研究在团队利用了 PARCB 模型系统,对从 10 名前列腺腺癌(PRAD)患者的上皮组织良性区域提取的基底细胞进行独立转化。基底细胞通过致癌慢病毒 PARCB 混合物转化,随后在体外类器官系统中培养。将来自每个患者组织样本的转化类器官扩增细胞皮下植入多只免疫功能低下的小鼠中,以便从匹配的起始模型中随时间过程收集肿瘤,然后进行多组学分析(图 1 A)。每个患者(P1-P10) 包含五到六个时间点样本,范围从基底细胞 (TP1) 到类器官 (TP2) 再到肿瘤 (TP3-TP5/TP6)(图 1 A)。他们发现肿瘤从鳞状细胞转变为腺癌,然后转变为混合型,最终转变为 SCN 表型(图 1 A)。此外,临床定义的神经内分泌标志物,包括 SYP 和 NCAM1,是在肿瘤进展到晚期的过渡过程中出现的(图 1 A)。
他们首先使用bulk RNA 测序(bulk RNA-seq)对基因表达进行时间分析,以了解小细胞神经内分泌前列腺癌(SCNPC)转分化过程中转录景观的变化。通过将PARCB样本投影到临床肺癌和前列腺癌肿瘤样本的主成分分析(PCA)中,他们验证了PARCB时间过程样本遵循从腺癌到SCN状态的转录定义的趋同轨迹(图1B)。其他SCNPC相关因子包括ASCL1和NEUROD1也在进展过程中升高(图1C),雄激素受体(AR) mRNA在肿瘤早期表达(图1C)。
为了确定由 10 个独立患者样本 (P1-P10) 生成的时间序列之间的转换轨迹,他们对转录组数据进行了聚类分析和 PCA分析,通过相应的差异基因模块定义了样本的层次聚类(HC),并发现所得的 6 个聚类(HC1-6)通常与收集时间相对应(图 1 D)。无监督 PCA 表明,每个系列的转分化路径遵循总体一致的“弧状”轨迹,在后期样本中存在可辨别的分叉(图 1 E)。因此,他们将晚期肿瘤进一步定义为分别具有相应HC5和HC6基因模块的“I类”和“II类”肿瘤。与腺癌特征评分相比,HC2 至 HC6 的 SCNPC 特征评分较高。对相应的6个差异基因模块进行GO分析,确定了hc之间独特或共有的通路,包括炎症反应(HC1和HC3,患者源性基底细胞和早期肿瘤)、细胞增殖(HC2,体外类器官)、表皮发育(HC3,早期肿瘤)、细胞活化(HC4,移行性肿瘤)、干细胞分化(HC5, I类晚期肿瘤)和神经/化学突触(HC5和HC6、HC5和HC6,I/II类晚期肿瘤)(图1E-F)。这些结果证明了腺癌到SCN状态的转分化是一个系统协调的过程,涉及一个过渡阶段,随后是神经元/神经内分泌基因特征富集的分叉通路。
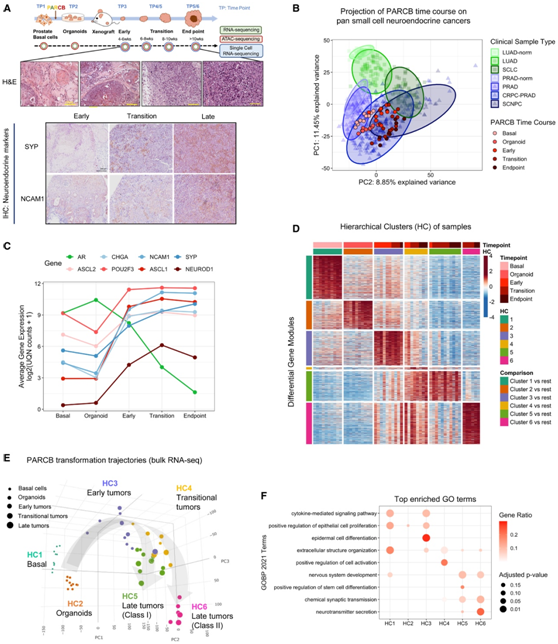
图1. PARCB转化模型的时间基因表达程序揭示了SCNPC转分化途径。
(A) PARCB 时程研究的示意图以及组织微阵列中连续肿瘤的神经内分泌标记物(SYP 和 NCAM1)的代表性苏木精和伊红 (H&E) 染色和免疫组织化学 (IHC) 染色。使用bulk RNA-seq(绿色圆圈)、bulk ATAC-seq(红色圆圈)和scRNA-seq(蓝色圆圈,仅肿瘤)对时间点 (TP1-6) 样本进行分析。(B) 将 PARCB 时程样本投影到由泛癌临床肿瘤数据集定义的 PCA 框架上。(C) 所选 SCNPC 相关蛋白和标记的平均基因表达。(D) 样品层次聚类 (HC) 的热图(列)和相应差异上调的基因模块(行)。(E) PARCB 时程样本和转分化轨迹(包括初级弧和次级分叉)的 PCA。(F)GO分析。
02
序列转录调节剂通过高熵且可接近的染色质状态调节重编程和神经内分泌程序
接下来,他们试图通过使用 ATAC 测序(ATAC-seq)进行染色质可及性分析,对 1600 多个转录因子进行广泛检测,从而定义 SCNPC 的转录进化。从肿瘤过渡期 (HC4) 到晚期(HC5 和 HC6),观察到跨染色体的总体可及染色质峰显著增加(图 2 A)。使用 ATAC 测序(ATAC-seq)数据进行的无监督 PCA 显示出弧形分叉轨迹,与使用 RNA-seq数据的结果一致(图 1 D 和图2 B)。他们发现过渡样本(HC4)具有最高的熵(图2B),这表明在转分化过程中存在高潜力且不太明确的转录状态。为了识别在转化轨迹的每个阶段识别染色质可及区域的转录因子,首先观察转录起始位点(TSS) 附近的整体可及性(图2C)。根据shannon熵分析,过渡样品 (HC4) 的可及峰显著增加(图2B-C)。基序富集分析表明:(1)代表性的应激反应因子如NFkB、JUN、ATF和STAT蛋白在早期到过渡阶段(HC1-4)都有活性,(2)重编程因子如POU/OCT和SOX家族在I类(HC5)肿瘤中有活性,(3)神经元/神经因子包括ASCL和NEUROD家族蛋白在II类(HC6)肿瘤的中有活性(图2D)。
为了确定转录因子的表达是否与其从基序富集分析中推断出的活性相对应,他们总结了转化阶段 (HC1-HC6) 中排名最高的转录因子(图2 E),观察到 (1) AR mRNA 表达在向晚期肿瘤进展过程中丢失,(2) FOXA1(SCNPC 的一种已知转录因子)在早期过渡阶段出现,以及(3)神经内分泌转录因子,如ASCL1、NEUROD1、ONECUT2、SOX2、INSM1和FOXA2在后期增加(图 2E)。ASCL1和ASCL2表达在肿瘤晚期升高(图 1C、图2E-F)。值得注意的是,它们的表达在不同的肿瘤中(HC5: ASCL2+和HC6: ASCL1+)富集,证明它们可能对分叉轨迹的潜在作用(图2E-F)。
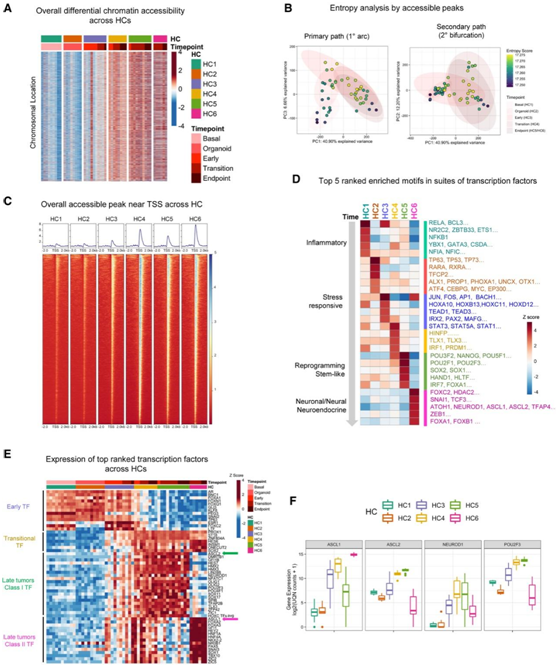
图2. 序列转录调节因子通过高熵且可接近的染色质状态调节重编程和神经内分泌程序。
(A) HC 中染色质可及性的总体差异。(B) 使用 ATAC-seq通过熵分析对 PARCB 时程样本的染色质可及性进行 PCA。(C) PARCB 时间过程研究中每个 HC 的 TSS 附近的总体平均可及性。(D) 使用 ATAC-seq从每个 HC 中的转录因子中富集的基序。(E) 使用bulk RNA-seq 在 PARCB 时间过程中排名最高的转录因子和已知的神经内分泌转录因子。(F) 每个 HC 中 ASCL1、ASCL2、NEURDO1 和 POU2F3 的表达。
03
转录因子定义的细胞群导致谱系分化和肿瘤异质性
为了确定时间过程肿瘤内的异质性程度,他们对四个时间定义的连续肿瘤组:P2、P5、P7 和 P8 (TP3–TP6)进行了单细胞转录组分析(scRNA-seq)(图 3 A)。从早期肿瘤到晚期肿瘤,他们观察到从基底 (KRT5 +) 到管腔 (KRT18 +)的谱系分化(图 3B-C)。转录调控因子YAP1的表达定义了非神经内分泌 SCLC 亚型,其高表达常见于 CRPC-PRAD 而不是 SCNPC,在早期肿瘤细胞群中富集(图 3B-C)。其他众所周知的神经内分泌转录因子(例如ASCL1、INSM1和FOXA2)在具有高 SCNPC 评分的同一细胞聚类中富集(图3C)。然而,在另一个细胞聚类中,ASCL2、POU2F3和SOX9以中等水平的SCNPC评分共表达(图3C)。来自人类原代细胞数据库(Human Primary cell Database)中的36种参考细胞类型中,有5种在PARCB时间过程肿瘤样本中高度富集(图3D)。所有肿瘤细胞与上皮细胞具有相似的转录组(图3D)。特别是,大多数肿瘤细胞(早期细胞除外)表现出胚胎干细胞和诱导多能干细胞的干细胞样基因表达模式,表明 SCNPC 发育和转分化过程中存在去分化转变(图 3D)。此外,表达ASCL1或ASCL2 的后期细胞具有神经元样基因表达谱,证实了 SCN 分化的出现(图3B-D)。
bulk RNA-seq数据中的肿瘤细胞聚类主要由处于相应不同转录状态的单细胞组成,具有一定程度的异质性(图3E)。此外,肿瘤中高表达的转录因子在单个细胞中显示出异质性模式(图2E)。过渡期(HC4)和晚期(HC5)肿瘤的基因波动程度最高,进一步强调了在反分化过程中增加的肿瘤内异质性的潜在作用。他们观察到ASCL1和ASCL2双阳性细胞的频率较低,主要在SCNPC肿瘤中,这可能反映了腺癌和SCN表型之间的过渡状态(图3F)。
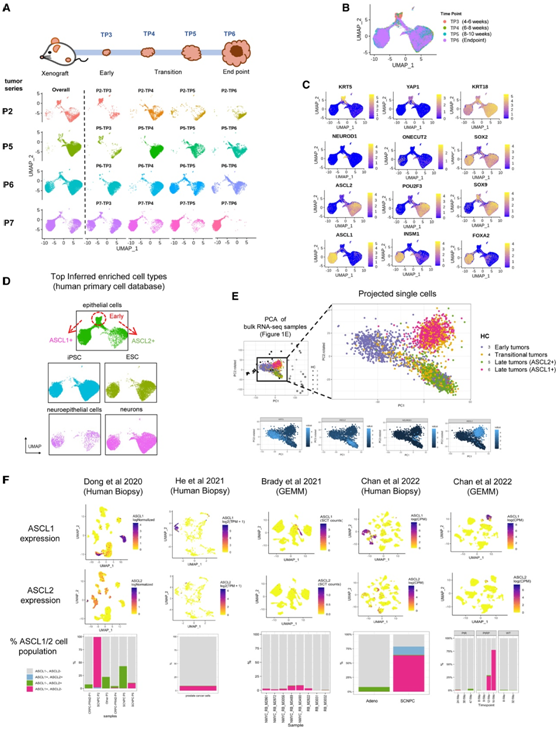
图3. 转录因子定义的细胞群的谱系分化和肿瘤异质性。
(A) 使用scRNA-seq 对P2、P5、P6 和 P7进行UMAP可视化分析。(B) 所有样本的时间 UMAP 可视化。(C) 选定标记和转录因子的表达。(D) 使用 SingleR 从人类细胞类型数据库中推断出最富集的细胞类型。(E) 通过bulk RNA-seq样本(上)在 PCA 框架上投影scRNA-seq样本以及所选标记和转录因子的表达(下)。(F) 来自五个scRNA-seq数据集的人体活检和 GEMM 模型肿瘤中 ASCL1(上)和 ASCL2(中)的表达以及 ASCL1/2 阳性细胞(表达值 > 0 的细胞)(下)的百分比。
04
ASCL1和ASCL2在SCNPC中具有独立的转录程序和谱系
鉴于ASCL1和ASCL2的表达水平在单个细胞中是互斥的,他们通过克隆示踪分析推测ASCL1和ASCL2是否代表不同的细胞亚系。以KRT5(基础标记)作为追踪的开始,推断的追踪结果为三个主要的谱系分支/状态(图4A)。正如假设的那样,表达ASCL1或ASCL2的单细胞在不同的谱系分支中富集(图4A-B)。RNA速率分析显示双阳性细胞在PARCB肿瘤中非常罕见。在P2-TP5肿瘤中观察到的双阳性细胞群体可能捕获了处于过渡状态的细胞(图4C),并且总体低双阳性频率与上述临床结果一致(图3F)。
为了进一步表征高水平表达ASCL1或ASCL2的细胞之间的转录差异,他们分析了它们的差异表达基因谱(图 4D)。参与突触和神经内分泌调节的基因(例如DDC、CACNA1A和INSM1 )在ASCL1+细胞中富集。ASCL2 +细胞表达具有干细胞样特征的基因,例如SOX9和POU2F3(图4D)。
为了鉴定与前列腺癌中 ASCL1 或 ASCL2 相关的转录程序,他们使用多个buk RNA-seq 检测的前列腺癌和模型数据集(包括癌症基因组图谱(TCGA)、其他患者肿瘤 (Beltran) 和模型数据集)构建了一个推断网络 SCNPC 模型数据集。利用该数据集分析鉴定了由ASCL1或ASCL2独立调节的336和352个基因(图4E)。引人注目的是,推断分析中只有 5 个基因受这两个因子(ASCL1或ASCL2)调节:TMEM74、RGS16、LHFPL4、CDCA7L和SOX2(图 4 E)。受 ASCL1 调节的基因富含神经内分泌分化标记物和因子,例如SYP、CHGA、NCAM1和NEUROD1(图 4 E)。ASCL2 与包括PTGS1/COX1、POU2F3、ANXA1在内的基因相关,这些基因通常具有免疫和应激反应性,并且具有干性(图 4D-E)。他们进一步证实,来自不同起源组织(前列腺、膀胱和肺)的PARCB肿瘤来源细胞系都只有一种或另一种与ASCL1或ASCL2表达相关的基因表达模式(图4F)。移行性PARCB肿瘤样本中ASCL1和ASCL2 mRNA的原位杂交进一步证实了这种互斥的表达模式(图4G)。这些结果证明了ASCL1和ASCL2定义独立的细胞亚系和转录程序,在SCNPC中具有干细胞样和神经内分泌富集。
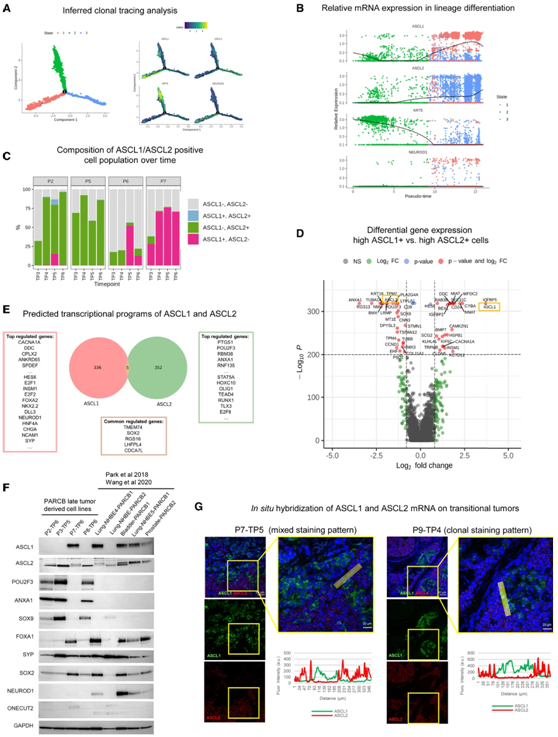
图4. ASCL1和ASCL2在SCNPC中指定独立的转录程序和亚谱系。
(A) 使用 Monocle 2 对 PARCB 时间过程样本进行推断克隆追踪分析。(B) 推断克隆追踪分析中 KRT5、ASCL1 和 ASCL2 的相对表达(伪时间)。(C) ASCL1 或 ASCL2 阳性、双阳性和双阴性细胞群随时间变化的百分比。(D) 高 ASCL1+ 与高 ASCL2+ 细胞群中差异表达基因的火山图。(E) 来自预测的 ASCL1 和 ASCL2 转录程序的代表性基因,根据来自患者和模型前列腺癌肿瘤的数据进行训练。(F) 免疫印分析。(G)ASCL1 和 ASCL2 的mRNA原位杂交分析。
05
ASCL1和ASCL2作为泛癌分类因子
他们发现 PARCB 时间样本具有相似的转录组和表观基因组特征,包括共有的干细胞样 (SCL) 组和共有的 NEPC 组(图 5 A)。鉴于 SCLC 和 SCNPC 的转录谱高度相似,他们将 PARCB 时程样本的 HC 分类与 SCLC 临床亚型进行了比较:ASCL1 (A)、NEUROD1 (N)、POU2F3 (P) 和 YAP1(Y)(图 5 B)。I/ASCL2+ (HC5) 肿瘤组与 SCLC-P 具有转录组相似性(图 5 B),这与多项分析中观察到的 ASCL2 和 POU2F3 共表达模式一致(图 3 C和图4 D)。同样,II 类/ASCL1+ (HC6) 肿瘤组在转录上与 SCLC-A 一致(图 5 B)。
在PARCB模型和临床样本中,ASCL1和ASCL2的表达水平具有可比性,HC1到HC6的转录模式通常与PRAD/CRPC-PRAD向SCNPC的转变相对应(图5C)。他们在CRPC-PRAD和SCNPC临床样本以及CRPC- PDX模型上进一步证实了ASCL1/2的普遍排斥性和低双阳性表达模式(图5D)。
通过比较广泛的泛癌细胞系中 ASCL1 和 ASCL2 的表达水平,他们发现除了肺癌之外,几乎所有癌症都可以分为三类:(1)表现出ASCL1(神经母细胞瘤)的表达,(2) ASCL2(结直肠癌和乳腺癌),以及 (3) 双阴性(其他癌症)(图 5 E)。只有 SCLC 和其他肺癌细胞系具有混合水平的ASCL1和ASCL2。结合本项研究的结果,这表明 ASCL2 和 POU2F3 在指定(小细胞)肺癌的中间和/或异质状态方面具有潜在作用(图 5 E)。在患者肿瘤泛癌数据中,再次观察到ASCL1或ASCL2的唯一表达,突出显示 ASCL1 和 ASCL2 定义的二元区别发生在多种组织类型中(图 5 F)。总之,在多种癌症和泛癌环境中观察到 ASCL1 和 ASCL2 之间存在相互排斥的关系。
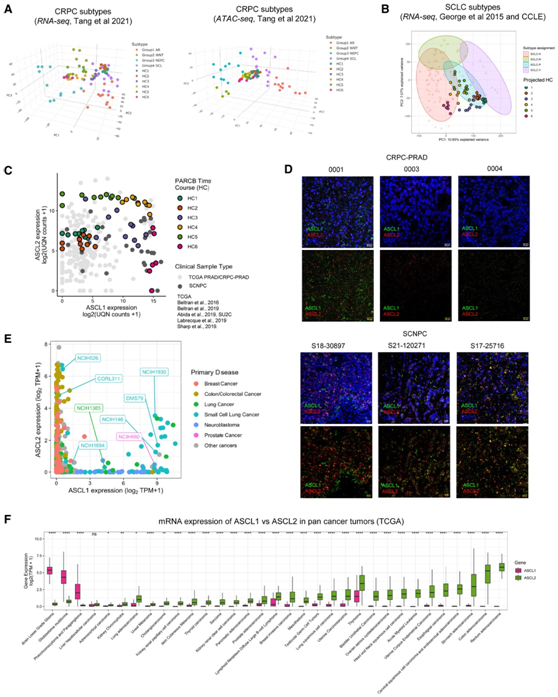
图5. ASCL1和ASCL2作为泛癌分类器。
(A) 使用 RNA 测序(左)和 ATAC 测序(右)在 CRPC 亚型定义的 PCA 框架上投影 PARCB 时间过程样本。(B) PARCB 时间过程样本在 SCLC 子类型定义的 PCA 框架上的投影。(C) PARCB 时程样本和多组临床 CRPC-PRAD 和 SCNPC 样本(包括 TCGA 和不同研究组)中 ASCL1 和 ASCL2 的 mRNA 表达。(D)临床 SCNPC 组织中 ASCL1 和 ASCL2 的原位RNA 杂交的代表性图像。(E) ASCL1 和 ASCL2 在泛癌细胞系 (CCLE) 中的 mRNA 表达。(F) TCGA 中泛癌肿瘤中 ASCL1 和 ASCL2 的 mRNA 表达。
06
通过相互作用和 TFAP4 表观遗传调控交替 ASCL1 和 ASCL2 表达
有证据表明SCNPC转分化过程中单细胞中ASCL1或ASCL2表达水平是相互排斥的,他们提出了两个假设:(1)这两个因子相互调节彼此的表达,或(2)它们具有一个共同的上游转录因子通过与各自基因调控元件的调节差异结合来改变它们的转录。
为了验证第一个假设,他们在多个 PARCB 肿瘤衍生细胞系(肺和前列腺)中表达 V5 标记的 ASCL2,并观察到ASCL1 蛋白表达在这些细胞中显著受到抑制(图6 A)。相反,V5标记的ASCL1的表达增加了ASCL2在蛋白质和mRNA水平上的表达(图6A)。因此,在本项研究的细胞模型中,ASCL1和ASCL2在蛋白质水平上相互调节,但以一种相互排斥的方式。
为了验证第二个假设,他们首先在PARCB时间过程ATAC-seq数据中注释了已知的ASCL1和ASCL2的启动子和增强子区域(图6B)。在ASCL1启动子和ASCL2增强子区域上发现了相反的开放和封闭染色质形成模式(图6B),生成了在这些区域中具有匹配基序的转录因子的排序列表(图6C)。通过对所有在ASCL1和ASCL2调控区均发现基序的因子进行广泛分析,发现TFAP4可形成不同的转录复合体来激活或抑制靶基因,包括促进结直肠癌中上皮细胞向间质转化和抑制非神经元细胞中的神经元程序。
染色质免疫沉淀实验证实了TFAP4 与ASCL1启动子和ASCL2增强子区域的直接差异结合。尽管由于细胞系内潜在的混合细胞克隆,细胞系具有不同程度的TFAP4结合信号,但在ASCL1细胞系(P7-TP6)中,TFAP4比ASCL2细胞系(P2-TP6和T3-TP5)在ASCL1启动子附近具有更高的结合亲和力。
为了确定TFAP4是否直接调控ASCL1和ASCL2的表达,他们在多个ASCL1+和ASCL2+细胞系中引入了一个多西环素诱导的靶向TFAP4的CRISPR sgRNA,包括PARCB肿瘤来源的细胞系和患者来源的细胞系NCI-H660。多西环素诱导TFAP4敲除后,ASCL1和ASCL2的表达均有不同程度的下降(图6D和图6F),然而,其他谱系相关蛋白表达没有改变(图6F)。细胞增殖实验显示,敲除TFAP4后,P7-TP6 (ASCL1)细胞生长轻微下降,而P3-TP5 (ASCL2)细胞生长急剧增加(图6E)。与腺癌和正常组织相比,小细胞癌中TFAP4的表达均显著增加(图 6F)。
因此,在本项转录调控回路研究中,他们发现ASCL1和ASCL2之间存在相互排斥的调控关系。在该回路中,ASCL1 和 ASCL2 具有共有的正调节因子 TFAP4。总结本项研究结果,PARCB 模型提供了由时间转录因子指定的SCNPC转分化模式(图 6 G)。
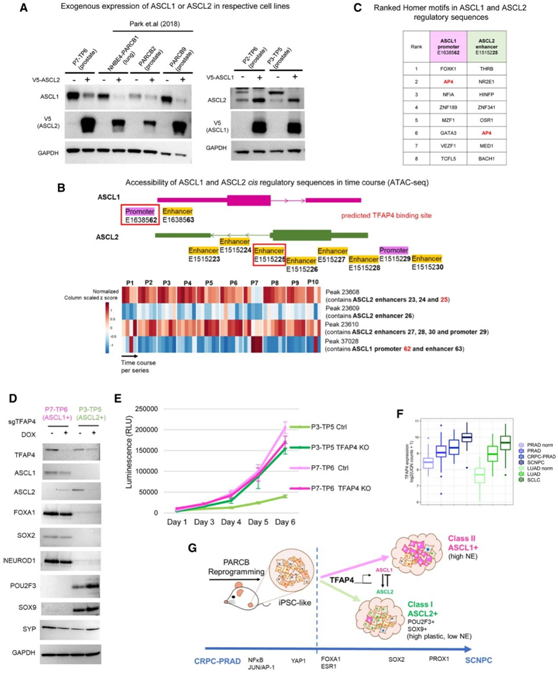
图6. 通过相互作用和TFAP4表观遗传调控交替ASCL1和ASCL2表达。
(A) 免疫印迹分析。(B) ASCL1 和 ASCL2 的假定顺式调控元件 (CRE) 示意图(上)以及使用 PARCB 时程 ATAC 测序的 ASCL1 和 ASCL2 CRE 的开放染色质可及性热图(下)。(C) ASCL1 启动子和 ASCL2 增强子区域中排名前 8 的转录因子基序分析。(D)免疫印迹分析。(E) 使用强力霉素诱导敲除 TFAP4 的 P7-TP6 (ASCL1+) 和 P3-TP5 (ASCL2+) 细胞系的细胞增殖分析。(F) 前列腺癌和肺癌数据集中的 TFAP4 表达。(G) PARCB 时间过程研究的概要。
+ + + + + + + + + + +
结 论
本项研究对PARCB模型进行了多组学时间过程分析,揭示了由ASCL1或 ASCL2的互斥表达定义的两个不同谱系,确定了 ASCL1 和 ASCL2 是潜在调节因子。本项研究提供了时间转录模式,并揭示了前列腺癌和肺癌之间的泛组织相似性,以及与正常神经内分泌细胞状态的联系。
+ + + + +



 English
English


