文献解读|Nat Commun(14.7):全外显子组测序揭示肝内胆管癌的基因组图谱,并确定SAV1为潜在驱动因素
✦ +
+
论文ID
原名:Whole-exome sequencing reveals genomic landscape of intrahepatic cholangiocarcinoma and identifies SAV1 as a potential driver
译名:全外显子组测序揭示肝内胆管癌的基因组图谱,并确定SAV1为潜在驱动因素
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.17
DOI号:10.1038/s41467-024-54387-8
背 景
肝内胆管癌 (ICC) 是仅次于肝细胞癌 (HCC) 的第二大常见原发性肝脏恶性肿瘤,全球发病率呈逐年上升趋势。诊断方法和临床筛查的进步使得 ICC 的早期发现和根治性切除成为可能;然而,由于复发率高,患者的长期生存率仍然较低,中国患者 ICC 的基因组特征仍然很大程度上未知。
实验设计
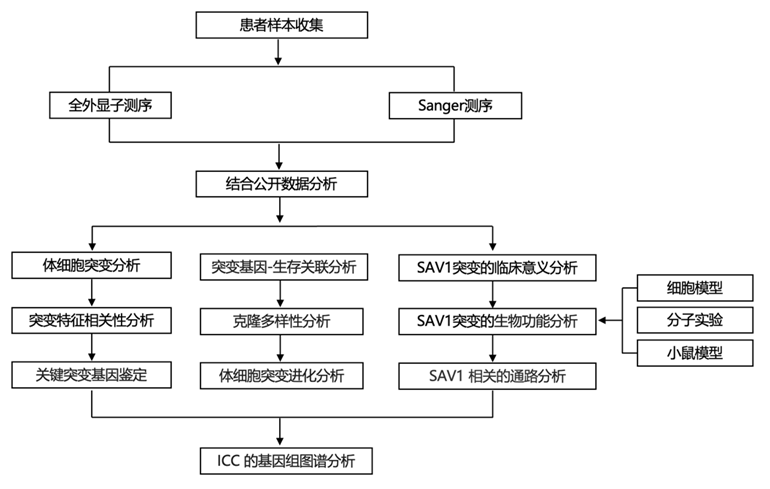
结 果
01
原发性 ICC 患者的基因组改变
为了探究中国 ICC 患者的基因组变异,研究团队对 204 例 ICC 患者的肿瘤和匹配的非癌性肝组织样本进行了全外显子组测序(WES)。肿瘤的平均测序深度为 445.9 倍,正常组织的平均测序深度为 138.7 倍。他们总共鉴定出 21772 个单核苷酸位点变异(SNV) 和 1302 个插入/缺失,每个肿瘤基因组有 2-1628 个突变。他们进行了 Sanger 测序以验证 1756 个随机选择的体细胞非同义突变,结果显示真实发现率很高(95.9%)。平均每 Mb 有 3.77 个个体细胞编码突变(图 1A)。
WES 结果表明,C > A 颠换、C > T 和 T > C 转换在所有 ICC 中普遍存在(图 1A),其他 ICC 队列也具有这一特征。此外,他们还鉴定了 17 个扩增片段,这些片段包含几个已知的致癌基因,包括MYC、 ERBB2和CCND1。他们还鉴定了 24 个丢失片段,这些片段包含肿瘤抑制基因,如TP53 (17p13)和CDKN2A/B (9q21)(图 1A)。此外,他们在 204 个肿瘤中的 44 个(21.6%)中鉴定了全基因组加倍。他们将肿瘤突变负荷 (TMB) 和拷贝数变异 (CNV) 负荷与患者预后联系起来。结果表明,高 TMB 可预测低无复发生存期 (RFS),但无法预测总生存期 (OS)。此外,CNV 负荷与患者预后无关,无论是 OS 还是 RFS。
他们应用 NMF 并在 204 个 ICC 样本中鉴定了六个突变特征(特征 A-F)(图 1B-C)。特征 A 以显性 T > A 突变为特征,与之前描述的特征 22高度相似,已知后者是由接触马兜铃酸引起的,并且与高突变负担相关。与此一致,特征 A 是高突变 ICC 样本中的主要特征。特征 B 以 C > G 突变为特征,与之前描述的特征 13 相似,后者是 APOBEC 驱动的高突变表型。特征 C 和 E 分别与之前描述的特征 1 和 5 高度相似,这两者都与衰老有关。特征 D 与之前描述的特征 20 相似,之前已证实该特征是由 DNA 错配修复缺陷所致,且与单核苷酸/多核苷酸重复序列中插入/缺失数量较高有关。与此一致,特征 D 主要在四种插入/缺失数量较高的 ICC 中发现。特征 F 的特征为 C > A 突变,与之前描述的特征 24 非常相似(相关相似性 = 0.94),与癌症中接触黄曲霉毒素有关。
根据突变特征的普遍性,层次聚类确定了九组肿瘤(Msig 聚类 1-9)(图 1C),这些肿瘤的特点是特定突变特征的富集。例如,Msig 聚类1 和 6 的特征是特征 A,因为它们包含的符合特征 A 的突变比其他聚类多。此外,Msig 聚类 3 的特征是特征 D,Msig 聚类 4 的特征是特征 F,Msig 聚类 5 的特征是特征 B,还揭示了基于特征的聚类与临床背景和遗传改变之间的关联。 Msig-clusters 1 和 6 与较高的 TMB 表现出显著的相关性,而 Msig-聚类 8 和 9 与较低的 TMB 相关。Msig-聚类 4 和 5 显示出更高的 TMB和更高的 CNV 负担。特别是,他们证实了 Msig-聚类5 与肝内胆管结石的存在之间的相关性,表明 AID/APOBEC 酶与胆管炎诱发的肿瘤发生有关。此外,Msig聚类3 和 9 分别与ARID1A突变或IDH1突变的存在表现出相关性。
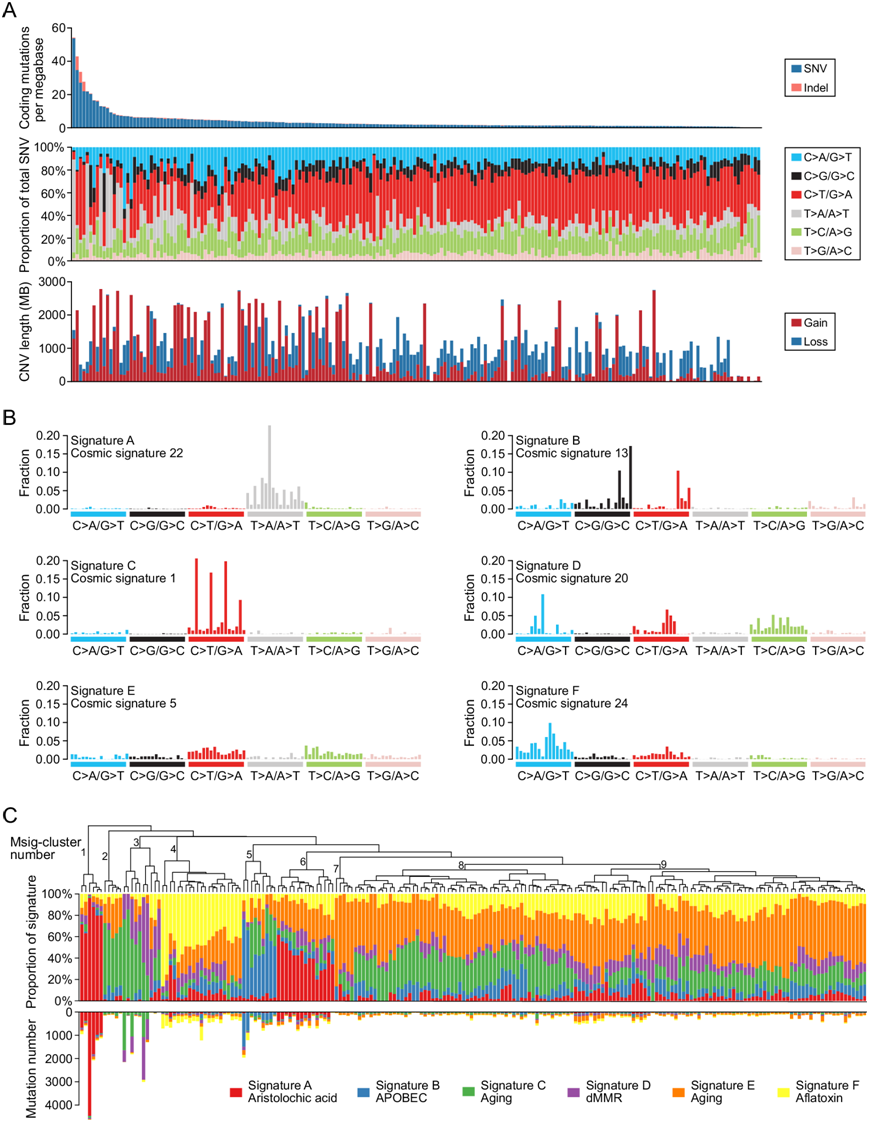
图1. 204 例中国原发性肝癌的整体基因组变异。
(A) 204个ICC编码区的突变负担。(B) 在 204 个 ICC 中确定的六种突变特征模式。(C) 根据每个样本中特征的强度对 204 个主要ICC进行无监督层次聚类。
02
显著突变的蛋白质编码基因及其与患者预后的关系
他们使用 MutSigCV 来识别癌症驱动基因,鉴定了13 个显著突变基因:TP53、KRAS、IDH1、ELF3、SAV1、BAP1、ARID1A、PBRM1、PTEN、ARID2、BRD7、CDKN2A和ACVR2A(图 2A)。他们还确定了具有拷贝数扩增的致癌基因(MYC、ERBB2和CCND1)以及具有拷贝数缺失的肿瘤抑制基因(CDKN2A和CDKN2B )。然后,他们将这 13 个基因的突变频率与 TCGA和 MSK队列中的突变频率进行了比较。在本研究的 ICC 队列中,13 个基因中有几个基因的突变频率高于 TCGA 和 MSK 队列,包括TP53、KRAS、ELF3和SAV1,而IDH1和 PBRM1的突变频率在本研究的 ICC 队列中略低于 TCGA 和 MSK 队列(图 2B)。
接下来,他们将特定基因的体细胞突变与患者结果关联起来,发现TP53、KRAS、ELF3和SAV1的体细胞突变与患者 OS 和/或 RFS 相关。当重点分析这四个基因的组合(TP53、KRAS、ELF3和SAV1)时(图 2C),四个基因中有两个或两个以上发生突变的患者的累积复发率最高(92.9%),明显高于四个基因中只有一个发生突变(76.3%)或四个基因均未发生突变(60.9%)的患者的累积复发率(图 2D)。同样,在四个基因中有两个或两个以上发生突变的患者的5年OS为7.7%,明显低于仅在四个基因中有一个突变(27.2%)或四个基因均未发生突变(45.3%)的患者(图 2E)。
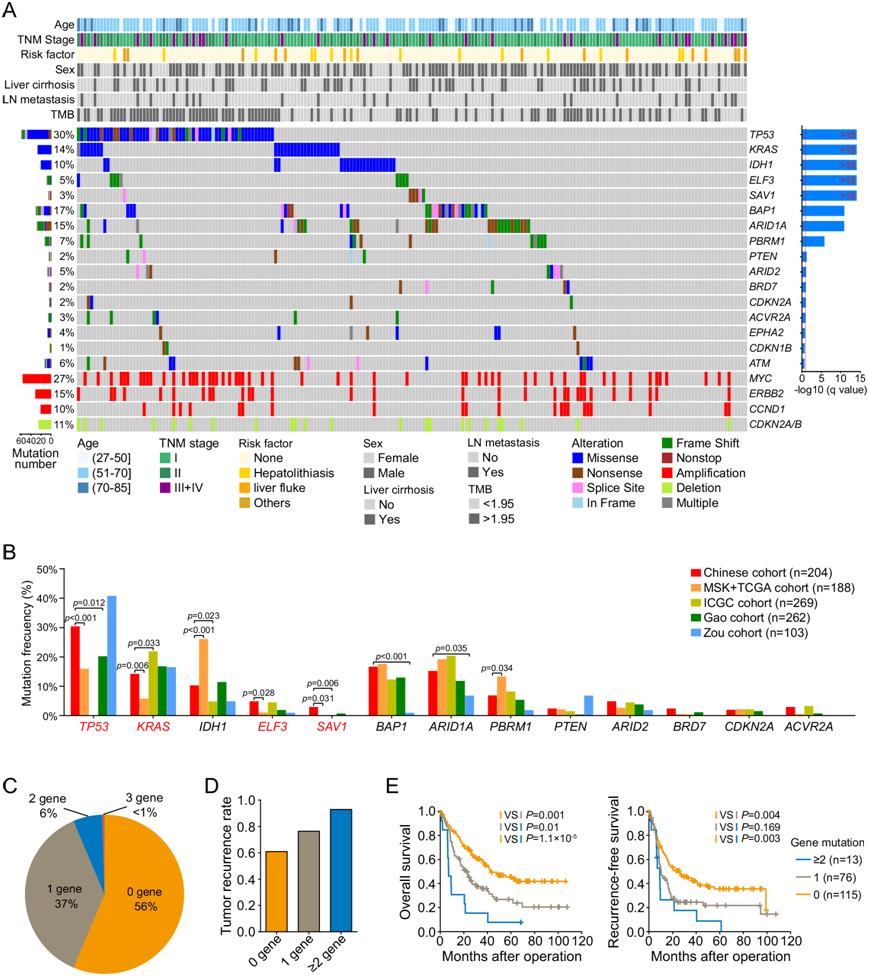
图2. 显著突变的蛋白质编码基因及其与患者结果的关联。
(A) 显示了13 个具有统计学显著突变水平的基因。(B) 比较队列中的 204 个 ICC 与其他队列的 ICC 之间 13 个显著突变基因的突变频率。(C) 204个 ICC 携带TP53、KRAS、ELF3和SAV1突变的比例。(D) 携带不同数量突变基因(TP53、KRAS、ELF3和SAV1)的 HCC 患者的肿瘤复发率。(E) Kaplan -Meier生存分析显示基于TP53、KRAS、ELF3和SAV1突变的总生存期和无复发生存期。
03
克隆多样性和复发性体细胞突变的进化
为了根据所有 ICC 样本的 WES 估计遗传多样性,他们使用了先前研究14中描述的分析流程来计算每个患者的Shannon指数,该指数不仅可以估算克隆的数量,还可以估算它们的相对丰度。具有单个克隆的患者的Shannon指数为 0,Shannon指数增加对应克隆数量增加和 CCF 分散度减少(图 3A)。他们将患者分为“克隆平衡”组(定义为Shannon指数高于所有患者的中位数)和“克隆优势”组(定义为Shannon指数低于中位数)(图 3A)。Kaplan-Meier 生存分析表明,与克隆平衡相比,克隆优势与明显较短的 OS 和 RFS 相关。单变量和多变量分析显示,Shannon指数是OS和RFS的独立预后因素(图 3B)。
接下来,他们通过分析复发性非同义突变在克隆事件和亚克隆事件中出现的频率,推断出 ICC 发育过程中体细胞改变发生的大致顺序。该分析证实,BAP1、ARID1A和TP53突变是最早出现的突变,其次是PBRM1、ELF3和KRAS突变。相比之下,ARID2和IDH1/2突变主要限于亚克隆事件,这些事件发生在较晚的时间点(图 3C)。
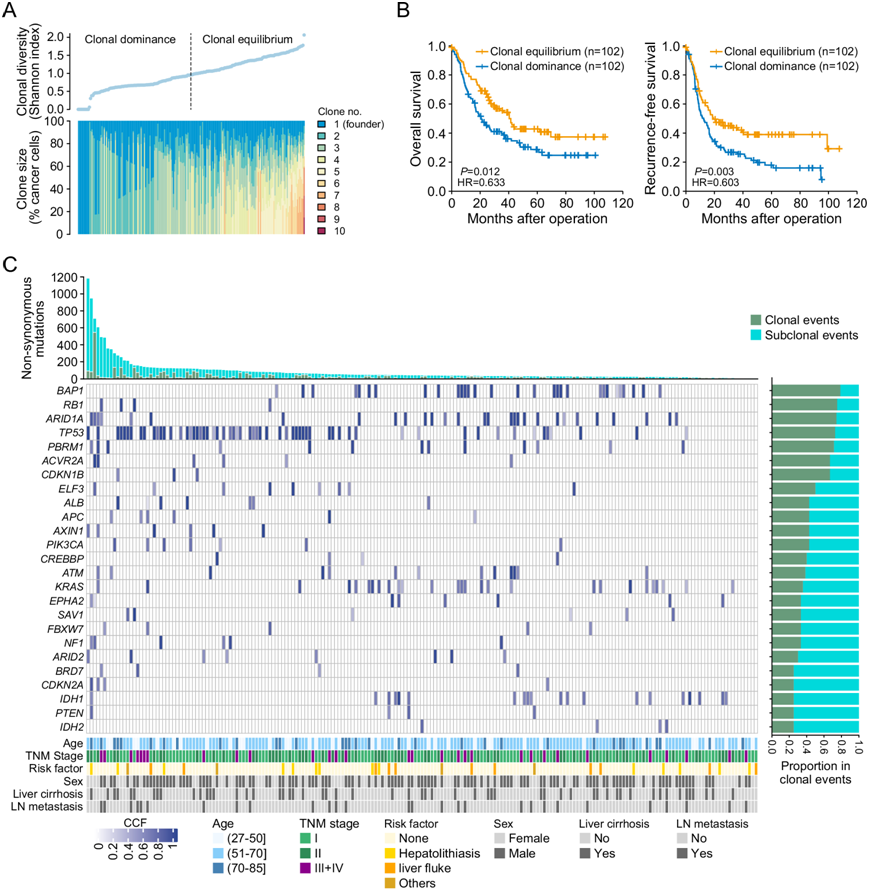
图3. 克隆多样性和复发性体细胞突变的进化。
(A) 204 个 ICC 中的克隆多样性通过 Shannon 指数量化和排序。(B) Kaplan -Meier 生存分析显示基于 Shannon 指数(克隆平衡和克隆优势)的总体生存率和无复发生存率。(C) 可能的癌症驱动基因中复发性突变的演变。
04
SAV1体细胞突变与 SAV1 表达降低相关,并且可预测根治性切除术后患者预后
他们通过Sanger测序评估了另外 468 对 ICC 和正常组织样本中SAV1的所有编码外显子。在 14 个 ICC 中的中发现了SAV1体细胞突变。他们在 20 个不同的患者中发现了 20 个SAV1体细胞突变(图 4A)。具体而言,20 个SAV1突变中有 14 个(70%)是截短突变,这表明SAV1在 ICC 中可能具有肿瘤抑制作用。
他们进一步通过免疫组化方法检测了672例ICC中SAV1的表达情况,结果显示,与匹配的非肿瘤肝组织样本相比,所有肿瘤组织样本中SAV1的表达均下调(图 4B),且在发生SAV1体细胞突变的患者中,肿瘤组织SAV1的表达进一步降低(图 4B)。然后,他们将SAV1体细胞突变和表达与患者的临床特征和结果相关联。SAV1体细胞突变与肿瘤大小增加和肿瘤分化差相关。SAV1 表达水平与较高的 CA19-9 和 GGT 水平、肿瘤大小增加和淋巴转移相关。在 672 名 ICC 患者中,与没有这些特征的患者相比,具有 SAV1 体细胞突变或 SAV1 表达降低的患者表现出更短的 OS 和 RFS(图 4C)。单变量和多变量分析证实,SAV1 体细胞突变和低表达是 OS 和 RFS 的独立预后因素。
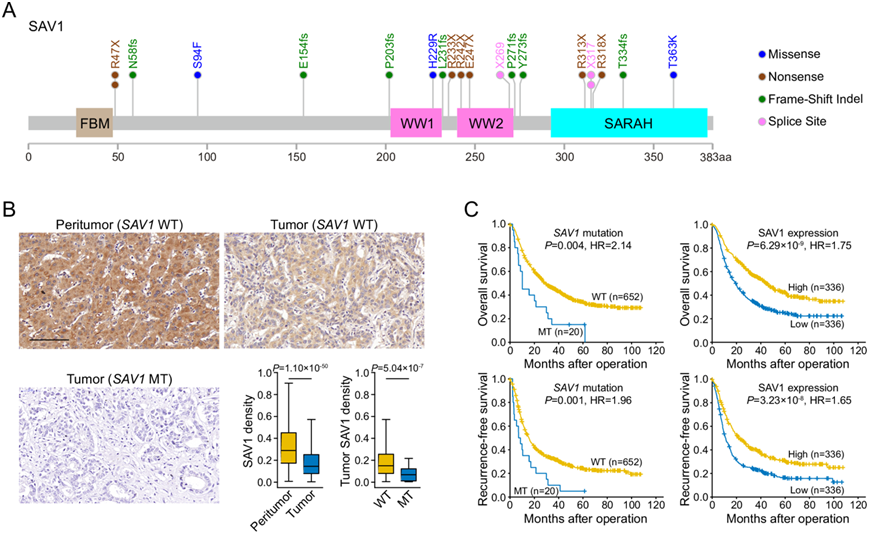
图4. 672 例 ICC 中SAV1突变的临床意义。
(A) 本研究确定的SAV1突变位点位置示意图。(B) 具有野生型 SAV1 或突变型 SAV1 (R47X) 的肿瘤周围组织和肿瘤组织中的代表性 SAV1 染色。(C) Kaplan -Meier 生存分析显示基于SAV1突变和表达水平的总生存率和无复发生存率。
05
SAV1在 ICC 中发挥抑癌基因作用
本项研究结果表明SAV1在 ICC 中可能发挥肿瘤抑制作用,接下来,他们对五种 ICC 细胞系(HuCCT1、CCLP1、RBE、HCCC-9810 和 SG231)进行了 WES。使用与 ICC 样本相同的过滤标准,所有 ICC 细胞系均鉴定为具有 WT SAV1。通过 Sanger 测序验证了细胞系的 WES 结果。Western 印迹和 qRT-PCR 证实,五种 ICC 细胞系(尤其是 HCCC-9810 和 SG231)中的 SAV1 mRNA 和蛋白质水平低于 H-69 细胞(图 5A)。
接下来,他们在 HuCCT1 细胞中敲低了 SAV1(图 5A)。生物功能研究表明,敲低 SAV1 导致 ICC 细胞增殖、克隆形成和侵袭能力增强(图 5B-D)。体内 ICC 小鼠模型显示,敲低 SAV1 加速了肿瘤生长和转移(图 5E)。他们生成慢病毒构建体以重新表达 WT,并在 SG231 细胞中筛选出突变的 SAV1 变体(图 5A)。结果表明,WT SAV1 的过表达显著抑制了 ICC 细胞增殖、克隆形成和侵袭能力。相比之下,SAV1 突变体的表达未能全部或部分引起这些影响,表明这些SAV1突变是失活突变(图 5B-D)。
他们将 SAV1 突变体与 WT SAV1 一起用于体内研究。与体外结果一致,WT SAV1 显著抑制了肿瘤生长和转移,而与 WT SAV1 相比,SAV1 突变体产生了更大的肿瘤体积和更高的转移率(图 5E)。这些结果进一步表明SAV1突变为失活类型,支持SAV1是 ICC 中的肿瘤抑制基因的观点,并且某些体细胞突变会消除其功能和肿瘤抑制作用。
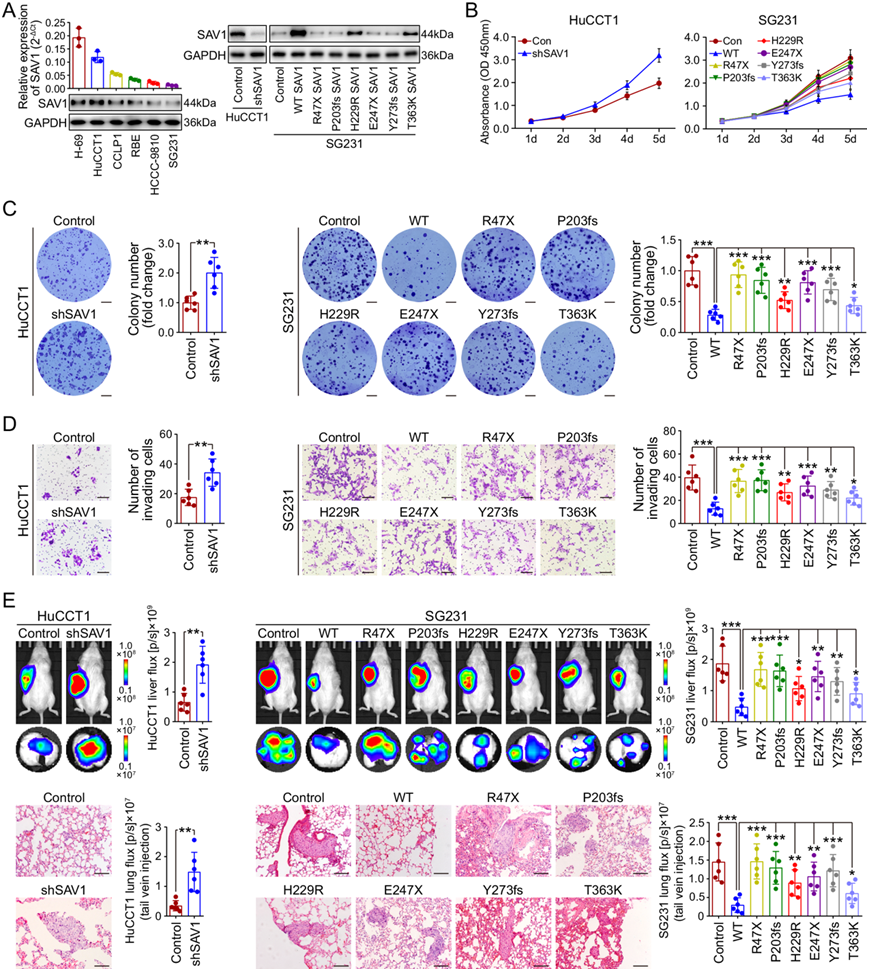
图5. 鉴定SAV1为 ICC 中的肿瘤抑制基因。
(A) qRT-PCR 和免疫印迹分析。(B) 与对照组相比,SAV1 敲低后 HuCCT1 细胞和表达野生型或突变型 SAV1 的 SG231 细胞的增殖。(C) 与对照组相比, SAV1 敲低后 HuCCT1 细胞和表达野生型或突变型 SAV1 的 SG231 细胞的克隆形成活性。(D) 与对照组相比,SAV1 敲低后 HuCCT1 细胞和表达野生型或突变型 SAV1 的 SG231 细胞的侵袭情况。(E) 小鼠肝肿瘤和肺转移的代表性生物发光图像,以及肺转移性结节的 H&E 染色图像。
06
SAV1 失活会抑制 Hippo 信号传导,从而导致 YAP 激活
在哺乳动物中,支架蛋白 SAV1 促进 Hippo 激酶级联的激活。因此,他们检测了 SAV1 对 ICC 细胞中 Hippo 信号传导的影响。Western blot 分析表明,在 HuCCT1 细胞中敲低 SAV1 可降低 YAP Ser127 磷酸化。相反,异位表达 SAV1 会增加 SG231 细胞中的 YAP Ser127 磷酸化(图 6A)。与 YAP 磷酸化一致,在敲低 SAV1 后,HuCCT1 细胞中 YAP 上游的胞浆激酶(MST1、MST2 和 LATS1)的磷酸化也降低,而在恢复 SAV1 表达后,SG231 细胞中的磷酸化增加(图 6A)。免疫荧光染色显示,敲低 SAV1 导致 HuCCT1 细胞中 YAP 聚集于核内,而过表达 SAV1 导致 SG231 细胞中细胞质 YAP 水平升高,细胞核 YAP 水平降低(图 6B、C)。这些结果表明 SAV1 触发 Hippo 激酶级联,导致 YAP 磷酸化、在细胞质滞留和失活。与 WT SAV1 相比,突变 SAV1 未能触发该激酶级联,这表明 SAV1 正向调节 Hippo 信号,并且其因突变而失活会抑制 Hippo 信号,从而导致 ICC 细胞中的 YAP 激活(图 6A-C)。免疫组织化学染色显示,具有 SAV1 体细胞突变的临床 ICC 样本倾向于显示 YAP 的核积累(图 6D),这进一步表明 SAV1 失活会抑制 Hippo 信号并导致 ICC 细胞中的 YAP 激活。此外,YAP 敲低或verteporfin(一种 YAP 抑制剂)处理可减轻 SAV1 敲低引起的体外细胞增殖、克隆形成和侵袭的增加(图 7A-D)以及体内 HuCCT1 细胞中的肿瘤生长和转移(图 7E-F)。此外,在 SG231 细胞中,过表达 S112A 突变体 YAP(一种不可磷酸化的 YAP 突变体),而非 WT YAP,可逆转 SAV1 对体外细胞增殖、克隆形成和侵袭以及体内肿瘤生长和转移的抑制作用(图 7B-F)。这些结果表明 SAV1 失活通过激活 YAP 促进 ICC 生长和转移。
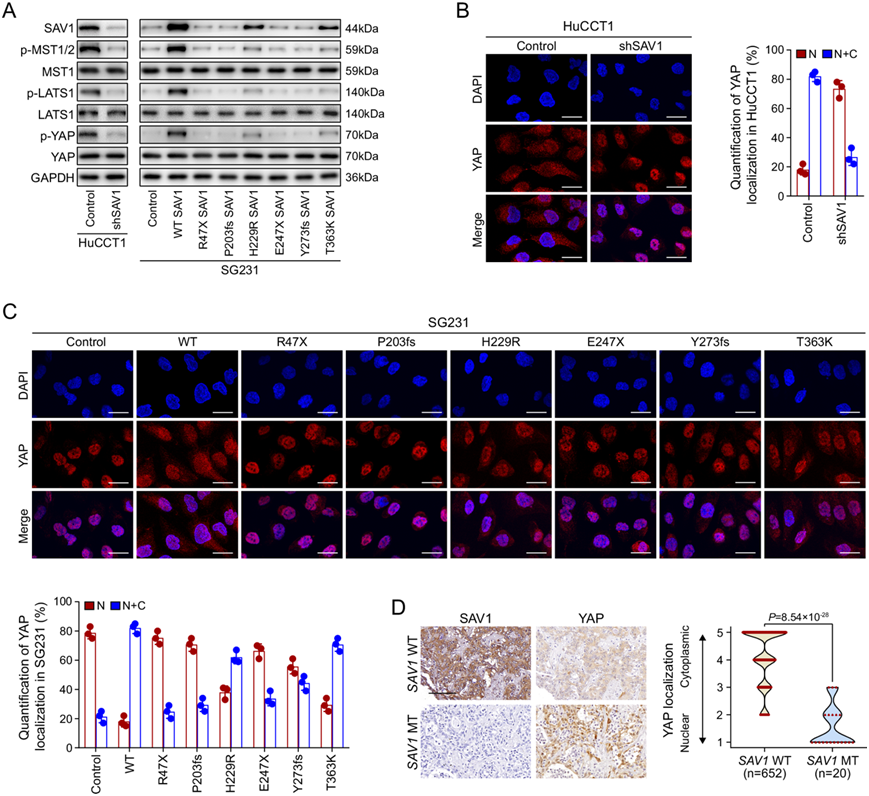
图6. SAV1 失活抑制了 Hippo 信号传导,导致 YAP 激活。
(A) 在 SAV1 表达改变后,ICC 细胞中 p-YAP、YAP 和 YAP 上游激酶 pMST1/2、MST1、pLATS1 和 LATS1 的表达。(B-C) 疫荧光染色显示所示细胞中的亚细胞 YAP 定位。(D) 具有野生型或突变型SAV1的肿瘤组织中的代表性 SAV1 和 YAP 染色。
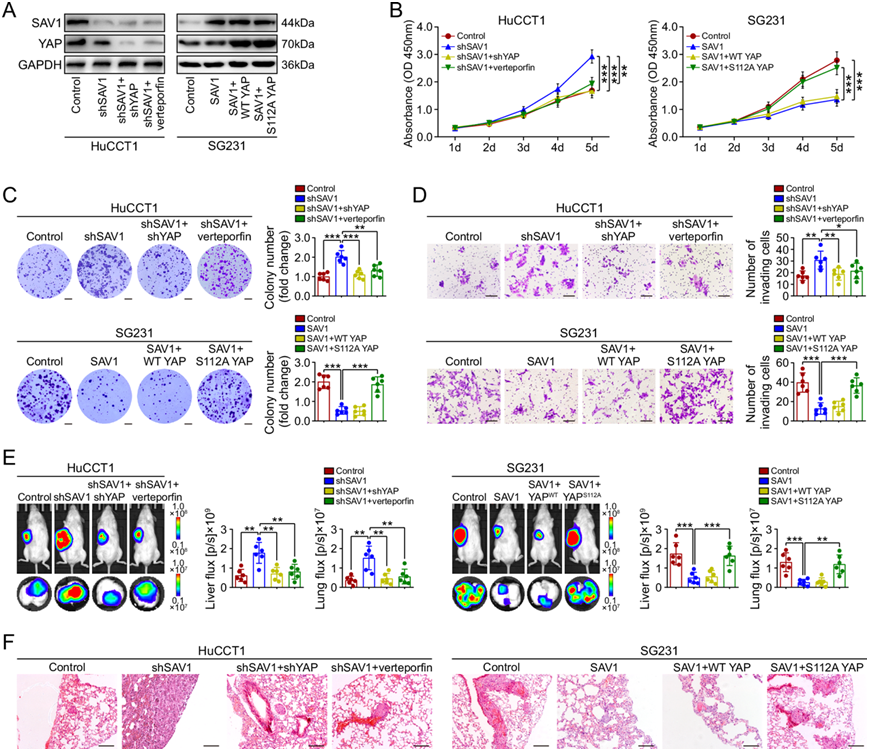
图7. SAV1 失活通过激活 YAP 促进 ICC 生长和转移。
(A) 免疫印迹显示稳定转染的 ICC 细胞中 SAV1 和 YAP 的表达。(B) 与对照组相比, YAP 敲低或用verteporfin (1 μg/ml) 处理的 HuCCT1 细胞在 SAV1 敲低后增殖。(C) 与对照组相比, YAP 敲低或用维替泊芬处理的 HuCCT1 细胞在 SAV1 敲低后克隆形成活性。(D) 与对照组相比,SAV1 敲低后 YAP 敲低或verteporfin处理的 HuCCT1 细胞的侵袭活性,以及SAV1 过表达后表达野生型 YAP 或 S112A YAP 的 SG231 细胞的侵袭活性。(E-F) 小鼠 肝肿瘤和肺 转移的代表性生物发光图像,以及肺转移性结节的 H&E 染色图像。
+ + + + + + + + + + +
结 论
本研究对 204 例中国原发性 ICC 进行了深度全外显子组测序,并表征了基因组改变和克隆进化,并揭示了它们与患者预后的关系,确定了六个突变特征,包括特征 A 和 F,它们与之前描述的分别与马兜铃酸和黄曲霉毒素暴露相关的特征高度相似。本研究还在 ICC 样本中确定了 13 个显著突变的基因,包括SAV1。本研究发现在 672 个 ICC 样本中 2.9% 的SAV1发生了突变。SAV1突变与较低的SAV1蛋白水平、较高的肿瘤复发率和较短的患者总体生存期相关。生物功能研究揭示了 SAV1 的肿瘤抑制作用:其失活会抑制 Hippo 信号传导,导致 YAP 激活,从而促进肿瘤生长和转移。总之,本项研究结果描绘了中国 ICC 的基因组图谱,并确定 SAV1 是 ICC 的潜在驱动因素。
+ + + + +



 English
English


