文献解读|Cell Rep Med(14.3):单细胞多组学分析揭示 DSRCT 中的异质转录程序和微环境
✦ +
+
论文ID
原名:Single-cell multiomics profiling reveals heterogeneous transcriptional programs and microenvironment in DSRCTs
译名:单细胞多组学分析揭示 DSRCT 中的异质转录程序和微环境
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.05.22
DOI号:10.1016/j.xcrm.2024.101582
背 景
促纤维增生性小圆细胞瘤 (DSRCT) 是一种罕见的软组织肉瘤 (STS) 亚型,与小圆细胞肉瘤 (SRCS) 实体相关。DSRCT 影响年轻人,平均年龄为 27 岁,男女性别比例为 3 至 5:1。该疾病传统上在腹盆腔内发展,并以多个腹膜结节和远处转移的形式扩散。DSRCT由 EWSR1::WT1 嵌合转录因子驱动。尽管存在这种独特的致癌驱动因素,DSRCT 仍表现出因果关系不明的多表型分化。
实验设计
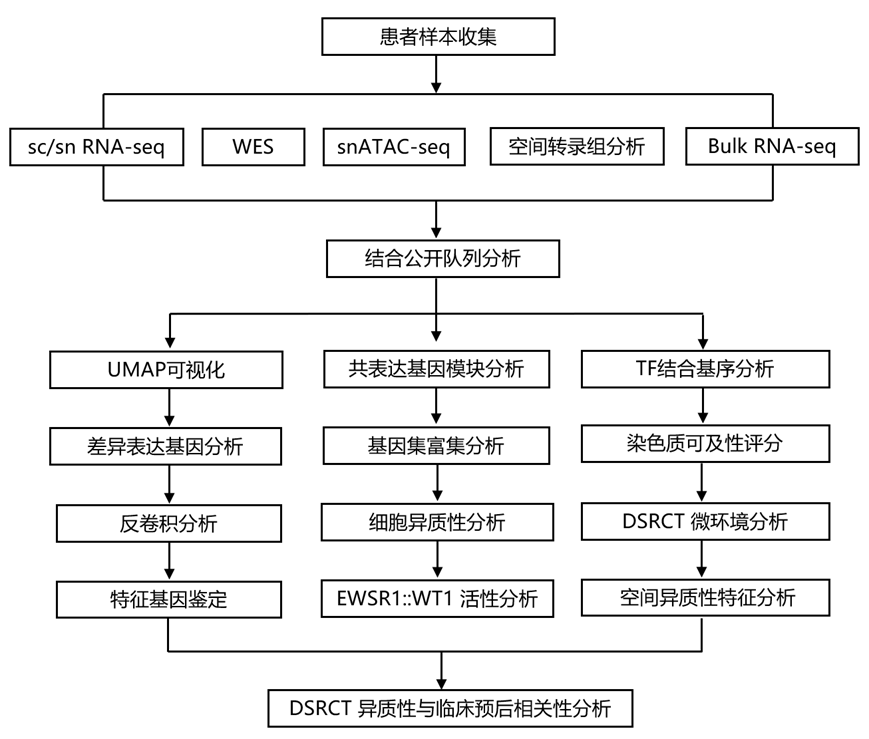
结 果
01
单细胞多组学分析揭示 DSRCT 细胞组成
为了全面研究 DSRCT 肿瘤内和肿瘤间的异质性,研究团队收集患者肿瘤样本并进行了以下鉴定:(1)单细胞转录组分析(scRNA-seq);(2)单细胞核转录组分析(snRNA-seq) 和单细胞转座酶染色质可及性分析(snATAC-seq);(3)全外显子组测序 (WES)和 (4) bulk 转录组分析(RNA-seq)(图 1 A-B)。
他们鉴定出 51671 个高质量细胞,其中包括来自肿瘤旁腹膜样本的 3063 个细胞,每个细胞表达的基因中位数为 1971 个,基于基因表达的聚类可以识别不同的细胞类型(图 1C-D)。从 DSRCT 与一组肉瘤组织型之间的差异基因表达 (DEG) 分析推断出的前 10 个 DSRCT 标记基因(图 1 D)和 DSRCT 特异性新转录本(图 1 E)。非恶性细胞类型用典型标记的表达进行标记。这些细胞包括癌症相关成纤维细胞(CAF)(表达COL1A1/SPARC/THY1)、骨髓细胞(表达C1QA/CD68/CD163)、淋巴细胞(NK和T细胞)(表达NKG7/IL7R/IL32/CD52/CD3E)、间皮细胞(表达CAV1/CALB2/MSLN)和内皮细胞(表达FABP4/VWF/PECAM1)(图1F-G)。排除 IC1 位点#1 肿瘤旁样本后,恶性细胞占检测细胞的 92%,而两种主要微环境细胞类型——CAF 和髓系细胞——分别占总细胞的5% 和 4%。DSRCT 恶性细胞的标记基因与之前描述的基因高度一致(例如APOA1 / CCL25 / GJB2 / GAL)(图1G)。这种单细胞衍生的细胞类型组成与 DSRCT 已知的组织学和免疫组织化学特征一致,含有主要由 CD68 + /CD163 +巨噬细胞、CD90 + (THY1) CAF 和极其罕见的淋巴细胞组成的少细胞纤维增生性基质(图 1 H)。
为了更广泛地研究细胞类型组成,他们应用了 CIBERSORTx24对由bulk RNA-seq分析的 29 个 DSRCT 样本进行反卷积。后者显示肿瘤细胞、CAF 和髓样细胞的比例各不相同,而淋巴细胞、内皮细胞和间皮细胞始终检测不到(图 1 I)。
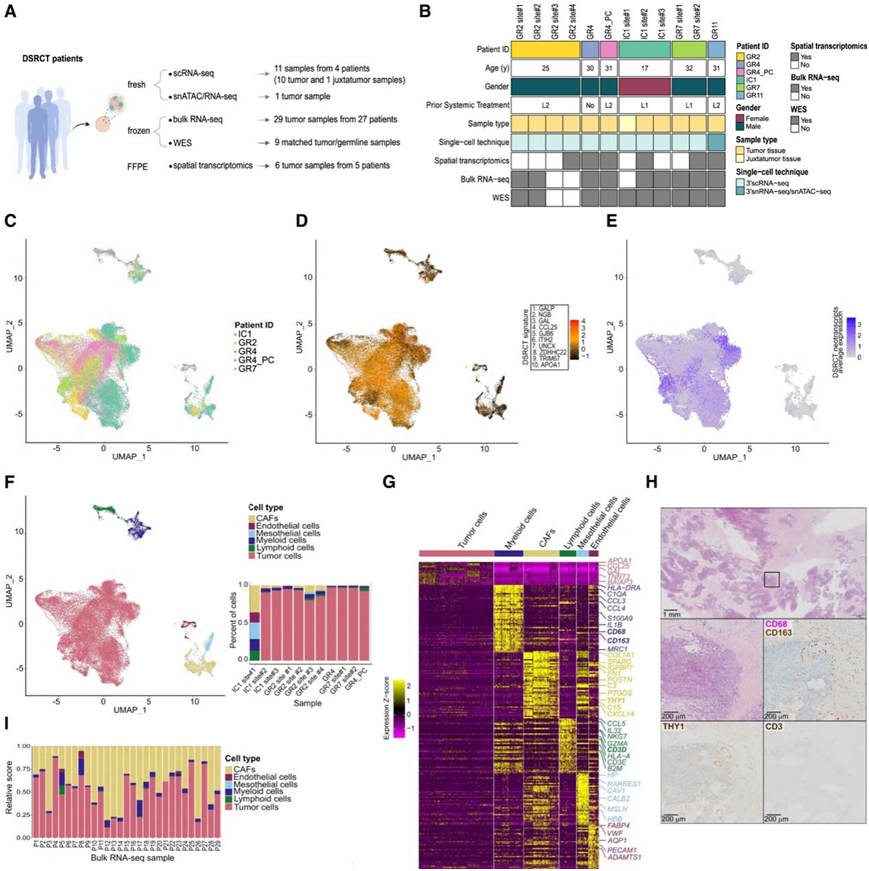
图1. scRNA-seq 重现 DSRCT 细胞组成。
(A) DSRCT 的单细胞多组学分析。(B) 患者和样本特征。(C) UMAP显示Int_sc数据集来源样本。(D) UMAP 显示 DSRCT 特征分数。(E) UMAP 显示 DSRCT 新转录本表达。(F) UMAP(左图)和条形图(右图)突出显示了 DSRCT 细胞亚群。(G) 热图显示Int_sc细胞类型前 50 个 DEG 的表达Z分数。(H) THY1、CD68/CD163 和 CD3 的 H&E 和 IHC 染色。(I)DSRCT bulk RNA-seq 细胞亚群反卷积分析。
02
DSRCT 肿瘤细胞具有特定的谱系和代谢相关状态
他们首先专注于剖析肿瘤细胞异质性,在个体和Int_sc数据集中使用基于基因表达的聚类。由于观察到数据集之间识别出的聚类具有高度一致性(来自个体患者和同步不同肿瘤部位),这由几乎每个Int_sc聚类都包含来自每个样本的细胞这一事实证实,他们进一步关注Int_sc数据集(图 1 C,图2 A)。
他们描绘出 13 个肿瘤细胞聚类(图 2 A):六个谱系相关聚类、两个代谢相关聚类和五个伪稳态相关聚类。谱系相关聚类包括(1)一个多谱系分化聚类(Multidiff_ASCL1 - 0),其特征是多谱系基因表达和原神经ASCL1标记基因;(2)两个间充质聚类(Mesenchymal_fibrosis - 8和Mesenchymal_secretion -11),分别由CHI3L1 / IQCG / IGFBP5 /ACTA2和CCK / TNNT3 / PTGDS的过表达定义;(3)一个上皮聚类(Epithelial_mesenchymal - 4),同时表达上皮(例如CLDN3 / CDH1 / MUC16)和间充质(例如MB / ACTA2)标记物;(4) 两个神经/神经元相关聚类:一个神经元/神经元聚类 (Neural_neuronal - 1)过表达IFI6 / LY6H / NTRK3,一个神经干细胞聚类 (Neural_stem - 19) 表达CCER2 / NES / ELAVL3/4 (图 2 A-B)。这两个代谢聚类包括(1)代谢糖酵解- 5,显示参与无氧糖酵解或 Warburg 效应的基因高表达(例如,ENO1/ENO2 / LDHA / NDUFA4L2);(2)代谢_丝氨酸-15,过表达参与丝氨酸代谢的基因(例如PSAT1 / ASNS / PHGDH)和氨酰基-tRNA 合成酶基因(例如YARS / CARS / GARS)(图 2 B)。
他们确定了另外五个聚类,称为“伪稳态”,与细胞周期或生物学相关性不确定的通路有关。后者包括 (1) 一个循环细胞聚类(循环细胞- 3),表达TOP2A/MKI67 / TYMS;(2) 两个表达编码核糖体蛋白的基因的聚类(核糖体分解代谢 - 2和核糖体干扰素反应 - 6);(3) 两个长链非编码 RNA (lncRNA) 富集聚类(Lnc_1 - 7 和 Lnc_2-17),过表达在癌症中经常上调的 lncRNA(例如MEG3 / XIST / GRID2 / MALAT1)(图2A-B)。
当关注同一患者化疗前后产生的GR4和GR4_PC样本时,他们观察到细胞群转录组特征的性质总体稳定,但是每个聚类的相对比例可能有所不同(例如属于循环细胞- 3和核糖体分解代谢- 2聚类的细胞增加(图2A)。
接下来,为了探索每个Int_sc聚类内的功能通路激活 ,他们进行了基因集富集分析 (GSEA)(图 2C),发现谱系和代谢相关通路显著富集,与之前确定的聚类的标记基因(图 2B)和其他谱系(如成肌细胞状态)相对应。有趣的是,LncRNA聚类在富集了RNA 剪接通路,这可能与 EWSR1 RNA 和 SWI/SNF 结合能力有关。
共表达基因模块的研究进一步支持了可塑性转录状态的假设(图2D)。他们确定了三个主要模块配置文件。第一类模块在神经(Neural_neuronal - 1, Neural_stem - 19)和Mesenchymal_fibrosis – 8聚类(例如模块9、8、4、5、6和1,分别富含lncRNA、神经-相关基因、细胞骨架-相关基因、干扰素反应-相关基因、转录调节和翻译相关基因)中均有高表达。相比之下,第二类模块仅在一个或两个聚类中高度激活。例如,模块 7 在上皮发育和细胞粘附(例如GJB2 / CCL25 / ITIH5 )中富集,在Epithelial_mesenchymal-4和Lnc_2 – 17聚类中特异激活;模块 13 由糖酵解相关基因(例如LDHA / GAPDH / ENO1)定义,特定于Metabolic_glycolysis – 5。第三个模块类别显示出对Int_sc聚类的有限变异性或特异性。总体而言,基因模块和DEG衍生聚类之间的变量相关性表明共调节因子在微调共有或特定转录程序的表达方面具有潜在作用。
上述结果表明,DSRCT具有转录驱动的可塑性。为了支持这一点,他们探索了遗传改变对肿瘤细胞异质性的贡献。他们从scRNA-seq中推断出拷贝数变异(CNV),并发现与匹配的WES高度一致(图2E-F)。他们发现罕见的已鉴定的CNV在每个样本的单细胞聚类中高度一致,从而加强了DSRCT细胞异质性来自转录可塑性而不是体细胞遗传(亚)克隆进化的假设。EWSR1::WT1在不同癌细胞中的表达变化有限,并且与DEG衍生的聚类无关,这表明在DSRCT肿瘤细胞异质性中的作用有限。通过免疫组织化学(IHC)分析,他们发现,WT1作为EWSR1::WT1的替代标记物,AE1/AE3、Desmin (DES)和CD56在肿瘤细胞中的表达是异质的(图2G)。总的来说,这表明除了EWSR1::WT1表达水平之外的因素,如可变的EWSR1::WT1活性、dna结合位点或染色质可及性的波动,都可能影响DSRCT的多表型分化。
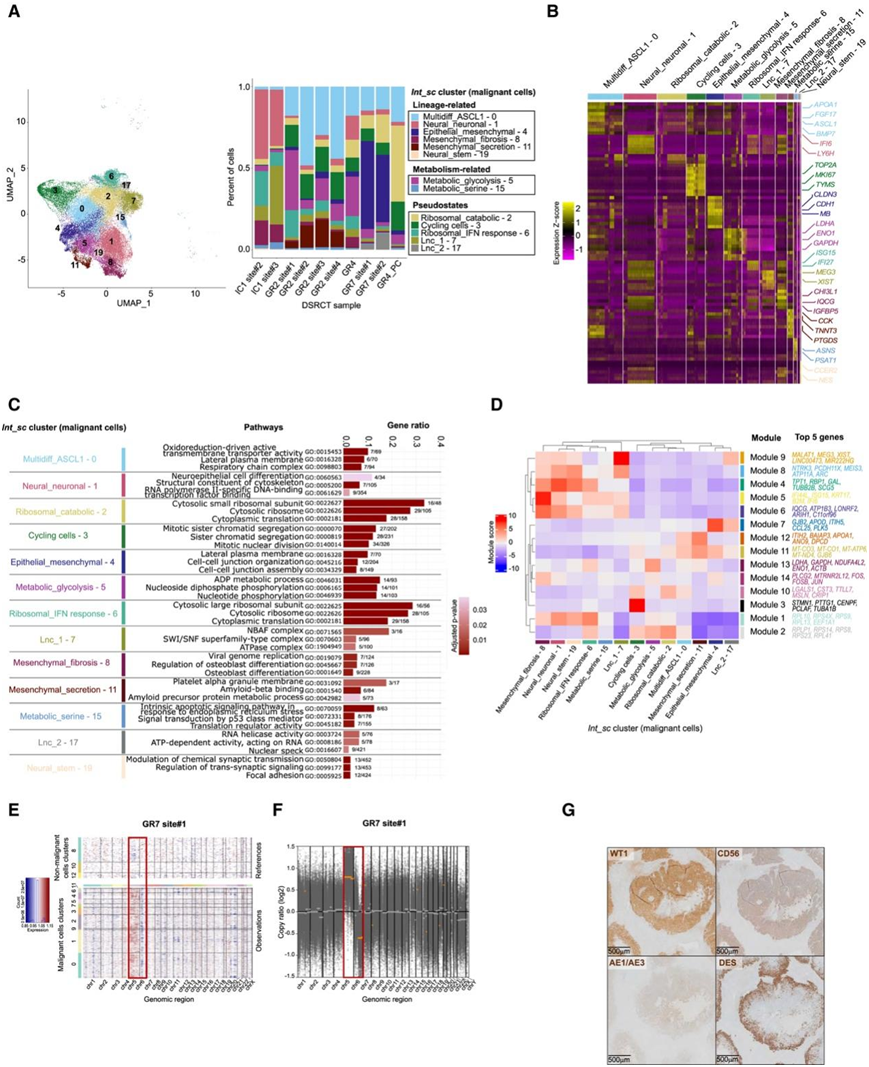
图2. DSRCT恶性细胞表现出多向分化和代谢状态异质性。
(A)UMAP(左图)和条形图(右图)突出显示单个数据集中的 DSRCT 恶性细胞聚类。(B) 热图显示每个 DSRCT 恶性细胞聚类前 50 个 DEG 的表达Z分数。(C) DSRCT 恶性细胞聚类中前 3 个通路。(D) HotSpot 共表达基因模块的层次聚类。(E)单细胞水平拷贝数变异 (CNV) 推断。(F)对 GR7 位点#1 进行 WES 衍生的 CNV 分析。(G) DSRCT 样本上 WT1、AE1/AE3、DES 和 CD56 的代表性 IHC 染色。
03
染色质景观塑造 DSRCT 细胞异质性
接下来,为了研究 EWSR1::WT1 依赖的染色质可及性调节与 DSRCT 转录异质性之间的联系,他们进一步对新鲜肿瘤样本 (GR11) 进行了单细胞多组学分析(snMultiome-seq)(图 1 A-B,图3 A)。通过结合基因表达和 ATAC 特征进行加权最近邻 (WNN) 聚类,确定了 13 个聚类(图 3 A)。与Int_sc数据集相比,DGE和峰富集分析都不能精准识别出之前描述的scRNA-seq聚类,除了WNN_cluster 9、WNN_cluster 4和WNN_cluster 3/11/12,它们的标记基因/峰分别代表非恶性细胞、线粒体基因富集聚类和循环细胞。使用内含子读数(“Int_sc_intron”数据集)将来自3 ' scRNA-seq参考数据集的聚类注释转移到snMultiome数据集上,可以更好地将snMultiome聚类与先前定义的细胞状态关联起来。虽然几个 WNN 聚类与单个Int_sc聚类紧密相连(例如WNN_cluster 3/11/12和Int_sc 循环细胞-3、WNN_cluster 5和Int_sc 代谢_糖酵解-5、WNN_cluster 10和Int_sc 间充质_纤维化-8),但其他成对对应关系不那么简单(图 3C)。
接下来,他们分析了恶性和非恶性细胞之间差异可及峰(图 3D)。恶性细胞中富集的基序与之前确定的 EWSR1::WT1 结合基序相对应,包括 EGR1/EGR3/SP2/ZNF263。非恶性细胞主要富集 FOS/JUN 和 BATF 基序(图3D),有趣的是,这与 EWSR1::WT1“off”ATAC 峰数据集中富集的基序相关。
为了在 snMultiome 数据集中探索 EWSR1::WT1 对染色质可及性的影响是否会影响 DSRCT 肿瘤细胞异质性,他们首先关注EWSR1::WT1 “on” ATAC 峰集,从中获得了 EWSR1::WT1 染色质可及性特征得分。WNN_cluster 5(标记为无氧糖酵解通路富集聚类)和 WNN_cluster 10 (标记为促纤维化间充质聚类)在恶性细胞中显示出最低的 EWSR1::WT1 染色质可及性特征得分(图 3E)。这与使用 EWSR1::WT1 ChIP-seq 结合峰数据集获得的数据一致(图 3F),他们从中同样获得了 EWSR1::WT1 靶向位点特征。
接下来,他们整合了 EWSR1WT1 沉默后 JN-DSRCT-1 细胞系的 RNA-seq 和 ChIP-seq 数据,以定义用作 EWSR1::WT1 TF 活性替代物的特定 EWSR1::WT1 调节子,确定了 66 个基因组区域,这些区域对应于 53 个独特基因,这些基因对应于 EWSR1::WT1 的直接靶标,其表达在沉默后显著降低(图3G)。正如预期的那样,EWSR1::WT1 调节子活性评分在肿瘤微环境 (TME) 细胞中几乎检测不到,而在肿瘤细胞中则显著较高(图 3 H-I)。
谱系相关的Epithelial_mesenchymal -4、Mesenchymal_secretion-11 、 Neural/neuronal-1、Multidiff_ASCL1-0和Neural_stem-19聚类的得分最高(图 3 H-I)。相比之下,伪稳态、代谢相关(Metabolic_glycolysis-5、Metabolic_serine-15)和促纤维化间充质(Mesenchymal_fibrosis-8)聚类的 EWSR1::WT1 调节子活性最低(图 3 E-F)。
总体而言,这些数据支持 EWSR1::WT1 活性有助于塑造 DSRCT 细胞状态:虽然高 EWSR1::WT1 活性(EWSR1::WT1high)与大多数多谱系分化状态有关,但低 EWSR1::WT1 TF 活性(EWSR1::WT1low)与以特定代谢(例如无氧糖酵解)或促纤维化间充质特征为特征的细胞状态相关。
接下来,他们使用 SCENIC推断增强子驱动的基因调控网络。当在整个snMultiome数据集或仅在恶性细胞中探索调控时,确定了337和341个活性转录因子(tf),其中253和226个是激活因子(即与染色质可及性增加相关)。肿瘤细胞中的激活因子调控结果与基于基序的分析一致(图3J)。在厌氧糖酵解(WNN_cluster 5)、间质纤维化(WNN_cluster 10)和循环细胞(WNN_cluster 3/11/12)聚类中检测到较低的EWSR1::WT1调控活性,这与Int_sc数据集中发现的EWSR1::WT1low细胞状态一致(图3I)。
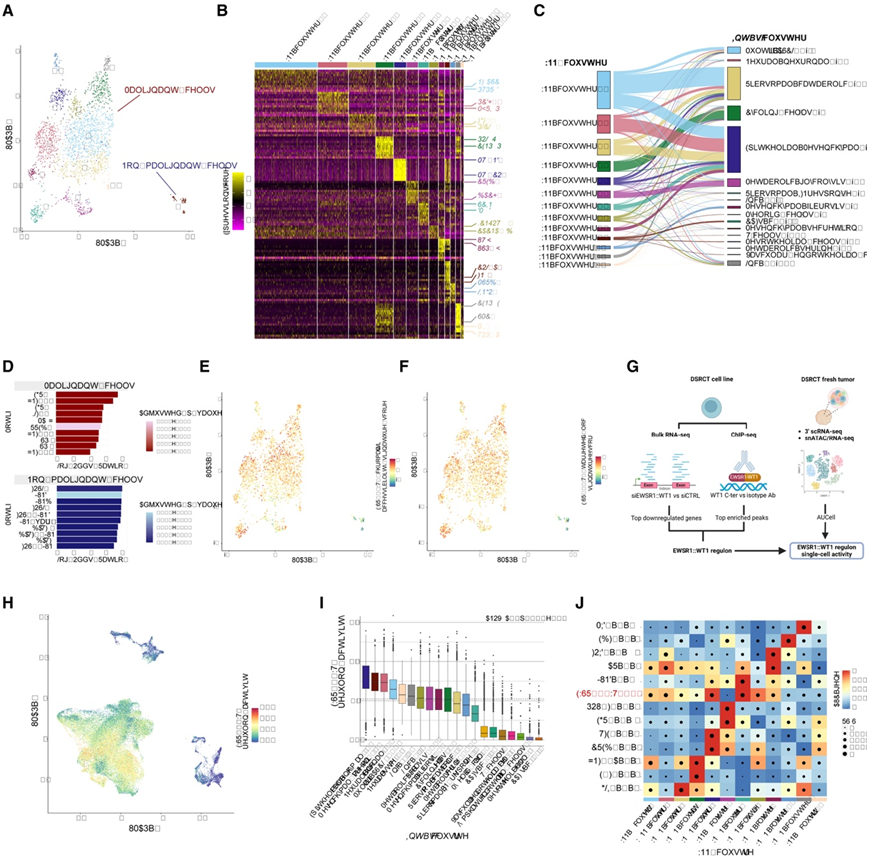
图3. EWSR1::WT1 活性和表观遗传重编程是 DSRCT 异质性的决定因素之一。
(A) GR11 样本 snMultiome WNN 聚类的 UMAP。(B) 热图显示WNN snMultiome 聚类中前 10 个 DEG 的表达Z分数。(C) WNN snMultiome 数据集上Int_sc聚类的特征转移。(D) 条形图显示恶性细胞和非恶性细胞中前 10 个富集基序。(E) UMAP 显示 snMultiome 分析中的 EWSR1::WT1 染色质可及性特征分数。(F) UMAP 显示 EWSR1::WT1 靶向基因座特征分数在 snMultiome 分析中。(G) 单细胞 EWSR1::WT1 调节子活性推断的图形表示。(H) UMAP 显示Int_sc数据集中的 EWSR1::WT1 调节子活性。(I)箱线图表示每个Int_sc聚类的 EWSR1::WT1 调节子活性。(J) 热图点图显示由调节子特异性评分 (RSS) 定义的最特异性调节子的基因 AUC。
04
DSRCT 微环境表现出免疫耐受特征
接下来,他们研究了来自 TME 的肿瘤细胞外部刺激是否也能塑造 DSRCT 异质性。总体而言,免疫细胞群稀少,仅占Int_sc数据集中分析的细胞的 6%(图 1 F-I,图4 A)。髓系细胞是主要亚群,占Int_sc数据集中所有免疫细胞的 63%(图 1 F)。使用 MoMac-VERSE 图谱进一步对髓系亚群进行反卷积,鉴定出大多数巨噬细胞和少数单核细胞和树突状细胞 (DC)(图 4 A)。占主导地位的髓系亚群具有致瘤性,具有 M2 巨噬细胞特征,包括 HES1(27.7%)、DC 样(11.9%)、TREM250(11.9%)以及 FTL53(11.7%)巨噬细胞或炎症单核细胞(IL1B/VEGFA 阳性)(8%)。对于淋巴亚群,他们根据 DGE 分析和已知的典型标记物确定了七个聚类(图4A)。鉴定出最丰富的细胞类型是 CD4 +记忆 T 细胞(24.3%),过表达CD4 / CD40LG / CD44 / IL7R(CD4 + 记忆 T 细胞-0聚类),其次是 CD8 +细胞毒性效应 T 细胞(23.1%,即所有Int_sc细胞的 0.6%),过表达CD8A+ / GZMB+ / GZMK+ / GZMA+ / GZMH +(CD8 + 效应 T 细胞-1)。淋巴样细胞表达谱显示免疫检查点如PDCD1(编码 PD-1)、HAVCR2(编码 TIM-3)或LAG3表达较低。
接下来,他们重点关注 CAF。初始Int_sc数据集聚类确定了两个 CAF 亚群,主要来自肿瘤组织样本和 IC1#1 肿瘤旁腹膜样本(图 1C-F,图4B)。进一步的 CAF 亚群聚类定义了七个不同的 CAF 亚群,根据标记基因手动注释这些亚群并建立了 CAF 典型标记(图4B-D)。CAF 亚群主要存在于肿瘤旁样本中(CD34/MYC 成纤维细胞 - 0、脂肪成纤维细胞 - 3、外膜成纤维细胞 - 7),炎症性 CAF - 6过表达补体途径基因(例如C7)和组成性脂滴蛋白PLIN2。CD34/MYC 成纤维细胞 - 0还含有前脂肪细胞/脂肪细胞干细胞标志物(例如SCARA5 / APOD / CXCL14),而外膜成纤维细胞 - 7也表达PI16 / CD55 / CD248,类似于血管微环境内发现的外膜基质细胞,可产生细胞外基质(图 4C-D)。
与已知的DSRCT特异性结缔组织增生基质一致,结缔组织增生相关基因(如MMP2/COL1A1/LOX/LOXL1/VEGFB)在所有CAF亚群中均高表达(图4E)。CAF 亚群大多具有免疫抑制特征,包括 T 细胞排斥标记物(例如MRC263)和 M2 巨噬细胞极化信号。炎症性CAF– 6进一步显示出参与髓系抑制细胞募集的基因的高表达,包括CCL2 / CXCL2 / CXCL8(图 4 E),最丰富的亚型是纤维增生性 CAF- 1和肌成纤维细胞 CAFs- 4(图 4 F)。
他们进一步通过 IHC 对八个 DSRCT 样本上的三种传统 CAF 标记物 MCAM、FAP 和 ACTA2(别名 αSMA)进行了表征(图4G)。MCAM+ CAF 位于血管周围,支持其周细胞样 CAF - 5特征。有趣的是,ACTA2high/FAPlow/MCAM- CAF 可能对应于肌成纤维细胞 CAF - 4,主要存在于肿瘤细胞胰岛之间或周围。相比之下,FAP high CAF(最有可能是促纤维增生性 CAF - 1)优先位于促纤维增生性基质和假包膜的突出小梁内(图 4G)。位于假包膜内的 CAF 中的 FAP/ACTA2 荧光比率也明显高于位于促纤维化区域或肿瘤细胞胰岛周围的 CAF 中的 FAP/ACTA2 荧光比率。
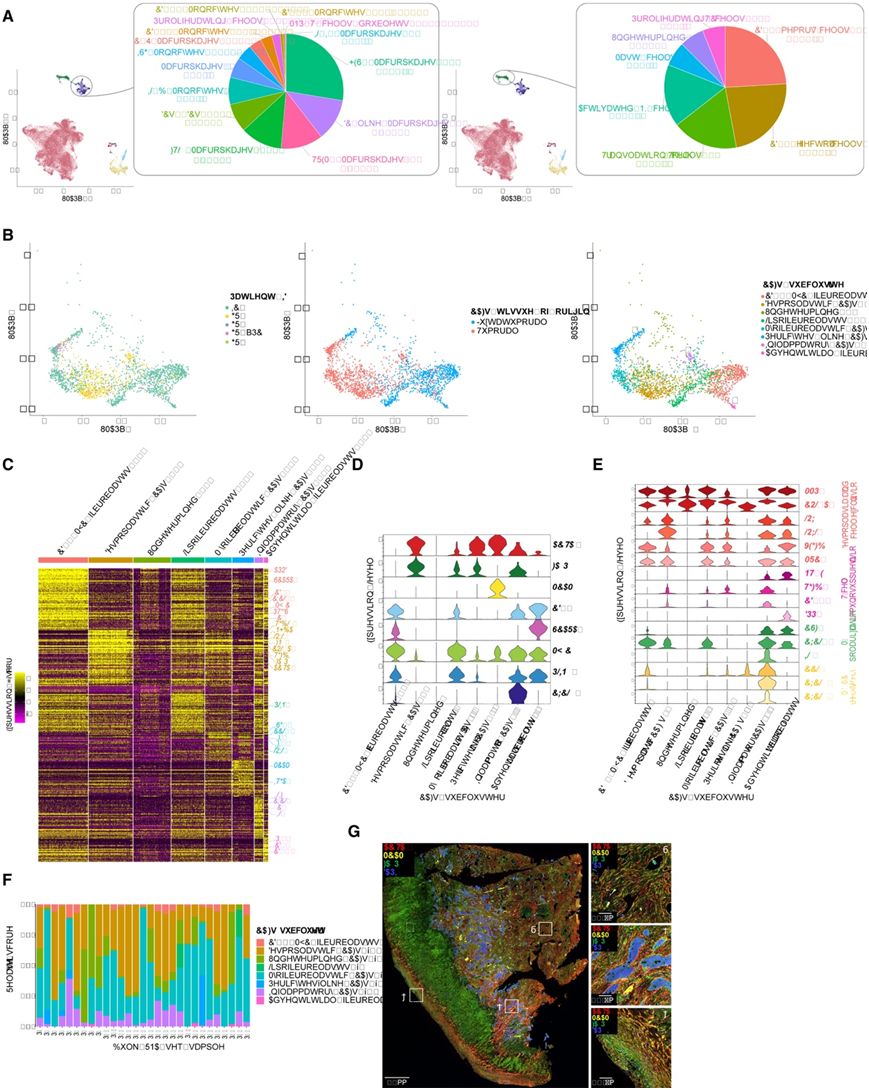
图4. DSRCT 微环境表现出免疫抑制特征和不同的 CAF 亚群。
(A)以饼图表示的Int_sc浸润性髓系(左图)和淋巴系(右图)亚群比例。(B) UMAP 图根据患者 ID(左)、来源组织(中)和子聚类(右)显示 CAF。(C)热图突出显示CAF亚聚类前 50 个 DEG 的表达Z分数。(D) 小提琴图显示了典型标记的CAF 亚聚类的表达谱。(E) 小提琴图显示免疫抑制标记的CAF亚群的表达谱。(F) DSRCT bulk RNA-seq CAF 亚群反卷积分析。(G)免疫荧光染色。
05
DSRCT 表型和代谢状态具有特定的空间分布
他们进一步在空间层面上表征 DSRCT 细胞亚群的异质性,并首先通过免疫荧光 (IF) 评估先前确定的恶性细胞和感兴趣的 CAF 标记物。在某些 DSRCT 样本(例如 GR2)中,DES/CHI3L1 表达仅限于肿瘤细胞胰岛的外围、THY1+ CAF 附近、侵袭性肿瘤前沿(图 2G,图5A),或位于促纤维化基质区域内的稀疏肿瘤细胞中。有趣的是,相应的 scRNA-seq 数据(图 5B)显示后者对应于间充质 DSRCT聚类(GR2 Mesenchymal_TNNT3-5、Mesenchymal_DES-9、Neuronal_mesenchymal-13和Mesenchymal_stem-14聚类),表达CHI3L1、DES、TNNT3和MSLN(图 5B)。根据这些发现,从 scRNA-seq 数据推断 DSRCT 肿瘤细胞与 CAF 之间的细胞间相互作用发生在CAF和间充质肿瘤细胞聚类之间(图5C)。
为了进一步探索肿瘤细胞状态与空间组织之间的关系,他们使用 Visium平台 对六个 scRNA-seq 匹配样本进行了空间转录组学分析(图 1 A-B)。通过应用斑点聚类和 DGE 分析,一致发现先前定义的基质区域(即增生区域、样本上存在的肿瘤假包膜和血管周围基质)以不同的斑点聚类为特征。在 GR2 位点#4 样本中,除了以血管周围 CAF 标志物(例如THY1、PDGFRB)和内皮细胞(例如ESM1)表达为特征的血管周围基质聚类(即Strom_endothelial cells-9)(图 5D-E)之外,还在促纤维化区域内发现了几个聚类,表明细胞外基质组成(Strom_SFRP4/LUM -6聚类中LUM、TIMP3和MMP9过表达)、M2 浸润( Strom_M2 – 1聚类中CD68过表达)或免疫抑制信号(Strom_C3/TGFβ1-7聚类中C3和TGFBI过表达)存在空间异质性(图5D-E)。他们还系统地鉴定了过表达编码组蛋白的转录本的肿瘤聚类,主要位于肿瘤细胞胰岛内。这些肿瘤点在空间上与富含间充质特征(例如,DES / CHI3L1 / TNNT3 / MSLN)和/或糖酵解特征(例如,ENO1 / ENO2 / LDHA)的肿瘤点不同,后者位于肿瘤细胞胰岛的边缘或侵袭前沿内(图 5D-G),这与之前的研究结果一致(图 5A),而具有间充质和/或糖酵解特征的肿瘤细胞位于富含缺氧的区域内。
有趣的是,他们观察到 (1) 缺氧和糖酵解 HALLMARK 特征与 (2) EWSR1::WT1 调节子活性以及氧化磷酸化 HALLMARK 特征(程度较弱)之间存在空间负相关性(图 5G-H),这表明位于胰岛中心的 DSRCT 肿瘤细胞表现出最高的 EWSR1::WT1 活性和增殖能力,可能依赖于氧化磷酸化,而位于基质内或基质旁边的细胞则表现出间充质和/或无氧糖酵解特征,这些特征可能至少部分由纤维增生引起的缺氧驱动。令人惊讶的是,当通过 IF 评估 DSRCT 球体上结蛋白 (DES) 间充质标志物的表达时,观察到结蛋白染色仅限于球体外围,而 WT1 染色是均匀的。这一临床前发现与之前对患者样本的观察结果一致(图 2 G ,图5 A),并表明 EWSR1::WT1 依赖性(图3H-I) 和非依赖性信号都可能影响一些谱系相关标志物的表达。
这些结果表明,DSRCT 异质性是由与分化通路特别相关的细胞内在机制和与无氧糖酵解特别相关的细胞外部微环境刺激共同造成的。
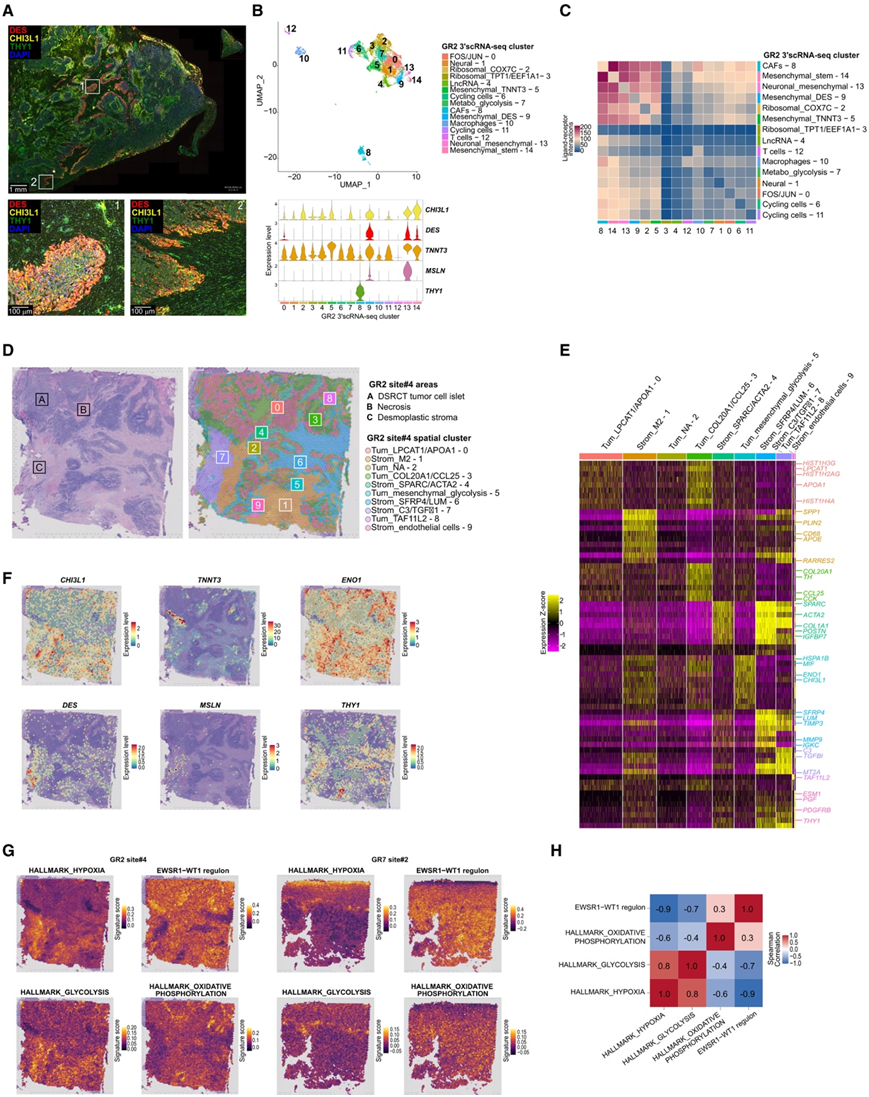
图5. DSRCT 异质性与肿瘤空间组织相关。
(A) 免疫荧光染色突出显示 GR2 样本上的间充质 DSRCT 肿瘤细胞 (DES+ 和/或 CHI3L1+)和 CAF (THY1+)。(B) UMAP 显示 GR2 3′ scRNA-seq 聚类(上),小提琴图(下)显示肿瘤细胞间充质标志物CHI3L1、DES 、 TNNT3和MSLN 的表达。(C) GR2 样本中细胞聚类之间的配体-受体相互作用,代表所有样本。(D)用于 Visium 检测的 GR2 位点#4 样本注释的 H&E 染色载玻片以及斑点聚类的空间表示。(E) 热图突出显示了GR2 位点#4 的Visium 分析中斑点聚类中前 10 DEG 的表达Z分数。(F)使用 Visium 分析法对 GR2 位点#4 样本中的CHI3L1、TNNT3、ENO1、DES、MSLN 和 THY1表达水平进行空间表示。(G) GR2 位点#4 和 GR7 位点#2 样本中 HALLMARK_HYPOXIA、GLYCOLYSIS、OXPHOS 和 EWSR1::WT1 调节子的空间基因特征得分。(H) Visium 检测中基因特征与 EWSR1::WT1 调节子之间的 Spearman 相关系数中位数。
06
DSRCT 异质性与预后相关
在探索了 DSRCT 肿瘤内异质性之后,他们试图探究患者间异质性以及两者之间的潜在联系。他们对DSRCT bulk RNA-seq队列中的Int_sc肿瘤细胞聚类进行了反卷积。除神经干细胞-19 外,所有单细胞聚类均可在所有样本中反复识别(图 6 A)。
DSRCT 的bulk RNA-seq数据的层次聚类确定了三个亚组(图 6 B)。第 3 组(其标记基因为GABRA1、ZIC3和IGF2BP1)与第 1 组或第 2 组之间的 DGE 分析显示,编码组蛋白的基因(例如H3C15/HIST2H3A、H3C8/HIST1H3G)、染色质重塑因子(例如CENPA、ANO9)和细胞周期激活因子(例如AURKB)富集。第 2 组中显著上调的基因(其中大多数 DEG 是ARX和MIR202 ),与第 1 组相比,主要富集在(1)上皮细胞分化(例如NOG、CDH3、CCL2)、细胞粘附和细胞外基质成分(例如CLDN18、COL26A1、EMID1)、抗原结合(例如IGHV3-30、SLC7A5、IL7R)和淋巴细胞活化(例如CD19、CD22);(2)与第 3 组相比,主要富集在上皮细胞分化(例如KRT80、CDH1、KRT17)、细胞粘附和细胞外基质成分(例如CLDN18、EMILIN3、COL6A5、FBLN1)、细胞因子活性(例如CCL28、CCL14、CCL18、IL10)以及对激素和外来化合物刺激的反应(例如ADH1B、ADH1C、FOXA1、FOS、JUN)。最后,与第 2 组相比,第 1 组富含参与翻译抑制的 microRNA(例如MIR148B、MIR326、MIR503),而与第 3 组相比,其通路没有显著的富集,表明这些亚组之间的异质性有限。尽管如此,这些亚组对总体生存期 (OS) 具有显著的预后价值:第 3 组患者的 OS 最差,而第 1 组和第 2 组分别为 24 个月和 27 个月(图6C)。
他们评估了来自 DSRCT 或其他肉瘤亚型的bulk RNA-seq数据中每个特征的表达分数。总体而言,与伪稳态(例如循环细胞 - 3)或代谢相关状态(代谢糖酵解 - 5)相关的特征不是组织型特异性的(图 6 D)。相比之下,与谱系相关的特征(Multidiff_ASCL1 - 0、神经神经元 - 1、上皮间充质 - 4、间充质纤维化-8和间充质分泌-11),对 DSRCT 表现出一定的特异性(图 6 E)。随后,他们通过 Kaplan-Meier 分析评估了 DSRCT bulk RNA-seq队列中每个特征的预后意义。作为阳性对照,较高的循环细胞 - 3特征(包括TOP2A、MKI67、TYMS和CDK1)得分与更差的结果显著相关(图6D)。
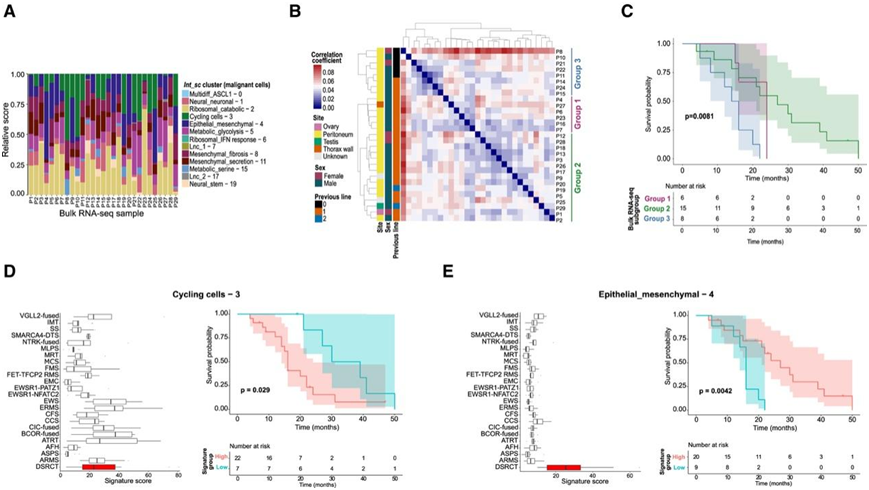
图6. DSRCT 显示患者间异质性,scRNA-seq 衍生的基因特征定义了 DSRCT 患者的预后。
(A)bulk RNA-seq Int_sc聚类反卷积分析。(B) bulk RNA-seq 样本层次聚类突出显示三个不同的亚组。(C)根据 DSRCT bulk RNA-seq 层次聚类绘制的 Kaplan-Meier 总体生存图。(D-E) 细胞特征评分的特异性和预后意义。
+ + + + + + + + + + +
结 论
本项研究对来自五名患者的 12 个样本进行单细胞多组学分析,发现 DSRCT 肿瘤细胞聚集成一致的亚群,其中谱系和代谢相关转录程序部分重叠。体外建模表明,与糖酵解和促纤维化状态相反,高 EWSR1::WT1 DNA 结合活性与大多数谱系相关状态相关。单细胞染色质可及性分析表明,EWSR1::WT1 结合位点变异性可能驱动不同的谱系相关转录程序,从而支持一定程度的细胞内在可塑性。空间转录组学显示,糖酵解和促纤维化状态专门定位在肿瘤细胞胰岛外围的缺氧环境中,这表明肿瘤细胞外部微环境线索还发挥着额外作用。最终确定了与患者生存率提高相关的单细胞转录组学衍生上皮特征,突出了本项研究结果的临床相关性。
+ + + + +



 English
English


