文献解读|Genome Med(10.4):空间多组学揭示了与人类肝细胞癌癌症干细胞相关的成纤维细胞亚群
✦ +
+
论文ID
原名:Spatial multiomics reveals a subpopulation of fibroblasts associated with cancer stemness in human hepatocellular carcinoma
译名:空间多组学揭示了与人类肝细胞癌癌症干细胞相关的成纤维细胞亚群
期刊:Genome Medicine
影响因子:10.4
发表时间:2024.08.13
DOI号:10.1186/s13073-024-01367-8
背 景
癌症相关成纤维细胞 (CAF) 是肿瘤微环境 (TME) 中的主要细胞类型,并且已在各种肿瘤中发现了 CAF 亚群。然而,CAF 如何在空间上调控肝脏 TME 内的其他细胞群以促进癌症进展仍不清楚。
实验设计
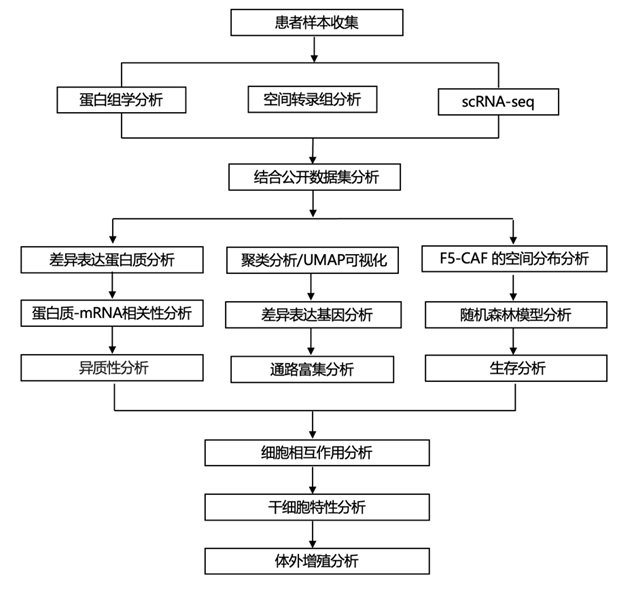
结 果
01
肝癌肿瘤基质的功能多样性和异质性
研究团队从东方肝胆外科医院 (EHBH) 接受手术切除的原发性肝癌(PLC)患者中获取了样本。他们选择了 6 名患者的福尔马林固定石蜡包埋 (FFPE) 组织进行蛋白质组学分析,选择了 11 名患者的新鲜 PLC 组织进行空间转录组学(ST)分析,选择了 5 名患者的新鲜肿瘤组织进行原代细胞分离(图1A)。主成分分析(PCA)显示不同样本组间存在显著差异(图1B)。在肿瘤实质 (T-P) 和非肿瘤实质 (N-P) 之间共鉴定出 997 个差异表达蛋白(DEP)(图1C)。GO分析显示T–P 中代谢相关通路下调、增殖/生长相关通路上调(图 1 C)。总共 312 个 DEP 可将肿瘤基质 (T-S) 与非肿瘤基质 (N-S) 区分开来(图 1 C)。T-S 中上调的蛋白质(COL11A1、POSTN、EFEMP2、COL4A1、CSPG2、FGL2、SRP14、TGFB1、STAT2 等)可能介导 ECM 重塑、细胞粘附、基质增殖、细胞通讯和信号传导。312 个 DEP 的通路富集表明,T–S 中的内吞作用、形态发生、伤口反应、血管生成和整合素通路活性高于 N-S。这些结果表明,基质在肝癌中也经历了重要的功能变化。
除了之前从 7 名患者(队列 2)中获得的 21 个 ST 样本外,他们还从另外 4 名患者中补充了 4 个 ST 作为队列 1(图 1 A)。有 96 个蛋白质和 mRNA 表达水平在 T–S 和 N–S 之间存在显著差异。大多数(81 个基因)在两个组学数据中表现出一致的上调或下调(图 1 D),蛋白质和 mRNA呈正相关性。为了定量基质区域内的转录组异质性,他们计算了配对点表达谱之间的 Pearson 距离。与 N-S 相比,T-S 表现出明显更大的 Pearson 距离和更大的异质性(图1E)。通过 Pearson 距离对 T-S 点进行聚类比 N-S 点聚类产生的聚类更多,表明肿瘤基质的功能更复杂、更多样化(图 1 E)。
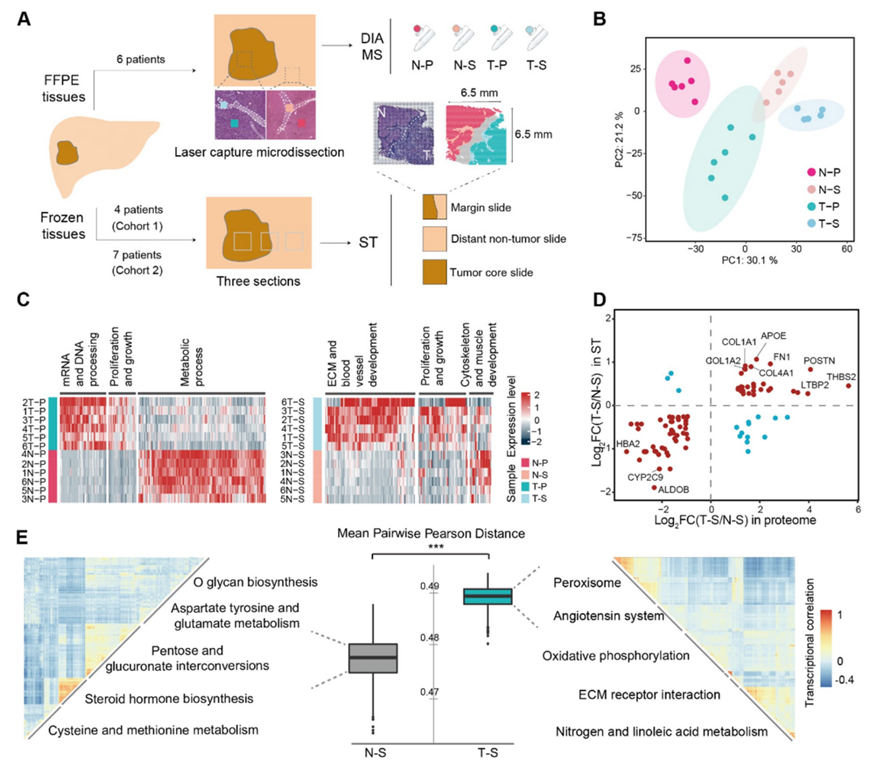
图1. 蛋白质组学和ST分析揭示人肝癌肿瘤基质的功能多样性和异质性。
(A)实验流程。(B) 所有样本蛋白质定量的主成分分析。(C) 不同组织中实质细胞(左)和基质细胞(右)的差异表达蛋白质及其相应的功能。(D) 蛋白质组学和ST数据中 T-S 和 N-S之间差异基因调控程度比较。(E) 不同区域基质点的异质性。
02
肝癌中成纤维细胞的功能多样性
接下来,他们进一步使用 ST 数据研究了 PLC 的细胞组成,生成 7 个稳健的聚类(图2A)。这些聚类具有高的标记基因表达值和较高比例的主要细胞类型(图2B)。正常肝细胞(ALB +)特异性地映射到非肿瘤组织;恶性细胞优先位于肿瘤区域,包括 HCC 患者中富集的恶性肝细胞(GPC3 +)和 ICC 患者中富集的恶性胆管细胞(KRT7 +和KRT19 +);非实质细胞包括成纤维细胞(COL1A1 +)、巨噬细胞(CD68 +)以及 NK 细胞、T 细胞和 B 细胞的混合物(图 2 B)。
为了探索不同空间位置的成纤维细胞,所有 5803 个成纤维细胞富集点根据空间位置分为三组(图 2 C-D):3160 个位于肿瘤组织内(T-F),1478 个位于非肿瘤组织(N-F),1165 个位于肿瘤界面区域(I-F)。T-F 表现出POSTN、NTS(参与代谢和免疫调节)和DLK1(细胞生长调节因子)表达升高,并上调血管生成和代谢相关通路(图2E)。N-F 表现出补体激活和小分子生物合成过程等功能通路富集(图2E)。I–F显示TAGLN(参与平滑肌收缩)和CRP(早期炎症和感染的生物标志物)表达上调(图2E)。这些结果显示肝脏 TME 内的成纤维细胞之间存在相当大的功能差异,表明 T–F和 I–F 中的功能改变与 N–F 中的功能改变明显不同。
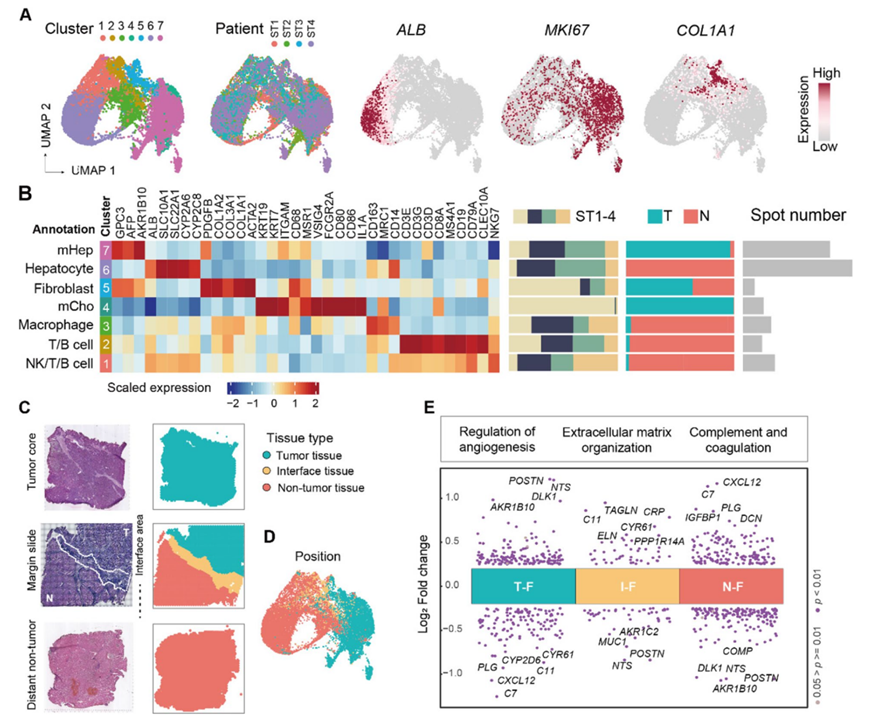
图2. ST 分析揭示的成纤维细胞功能多样性和异质性。
(A)UMAP可视化。(B)可变基因的表达分析。(C) H&E 染色分析和斑点相应的空间位置分析。 (D) 按位置标记的 ST 点的 UMAP 可视化。(E) 差异基因表达分析。
03
鉴定具有不同转录谱的 CAF 亚群
为了进一步研究肿瘤细胞周围成纤维细胞的特殊性,他们探索了是否存在特异性地在肿瘤组织中富集的成纤维细胞亚型。重新聚类将5803个成纤维细胞富集点分成7个亚群(F1-F7)(图3A)。除最小聚类F7外,其余6个聚类出现在大多数患者样本中。空间分布显示,F1、F2和F6在肿瘤/非肿瘤区域富集;F4在非肿瘤区域显著富集;与非肿瘤区域相比,F3和F5在肿瘤内/肿瘤界面区域显著富集(图3B)。细胞轨迹分析显示F5位于终端,分化潜能较弱(图 3 A)。
他们随后使用另外 14 名 PLC 患者的公开单细胞转录组(scRNA-seq) 数据来解析 ST 识别的成纤维细胞聚类。scRNA-seq 数据中的 1800 个成纤维细胞保留下来,并同样分配给六个成纤维细胞亚群(图 3 C)。四个亚群(TAF1–TAF4)在肿瘤组织中的数量多于非肿瘤组织,而另外两个亚群(NAF1 和 NAF2)在非肿瘤组织中更丰富。F5 和 TAF4 之间存在相似性(图3 D)。标记基因和功能表征的比较表明 F5 和 TAF4 之间存在更密切的相关性。一些在肿瘤基质蛋白质组学数据中高度表达的胶原基因,即COL1A1、COL1A2、COL3A1和COL4A2,在 TAF4和 F5中也高度表达(图 3 E)。F5 的高表达基因可能在 ECM、结构组织和粘着斑相关功能方面富集(图3F)。
他们定义了与 TAF4 共有的 F5 的前 5 个标记基因:COL1A2、COL4A1、COL4A2、CTGF和FSTL1(图 3 G)。当这些基因共表达时,scRNA-seq 数据中的独特细胞证实这些细胞是单细胞亚群(图 3 H)。基于这些多重验证方法,他们发现F5-CAF 对应于单细胞亚型 TAF4。然后,他们进行了 LOWESS 回归以评估 F5-CAF 评分与肿瘤界面距离之间的关联。他们发现 F5-CAF 评分在肿瘤界面区域最高,在肿瘤区域和相邻的非肿瘤区域均进一步降低(图3 I)。
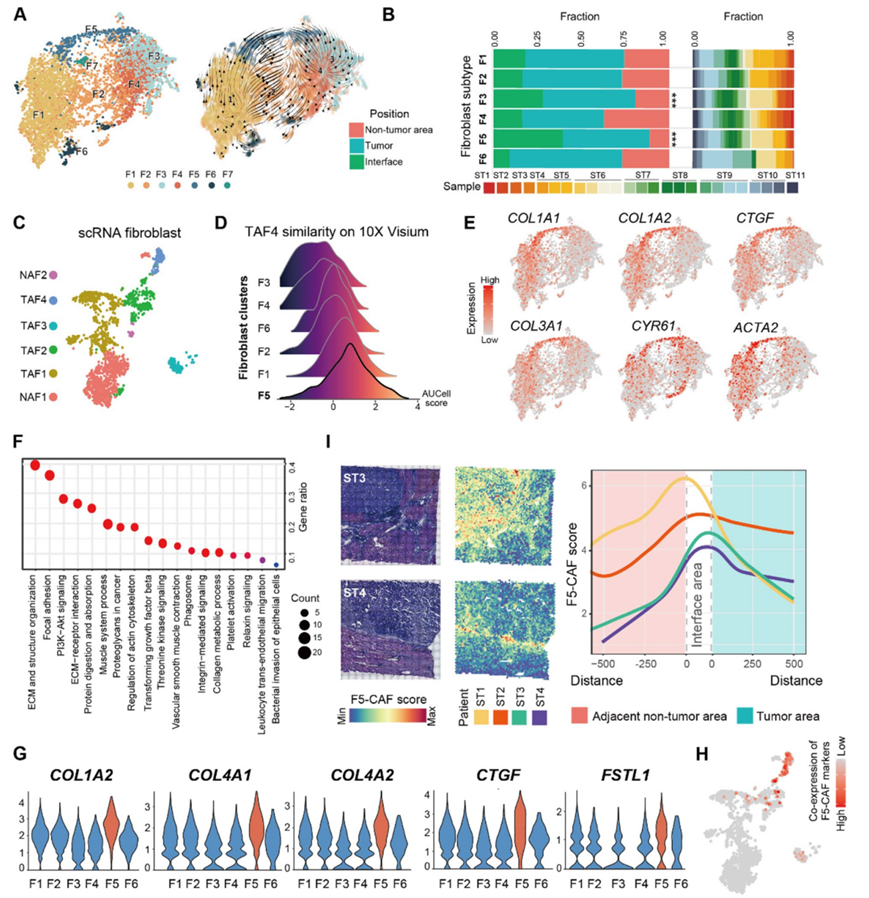
图3. CAF 亚群及其转录特征。
(A) 5803 个成纤维细胞富集点的 UMAP(左)和轨迹(右)。(B) 成纤维细胞亚群组成显示为不同位置和个体患者的百分比。(C) UMAP可视化。(D) 与每个 ST 聚类匹配的 TAF4 成纤维细胞的 AUCell 评分。(E) 成纤维细胞富集点中肌成纤维细胞标志物表达的 UMAP 特征图。(F) GO分析。(G) F5标记基因的表达。(H) 标记基因的总表达。(I) F5-CAF 评分的空间分布。
04
F5-CAF与 HCC 患者预后不良相关
为了在单细胞水平上验证肝癌中 F5-CAF 亚群的存在,他们对 92 例 HCC 患者的肝癌组织进行了 mIF 染色以分析 F5-CAF(图 4 A)。不同标记基因的组合(COL1A2、COL4A1、COL4A2、CTGF和FSTL1)用作随机森林模型的输入,以区分 F5-CAF 与其他成纤维细胞。CTGF、COL4A2和FSTL1这个组合准确鉴定F5-CAF所需的基因数量最少(图4B)。因此,他们对这三个基因和COLIA2(成纤维细胞的一般标记基因)进行了mIF染色。为了避免干扰实质细胞的基因表达,他们使用基质中的CTGF+FSTL1+COL4A2+细胞来代表F5-CAF(图4C)。根据 F5-CAF 标志物的表达水平为每个肿瘤样本定义风险评分,并显示对预后有显著影响(图4D)。他们发现肿瘤基质中丰富的 F5-CAF(> 82 细胞/mm2)与不良生存相关(图 4 E)。类似地,肿瘤界面区域 F5-CAF较多(> 22 个细胞/mm2)的患者生存时间较短(图4 F)。综上所述,mIF 证实了 F5-CAF的存在,并且它们的丰度与较差的预后相关。鉴于肿瘤界面区域中 F5-CAF 丰度较高,本项的结果也表明肿瘤界面的潜在重要性,它可能为肿瘤细胞的生长和侵袭提供合适的 TME。
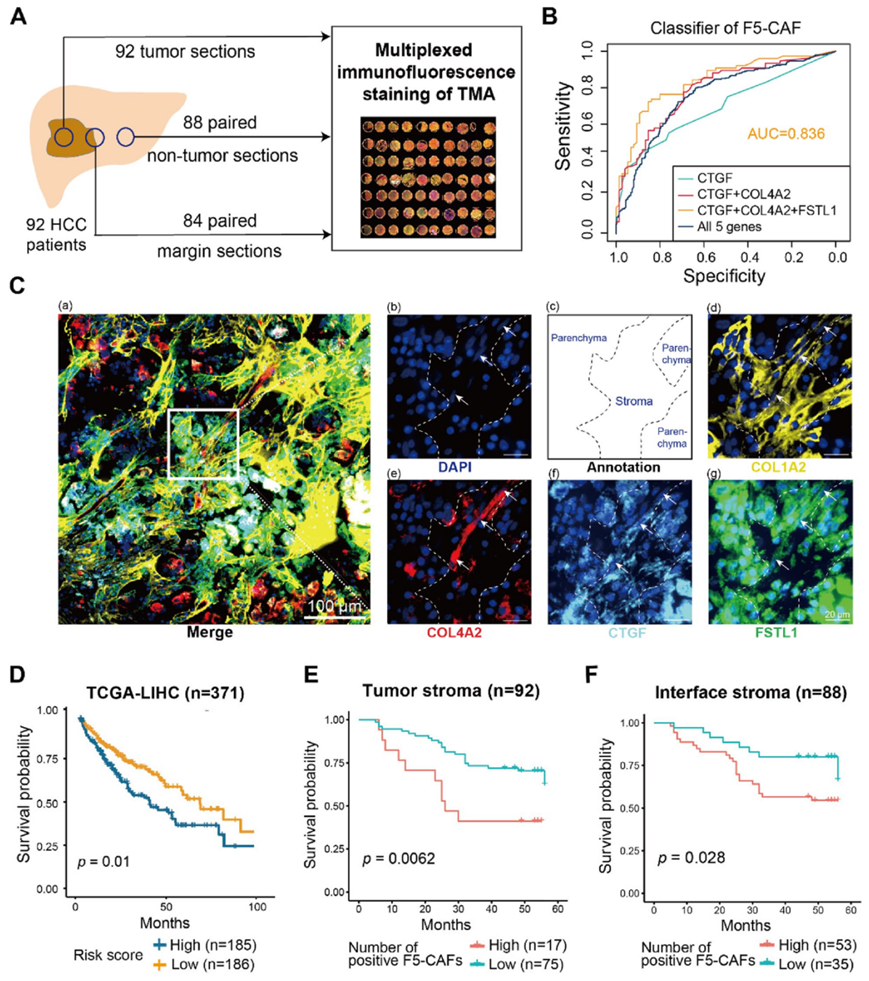
图5. 肝细胞癌 (HCC)患者的 F5-CAF 与不良预后相关。
(A) 肝细胞癌 (HCC) 组织微阵列 (TMA) 的多重免疫荧光 (mIF) 染色的实验流程。(B) 随机森林模型预测的基因组合的受试者工作特征曲线。(C) 使用mIF 染色的肿瘤核心组织的代表性合成图像。(D) TCGA队列中患者的总体生存分析。
05
F5-CAF 位于与HCC 中的癌症干细胞相关的微环境内
细胞间共定位分析显示,不同的成纤维细胞聚类具有不同的空间共定位模式,F5-CAF 微环境中的免疫细胞、成纤维细胞和癌细胞比预期的要多。此外,肿瘤界面也存在大量相互作用,非肿瘤、肿瘤界面和肿瘤区域的细胞类型之间分别有 3111、4791 和 3929 个显著的配体-受体对(L-R 对)。将 LR 对的数量视为相互作用强度,肿瘤区域内的 F5-CAF 与癌细胞的相互作用比肿瘤区域内的其他成纤维细胞更强(图 5 A),表明其潜在功能更强。
他们设计了两种策略来分析 F5-CAF 和细粒度细胞状态之间的共定位(图 5B)。首先,比较不同位置的斑点之间的模块得分:靠近 F5-CAF 的斑点、靠近其他成纤维细胞的斑点和没有成纤维细胞的远处斑点。其次,将 F5-CAF 邻域中斑点的最大模块得分定义为微环境强度指数,随后计算其与 F5-CAF 得分的相关性。他们应用这些策略来研究肿瘤内和肿瘤界面区域中 F5-CAF 斑点周围的细粒度癌细胞状态。
在8 名 HCC 样本患者中,F5-CAF 在肿瘤内和肿瘤界面处周围的 M2 巨噬细胞评分较高(图 5 C)。在 scRNA-seq 数据中,他们证实与其他成纤维细胞相比,F5-CAF 与 M2 巨噬细胞之间检测到更多的相互作用,包括 CXCL12:CXCR4;LGALS9:COLEC12/HAVCR2;ICAM1:aMb2 复合物/aXb2 复合物。他们为每个恶性斑点定义了得分。F5-CAF 周围的斑点比其他成纤维细胞附近的斑点具有更高的干性模块得分,尤其是在肿瘤中(图 5D-E)。F5-CAF 周围的斑点在肿瘤中表达更高水平的干性相关基因,例如CD44、CD47、KRT19和EPCAM(图 5F)。他们在本研究的队列和TCGA数据中证实了F5-CAF评分与干性模块评分之间存在相关性(图5G-H)。
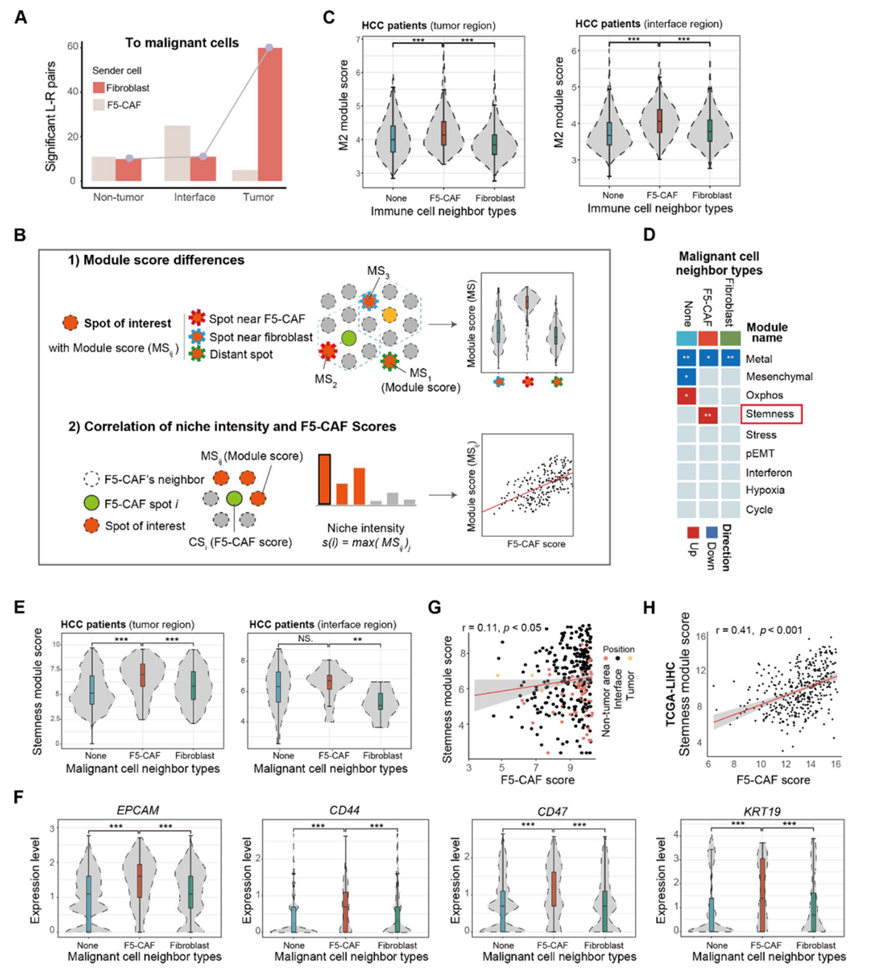
图5. F5 -CAF 与 HCC TME 中其他细胞的空间共定位。
(A) 非肿瘤、肿瘤界面和肿瘤区域中 F5-CAF /其他成纤维细胞-恶性细胞的显著 L-R 对。(B) 细胞邻域示意图。(C) 不同组中免疫富集点的 M2 模块得分的提琴图。(D) 不同组中富集的癌细胞状态热图。(E) 不同组恶性斑点干性模块评分的小提琴图。(F) 不同组恶性斑点中癌症干细胞标志物的表达。(G) 成纤维细胞-癌细胞群落中 F5-CAF 评分和干性模块评分之间的 Pearson 相关性。(H) 癌症干细胞标志物的表达。
EpCAM染色通常用于标记肝干细胞或肝CSC,发现肿瘤间质中EpCAM阳性细胞在空间上与F5-CAF相邻(图6A),并且F5-CAF的数量与EpCAM阳性细胞的数量相关。为了表征 F5-CAF 和 CSC 之间的信号传导,他们选择了具有更高干性模块的恶性斑点作为候选 CSC,并研究了它们与 F5-CAF 之间的信号传导。他们假设 F5-CAFs 分泌的配体与 CSC 相互作用以调节干性。使用 NicheNet方法(图 6B),确定了最有可能发生相互作用的 LR 对(图 6C)。通过空间邻近性分析对共定位表达的对进行优先排序(图 6C),他们确定了关键的干性通路,包括 NOTCH 和 TGFβ 通路(图6C),其中表达了 CSC 相关基因(图 6D)。此外,他们发现 Notch 配体 Jag1 在 F5-CAF 中高表达,可与相邻 CSC 上的 Notch 受体结合,并且这种共表达在肿瘤内比在肿瘤界面更明显(图 6 E)。F5-CAF 中的分泌性 TGFB 和 INHBA 配体也可以与整个肿瘤内和肿瘤界面区域中的 CSC 上的 TGFBR1 和 ACVR2A 相互作用(图 6 E)。在 F5-CAF 附近的 CSC 中可以检测到下游SMAD2和SMAD3的上调表达,这表明 TGFB1/INHBA-SMAD2/3 信号轴参与增强干细胞样特性和调节 ECM 蛋白沉积。综上所述,这些结果表明 F5-CAF通过多种通路维持肝脏 CSC 的干性。
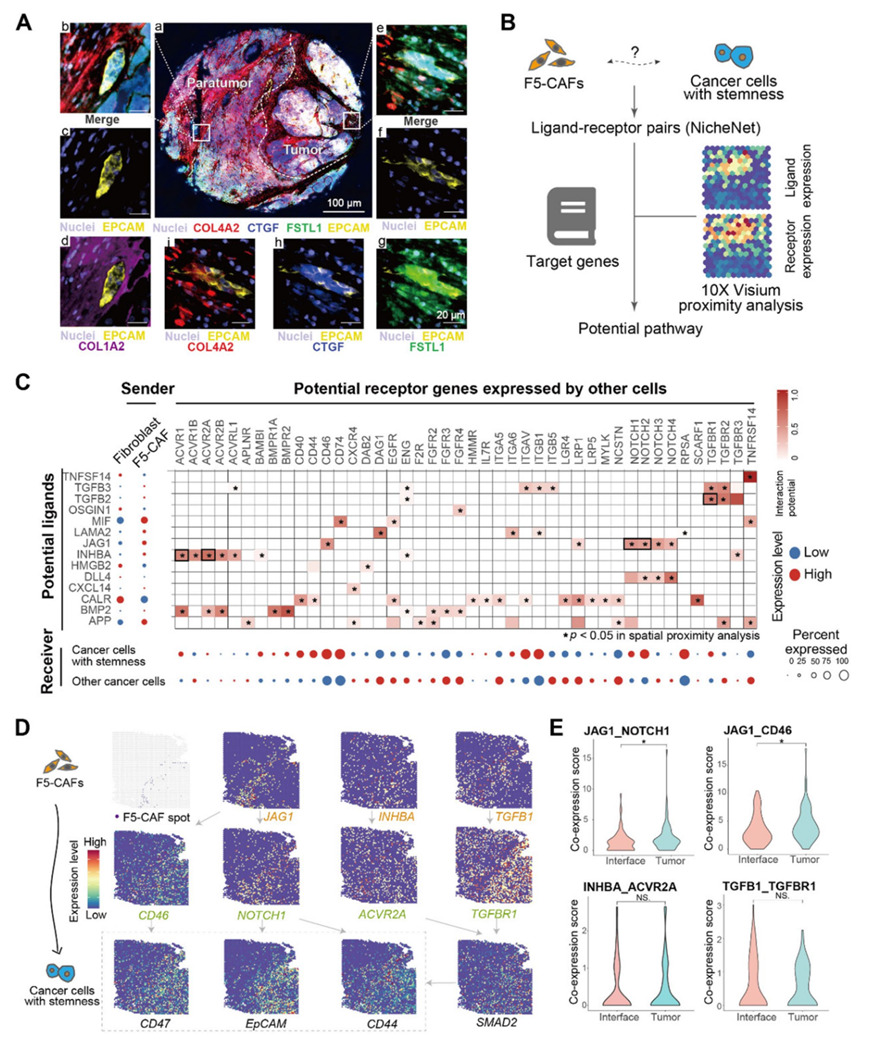
图6. F5-CAF 与 HCC CSC之间的细胞相互作用。
(A) HCC界面区域的代表性复合 mIF 图像。(B) TME中 F5-CAF 配体受体(L-R)分析的示意图。(C) NicheNet 预测的 F5-CAF 和其他调节癌细胞的成纤维细胞亚群中配体的平均表达。(D) F5-CAF 表达的选定配体的空间特征图和具有干细胞特性的癌细胞的同源受体表达。(E) 不同位置的 L–R 共表达得分。
06
患者来源的 F5-CAF促进肝癌细胞体外增殖和干细胞化
他们从五名 PLC 患者(三名 HCC 患者和两名 ICC 患者)切除的肿瘤组织中建立了五种原发性 CAF 细胞系。这些细胞很好地附着在培养板上,呈三角形、梭形、星形或梭形,具有典型的成纤维细胞形态。所有这些细胞均表达 α 平滑肌肌动蛋白 (α-SMA)、纤连蛋白 (FN1) 和 COL1A2。在五种 CAF 系中,几乎所有 CAF5(源自 ICC 组织)和 CAF9(源自 HCC 组织)细胞 (> 99%) 均共表达 CTGF、COL4A2 和 FSTL1(图 7 A),即 F5-CAF的标志物。相反,CAF2、CAF7 和 CAF8 中分别只有 35%、80% 和 73% 的细胞共表达这些标志物,表明这三种 CAF 系中存在混合细胞组成。在 scRNA-seq 数据集中,CAF5 和 CAF9 的转录谱与 TAF4(即 F5-CAF)的转录谱更为相似(图7 B,图3 H)。因此,这两个细胞系用作进一步实验的代表性 F5-CAF。
为了研究 F5-CAF是否促进肝癌细胞的生长,他们首先将 CAF 条件培养上清液与两种肝癌细胞在体外共培养。CAF5 或 CAF9 的条件培养上清液确实表现出更明显的刺激肝癌细胞体外生长的作用,而非特异性 CAF 细胞系 CAF2(表现出较低的 CTGF +和 FSTL1+表达)的作用与人肝星状细胞 LX2 相比要弱得多(图 7C)。与LX2或CAF2细胞相比,CAF5和CAF9细胞显著增强了肝癌细胞的克隆形成能力(图7D)。当CAF5或CAF9细胞与Hep3B细胞直接共培养时,其促进作用更为明显(图 7D)。当CAF5或CAF9细胞与肝癌细胞共培养时,添加针对DDR1或COL4A2的中和抗体,而非对照IgG抗体,在一定程度上抑制了肝癌细胞的克隆形成(图 7E),这表明DDR1可能参与了F5-CAF介导的对肝癌细胞的促进作用。最后,他们检测了共培养的肝癌细胞中干性基因的表达。无论是接触培养还是非接触培养,CAF5或CAF9都增强了某些干性基因的表达(图 7F),包括EPCAM,CD133和SMAD2。综上所述,这些结果表明F5-CAF促进肝癌细胞的体外增殖和干性。

图7. 患者来源的 F5-CAF 促进肝癌细胞的体外增殖和干细胞特性。
(A) mIF 染色数据中培养的原代 CAF9 细胞中 F5-CAF 标志物(CTGF、COL4A2 和 FSTL1)的共同表达。(B) 原代 CAF 细胞和 F5-CAF 亚型之间的关系。(C) CCK-8 实验显示 CAF 的条件培养上清液对肝癌细胞生长的影响。(D) 与CAF共培养或在 transwell 中共培养时 Hep3B 肝癌细胞的克隆形成能力。(E) 直接与CAF共培养的肝癌细胞的克隆形成能力。(F) 热图显示与所示 CAF 或 LX2 细胞共培养后肝癌细胞中两种干性基因的表达水平。
+ + + + + + + + + + +
结 论
本研究利用空间多组学分析全面表征了肝癌 TME 中的肿瘤基质和 CAF。在 HCC 中发现了一个 CAF 亚群 F5-CAF,其以 COL1A2、COL4A1、COL4A2、CTGF 和 FSTL1 的表达为标志,与癌症干性和不良预后相关。本项研究结果提供了 TME 中的 CAF 亚群通过支持 CSC 的存活来促进肝癌发展的潜在机制。
+ + + + +



 English
English


