文献解读|Nat Commun(14.7):颅底脊索瘤的蛋白质组学表征
✦ +
+
论文ID
原名:Proteogenomic characterization of skull-base chordoma
译名:颅底脊索瘤的蛋白质组学表征
期刊:Nature Communications
影响因子:14.7
发表时间:2024.09.27
DOI号:10.1038/s41467-024-52285-7
背 景
脊索瘤是一种罕见、生长缓慢、局部侵袭性的恶性骨肿瘤,起源于胚胎脊索残留,主要位于整个中轴骨骼,如颅底、活动脊柱和骶骨。脊索瘤占所有骨恶性肿瘤的 1% 至 4%。脊索瘤的发病率为每年每 10 万人中有 0.08 例,颅底部位每年每 200 万人中有 1 例。脊索瘤的发病机制尚不清楚。颅底脊索瘤(SBC)是一种罕见的恶性骨癌,复发率高。虽然基因组学研究取得了进展,但其分子特征和有效疗法仍然未知。
实验设计
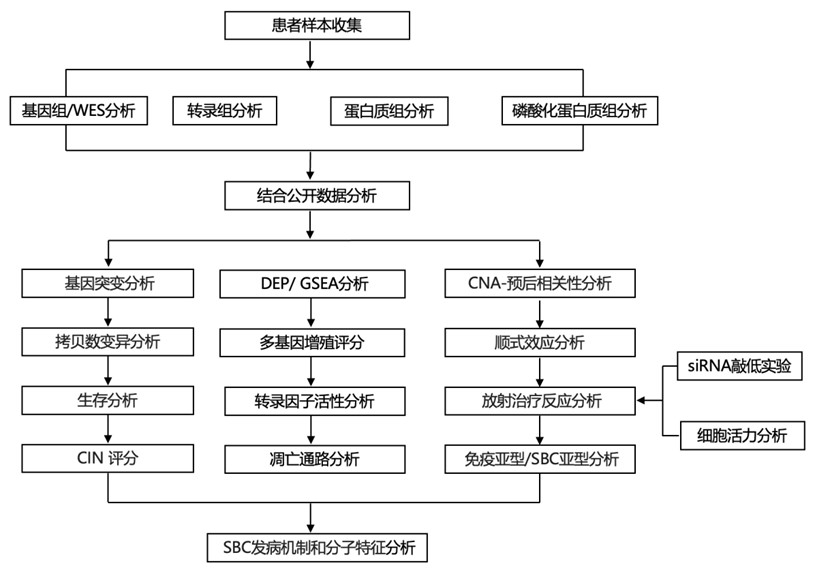
结 果
01
SBC 的蛋白质组学概况
为了建立 SBC 的蛋白质组学图谱以改善治疗反应,研究团队从中国上海华山医院通过手术切除收治的 162 名 SBC 患者中收集了 187 个肿瘤样本。187 个样本包括 121 个原发性肿瘤和 66 个复发性肿瘤(图 1A),并进行了全外显子组测序 (WES)、转录组分析(RNA-seq)、蛋白质组学和磷酸化蛋白质组学分析,共检测到 1903 个突变,包括 1748 个单核苷酸变异 (SNV) 和 155 个插入/缺失突变 (indel)。他们发现PCDHA3 (9%) 和LYST (6%) 是原发性 SBC 中突变频率最高的基因(图 1B),并且这些突变基因的 mRNA 和蛋白质表达与缺乏这些基因突变的 SBC 中的表达没有显著差异。复发性样本所显示的基因突变总体上较少,表明原发性队列和复发性队列之间的突变多种多样。具体而言,复发性肿瘤中发现的最常见突变,例如C8B、CDH23、COL3A1和CREBBP,在复发性肿瘤中的突变频率高于在原发性肿瘤中的突变频率,这表明复发性肿瘤具有与原发性肿瘤不同的突变组。
大多数 SBC 样本的肿瘤突变负担 (TMB) 相对较低,并且通常低于癌症基因组图谱 (TCGA) 中测序的大多数癌症类型(图 1C)。WES结果显示,原发肿瘤中最显著扩增位点位于染色体1q、2p和q、5p和q、6p和q、7p和q和21p,缺失位点位于染色体3p和q、4p和q、9p和q、10p和q、13q、14q、17p、18p和q、19p和q、21p和22q(图1D)。根据染色体臂水平的拷贝数变异(CNA)结果(图1E),扩增频率最高的前十个染色体臂依次是:7p(61%)、7q(60%)、21p(47%)、1q(40%)、6q(39%)、5p(37%)、5q(36%)、2p(34%)、2q(34%)、6p(33%)。缺失频率最高的前十个染色体臂分别是:22q(60%)、3p(49%)、13q(48%)、14q(46%)、10q(45%)、3q(44%)、10p(41%)、9q(38%)、9p(37%)和18p(36%)(图1E)。
染色体不稳定性(CIN) 是人类癌症的一个标志,它导致细胞分裂过程中 CNA 的引入。此外,高 CIN 与不良预后、转移和抗肿瘤治疗耐药性相关。他们根据 CIN 评分的分布将 SBC 肿瘤分为 CIN 高 (CIN +) 或 CIN 低 (CIN-) 亚组(图 1F)。对原发性肿瘤数据的进一步分析表明,CIN+ 状态与较差的总生存期 (OS)和无进展生存期 (PFS)显著相关,提示 CIN 可以提供预后信息(图 1G)。原发性肿瘤和复发性肿瘤 CIN 评分的比较表明,复发性肿瘤的 CIN 评分明显较高,提示 CIN 状态也与 SBC 复发有关(图 1H)。
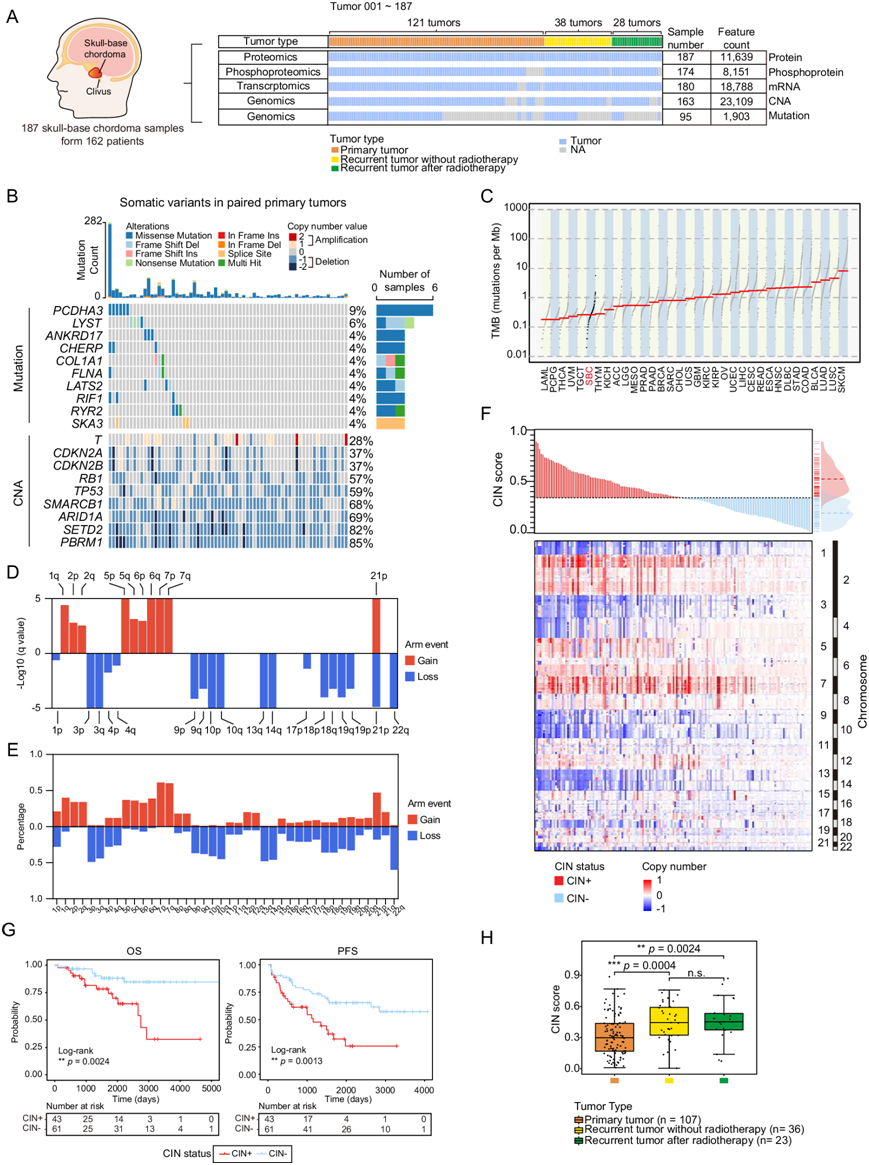
图1. 颅底脊索瘤(SBC)的多组学景观。
(A) 队列研究示意图。(B) 至少4% 的病例或已知脊索瘤相关基因发生突变的基因遗传图谱。(C) SBC队列与癌症基因组图谱 (TCGA)中包含的其他癌症队列之间的肿瘤突变负担 (TMB) 比较。(D) 原发性 SBC 肿瘤中显著的 GISTIC 臂级拷贝数变异 (CNA)。(E) 原发性SBC 肿瘤中臂级 CNA 增益和缺失事件的百分比。(F) SBC 肿瘤中染色体不稳定性(CIN) 状态和 GISTIC CNA 的分布。(G)生存分析。(H) 原发性肿瘤、未放疗复发肿瘤及放疗后复发肿瘤的CIN评分。
02
CIN + SBC 的蛋白质组学分析
基于蛋白质组学数据的差异表达蛋白 (DEP) 和基因集富集分析 (GSEA) 还表明,包括 MYC 靶点、E2F 靶点、mTORC1 信号和 DNA 修复通路在内的致癌通路在 CIN + SBC组 中显著上调,而与肿瘤微环境相关的通路,包括凝血、同种异体移植排斥和上皮间质转化通路,以及细胞凋亡通路均显著下调(图 2A)。这些上调的通路表明在 CIN 较高的 SBC 中具有更大的增殖潜力。因此,他们分析了每个样本的多基因增殖评分(MGPS),这是肿瘤细胞周期进展潜力的指标,结果显示 MGPS 评分与 CIN 评分之间存在显著相关性(图 2B)。
与对照组相比,所有CIN+细胞组的增殖率都有所增加(图 2C-D)。此外,他们还进行了流式细胞分析以研究CIN+细胞和对照细胞中细胞周期进程的变化(图 2D)。结果表明,S 期 CIN+ 细胞的比例高于对照组,这表明 CIN+ 细胞中 G1/S 转换可能得到促进。此外,对照组中 G2 期细胞的数量比 G2 期 CIN+ 细胞多,这表明 CIN+ 细胞中 G2/M 转换可能上调。结果表明 CIN+ 细胞中细胞周期进程得到促进。总之,额外的实验结果与之前基于蛋白质组学数据的发现相结合,提供了证据表明 CIN + SBC 肿瘤与增殖增强有关。
CIN 可由多种因素诱发,其中包括 DNA 复制应激 (RS) 和有丝分裂错误等。因此,为了研究 SBC 中 CIN 的推定病因,他们使用单样本GSEA (ssGSEA)探索了与已知 CIN 机制相关的通路。 与 CIN- 肿瘤相比,CIN+ 肿瘤中的复制应激通路活性显著上调(图2E)。而其他通路,包括有丝分裂期间的染色体分离、端粒功能障碍、同源重组、非同源末端连接和 PI3K-AKT 活化通路,在 CIN+ 和 CIN- 组之间没有显著差异,这表明DNA复制应激(RS)可能是导致 SBC 中染色体拷贝数事件不稳定的主要原因。蛋白质组学数据表明,RPA1、PCNA和 TP53BP1蛋白水平的表达水平在 CIN+ SBC 中均显著升高(图 2F),证实这些肿瘤中存在 DNA RS。组蛋白伴侣也是基因组维护和应激耐受所必需的,是细胞对复制压力有效反应的关键介质。H2AX 蛋白是组蛋白 H2A 进化上保守的变体,其磷酸化在先前的研究中报道为 RS 的标志物。他们根据本研究中的磷酸化蛋白质组学数据,分析了组蛋白 H2AX 磷蛋白的丰度。结果显示,与 CIN- SBC 肿瘤相比,CIN + SBC 肿瘤中的 H2AX 磷蛋白水平显著上调(图 2F)。
为了说明 DNA RS 影响 CIN+ 肿瘤的机制,他们分析s了标志通路和 DNA RS 通路的 ssGSEA 评分之间的 Spearman 相关系数,结果表明 DNA RS 基因集与 E2F 靶基因集的相关性最高(图 2G)。E2F 靶基因是 E2F 转录因子的下游,对 E2F 靶基因的进一步研究发现,与 RS 相关的几个 E2F 靶基因的表达水平显著增加,包括 MCM2-7、ORC2 和 RPA1。在所有 E2F 家族成员中,只有 E2F 的关键激活因子 E2F3 在 SBC 中的 mRNA 表达、蛋白质表达和转录因子 (TF) 活性水平上与 CIN 评分呈正相关(图 2H)。由于蛋白质是细胞的功能执行者,他们进一步研究了 SBC 肿瘤中 E2F3 的蛋白质丰度。结果显示,E2F3 蛋白表达水平与 CIN 评分呈正相关,并且在 CIN+ 组中显著增加。这些结果表明,E2F3 可能是导致 CIN+ SBC 中 E2F 靶标异常高表达的原因。
E2F3 是细胞周期检查点调节蛋白的已知靶点,例如 CDKN2A、细胞周期蛋白依赖性激酶 (CDK)、细胞周期蛋白 (CCN) 和 RB1。磷酸化蛋白质组学分析表明,包括 CDK1、CDK2、CDK4 和 CDK5 在内的几种 CDK 的激酶活性水平与 E2F3 转录活性呈正相关 (图 2I)。他们发现 RB1 的磷酸化与 E2F3 TF 活性相关,这表明 CDK4 激活介导的 RB1 抑制或 RB1 缺失相关的 E2F3 激活机制导致 SBC 中的 CIN+ 表型(图 2J)。高水平的 CIN 和持续的 DNA RS 通常会在未转化细胞中诱导细胞凋亡和细胞死亡。相反,他们的 GSEA 和 ssGSEA 分析表明 CIN+ SBC 中的凋亡通路下调(图 2K)。在 CIN+ 肿瘤中还观察到凋亡相关基因(如TP53、BAK1和BAD)的缺失或下调,表明 CIN+ SBC 也伴有细胞凋亡的抑制。CIN+SBC细胞凋亡比例(晚期凋亡细胞(Q2)1.56%,早期凋亡细胞(Q4)0.73%)低于对照细胞(Q2 9.23%,Q4 27.21%)(图 2L)。这些结果证实CIN+SBC细胞中DNA RS发生诱导,且与对照细胞相比,CIN+细胞的凋亡减少。CIN+SBC细胞的相应实验和分析显示RS水平升高,并证实这些CIN+细胞的E2F转录活性(与对照细胞相比)显著上调。
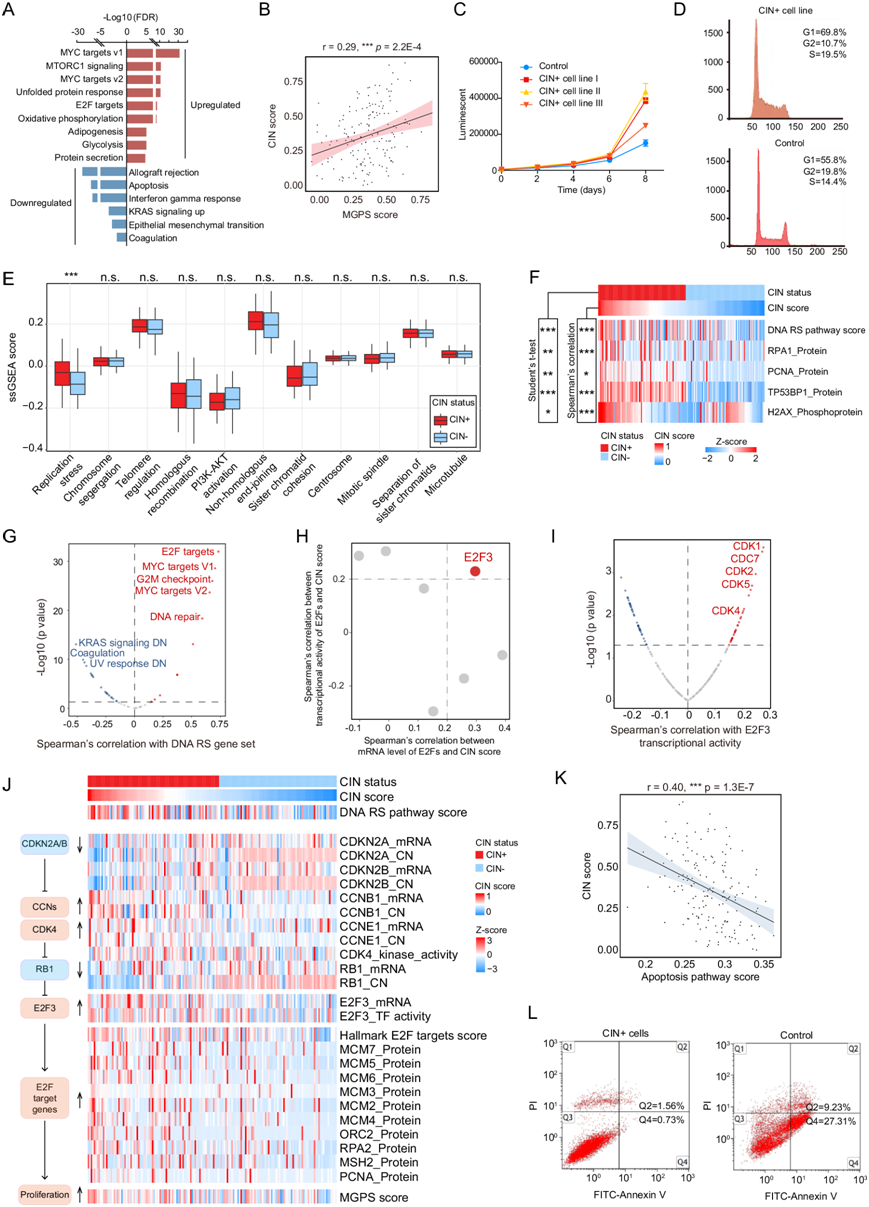
图2. CIN + SBC 的 mRNA、蛋白质和磷蛋白表达水平的蛋白质组学分析。
(A) CIN+ 和 CIN- SBC 之间差异表达蛋白的富集分析。(B) 散点图显示 MGPS 评分与 CIN 评分的 Spearman 相关系数和p值。(C) CIN+ 细胞和对照细胞的增殖曲线。(D) 流式细胞分析显示 CIN+ 细胞与对照细胞相比的细胞周期进程。(E) 已知CIN 的 ssGSEA 评分导致 CIN+和 CIN- SBC 样本之间的通路。(F) CIN 评分和 DNA 复制应激 (RS) 标记物的蛋白质丰度的热图。(G) 散点图显示 DNA RS 通路和标志性通路的 ssGSEA 评分之间的 Spearman 相关性。(H) 散点图显示 CIN 评分与 E2F 的 mRNA 表达水平和转录因子 (TF) 活性的 Spearman 相关系数。(I) 散点图显示 E2F3 TF 活性和激酶活性之间的 Spearman 相关系数。(J) 与 CIN + SBC中细胞周期调控相关的多组学特征热图。(K) 凋亡途径表达评分与 SBC 中的 CIN 评分呈负相关。(L) 流式细胞分析。
03
1q 增益导致 SBC 预后较差,这与线粒体蛋白质稳态有关
WES 分析还揭示了 SBC 样本中存在多个臂级增益和丢失。特别是,在本项研究中,1q 增益与较差的 OS 最显著相关(图 3 A-B),并且与原发性 SBC 队列中较短的 PFS 相关(图 3B)。CIN+ 肿瘤携带 1q 增益的频率高于 CIN- 肿瘤(图 3C),并且具有 1q 增益的肿瘤的 CIN 评分显著更高(图 3D)。与WT肿瘤相比,具有1q增益的肿瘤表现出明显更高的CIN评分。“1q增益”中的CIN评分高于“其他”中的CIN评分,这表明染色体1q增益、CIN和这些患者的预后较差之间存在密切的联系。
为了鉴定 1q 染色体上 SBC 的潜在驱动因素,并明确 1q 增益直接影响的下游信号通路,他们筛选了位于 1q 染色体上与 1q 拷贝数呈正相关的基因,即顺式事件基因(图3E)。这些顺式事件基因大多富集在线粒体相关通路中,包括线粒体、线粒体基质和线粒体翻译(图 3F)。1q 增益的肿瘤表现出与线粒体基因表达相关的基因显著富集(图 3G)。此外,线粒体基因集的 ssGSEA 评分也与 CIN 评分呈正相关(图 3H),ATP5A1 和 TOMM20 的 H 评分在具有 1q 增益的肿瘤中显著上调(图 3I)。这些结果说明,1q增益样本中线粒体翻译相关基因表达水平升高,提示1q增益SBC对线粒体功能存在影响。
接下来,他们筛选了 MitoCarta3.0 数据集中所有线粒体通路与 1q 染色体获得的关联,并评估了它们对 1q 获得患者预后的影响。在这些线粒体通路中,线粒体蛋白质稳态不仅与 1q 的拷贝数呈显著正相关,而且与患者较差的 PFS 表现出最强的关联(图 3J)。与其他线粒体通路相比,线粒体蛋白质稳态途径与 1q 增益和 PFS 的相关性更显著(图 3J),这表明蛋白质稳态通路可能与其他线粒体途径相比与 1q 增益 SBC 的预后较差更相关。总体而言,在 1q 增益肿瘤中所有上调的途径中,蛋白质稳态通路与 PFS 显示出最显著的相关性(图 3J);相关蛋白质(如 HSPD1、HSPE1 和 DNAJA3)的 mRNA 和蛋白质水平在这些 1q 增益肿瘤中均显著上调,并且与预后较差有关(图 3K)。
结果显示,氨基酸通路与蛋白质稳态途径表现出最强的相关性,并且与 SBC 患者的 PFS 较差有关(图 3L)。在所有参与氨基酸代谢通路的基因中,SHMT2 与蛋白质稳态高度相关。此外,SHMT2 表达水平较高的 SBC 患者的 PFS 明显较短,提示SHMT2与1q增益SBC患者预后较差有关。SHMT2是参与氨基酸代谢的关键酶,对Burkitt淋巴瘤中的肿瘤细胞生长和活力至关重要。这些结果表明,1q增益的SBC中上调的蛋白质稳态相关基因可能有助于这线粒体代谢功能增强,从而为适应肿瘤微环境提供优势,并促使代谢重塑以维持肿瘤增殖(图 3M)。

图3. 1q 染色体增益对 SBC 的影响。
(A) 火山图显示原发性 SBC中显著的臂级 CNA 事件 及其与预后的关系。(B)生存分析。(C) 堆积条形图显示 CIN+ 和 CIN- SBC 中有或没有 1q 增益的肿瘤比例。(D) 箱线图显示原发性/复发性 SBC 肿瘤之间的 CIN 评分差异。(E) 维恩图显示 1q 染色体上显著的顺式事件。(F) 富含显著 1q顺式效应基因的通路。(G) GSEA图显示与其他肿瘤相比,1q 增益的肿瘤中线粒体基因表达上调。(H) 散点图显示 CIN 评分与线粒体基因集的 ssGSEA 评分之间的 Spearman 相关系数和p值。(I) 1q 增益肿瘤与 1q WT 肿瘤之间的ATP5A1和 TOMM20的组织化学评分。(J) 散点图显示线粒体基因集评分与 1q 拷贝数的 Spearman 相关系数。(K) 与 SBC 中 1q 增益相关的代表性重要顺式和反式事件相关的基因热图。(L) 散点图显示PFS 的p值和代谢相关通路的 Spearman 相关系数。(M) 描述 1q 染色体拷贝数变异的多层次调控的示意图。
04
RPRD1B 表达可预测 SBC 对放射治疗的反应
他们根据患者在中位 3 年随访内是否复发,将这些肿瘤分为放射抗性组和放射敏感组。每组根据治疗情况进一步分为高剂量或低剂量亚组(高剂量 > 60 Gy,低剂量 < 60 Gy)(图 4A)。因此,根据对放射治疗的反应和放射剂量,将放疗前的肿瘤分为四组:低剂量放射敏感(n = 26)、高剂量放射敏感(n = 21)、低剂量放射抗性(n = 19)和高剂量放射抗性(n = 7)亚组。
放射治疗是一种重要的癌症治疗策略,它直接或间接地导致肿瘤细胞的DNA损伤,从而阻止肿瘤细胞分裂和存活。DNA修复通过修复放射治疗引起的DNA损伤在癌症放射耐药性的形成中起着维持基因组稳定性的关键作用。因此,他们重点关注了放射耐药患者放疗前肿瘤中DNA修复显著上调的观察结果。然后,他们利用蛋白质组学数据研究了不同放射治疗程度之间的差异通路。结果表明,与低剂量放射敏感肿瘤相比,蛋白质组学数据推断的DNA修复通路评分在较高放射治疗程度中显著上调。他们还分析了所有与DNA修复过程相关的蛋白质。与放射抗性相关的蛋白质的表达有显著差异,包括CUL4A,HMGB1,PRKDC,RPRD1B和ATM(图 4A)。剂量反应分析显示,高剂量和低剂量抗性的CIN评分均高于低剂量放射敏感亚组(图 4B)。四种亚型中 CIN+ 和 CIN- 肿瘤的比例有显著差异,其中低剂量放射敏感亚型的 CIN+ SBC 比例较低。
由于这些结果提示放射抗拒程度可能与 CIN 状态有关,他们接下来进行相关性分析,结果显示 204 个蛋白与放射抗拒程度显著正相关,1132 个蛋白与 CIN 评分显著正相关。其中,RPRD1B 与放射抗拒程度和 CIN 评分均显著相关(图 4C),且高剂量和低剂量放射抗拒组的 RPRD1B 蛋白表达均高于低剂量放射敏感组(图 4D)。总体而言,他们比较了不同程度放疗反应患者的放疗前肿瘤样本中蛋白质表达的差异,并观察到放疗抗性程度较高的组中DNA修复通路和RPRD1B显著上调(图 4D)。
为了进一步确定 RPRD1B 表达是否确实在功能上有助于放射治疗的反应,他们使用 siRNA 敲低了 SBC 细胞系中的 RPRD1B,并在体外评估了对放射治疗的敏感性。在通过 Western blot 确认 RPRD1B 抑制后,用 32 或 64 Gy 处理的 RPRD1B 敲低细胞和对照细胞后,与对照组相比,RPRD1B 敲低细胞的细胞活力/存活率显著降低(图 4 E-F)。同源依赖性重组 (HDR) 和错配修复 (MMR) 通路与 CIN 得分和 RPRD1B 水平在本研究的数据集中显著相关(图 4G)。在本研究的数据库中,HDR 相关蛋白(包括 PARP1、RECQL、BARD1、RPA1/2/3、PALB2 和 XRCC2)以及 MMR 相关蛋白(例如 MSH2、MSH6、MSH3 和 PMS1/2 )与 CIN 评分呈显著正相关(图 4H)。细胞周期相关蛋白均与 CIN 评分呈显著正相关,包括 PCNA、复制因子 C(RFC)、DNA Pol δ1、DNA Pol δ2、DNA Pol δ4 和 DNA 连接酶 1 或 DNA 连接酶 3(图 4H)。
接下来,他们利用相关性分析来探索细胞周期的哪个特定阶段受到 HDR 和 MMR 通路的影响,并发现 G1 和 S 期的 mRNA 和蛋白质通路评分与 CIN 评分、HDR 和 MMR 显著相关(图 4I),其中 S 期具有最强的相关性(图 4 I-J)。由于 MCM2 磷酸化已明确促进细胞周期进程,他们分析了 MCM2 的磷酸化蛋白质组学数据,结果显示其磷酸化与 HDR 之间存在显著关联(图 4K)。值得注意的是,在所有 MCM2 磷酸化位点中,MCM2_S27 与 HDR 的相关性最强(图 4K)。使用底物磷酸化水平推断激酶活性分析表明 CDC7 激酶活性与 MCM2_S27 磷酸化具有最高的相关性(图 4K),这与报道的 CDC7 在 S 期激活 MCM 复合物的功能相一致(图 4L)。这些结果共同表明,RPRD1B 表达增加,促进 HDR 和 MMR 通路,可能导致 CIN+ SBC 的放射抗性。
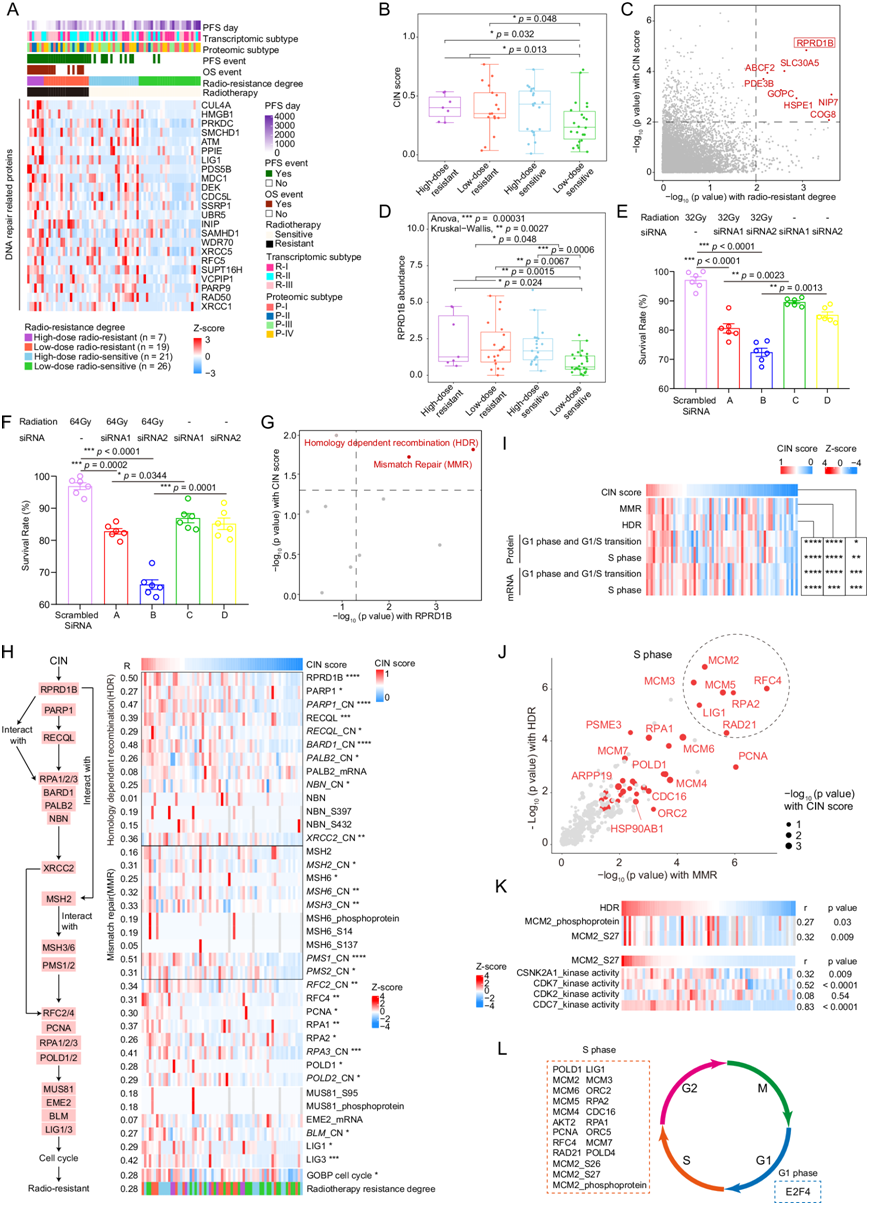
图4. RPRD1B 表达预测 SBC 对放射治疗的反应。
(A) 放射抗性组与放射敏感组间差异调节DNA 修复相关蛋白的热图。(B) 高剂量抗性、低剂量抗性、高剂量敏感、低剂量敏感组的 CIN 评分。(C) 蛋白质与放射抗性程度和 CIN 评分均显著相关。(D) 高剂量抗性、低剂量抗性、高剂量敏感、低剂量敏感组间 RPRD1B 蛋白表达水平。(E-F)脊索瘤细胞活力测定。 (G) HDR和 MMR 通路与 CIN 评分和 RPRD1B 显著相关。(H) 热图显示 HDR 和 MMR 相关基因的拷贝数/mRNA/蛋白质/磷蛋白水平、细胞周期通路的 ssGSEA 评分和放射抗性程度。(I) HDR、MMR、G1 期和 S 期的 ssGSEA 评分。(J) 细胞周期相关蛋白与 HDR 和 MMR 的相关性。(K) 热图显示 MCM2 磷蛋白、MCM2_S27、CSNK2A1、CDK7、CDK2 和 CDC7 的丰度/激酶活性。(L) 简要模型描述了受 CIN 评分、HDR 和 MMR影响最大的 G1 和 S 期基因。
05
与 9p 和 10q 缺失相关的“免疫冷” SBC
为了研究肿瘤免疫微环境在 SBC 中的可能作用,他们使用 xCell 平台对RNA-seq数据进行了细胞类型反卷积分析,以推断肿瘤微环境中不同细胞类型的相对丰度(图 5A)。基于推断的免疫细胞比例的共识聚类确定了三组具有不同免疫和基质特征的肿瘤:免疫热、免疫冷和免疫混合亚型(图 5 A-B)。在免疫冷亚型中观察到的免疫细胞比例较少(图 5A),其 CIN 评分和 CIN + 比例高于其他两种亚型。相应地,几种免疫相关通路,包括 IL6/JAK/STAT3 信号传导、干扰素-γ 反应和补体通路,以及关键免疫细胞表面蛋白,如 CD3D/E/G、CD8A/B、CD274、PDCD1 和 TIGIT,在免疫冷亚型肿瘤中显著下调(图 5A)。蛋白质组学结果显示,CD3D、CD3E、CD3G、CD8A、CD163、PDCD1LG2、TNF、TNFSF10、CXCL10、FASLG、GZMK、HLA-DRA、HLA-DRB1、HLA-DPB1、VWF 和 ZAP70 等几种重要的免疫相关蛋白的表达水平在免疫热亚型中也显著上调(图 5A)。
为了进一步阐明免疫亚型与 CIN 之间的关联,他们根据 CIN+ 或 CIN- 状态将三种免疫亚型分为六个亚组。临床上,与相应的 CIN- 肿瘤相比,热肿瘤、冷肿瘤和混合肿瘤的 CIN+ 亚组的 PFS 明显较差(图5C)。此外,CIN 评分与免疫评分呈显著负相关(图 5D)。为了确定潜在的遗传基础,与染色体臂拷贝数的相关性分析显示,免疫评分和 CIN 评分均与染色体 10q 和 9p 臂水平拷贝数显著相关(图 5E),表明 9p 和 10q 的丢失与 CIN + SBC 肿瘤中的免疫抑制微环境有关。
根据蛋白质组学数据,GSEA 结果表明 9p 与炎症反应和 IL6/JAK/STAT3 信号基因集的表达呈显著正相关(图 5F),而 10q 与通过 NF-kB的 TNF-α 信号传导和干扰素 (IFN) α 反应基因集呈正相关(图 5G)。转录组学结果还显示,在蛋白质组学和转录组学水平上,9p缺失肿瘤中炎症反应和IL6/JAK/STAT3通路下调,10q缺失肿瘤中通过NFkB和干扰素α信号通路的TNFA信号下调(图 5F-G),这表明蛋白质表达水平的免疫过程的改变与转录组数据一致。9p21.3 的拷贝数与位于该区域上的几个 IFN 基因和位于 9p 上的 IL6/JAK/STAT 信号基因(即JAK2)的 mRNA 水平呈正相关,这也与其他 IFN 信号基因和免疫检查点基因的缺陷有关(图 5H),表明免疫反应降低,与之前报道的 9p 丢失导致 IFN 通路下调导致肿瘤免疫逃逸相一致。此外,上述 GSEA 结果表明 10q 缺失可能下调 NF-kB 信号和 IFN 信号,因为位于 10q 上的中枢促炎激活剂 NFKB2 和 CHUK 94在 10q 丢失的 SBC 中减少(图5I)。NFKB2 可以促进其他细胞因子的表达,例如 CCL2/4/5/7/8 和 CXCL10/12/2/5/9,这些细胞因子在 10q 缺失的 SBC 中也下调(图 5I)。9p 和 10q 丢失可能通过影响免疫相关通路(包括 IFN 信号和 NF-kB 信号通路)导致 CIN+ 肿瘤的免疫逃逸,这表明免疫检查点抑制剂 (ICI) 疗法可能对 CIN- SBC 有效,而非 CIN+ SBC(图 5J)。
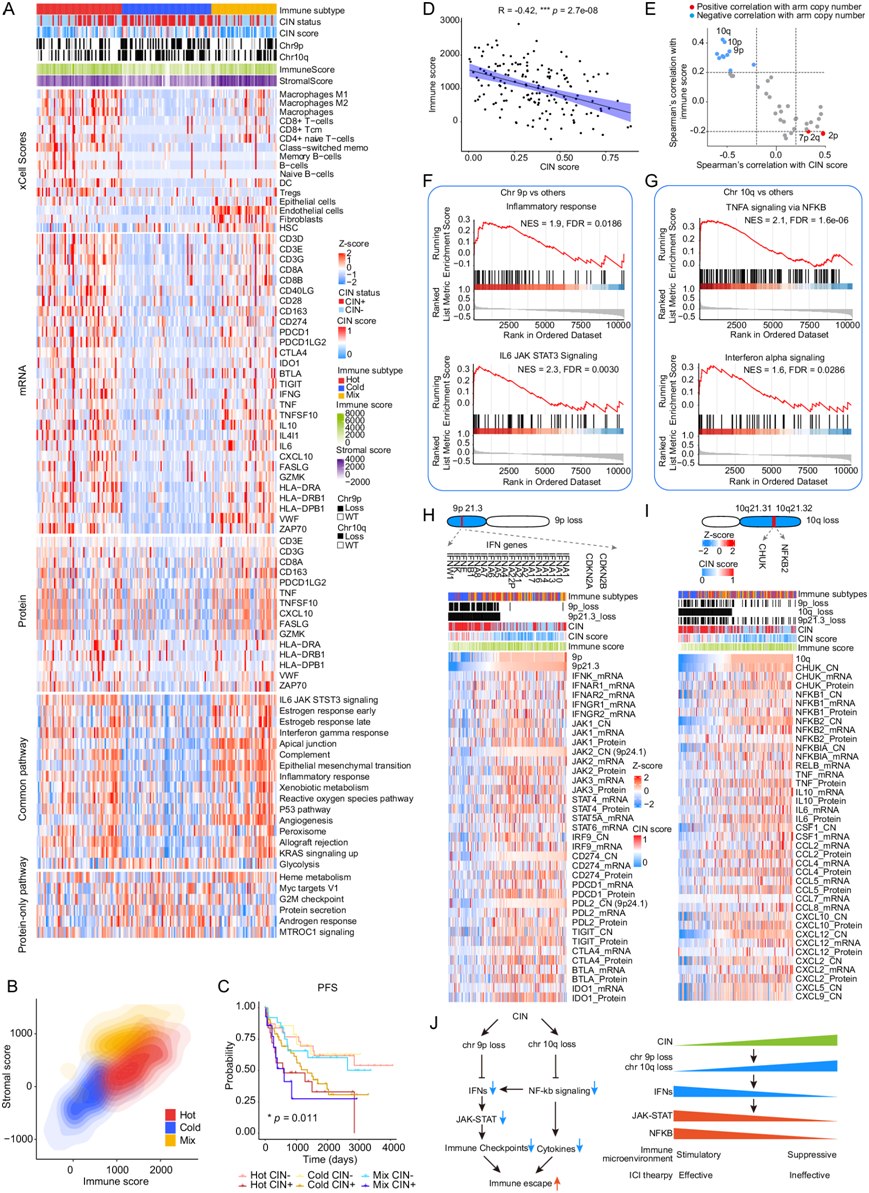
图5. 与 9p 和 10q 丢失相关的免疫冷性 SBC。
(A) 热图显示了三种免疫亚型中细胞类型组成和选定关键基因/蛋白质和通路的丰度。(B) 基于不同免疫亚型的基质核心(y轴)和免疫评分(x轴)的二维密度轮廓图。(C) 基于 CIN 状态的六个亚组的 PFS 的 Kaplan-Meier 曲线。(D) 散点图说明臂级拷贝数与 CIN 评分以及免疫评分之间的相关性。(E) 染色体臂与免疫评分和 CIN 评分显著相关。(F) GSEA图显示基于蛋白质组学数据的 9p 染色体与炎症反应和 IL6/JAK/STAT3 信号传导呈显著正相关。(G) GSEA图显示基于蛋白质组学数据的 10q 染色体通过 NF-KB 与 TNF-α 信号传导和干扰素 (IFN) α 反应呈显著正相关。(H) 9p 染色体拷贝数丢失的热图以及关键干扰素受体基因、IL6/JAK/STAT 信号通路基因和关键免疫检查点的拷贝数 (CN)/mRNA/蛋白质丰度。(I) 10q 染色体拷贝数丢失的热图以及 NF-KB 相关基因和关键细胞因子的拷贝数 (CN)/mRNA/蛋白质丰度。(J) 9p 丢失和 10q 丢失的综合效应示意图。
06
SBC 的蛋白质组亚型分析
根据变异性最高的 30% 蛋白质,他们在 187 个肿瘤中确定了四种蛋白质组亚型。 根据其不同的蛋白质组学特征和临床特征,将这些组指定为 PI、P-II、P-III和 P-IV(图6 A-B),而转录组聚类用于将 180 个 SBC 分为 RI、R-II和 R-III亚型。P-II 和 P-III 亚型的 CIN 评分明显高于 PI 和 P-IV 亚型(图 6C)。此外,ssGSEA 分析探索了蛋白质组学亚型之间的分子特征差异(图 6B)。他们观察到 PI 亚型表现出最高水平的 ECM 相关蛋白,包括参与粘着斑、ECM 受体相互作用和血管生成途径的蛋白(图 6B)。与较低 CIN 亚型(PI 和 P-IV)相比,较高 CIN 亚型(P-II 和 P-III 亚型)显示 MYC 靶标、E2F 靶标、氧化磷酸化、PI3K-AKT-mTOR 信号传导和 DNA 复制通路上调,进一步验证了 CIN+ 特征与进展相关过程水平增加之间的相关性(图 2A)。相比之下,P-IV 亚型与代谢相关通路相关的蛋白质水平增加,例如丙酮酸代谢和 N-聚糖生物合成。对 xCell 中的免疫评分评估显示四个亚组之间存在显著差异,其中富含冷肿瘤的 P-II 亚型的免疫评分最低(图 6 D-E),这表明 P-II 肿瘤可能对 ICI 没有反应。
比较每种蛋白质组亚型的原发患者的临床数据,结果表明 CIN 评分较高的亚型(P-II 和 P-III)患者的 PFS 比 CIN 评分较低的亚型(PI 和 P-IV)患者的 PFS 更差(图 6F),这与在此 SBC 队列中观察到的 PFS 较差与 CIN 评分较高之间的关联一致(图 1H)。以 ECM 相关通路为特征的 PI 亚型的预后相对较好于 P-II 和 P-III 亚型(图 6B-G)。
P-IV 亚型富含代谢相关通路,与 CIN 评分较高的亚型(P-II 和 P-III 亚型)相比,其预后也相对较好(图 6B-G)。与其他亚型相比,P-IV 亚型中的代谢相关通路,如 N-糖生物合成和丙酮酸代谢显著上调。
有趣的是,P-II 亚型(CIN 评分较高的亚型)患者的 OS 明显差于 P-III 亚型(另一种 CIN 评分较高的亚型)患者(图 6G)。为了证明这两种 CIN 评分较高的亚型是否显示出不同的预后,他们随后确定了 P-II 和 P-III 亚型之间的差异蛋白质和通路,结果显示 P-II 亚型中免疫相关通路下调,包括趋化因子信号通路和 JAK-STAT 信号通路,这与 P-II SBC 与其他 SBC 相比免疫评分较低相一致(图 6D)。他们发现,推测的凋亡相关信号通路如TRAIL、NF-kB、WNT和TNF-α的活性在P-II亚型中显著降低(图6H),其中在TRAIL通路中检测到的降幅最大(图6I)。
比较结果表明,已知的肿瘤抑制因子 IRF1在 P-II 亚型中显著下调(图 6J)。据报道,IRF1 可诱导 TRAIL 表达。此外,IRF1 的 TF 活性评分与 TRAIL 通路的活性评分呈正相关(图 6K),而包括 TRAIL(TNFSF10)、CASP8/10/3/7 和 LMNA 在内的几种 TRAIL 通路基因在 P-II 亚型中显著下调(图 6L)。他们提出假设:IRF1失活可能导致TRAIL通路下调,进而抑制凋亡功能,最终导致P-II亚型患者的预后比P-III亚型患者更差。为了验证这种可能性,他们收集了siRNA诱导的IRF1 KD SBC细胞和对照细胞进行蛋白质组学分析,以确定差异表达基因集(图 6M)。ssGSEA分析显示,凋亡通路蛋白在IRF1 KD SBC样本中确实下调(图 6N)。
这些结果表明 SBC 的四种蛋白质组亚型之间存在不同的分子机制,尤其是在两种 CIN 评分较高的亚型 P-II 和 P-III 亚型之间,它们的生存结果和凋亡相关蛋白(如 TRAIL)的调节活性明显不同。

图6. SBC 队列的共识聚类分析确定了四种蛋白质组亚型。
(A) 热图显示了四种蛋白质组亚型的特征。(B) 通路富集分析。(C-D) 箱线图显示了不同蛋白质组亚型的 CIN 评分和免疫评分。(E) 热图显示了免疫聚类与蛋白质组亚型的重叠。(F-G)生存分析。(H) P-II 和 P-III 亚型之间的 PROGENy 通路评分热图。(I) 箱线图显示 P-II 亚型的 TRAIL 通路评分低于P -III 亚型。(J) 箱线图显示P -II 亚型的 IRF1 TF 活性评分低于 P-III 亚型。(K) 散点图显示 IRF1 TF 活性评分与 TRAIL 通路评分的 Spearman 相关性。(L) 热图显示与 P-III 亚型相比,P-II 亚型中代表性 TRAIL 通路相关基因显著下调。(M) IRF1 KD 细胞与对照细胞之间的IRF1基因qPCR 结果。(N) 箱线图显示 IRF1 KD 细胞与对照细胞之间的凋亡通路评分。
+ + + + + + + + + + +
结 论
本项研究对 187 个颅底脊索瘤进行了综合基因组学、转录组学、蛋白质组学和磷酸化蛋白质组学分析,将染色体不稳定性确定为预后预测因子和潜在治疗靶点。多组学数据揭示了染色体不稳定性下游效应,RPRD1B 是放射治疗耐药患者的假定靶点。染色体 1q 增益与染色体不稳定性和线粒体功能上调有关,导致临床结果较差。本研究鉴定出与染色体 9p/10q 缺失和免疫逃避相关的免疫冷亚型。基于蛋白质组学的分类揭示了具有高染色体不稳定性及免疫冷特征的亚型(P-II 和 P-III),其中 P-II 肿瘤表现出更高的侵袭性。
+ + + + +



 English
English


