文献解读|Nat Commun(16.6):不同阶段膀胱尿路上皮癌的蛋白质基因组学揭示了乳头状癌和原位癌的不同分子特征
✦ +
+
论文ID
原名:Proteogenomics of different urothelial bladder cancer stages reveals distinct molecular features for papillary cancer and carcinoma in situ
译名:不同阶段膀胱尿路上皮癌的蛋白质基因组学揭示了乳头状癌和原位癌的不同分子特征
期刊:Nature Communications
影响因子:16.6
发表时间:2023.09.13
DOI号:10.1038/s41467-023-41139-3
背 景
膀胱癌是全球第十大常见癌症,每年报告大约 570000 例新发膀胱癌病例。在组织病理学上,膀胱尿路上皮癌(UC)的进展是一个多步骤的过程,首先是非浸润性尿路上皮增生,发展为原位癌(CIS)或乳头状尿路上皮癌(PUC),再发展为浸润性癌(固有膜或肌肉浸润),最终达到淋巴结转移和远处转移的潜在致死阶段。
PUC 的复发率很高,而 CIS 的进展率很高。两个不同分支(PUC 和 CIS)的具体特征及其生物标志物仍有待探索。此外,目前对于PUC和乳头状的致病途径以及基因组畸变如何影响蛋白质组改变和磷酸化蛋白质组作用仍不清楚。
实验设计
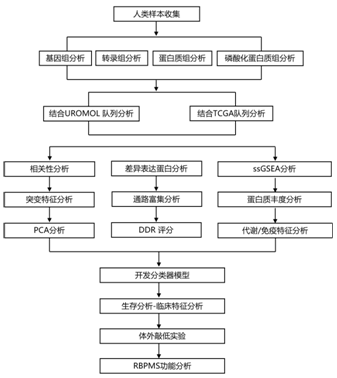
结 果
01
膀胱尿路上皮癌进展队列的蛋白质组学景观
本研究共收集190例UC患者的448例样本,包括癌前期(尿路上皮形态正常[normal]、增生、不确定恶性潜能的尿路上皮增生[UPUMP])、良性期(乳头状瘤)和肿瘤期(CIS、PUC、浸润性癌,无明确组织学[NOS]或组织学变异[variant])(图1a)。所有患者均无术前治疗史,均来自上海中山医院。共收集448份样本进行蛋白质组分析,其中211份样本、125份样本和67份样本分别进行磷酸化蛋白质组分析、全外显子组测序(WES)和转录组分析(RNA-seq)(图1b)。
对 448 个样品进行无标记定量测量,在蛋白质和肽水平上鉴定出16151 个蛋白质(图 1c)。对211个样品进行了磷酸化蛋白质组学分析,鉴定并定量了对应于6476个磷蛋白的37204个磷酸位点(图1d)。对67份样本进行RNA-seq,每个样本鉴定出16318个基因。
在基因组水平上,不同肿瘤阶段和病理亚型检测到不同的突变。至于良性尿路上皮乳头状瘤,其突变基因较少。几乎所有乳头状瘤病例中都只存在 HRAS 的致癌热点突变,而很少观察到细胞周期基因和染色质修饰基因的改变,这表明乳头状瘤主要是由 RAS 通路激活驱动的(图 1e)。最恶性的肌肉浸润性肿瘤(MIBC),与非肌肉浸润性肿瘤(NMIBC)和良性乳头状瘤相比,MIBC中 TP53的突变更为频繁(图1e)。研究者团队发现SBS1突变特征在早期患者(NMIBC)中稍微频繁一些,而SBS30突变特征在晚期患者(MIBC)中普遍存在(图1f)。此外,SBS1突变特征仅存在于关注疾病早期的UROMOL队列中(图1g),而SBS30突变特征仅存在于关注疾病晚期的TCGA队列中(图 1h)。这些结果进一步表明,SBS1突变特征属于疾病早期特征,而SBS30突变特征属于疾病后期特征。
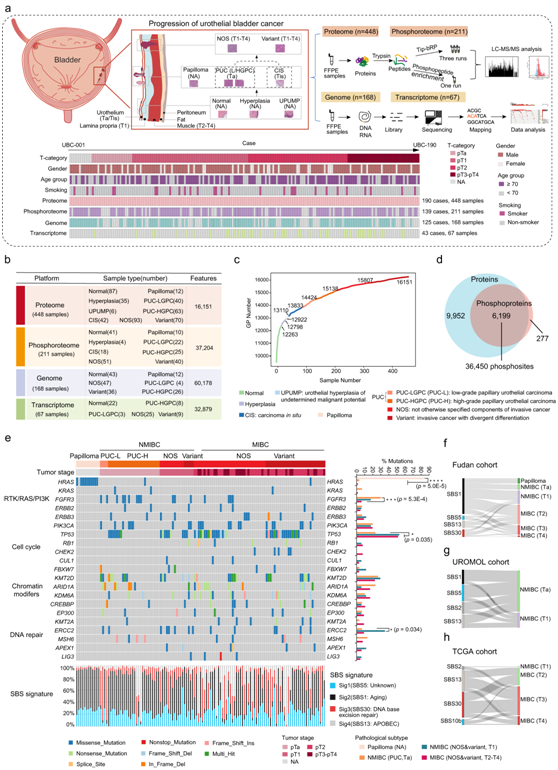
图1. 膀胱尿路上皮癌进展队列的蛋白质组图谱。
(a) 上:描述膀胱尿路上皮癌 (UC) 进展和实验工作流程的模型。下:临床信息以及蛋白质组、磷酸化蛋白质组、WES 和 RNA-seq 分析的样本数量。(b) 本研究中生成的数据和元数据摘要。(c) UC进展中蛋白质鉴定的累积数量。(d) 蛋白质和磷蛋白的重叠分析。(e) 按肿瘤分期和病理亚型划分的膀胱尿路上皮癌基因组图谱概述。(f)本研究的队列中不同肿瘤阶段的 SBS 特征和膀胱尿路上皮癌的桑基图分析。 (g) UROMOL队列中SBS特征和不同肿瘤阶段的膀胱尿路上皮癌的桑基图分析。 (h) TCGA 队列中不同肿瘤阶段的 SBS 特征和膀胱尿路上皮癌的桑基图分析。
02
与 APOBEC 特征相关的 DNA 损伤信号是原位癌进展的关键信号通路
对 8146 个蛋白质的主成分分析 (PCA) 区分了癌前病变和癌症,表明 CIS 发生和进展过程中存在异常的蛋白质组景观(图2a)。差异表达蛋白的通路富集分析表明,正常富集蛋白参与上皮细胞分化和活性氧 (ROS) 代谢,而增生富集蛋白主要参与趋化因子信号传导和细胞对干扰素的应答等免疫应答(图2b-c)。UPUMP(尿路上皮增厚且没有真正的乳头状叶的病变)与碳水化合物代谢和共价染色质修饰通路相关(图2b-c)。有趣的是,他们发现CIS与侵袭性肿瘤(NOS)具有相似的恶性肿瘤相关蛋白表达谱,如更强的细胞增殖和DNA损伤修复,这与CIS的高危特征是一致的(图2c)。此外,他们发现CIS和NOS的ROS代谢下调,对DNA损伤刺激的反应上调(图2d)。
ROS的产生是癌症进展的标志之一,它会导致DNA和蛋白质的氧化损伤。他们根据已知的 DDR 标记磷蛋白生成了 DNA 损伤反应 (DDR) 评分(图2e),正如预期的那样,CIS 和 NOS 显示出较高的 DDR 分数(图 2e)。
为了进一步探讨 CIS 和 NOS 中 DDR 分数较高的原因,他们计算了 DDR 分数和突变特征的 Spearman 相关系数。DDR 评分与 APOBEC 突变特征具有最高的相关性(图 2f)。同时,DDR的评分与APOBEC3s 蛋白(APOBEC3A、APOBEC3B、APOBEC3C 和 APOBEC3G)的表达显著相关(图 2g-h)。同时,在 CIS 和 NOS 中也观察到较高水平的 APOBEC3s 蛋白(图 2i)。
接下来,他们探究了 APOBEC3s 蛋白水平较高的来源和后果。APOBEC3s的蛋白质丰度与本项研究队列中的嘧啶代谢和DNA修复KEGG基因集呈正相关,这在公开数据集UROMOL队列中得到了进一步证实(图2j)。通路分析显示,许多参与DNA修复和嘧啶代谢的蛋白质在CIS和NOS中的富集程度更高,例如FEN1、MSH6、PRPS2和GMPS(图2k)。这些结果证明了,氧化/抗氧化调控失衡过程中的DNA断裂可以提供单链DNA的来源,进一步刺激APOBEC3表达,并促进APOBEC介导的诱变和CIS进展(图2l)。
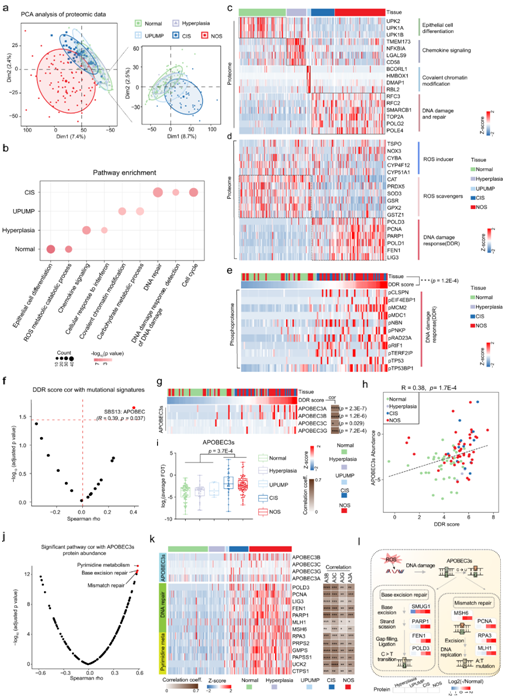
图2. 与 APOBEC 特征相关的 DNA 损伤信号传导是 CIS 进展中的关键信号传导通路。
(a) 蛋白质组数据(8146 个蛋白质)的主成分分析 (PCA)。 (b) 正常、增生、UPUMP、CIS 和 NOS 中差异表达蛋白富集的通路。(c) 正常、增生、UPUMP、CIS 和 NOS 中差异表达蛋白的热图。(d) 活性氧 (ROS) 代谢和 DNA 损伤反应相关基因的蛋白质丰度热图。 (e) 热图显示了用于确定 DNA 损伤反应 (DDR) 评分的一组磷蛋白的每个样本的磷酸化状态。(f) 火山图显示 DDR 评分与突变特征之间的相关性。(g) 左:不同组织中 APOBEC3s 蛋白丰度和 DDR 评分的热图。右:热图显示 APOBEC3s 蛋白丰度与 DDR 评分之间的 Spearman 相关性。(h) DDR 评分与 APOBEC3 蛋白质丰度的相关性。(i) APOBEC3s在正常、增生、UPUMP、CIS和NOS中的表达谱。(j) 火山图显示富集的 KEGG 通路评分[(样本特异性基因集富集分析 (ssGSEA) ] 和 APOBEC3s 蛋白质丰度之间的相关性。 (k) 左:热图显示正常、增生、UPUMP、CIS 和 NOS 样本中参与 DNA 修复和嘧啶代谢的蛋白质的相对丰度。右:热图显示 APOBEC3 与参与 DNA 修复和嘧啶代谢的蛋白质之间的 Spearman 相关性。 (l) 与 APOBEC 突变特征相关的 ROS 和 DNA 修复通路的示意图。
03
蛋白质组学特征区分乳头状瘤和乳头状尿路上皮癌
差异表达蛋白的通路富集分析显示,PUC中富集的蛋白参与JAK STAT信号通路、mTOCR1信号通路和DNA修复,而乳头状瘤中富集的蛋白主要参与P53通路、MAPK通路和WNT beta信号通路(图 3a)。利用PTM特征富集分析从磷酸化位点推断的激酶活性评分分析显示,在乳头状瘤和PUC中活化的主要激酶如CDK16、MAP3K8和TRIB2在PUC中活化,而在乳头状瘤中活化的主要激酶有RPS6KA2、PRKCG和IKBKE(图3a)。
为了确定乳头状瘤和 PUC 基因组驱动因素的差异,他们比较了它们之间基因组变异的差异。结果显示,乳头状瘤具有较高的基因突变率,如MPRIP、HRAS和MAP3K1,而PUC具有较高的基因突变率,如FGFR3和PPFIBP1(图3a)。四种蛋白(HRAS、ALDH7A1、CBLB和MPRIP)在乳头状瘤和PUC之间表达不同(图3b)。
HRAS突变患者的HRAS蛋白表达水平较高(图3c),并且乳头状瘤中HRAS的表达高于PUC(图3d)。
为了进一步建立遗传改变和相应下游通路之间的联系,他们分析了 HRAS 的蛋白质丰度和富集通路之间的相关性。RAS突变蛋白通过MAPK和PI3K等下游信号通路调节肿瘤细胞增殖、凋亡和血管生成。HRAS的蛋白丰度与MAPK通路呈正相关(图 3e), HRAS的较高表达与MAP3K1、MAPK1和RPS6KA3的较高磷酸化呈正相关(图 3f-h),并且RPS6KA3在乳头状瘤中的表达高于PUC(图3i-j)。此外, HRAS的表达与mTORC1信号通路呈负相关(图 3e),并且RPS6KA3的表达与TSC2呈正相关(图 3k)。已有研究证明RPS6KA3 有效抑制 TSC2 抑制 mTOR 信号传导的能力,而TSC2 与 mTORC1 信号通路呈负相关(图 3i)。这些结果表明,HRAS蛋白可能通过抑制TSC2能力来抑制mTOR1信号通路(图3m-n)。
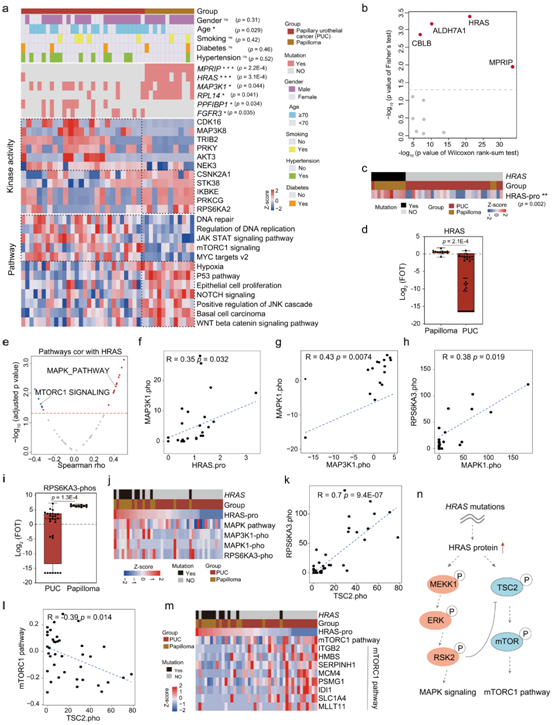
图3. 蛋白质基因组谱可区分乳头状瘤和乳头状尿路上皮癌。
(a) 激酶活性评分的热图以及乳头状瘤和乳头状尿路上皮癌 (PUC) 之间的差异调节途径,并注释有临床特征。 (b) 散点图显示显著不同的突变基因及其蛋白表达差异乳头状瘤和 PUC。(c) HRAS突变的患者中 HRAS 的蛋白表达。(d) 箱线图显示乳头状瘤和 PUC中 HRAS 的蛋白表达。 (e) 火山图显示不同途径与 HRAS 蛋白表达之间的相关性。(f) HRAS 蛋白丰度与 MAP3K1 磷蛋白丰度的相关性。(g) MAPK1 磷蛋白丰度与 MAP3K1 磷蛋白丰度的相关性。(h) MAPK1 磷蛋白丰度与 RPS6KA3 磷蛋白丰度的相关性。(i) 箱线图显示乳头状瘤和 PUC中 RPS6KA3 的磷蛋白表达。(j) MAPK 通路的共磷酸化特征与HRAS突变一致。(k) TSC2 磷蛋白丰度与 RPS6KA3 磷蛋白丰度的相关性。(l) TSC2磷蛋白丰度与mTORC1通路的相关性。(m) 排序的 HRAS 蛋白丰度和 mTORC1 通路相关基因的蛋白丰度的热图。(n) 描述HRAS突变多级调控的模型。
04
乳头状尿路上皮癌与原位癌不同的代谢和免疫特征
PUC 和 CIS 是早期膀胱癌的两种主要形式,具有不同的临床、病理和分子特征。根据组织学分级,CIS是一种高级别肿瘤,而PUC可分为高级别和低级别肿瘤(HGPC和LGPC),其分子肿瘤发生机制不同。对蛋白质组(8134 个蛋白质)和磷酸蛋白质组(2222 个磷蛋白)数据进行 PCA 分析,将 CIS 样品与 PUC 样品分开(图 4a),揭示了 PUC 和 CIS 之间的分子差异。样本特异性基因集富集分析(ssGSEA)显示,与糖脂代谢相关的通路,如甘油磷脂代谢、糖酵解和糖异生,在PUC组中富集(图4b-c)。相反,上皮间质转化 (EMT) 以及其他免疫和致癌信号通路,例如肿瘤坏死因子-α (TNF-α)、补体级联和 IL6 JAK-STAT3 信号通路在 CIS 组中丰富(图 4b-c)。此外,他们发现HGPC和CIS比LGPC更富集有丝分裂纺锤体组装和DNA复制通路(图4b-c)。
为了进一步研究 PUC 和 CIS 之间的不同分子机制,他们重点关注转录因子(TF),因为它们调节许多生物过程并在癌症的发展中发挥关键作用。有趣的是,他们发现 FOXO1 和 JUN 蛋白分别在 PUC 和 CIS 中显著过表达(图 4d)。FOXO1 属于FOXO 转录蛋白家族,是葡萄糖代谢的主要调节因子。AKT1是磷酸化FOXO1的激酶之一,与FOXO1蛋白丰度的相关性最高(图4e)。值得注意的是,与 CIS 相比,PUC 中的 AKT1激酶活性和的蛋白质丰度更高(图4f)。
去磷酸化的 FOXO1 上调糖异生基因,例如编码磷酸烯醇丙酮酸羧基激酶和葡萄糖 6-磷酸酶催化亚基的基因,而 AKT1 通过磷酸化 FOXO1 抑制糖异生。这些结果表明AKT1通过调节PUC中FOXO1的磷酸化来调节糖异生和糖酵解(图 4g)。
CIS 和 PUC 之间倍数差异最高的另一个转录因子是 JUN(图 4d)。JUN是癌变事件的关键调控因子,影响一系列细胞增殖、迁移和免疫调节因子的表达,与癌症的发生和转移密切相关。许多参与上皮间充质转换(EMT)和免疫的蛋白质,即JUN靶基因(TG),在CIS中表达上调(图 4h),例如 SERPINA3、ITGB5 和 VCAM1。这些结果表明JUN可能通过调节CIS中JUN下游的TG来调节EMT和免疫反应。
他们根据蛋白质组数据比较了 PUC 和 CIS 的 xCell 评分。CIS 中的微环境和免疫评分高于 PUC(图 4i),表明 CIS 中免疫细胞的肿瘤浸润程度高于 PUC。随后,他们比较了 CIS 和 PUC 中常见的几种免疫细胞的 z 分数,发现肿瘤浸润免疫细胞的组成在肿瘤类型之间存在显著差异(图 4j)。CIS 比 PUC 具有更高的 CD8 + T 细胞、树突状细胞和巨噬细胞 M1 的浸润(图 4j)。此外,他们观察到糖酵解与 PUC 和 CIS 中的免疫评分呈现最高的负相关性(图4j-k),包括负责产生和分泌乳酸的相关酶的富集,乳酸是肿瘤微环境中已知的免疫抑制因子。
总之,这些结果表明,PUC 的特点是糖脂代谢相关通路水平较高,而 CIS 具有较高的免疫细胞浸润(图 4l)。
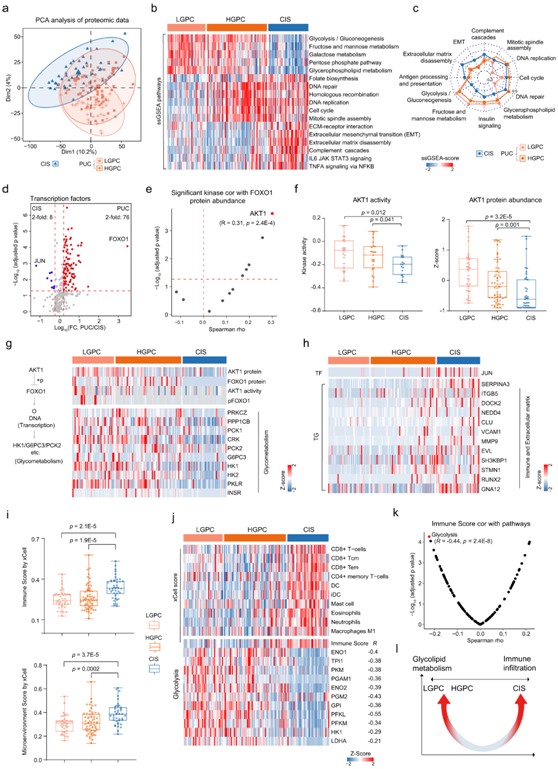
图4. 乳头状尿路上皮癌和原位癌不同的代谢和免疫特征。
(a) 对低级别乳头状癌 (LGPC)、高级别乳头状癌 (HGPC) 和原位癌 (CIS) 的蛋白质组数据(8134 个蛋白质)进行主成分分析 (PCA)。(b) 热图显示了ssGSEA通路得分。(c) LGPC、HGPC 和 CIS 之间的代表性路径。径向轴值为 ssGSEA 路径评分。 (d) PUC 或 CIS 之间转录因子差异的蛋白质丰度。(e) 火山图显示基于蛋白质水平的激酶与 FOXO1 的相关性。(f) 左:LGPC 、HGPC和 CIS组中 AKT1 的激酶活性 。右:LGPC、HGPC和 CI组中 AKT1 的蛋白质丰度。(g) AKT1 调节的糖代谢相关基因的蛋白质丰度热图。(h) 参与免疫和细胞外基质的JUN靶基因的蛋白质丰度热图。(i) LGPC、HGPC和 CIS的微环境评分和免疫评分。(j) 上:LGPC、HGPC 和 CIS 之间免疫细胞浸润的热图。下:糖酵解相关基因的蛋白质丰度热图。(k) 火山图显示富集通路评分与免疫评分之间的相关性。(l) 乳头状尿路上皮癌(PUC:LGPC 和 HGPC)和 CIS 不同特征的概述。
05
PUC 和 CIS 来源肿瘤的区别及其与临床结果的关联
浸润性膀胱尿路上皮癌(包括固有膜浸润和肌肉浸润)可能由 CIS 和 PUC 发展而来。他们使用RapidMiner 9.6.0平台构建了基于PUC和CIS过表达蛋白的Fast-Large Margin分类器模型(图 5a-b)。为了评估PUC和CIS分类器模型的准确性,他们从Dyrskjøt的队列中加入了额外的独立样本(验证队列,包括15个PUC样本和5个CIS样本)(图5c),分类器模型在验证队列中达到了95%的高准确率(图5d)。
为了区分侵袭性肿瘤的起源,他们在侵袭性肿瘤样本中应用了分类器模型。将33 个侵袭性肿瘤样本分类为 CIS 来源,将53 个样本分类为 PUC 来源。与PUC和CIS的特征一致,PUC来源的样品以糖脂代谢通路为特征,而CIS来源的样品以较高水平的免疫细胞浸润和细胞外基质通路为特征(图5e)。令人惊讶的是,他们发现 CIS 来源的患者与较差的总生存期 (OS) 和较差的无进展生存期 (PFS) 相关(图5f)。此外,CIS来源的患者比PUC来源有更多的转移(图 5e),CIS 来源患者的生存率较差且免疫评分较高(图5g-h)。
因此,本项研究提供了一个分类器模型,用于区分侵袭性肿瘤与预后和转移相关的PUC来源和cis来源肿瘤(图5i)。
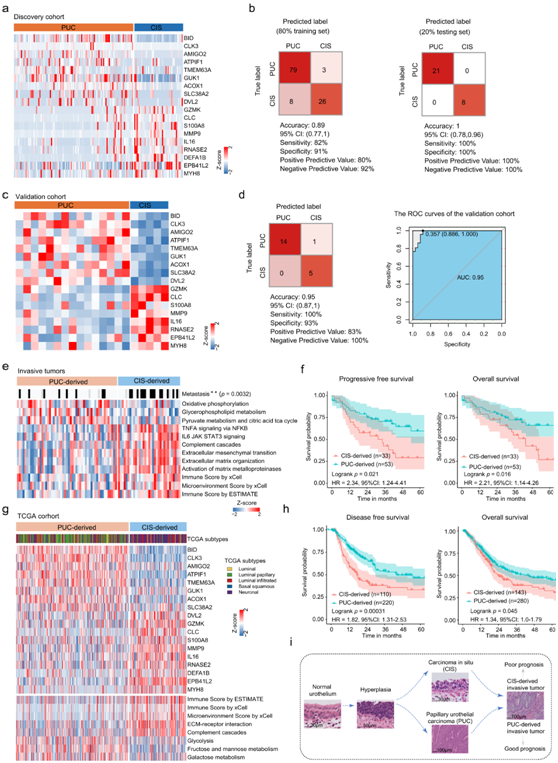
图5. PUC 和 CIS 来源肿瘤的区别及其与临床结果的关联。
(a) 区分 PUC 和 CIS 的分类器模型蛋白质的热图。 (b) 使用发现队列中 80% 训练集和 20% 测试集的逻辑回归分类器的分类误差矩阵。 (c) 在验证队列中区分 PUC 和 CIS 的分类器模型基因的热图。 (d) 左:验证队列中每个方框中均注明了已识别的样本数量。右:分类器模型在验证队列中预测 PUC 和 CIS 的 ROC 曲线。(e) 热图显示了 PUC 来源组和 CIS 来源组之间差异表达的选定途径的 ssGSEA 评分、微环境评分和免疫评分,并注释有临床特征。 (f) PUC 来源组和 CIS 来源组的无进展生存期和总生存期的 Kaplan Meier 曲线。(g) 上:分类器模型基因的热图,在 TCGA 队列中将侵袭性肿瘤的起源分类为 CIS 来源和 PUC 来源。下:热图显示了 TCGA 队列中的ssGSEA 评分、微环境评分和免疫评分。(h) TCGA 队列中 PUC 来源组和 CIS 来源组的无病生存率和总生存率的 Kaplan Meier 曲线。(i) 建立尿路上皮性膀胱癌进展的两个不同分支(PUC来源和CI来源)的特征模型。
06
RBPMS 的缺失可能导致肿瘤转移
在本项研究的队列中,20% 的患者记录为有远处转移。通过 Kaplan-Meier 曲线显示,与非转移组相比,转移组的生存率明显较低(图 6b)。比较两组患者的基本特征,如性别、年龄、吸烟史,结果显示没有显著差异(图 6a)。
差异表达蛋白的通路富集分析表明,转移富集的蛋白参与细胞外基质组织、细胞粘附和骨骼系统发育,而非转移富集的蛋白主要参与细胞周期的调节、GTPase活性的正向调节,并调节细胞增殖(图 6c)。
基因组信息显示,转移组具有较高的DMBT1、ARAP2、CWF19L1和COL27A1突变(图 6a)。
为了进一步确定转移组和非转移组中基因组驱动因素的差异,他们观察到转移组中有 20 个峰变化更频繁(图6d)。在 20 个改变的峰中,8p12 缺失与不良预后显著相关(图 6d),这表明8p12缺失与UC转移相关,其中可能隐藏着一些转移抑制基因。为了鉴定转移抑制基因,他们在8p12上发现了9个顺式效应基因,例如RBPMS、DCTN6和GSR(图 6e)。转移肿瘤组中RBPMS的蛋白质丰度显著低于非转移肿瘤组(图 6f-g)。与 PUC 和 PUC 来源肿瘤相比,在 CIS 和 CIS 来源肿瘤中也观察到 RBPMS 表达水平较低,说明RBPMS的差异在疾病早期就已经出现。通路富集分析表明,细胞周期通路在具有RBPMS缺失的肿瘤中过度表达(图 6h)。
为了进一步揭示RBPMS在UC生长和转移中的潜在机制,他们分析了与RBPMS表达相关的TF(图 6i)。在RBPMS的相关tf中,SMAD3在转移组的相关系数高于非转移组(图 6j)。他们进一步观察到RBPMS和SMAD3与预测的AP-1活性呈负相关(图6k-l)。在本项研究的队列中,AP-1的许多靶基因,如CCL2、VCAM1和MMP9,随着AP-1活性的增加而下调,这在UROMOL队列中得到了进一步的验证(图6m)。这些可能是由于 RBPMS 抑制 SMAD3 介导的 AP-1 反式激活,并且 RBPMS 阻止 SMAD3 招募到 AP-1 靶基因的启动子所致。
这些发现表明8p12缺失在转移组中频繁发生,顺式效应基因RBPMS通过抑制AP-1反式激活发挥抑癌基因的作用(图8n)。
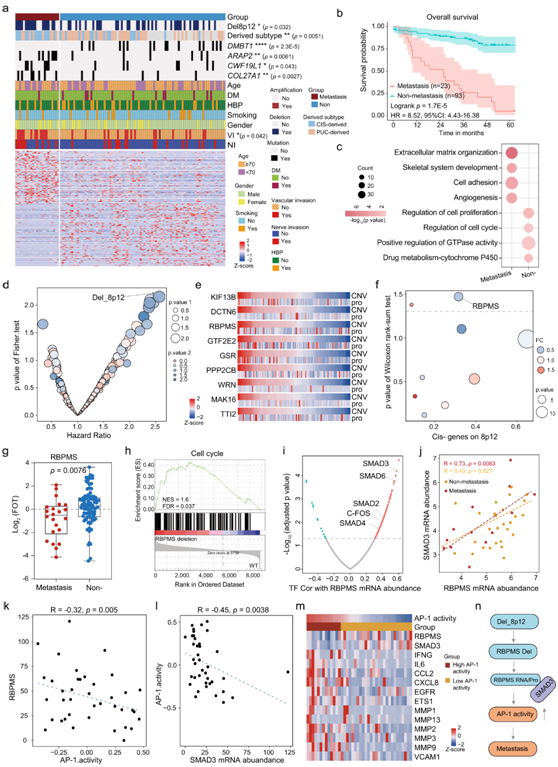
图6. RBPMS 的缺失可能导致肿瘤转移。
(a) 热图显示转移性肿瘤和非转移性肿瘤之间的差异。(b) 转移性组和非转移性组总生存率的 Kaplan Meier 曲线。 (c) 转移性和非转移性肿瘤中差异表达蛋白的通路富集。(d) 转移性和非转移性肿瘤中不同的拷贝数变异(CAN) 及其与预后的联系。 (e) 8p12 中 9 个顺式效应的蛋白质丰度热图。 (f) 9个顺式效应蛋白在转移性和非转移性肿瘤中的差异表达。(g) 箱线图显示 RBPMS 在转移性和非转移性肿瘤中的表达水平。(h) GSEA 分析显示细胞周期在 RBPMS 缺失肿瘤和 WT 肿瘤中差异表达。(i) 火山图显示不同 TF 和 RBPMS mRNA 丰度之间的相关性。(j) RBPMS mRNA 丰度与 SMAD3 mRNA 丰度的相关性。(k) RBPMS mRNA 丰度与 AP-1 活性的相关性。(l) SAMD3 mRNA丰度与AP-1活性的相关性。(m) 热图显示 AP-1 活性和目标基因的 mRNA 丰度。(n) 描述 8p12 缺失多级调控的模型。
07
RBPMS缺陷通过激活AP-1转录因子促进UC进展
为了研究RBPMS在UC转移中的作用,他们首先敲低人膀胱癌T24和5637细胞系中的RBPMS表达,发现敲低RBPMS的细胞与对照细胞相比表现出增加的增殖能力(图7a),RBPMS 过表达减少 T24 细胞的细胞侵袭(图 7b),表明RBPMS 的缺失与 UC 的转移相关。
为了进一步验证在蛋白质组学研究中关于 RBPMS 和 AP-1 活性之间显著相关性,他们检测了培养细胞中 RBPMS 和 AP-1 活性之间的相关性。结果证实 AP-1 荧光素酶报告基因可以有效显示 AP-1 活性(图7c)。在这个系统中, RBPMS 敲低导致 AP-1 活性显著增加(图 7c)。接下来,他们使用半定量比色试剂盒测量AP-1家族成员的细胞内活性。在RBPMS敲除细胞中,发现AP-1家族成员的活性,包括c-Jun和c-Fos,与正常细胞相比显著增加(图7d)。AP-1的靶标,如IL6、MMP9和SDHB,在RBPMS敲低的T24和5637细胞中增加,而在RBPMS过表达的T24和5637细胞中减少(图7e)。此外,RBPMS的缺失促进了T24细胞的异种移植瘤生长,而c-Fos的敲低部分消除了RBPMS的作用并延迟了肿瘤细胞的异种移植物生长(图7f)。
他们在 5637 细胞中使免疫共沉淀进一步验证了 RBPMS 与 c-Fos 相互作用,但不与 c-Jun 相互作用(图 7g)。在T24和5637细胞中,RBPMS的敲低导致c-Fos与c-Jun的结合能力增强,而RBPMS的过表达导致c-Fos与c-Jun的结合能力降低(图7h-i),这表明RBMPS的缺失促进了c-Fos/c-Jun复合物的形成。与对照细胞相比,RBPMS敲低细胞中染色质片段中的c-Fos增加,这表明在RBPMS缺失的情况下,有更多的c-Fos与染色质结合(图7j)。最后,使用染色质免疫沉淀(ChIP)-qPCR,他们发现在 RBPMS 敲低的 T24 和 5637 细胞中,c-Fos 与 IL6、MMP9 和 SDHB 启动子的结合能力增强(图 7k),表明有更多的c-Fos位于AP-1靶基因的启动子区域并参与这些基因的转录激活。总之,这些结果表明 RBPMS 缺陷通过促进 c-Fos/c-Jun 复合物的形成促进 UC 发展,从而导致 AP-1 的激活。
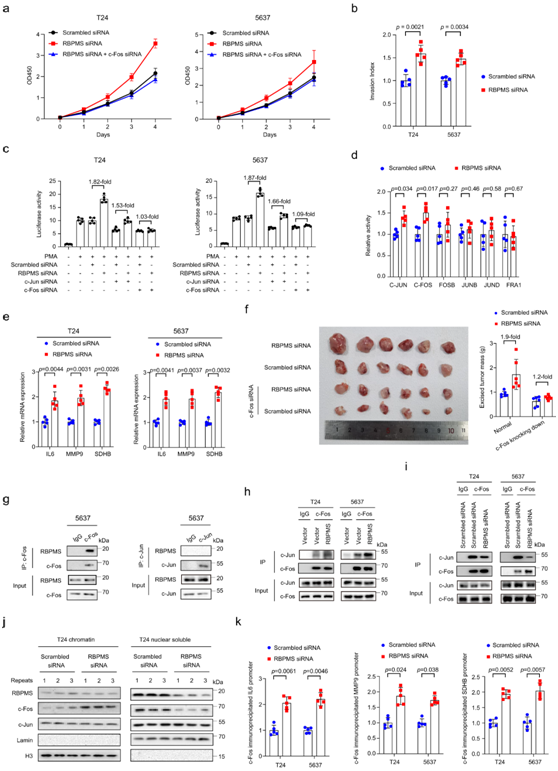
图7. RBPMS 缺失通过激活 AP-1 转录因子促进 UC 进展。
(a) RBPMS siRNA 或 c-Fos siRNA 转染后 T24 和 5637 细胞的增殖能力。(b) RBPMS siRNA或c-Fos siRNA转染后检测T24和5637细胞的侵袭能力。(c) AP-1转录活性(荧光素酶活性)分析。 (d) 通过半定量比色试剂盒测量 AP-1 家族成员的细胞内活性。(e) 通过 RT-qPCR 分析 T24 或 5637 细胞中 IL-6、MMP9 和 SDHB 的表达。(f) RBPMS siRNA 和/或 c-Fos siRNA 影响体内肿瘤生长。(g) 使用免疫共沉淀分析验证 c-Fos 和 RBPMS、c-Jun 和 RBPMS 在 5637 细胞中的相互作用。 (h) 免疫共沉淀测定用于验证 RBPMS 过表达后 T24 和 5637 细胞中 c-Fos 和 c-Jun 之间的相互作用结合能力。(i) 免疫共沉淀测定用于验证 RBPMS 敲低后 T24 和 5637 细胞中 c-Fos 和 c-Jun 之间的相互作用结合能力。(j) Western blotting测定T24细胞核可溶部分或染色质富集部分中RBPMS、c-Fos、c-Jun、Lamin和H3的表达水平。 (k) 通过 ChIP-qPCR 评估 IL-6、MMP9 和 SDHB 启动子结合活性。
+ + + + + + + + + + +
结 论
本项研究对来自 190 名 UC 患者的 448 个样本进行了全面的多组学分析,涵盖了整个疾病阶段和分级。蛋白质基因组整合分析表明HRAS突变调节 mTOR 信号传导促进尿路上皮乳头状瘤的进展。DNA 损伤是CIS进展中的关键信号通路,并与 APOBEC 特征相关。与 CIS 相比,PUC 的糖脂代谢增加和免疫细胞浸润降低与相关。蛋白质组学分析可区分侵袭性肿瘤(PUC 来源的和 CIS 来源的),这与不同的临床预后和分子特征有关。此外,与 CIS 来源肿瘤相关的 RBPMS 缺失可增加 AP-1 的活性并促进转移。这项研究揭示了 UC 进展的两个不同分支(PUC 和 CIS)的特征,最终可能有益于临床实践。
+ + + + +



 English
English


